РАДИОХИМИЯ, 2020, том 62, № 2, с. 130-141
УДК 621.039 + 621.039.72
КАТАЛИТИЧЕСКОЕ РАЗЛОЖЕНИЕ N2O В
ВОЗДУШНОМ ПОТОКЕ СИСТЕМ ГАЗООЧИСТКИ
РАДИОХИМИЧЕСКИХ ПРОИЗВОДСТВ
© 2020 г. С. А. Кулюхин*, И. А. Румер, М. П. Горбачева, А. А. Бессонов
Институт физической химии и электрохимии им. А. Н. Фрумкина РАН
119071, Москва, Ленинский пр., 31, корп. 4
*e-mail: kulyukhin@ipc.rssi.ru
Получена 05.03.2019, после доработки 28.06.2019, принята к публикации 29.06.2019
Исследовано каталитическое разложение N2O в воздушном потоке при температуре от ~420 К до ~755 К
в присутствии катализаторов на основе γ-Al2O3. Установлено, что степень разложения N2O в присутствии
катализаторов, содержащих Mg, Ni, Co и Fe, не превышает ~25% при температуре композита ~735 К
и времени контакта газового потока с ним 5-6 с. Показано, что композит Al2O3-2RuO2-400 позволяет
осуществить практически полное разложение N2O в воздушном потоке при температуре 738-753 К и
времени контакта 7-15 с.
Ключевые слова: закись азота, каталитическое разложение, система газоочистки радиохимических
производств
DOI: 10.31857/S0033831120020057
Проблема обезвреживания N2O актуальна и
дают методы, основанные либо на высокотемпера-
важна для радиохимических операций, таких как
турном каталитическом разложении N2O, либо на
гидрометаллургическая переработка нитридного
сорбции с использованием различных сорбцион-
топлива [1, 2], денитрация кубовых остатков и ку-
ных материалов [7-10].
бового раствора, образующихся при упаривании
Использование адсорбционных методов не
высокоактивных отходов от переработки ОЯТ раз-
всегда эффективно, поскольку требует дальней-
личных реакторов [3, 4]. В данных процессах обра-
шей регенерации отработанных сорбентов.
зуются различные оксиды азота (N2O, NO и NO2),
Несмотря на то, что каталитические методы
от которых необходимо очистить газовую фазу
очистки газовых выбросов от N2O являются пред-
[1, 4]. При этом установлено, что в процессах дени-
почтительными, практически все катализаторы,
трации оксиды азота преимущественно находятся
независимо от состава, начинают эффективно раз-
в виде N2O, который не подлежит регенерации.
лагать N2O только при температурах выше 773 К, в
Действительно, использование различных жидких
основном, в инертной среде с низким содержани-
ловушек позволяет практически количественно
ем кислорода и паров воды [7-9].
очистить газовый поток от NO и NO2 [5, 6]. В то
Одним из неорганических материалов, часто
же время N2O (парниковый газ), который являет-
используемым в качестве носителя для катали-
ся несолеобразующим оксидом и практически не
заторов, является γ-Al2O3. Возможность направ-
взаимодействует ни со щелочами, ни с кислотами,
ленного регулирования пористой структуры при
представляет главную проблему при локализации
синтезе позволяет считать, что в настоящее время
окислов азота [4].
γ-Al2O3 является наиболее подходящим матери-
При очистке газовых потоков от N2O в радио-
алом для создания эффективных катализаторов
химических производствах преимуществом обла-
разложения N2O. При этом наиболее активными
130
КАТАЛИТИЧЕСКОЕ РАЗЛОЖЕНИЕ N2O
131
Таблица 1. Условия синтеза и обозначения композитов на основе γ-Al2O3, содержащих Cu, Ni и Fe
Металл
Условия синтеза
Обозначение
Cu(II)
2 моль/л NH4OH, 2.5 ч; 563 К, 10 ч
Al2O3-7Cu-2Амк
24 моль/л NH4OH, 24 ч; 563 К, 10 ч; 873 К, 5 ч
Al2O3-7Cu-24Амк
Ni(II)
2 моль/л NH4OH, 2.5 ч; 563 К, 10 ч
Al2O3-7Ni-2Амк
24 моль/л NH4OH, 24 ч; 563 К, 10 ч; 873 К, 5 ч
Al2O3-7Ni-24Амк
Fe(III)
2 моль/л NH4OH, 2.5 ч; 563 К, 10 ч
Al2O3-7Fe-2Амк
24 моль/л NH4OH, 24 ч; 563 К, 10 ч; 873 К, 5 ч
Al2O3-7Fe-24Амк
в процессах каталитического разложения N2O
(2) Al2O3-7Cu-2Амк-1050, полученный в ре-
являются благородные металлы (Pt, Rh, Ru, Au).
зультате прокаливания Al2O3-7Cu-2Амк на возду-
Учитывая широкое использование в составе ката-
хе при температуре 1323 К в течение 5 ч.
лизаторов d-элементов (Cu, Co, Ni, Fe, Mn и др.),
(3) Al2O3-nNi0 (n = 7 или 10), содержащий 7
представляло интерес исследовать эффективность
или 10 мас% Ni0, полученный восстановлением
различных композиционных материалов на основе
Ni2+ до металла в токе водорода при температуре
γ-Al2O3 для низкотемпературного разложения N2O
873 К. В качестве прекурсора использовали мате-
в воздушном потоке. Это и составило цель работы.
риал на основе γ-Al2O3, содержащий рассчитанное
количество Ni(NO3)2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(4) Al2O3-10MOx-700 (M = Mg, Ni, Co, Fe), со-
Для получения композитов в качестве матриц
держащий 10 мас% оксидов металлов, полученный
был использован гранулированный γ-Al2O3 с раз-
путем прокаливания прекурсоров на воздухе при
мерами гранул 3.0-8.0 мм (ТУ-2163-004-81279372-
температуре 973 К в течение 5 ч. В качестве пре-
11).
курсора использовали материал на основе γ-Al2O3,
Водные нитраты Cu, Ni, Co и Fe, трихлорид ру-
содержащий нитраты соответствующего металла.
тения, а также все кислоты, щелочи и гидразин ги-
(5) Al2O3-10MOx-1050 (M = Mg, Ni, Cu, Co),
драт, используемые в работе, были марки х.ч.
содержащий 10 мас% оксидов металлов, полу-
Синтез прекурсоров композитовAl2O3-M-nАмк
ченный в результате прокаливания прекурсоров
(M = Cu, Ni, Fe; n = 2 или 24) проводили путем
на воздухе при температуре 1323 К в течение 5 ч.
пропитки γ-Al2O3 7%-ными водными растворами
В качестве прекурсора использовали материал на
нитратов соответствующих металлов с последую-
основе γ-Al2O3, содержащий нитраты соответству-
щим высушиванием при 423 К на воздухе. Синтез
ющего металла.
композитов осуществляли путем обработки пре-
(6) Al2O3-10MOx-10Co3O4-700 (M = Ni, Fe),
курсоров водными растворами 2 и 24 моль/л ам-
содержащий по 10 мас% оксидов металлов, полу-
миака, выдерживанием в течение 2.5 и 24 ч соот-
ченный в результате прокаливания прекурсоров
ветственно и кондиционированием на воздухе в
на воздухе при температуре 973 К в течение 5 ч.
течение 5 или 10 ч в зависимости от температуры.
В качестве прекурсора использовали материал на
Использование растворов 2 и 24 моль/л аммиака
основе γ-Al2O3, содержащий нитраты соответству-
позволяло получать в составе прекурсоров различ-
ющих металлов.
ные по составу аммиачные комплексы d-элементов.
(7) Al2O3-10MOx-10Co3O4-10MgO-700 (M =
В табл. 1 приведены условия синтеза и обозна-
Ni, Fe), содержащий по 10 мас% оксидов металлов,
чения композитов на основе γ-Al2O3, содержащих
полученный в результате прокаливания прекурсо-
Cu, Ni и Fe.
ров на воздухе при температуре 973 К в течение
В работе также исследовали другие материалы
5 ч. В качестве прекурсора использовали материал
на основе γ-Al2O3:
на основе γ-Al2O3, содержащий нитраты соответ-
(1) Al2O3-7Fe-2Амк-ГГ, полученный в резуль-
ствующих металлов.
тате обработки Al2O3-7Fe-2Амк гидразингидра-
(8) Al2O3-nRuO2 (n = 1 или 4), полученные в
том с последующей высушиванием на воздухе при
результате сорбции газообразного RuO4 на матри-
температуре 563 К.
це γ-Al2O3 в процессе отгонки Ru из азотнокисло-
РАДИОХИМИЯ том 62 № 2 2020
132
КУЛЮХИН и др.
буемой навеской исходного γ-Al2O3, рассчи-
4
Б
тывали на основании данных о его насыпной
А
В
массе. В паспорте на коммерческий γ-Al2O3
указано, что насыпная масса γ-Al2O3 состав-
3
ляет 0.78 г/см3. Количество RuCl3 рассчиты-
2
вали на основании данных о требуемой кон-
1
центрации импрегната (RuO2) в катализаторе.
5
В результате весь раствор практически полно-
Воздух
стью впитывался в гранулы γ-Al2O3. Гранулы
или Ar
приобретали коричневый цвет. Со временем
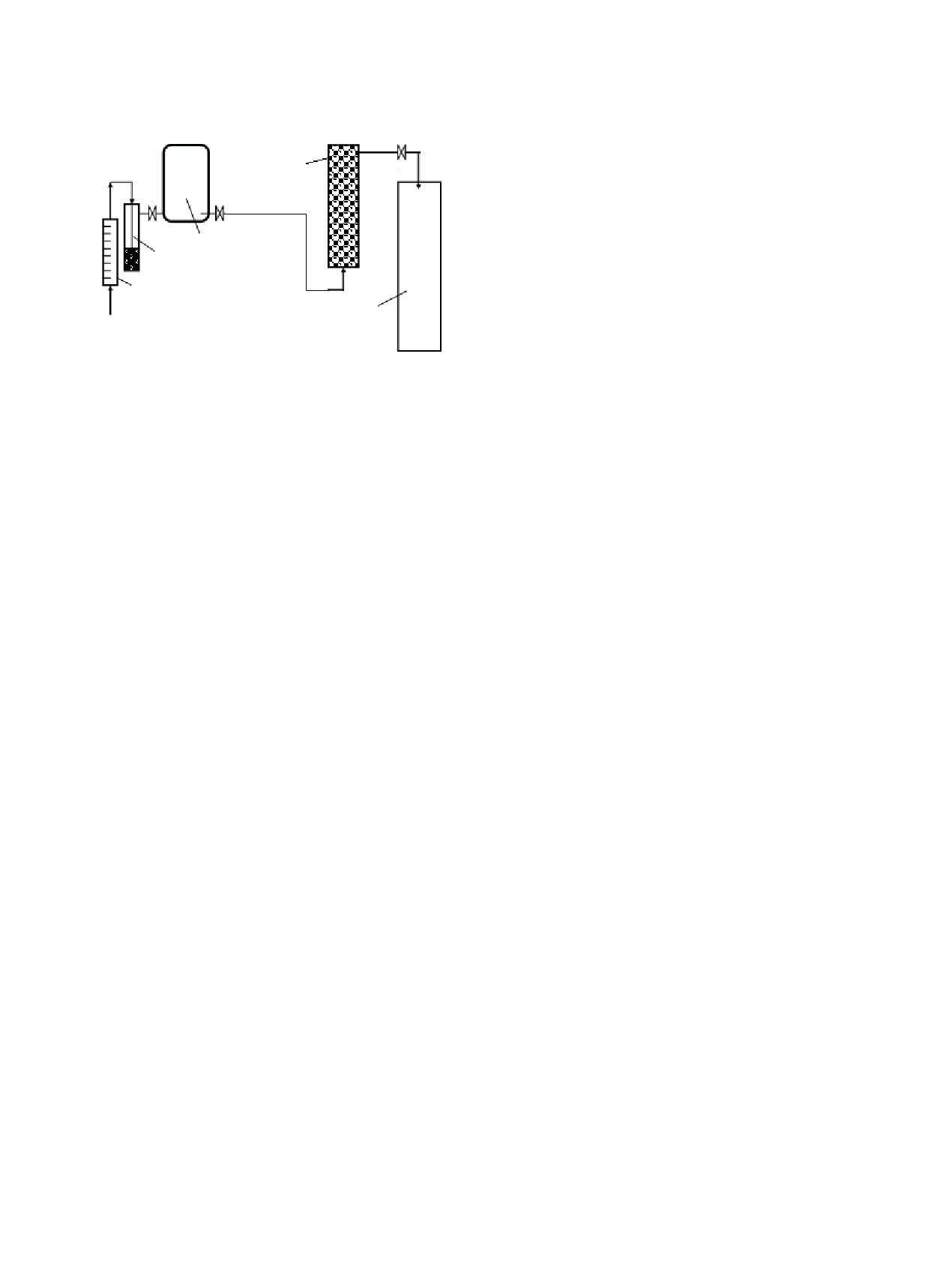
Рис. 1. Схема лабораторной установки для изучения
цвет гранул изменялся с коричневого на чер-
разложения N2O в воздушном потоке (1 - ротаметр,
2 - гидрозатвор с глицерином, 3 - реакционная камера
ный. Гранулы на 24 ч оставляли в контакте с
с N2O, 4 - реактор с исследуемым композитом, поме-
небольшим количеством раствора, которое
щенный в шахтную печь, 5 - накопительная емкость
не впиталось в них, при периодическом пере-
для сбора газообразных продуктов реакций с участием
N2O).
мешивании. Гранулы были окрашены более
или менее равномерно. Через 24 ч гранулы
го раствора. Композиты содержали 1 или 4 мас%
с остатком раствора перегружали в кристал-
RuO2 и представляли собой круглые гранулы чер-
лизатор, который помещали в сушильный
ного цвета.
шкаф. Высушивание катализатора проводили
(9) Al2O3-2RuO2-400 - композит на основе
в две стадии. Сначала прекурсор катализато-
γ-Al2O3, содержащий 2 мас% RuO2, получен-
ра γ-Al2O3-H3RuCl6 сушили при температуре
ный путем пропитки и термостатирования по
383 К на воздухе до воздушно-сухого состо-
следующей методике. В термостойкий сте-
яния. Затем гранулы прокаливали на воздухе
клянный стакан емкостью 2.0 л помещали
при температуре 673 К в течение 5 ч.
рассчитанное количество RuCl3 и добавляли
Все композиты на основе γ-Al2O3 представ-
определенное количество 1 моль/л НСl (V/m =
ляют собой сферические частицы правильной
20). Проводили растворение при постепенном
формы. Физические адсорбционные исследова-
подъеме температуры от комнатной (298-303 К)
ния синтезированных композитов и исходного
до 343-353 К. В первый момент при комнат-
γ-Al2O3 проводили на анализаторе Nova 2200 фир-
ной температуре раствор имел темно-зеле-
мы Quantachrome Instruments (США) по методике,
ный-болотный цвет, и взятая навеска RuCl3
представленной в работе [11].
полностью не растворялась. При повышении
Для изучения процессов разложения N2O с ис-
температуры раствор начинал приобретать
пользованием синтезированных композитов была
красно-коричневый цвет («иодный»), и вся на-
использована лабораторная установка, схема кото-
рой приведена на рис. 1.
веска RuCl3 полностью растворялась с образо-
ванием раствора H3RuCl6. Конденсат, образу-
Установка состоит из ротаметра (1), гидроза-
твора с глицерином (2), реакционной камеры с
ющийся в верхней части стакана и на закры-
N2O (3), реактора с исследуемым композитом, по-
вающем его часовом стекле, имел рН 5-6, т.е.
мещенным в шахтную печь (4), накопительной ем-
конденсат не содержал паров кислоты. После
кости для сбора газообразных продуктов реакций
полного растворения RuCl3 в стакан добавля-
с участием N2O (5).
ли при перемешивании рассчитанную навеску
Эксперимент проводили следующим образом.
γ-Al2O3. Количество раствора H3RuCl6, необ-
В предварительно вакуумированную реакцион-
ходимого для пропитки γ-Al2O3, составляло
ную камеру (3) объемом 125 см3 вводили опреде-
25% от объема, занимаемого требуемой наве-
ленное количество N2O и доводили воздухом дав-
ской чистого γ-Al2O3. Объем, занимаемый тре-
ление внутри камеры до атмосферного. В реактор
РАДИОХИМИЯ том 62 № 2 2020
КАТАЛИТИЧЕСКОЕ РАЗЛОЖЕНИЕ N2O
133
Таблица 2. Некоторые физические адсорбционные характеристики исследованных композитных материалов и ис-
ходного γ-Al2O3
№ эксп.
Материал
Sуд, м2/г
Vпор, см3/г
dпор, нмa
1
Al2O3
278.2
0.35
5.1
2
Al2O3-7Cu-2Амк
230.3
0.44
7.2
3
Al2O3-7Cu-2Амк-1050
42.0
0.16
6.5
4
Al2O3-7Cu-24Амк
263.2
0.33
3.6
5
Al2O3-7Ni-2Амк
254.9
0.45
6.6
6
Al2O3-7Ni-24Амк
204.4
0.27
4.0
7
Al2O3-7Fe-2Амк
236.4
0.41
5.0
8
Al2O3-7Fe-24Амк
199.8
0.27
3.6
9
Al2O3-10Ni0
238.3
0.44
3.3
10
Al2O3-10MgO-700
176.6
0.37
3.3
11
Al2O3-10MgO-1050
49.1
0.15
6.5
12
Al2O3-10Co3O4-700
183.5
0.37
3.3
13
Al2O3-10CoO-1050
28.3
0.11
6.5
14
Al2O3-4CuO-700
205.8
0.42
3.9
15
Al2O3-4Cu2O-1050
4.9
0.01
2.0
16
Al2O3-3NiO-700
177.7
0.38
3.3
17
Al2O3-3NiO-1050
62.2
0.21
5.6
18
Al2O3-10NiO-700
228.0
0.44
2.9
19
Al2O3-10Fe2O3-700
195.4
0.40
3.3
20
Al2O3-10NiO-10Co3O4-700
195.0
0.38
3.3
21
Al2O3-10NiO-10Co3O4-10MgO-700
195.3
0.38
3.3
22
Al2O3-10Fe2O3-10Co3O4-700
198.3
0.40
3.2
23
Al2O3-10Fe2O3-10Co3O4-10MgO-700
200.0
0.39
3.3
22
Al2O3-2RuOx-400
204.5
0.27
2.0
а Приведено среднее значение размера пор.
(4) помещали исследуемый материал и устанавли-
емкости после окончания эксперимента также
вали его в шахтную печь. Подсоединяли реакци-
проводили отбор проб газовой фазы в кюветы
онную камеру к гидрозатвору с глицерином (2) и
для ИК спектроскопии из газового пространства
к реактору с исследуемым материалом (4), а затем
системы [реакционная камера с N2O (3), реактор
к накопительной емкости для сбора газообраз-
с исследуемым композитом (4), соединительные
ных продуктов с участием N2O объемом 1400 см3
шланги]. Перед измерением ИК спектров газовой
(5). Накопительную емкость предварительно ва-
фазы из накопительной емкости и системы прово-
куумировали с помощью форвакуумного насоса.
дили измерение фоновых ИК спектров используе-
Включали нагрев шахтной печи и устанавливали
мых кювет.
требуемую температуру композита.
Измерение ИК спектров проводили на спек-
После монтажа всей лабораторной установки
трометре Specord M80. Перед измерением ИК
и нагрева композита на установке открывали все
спектров давление в газовых кюветах доводили
краны и начинали отбор N2O из реакционной ка-
до атмосферного с помощью газообразного азота.
меры в накопительную емкость для сбора газо-
Количественную оценку содержания N2O прово-
образных продуктов с участием N2O. Проводили
дили по градуировочным кривым для полос n =
отбор газовой фазы из накопительной емкости
2240 и 1300 см-1 [12, 13]. Точность измерения
в кюветы для измерения ИК спектров. Газовые
±10%.
кюветы для ИК спектроскопии с окнами из KBr
Исходное количество N2O находилось в интер-
имели объем 125 см3 и длину поглощающего слоя
вале от ~0.8 до ~3.4 ммоль/л. Скорость воздуха (v)
100 мм. Помимо отбора проб из накопительной
составляла 0.1-0.2 л/мин, время контакта газовой
РАДИОХИМИЯ том 62 № 2 2020
134
КУЛЮХИН и др.
3.0
10
2.5
8
2.0
6
1.5
4
1.0
2
0.5
0.0
0
300
400
500
600
700
800
400
450
500
550
600
650
700
750
T, K
T, K
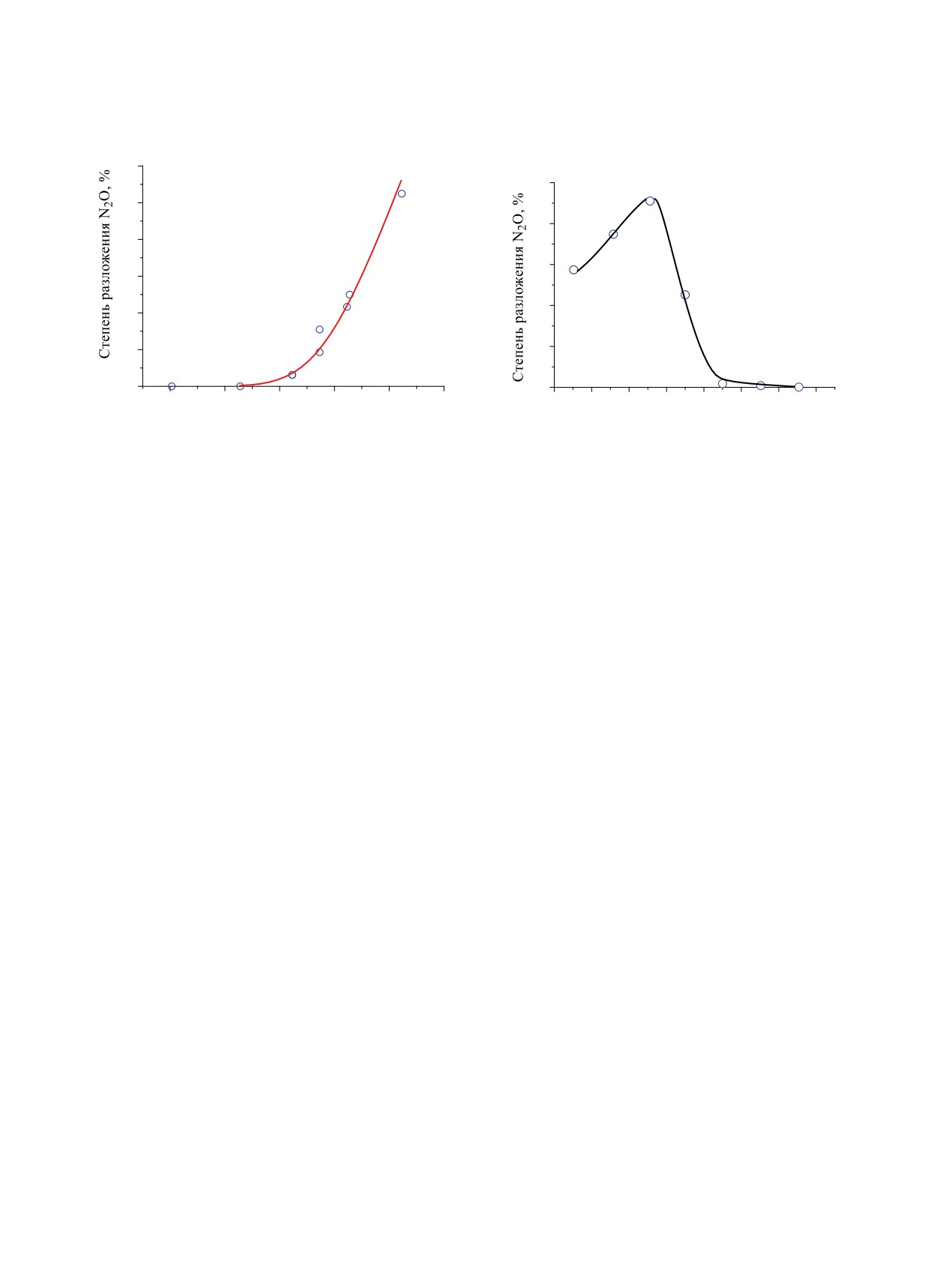
Рис. 2. Температурная зависимость степени разложе-
Рис. 3. Зависимость степени разложения N2O на ком-
ния N2O.
позите Al2O3-7Cu-2Амк от температуры.
фазы с материалом внутри реактора (τ) находи-
ложению в отсутствие композитов. В работе [14]
лось в диапазоне от ~1.5 до ~13.5 с. Температура
отмечено, что в отсутствие катализатора терми-
материала внутри реактора изменялась от ~423 до
ческое разложение при 673-803 К незначительно
~743 К. Точность измерения температуры ±3°С.
(0.22-0.23%). С другой стороны, в работе [15] от-
Термогравиметрический анализ компози-
мечено, что при температуре выше 773 К происхо-
тов проводили с использованием дериватогра-
дит полное разложение N2O на N2 и O2. Поскольку
фа марки Q-1500 системы Paulik-Paulik-Erdey
цель нашей работы заключалась в создании ма-
(МОМ, Будапешт, Венгрия). Образцы нагревали
териалов для разложения N2O в газовых потоках
в Pt-тиглях в атмосфере воздуха со скоростью
при температурах не выше 773 К, нами предвари-
10°С/мин.
тельно был изучено термическое разложение N2O
в диапазоне температур от 298 до 723 К в динами-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ческих условиях.
В табл. 2 представлены физические адсорбци-
На рис.
2 приведена зависимость степени
онные характеристики некоторых исследованных
разложения 2.9 ммоль/л N2O от температуры.
композитных материалов и исходного γ-Al2O3.
Воздушный поток, содержащий N2O, находился в
Как видно из табл. 2, синтезированные компо-
зоне нагрева в течение 5-6 с.
зиты, за исключением материалов, прокаленных
Как видно из рис. 2, степень разложения N2O
при 1323 К, имеют хорошо развитую поверхность
при 723 К составляет ~2.75%, что заметно отли-
(170-260 м2/г) и относительно большой размер
чается от данных, приведенных в работе [14]. При
пор (2-7 нм). В результате термической обработки
температуре 523, 623 и 723 К степень разложения
материалов при 1323 К удельная поверхность ком-
N2O составляет ~0.2, ~1.3 и ~2.75% соответствен-
позитных материалов снижается более чем в 5 раз.
но, т.е. при изменении температуры от 523 К до
Исходя из данных табл. 2, можно предположить,
723 К разлагается от 0.004 до 0.054 ммоль/л N2O.
что химическая обработка исходного γ-Al2O3 не-
значительно влияет на физические адсорбционные
При 423 К термического разложения N2O не про-
свойства материалов. Основное изменение данных
исходит.
характеристик композитов происходит в процессе
В табл. 3 приведены данные по разложению
их высокотемпературной обработки.
N2O в процессе пропускания воздушного пото-
Прежде, чем приступить к исследованиям ката-
ка через слой различных композитов на осно-
литического разложения N2O, мы провели предва-
ве γ-Al2O3, нагретых до температуры от ~423 до
рительные исследования по его термическому раз-
~743 К.
РАДИОХИМИЯ том 62 № 2 2020
КАТАЛИТИЧЕСКОЕ РАЗЛОЖЕНИЕ N2O
135
Таблица 3. Данные по разложению N2O в воздушном потоке в присутствии композитов на основе γ-Al2O3 (vгаза =
0.1-0.2 л/мин, содержание влаги в воздухе = 3-4 об.%, Sреактора = 2.85 см2)а
№
m(N2O), мМ
Композит
Ткомп, К
h, см
τ, c
α, %
эксп.
исходная
конечная
1б
Al2O3-7Cu-2Амк
526
4.6
4.9
0.85
0.79
~7.1
2б
Al2O3-7Cu-2Амк
426
4.9
6.7
3.04
2.86
~5.9
3б
Al2O3-7Cu-2Амк
527
2.7
1.7
3.04
2.90
~4.6
4б
Al2O3-7Cu-2Амк
528
4.8
8.0
3.21
2.92
~9.0
5б
Al2O3-7Cu-2Амк
525
9.0
19.8
3.30
2.97
~10.0
6б
Al2O3-7Cu-2Амк
625
4.8
6.2
3.21
3.20
~0.3
7б
Al2O3-7Cu-2Амк
727
4.9
7.2
3.08
3.08
< 0.01
8б
Al2O3-7Cu-2Амк-1050
527
7.4
6.4
3.13
3.07
~1.9
9б
Al2O3-7Cu-2Амк-1050
731
7.4
6.3
3.35
3.06
~8.7
10б
Al2O3-7Cu-24Амк
525
4.1
4.5
0.80
0.72
~10.0
11б
Al2O3-7Cu-24Амк
528
4.3
6.5
2.95
2.68
~9.2
12б
Al2O3-7Cu-24Амк
726
4.5
5.8
3.35
3.17
~5.4
13б
Al2O3-7Ni-2Амк
526
4.8
7.2
3.21
3.16
~1.6
14б
Al2O3-7Ni-2Амк
733
4.8
6.5
2.99
2.98
~0.3
15б
Al2O3-7Ni-24Амк
526
4.4
6.2
3.04
2.86
~5.9
16б
Al2O3-7Ni-24Амк
726
4.2
6.0
3.21
3.08
~4.0
17б
Al2O3-7Fe-2Амк
525
4.8
7.9
3.04
2.95
~3.0
18б
Al2O3-7Fe-2Амк
727
4.5
9.3
3.13
3.13
< 0.01
19б
Al2O3-7Fe-2Амк-ГГ
524
4.6
2.6
1.07
1.05
~1.9
20б
Al2O3-7Fe-24Амк
523
4.0
4.2
0.76
0.70
~7.9
21б
Al2O3-7Fe-24Амк
526
4.4
6.3
3.04
2.76
~9.2
22б
Al2O3-7Fe-24Амк
728
4.5
6.9
3.17
2.83
~10.7
23б
Al2O3-7Ni0
426
4.5
6.0
3.13
2.99
~4.5
24б
Al2O3-7Ni0
527
4.5
6.1
2.95
2.76
~6.4
25б
Al2O3-10Ni0
527
4.5
4.6
0.89
0.84
~5.6
26б
Al2O3-10Ni0
426
7.2
5.6
3.35
2.98
~11.0
27б
Al2O3-10Ni0
526
7.2
7.2
3.26
2.73
~16.3
28
Al2O3-10MgO-700
528
5.8
3.4
1.61
1.61
~0.2
29
Al2O3-10MgO-700
628
5.7
4.4
1.61
1.61
~0.2
30
Al2O3-10MgO-700
723
5.3
3.5
1.38
1.15
~16.5
31
Al2O3-10MgO-1050
526
5.6
3.0
1.70
1.67
~1.5
32
Al2O3-10MgO-1050
625
5.7
4.2
1.70
1.69
~0.3
33
Al2O3-10MgO-1050
723
5.0
3.7
1.33
1.24
~6.7
34
Al2O3-10Co3O4-700
526
5.4
3.4
1.88
1.88
~0.2
35
Al2O3-10Co3O4-700
625
5.4
3.5
1.52
1.51
~0.4
36
Al2O3-10Co3O4-700
733
5.0
4.1
1.43
1.34
~6.4
37
Al2O3-10CoO-1050
530
5.5
4.4
1.70
1.69
~0.3
38
Al2O3-10CoO-1050
626
5.3
4.2
1.65
1.62
~1.7
39
Al2O3-10CoO-1050
723
5.0
3.7
1.33
1.24
~6.7
40
Al2O3-4CuO-700
525
5.6
3.5
1.61
1.59
~1.1
41
Al2O3-4CuO-700
624
5.5
3.4
1.21
1.12
~7.4
42
Al2O3-4Cu2O-1050
525
5.6
3.0
1.52
1.45
~4.6
43
Al2O3-4Cu2O-1050
626
5.4
3.4
1.83
1.79
~2.0
44
Al2O3-3NiO-700
529
5.7
3.2
1.79
1.75
~2.5
45
Al2O3-3NiO-700
625
5.8
3.4
1.61
1.58
~1.7
РАДИОХИМИЯ том 62 № 2 2020
136
КУЛЮХИН и др.
Таблица 3. (продолжение)
№
m(N2O), мМ
Композит
Ткомп, К
h, см
τ, c
α, %
эксп.
исходная
конечная
46
Al2O3-10NiO-700
527
6.0
4.0
1.34
1.28
~4.7
47
Al2O3-10NiO-700
729
5.5
4.4
1.34
1.20
~10.5
48
Al2O3-3NiO-1050
528
5.8
3.7
1.70
1.68
~1.1
49
Al2O3-3NiO-1050
626
5.8
3.3
1.43
1.37
~4.1
50
Al2O3-10Fe2O3-700
523
6.0
4.6
1.47
1.45
~1.5
51
Al2O3-10Fe2O3-700
729
5.8
4.4
1.43
1.27
~11.4
52
Al2O3-10NiO-10Co3O4-700
527
6.0
3.7
1.29
1.29
< 0.001
53
Al2O3-10NiO-10Co3O4-700
740
5.4
4.4
1.29
1.08
~16.9
54
Al2O3-10NiO-10Co3O4-10MgO-700
525
5.8
3.6
1.52
1.49
~2.1
55
Al2O3-10NiO-10Co3O4-10MgO-700
742
5.4
4.2
1.47
1.41
~4.1
56
Al2O3-10Fe2O3-10Co3O4-700
524
5.9
3.9
1.47
1.47
< 0.001
57
Al2O3-10Fe2O3-10Co3O4-700
735
5.7
5.3
1.43
1.07
~24.8
58
Al2O3-10Fe2O3-10Co3O4-10MgO-700
524
5.8
3.3
1.56
1.54
~1.4
59
Al2O3-10Fe2O3-10Co3O4-10MgO-700
737
5.5
4.3
1.43
1.40
~2.2
60б
Al2O3-4RuO2
423
6.8
6.4
0.31
0.29
~6.5
61б
Al2O3-4RuO2
424
6.5
6.0
0.98
0.80
~18.4
62б
Al2O3-RuO2
384
5.5
8.5
3.04
2.85
~6.3
63б
Al2O3-RuO2
525
3.9
5.1
3.26
2.95
~9.5
64б
Al2O3-4RuO2
425
6.8
6.4
3.13
2.58
~17.6
65в
Al2O3-nRuO2
626
21.7
13.1
0.98
0.57
~42.3
66
Al2O3-2RuO2-400
525
5.9
3.4
1.12
1.12
< 0.001
67
Al2O3-2RuO2-400
625
5.7
3.9
1.21
1.20
~1.9
68
Al2O3-2RuO2-400
726
5.9
3.3
1.43
0.85
~40.3
a Примечание: h - высота слоя композита в реакторе; τ - время контакта газовой фазы с композитом в реакторе; α - степень раз-
ложения N2O
б Результаты получены в ходе выполнения договора № 60-13 от 15 октября 2013 г. на тему: «Физико-химические исследования
фазового состава газовых сред, образующихся в технологических операциях растворения нитридного топлива и газоочистки» в
рамках проекта «Прорыв»
в Опыт проводили на двух последовательно соединенных колонках, содержащих по два слоя материалов. 1-я колонка - Al2O3-
4RuO2 (m = 15.5 г, h = 6.0 см) (нижний слой) и Al2O3-4RuO2, использованный в эксп. 7 данной таблицы (m = 15.1 г, h = 7.0 см)
(верхний слой). 2-я колонка - Al2O3-4RuO2 с диаметром частиц менее 1 мм (m = 4.1 г, h = 2.7 см) (нижний слой) и Al2O3-RuO2
(m = 10.9 г, h = 6.0 см) (верхний слой). Газ поступал в колонки снизу вверх.
Как видно из табл. 3, в процессе пропускания
Аналогичное падение эффективности разло-
газового потока, содержащего различные количе-
жения также наблюдается для композитов Al2O3-
ства N2O, через слой композита на основе γ-Al2O3,
7Ni-2Амк и Al2O3-7Fe-2Амк (эксп. 13, 14, 17 и 18
имеющего различную температуру, разлагается от
в табл. 3).
0.02 до 0.55 ммоль/л N2O. При этом степень разло-
Наблюдаемое явление можно объяснить тем
жения во всех случаях не превышает 20%.
фактом, что в системе с композитами Al2O3-7M-
Исследование зависимости степени разложения
2Амк (M = CuII, NiII, FeIII) при температуре выше
N2O от температуры композита типа Al2O3-7МII-
573 К одновременно протекает 2 независимых
2Амк показало, что в первый момент при увели-
процесса - каталитическое разложение N2O и об-
чении температуры до 523 К степень разложения
разование N2O в результате деструкции композита.
N2O возрастает, однако при дальнейшем увели-
Согласно работе [16] образование N2O при терми-
чении температуры до 723 К степень разложения
ческом разложении нитратов d-элементов может
резко уменьшается (эксп. 2, 4, 6 и 7 в табл. 3).
быть представлено следующими реакциями:
На рис. 3 приведена зависимость изменения
M(NO3)n·mH2O → MxOy
степени разложения N2O (2.9-3.2 ммоль/л) от тем-
пературы для композита Al2O3-7Cu-2Амк.
+ (HNO3, NO, NO2, O2, H2O),
(1)
РАДИОХИМИЯ том 62 № 2 2020
КАТАЛИТИЧЕСКОЕ РАЗЛОЖЕНИЕ N2O
137
2NO → N2O2,
(2)
Важно отметить, что снижение концентрации
N2O2 + NO = N2O + NO2.
(3)
N2O в воздушном потоке не приводит к уменьше-
нию степени разложения N2O, которая сохраняет-
Именно из-за протекания реакций образования
ся на уровне 7-10% (эксп. 1 и 5 в табл. 3).
N2O при термическом разложении нитратов d-эле-
ментов, входящих в состав композитов, нами не
В работе [17] для разложения N2O в инерт-
обнаружено снижения количества N2O в воздухе.
ной атмосфере использован катализатор Ni0/α-
Как видно из табл. 3, кондиционирование ком-
Al2O3. Установлено, что при разложении N2O на
позитов типа Al2O3-7МII-24Амк (M = Cu, Ni) при
Ni-катализаторе вся поверхность металлического
873 К в течение 5 ч также, по-видимому, не при-
никеля покрывается адсорбированными атомами
водит к заметному разложению нитратов d-эле-
кислорода, образующимися при разложении N2O.
ментов в составе композитов. В результате нами
Именно по этой причине на поверхности катализа-
наблюдалось некоторое снижение степени разло-
тора не происходит сорбции N2 и N2O. В процессе
жения N2O в газовом потоке при росте темпера-
контакта каждая молекула N2O, сорбированная на
туры композита в реакторе (эксп. 11, 12, 15 и 16 в
катализаторе, подвергается разложению с обра-
табл. 3).
зованием газообразного N2 и хемосорбированной
В случае композита Al2O3-7Fe-24Амк конди-
молекулы кислорода. При температуре до 338 К
ционирование способствовало повышению его
N2O не разлагается на катализаторе. Учитывая
каталитической эффективности в процессе разло-
результаты данной работы, мы провели экспери-
жения N2O (эксп. 21 и 22 в табл. 3).
менты по каталитическому разложению N2O в
Дальнейшее кондиционирование композита
воздушном потоке в присутствии композитов на
Al2O3-7Cu-2Амк при температуре 1323 К приво-
основе γ-Al2O3, содержащих 7 и 10 мас% Ni0.
дит к полному разложению нитрата меди в составе
Как видно из табл. 3, исследованные компози-
материала. Для полученных материалов увеличе-
ты Al2O3-nNi0 (n = 7, 10) обладают достаточно вы-
ние их температуры в процессе разложения N2O
сокой эффективностью разложения N2O. Уже при
приводит к заметному повышению их каталити-
426 К использование данных композитов позво-
ческой активности, направленной на разложение
ляет обезвреживать от ~0.15 до ~0.4 ммоль/л N2O
N2O (эксп. 8 и 9 в табл. 3). Однако эффективность
при его исходном количестве около ~3.1 ммоль/л
разложения N2O остается относительно низкой и
(эксп. 23 и 26 в табл. 3). Увеличение температуры
не превышает ~10%.
композита приводит к росту степени разложения
Модифицирование композита путем обработки
N2O. Так, например, для обоих композитов увели-
гидразингидратом также не оказывает положи-
чение температуры до 526-527 К приводит к повы-
тельного эффекта на разложение N2O (эксп. 19 в
шению степени разложения N2O в ~1.5 раза (эксп.
табл. 3).
23, 24, 26 и 27 в табл. 3). Снижение концентрации
Помимо условий приготовления композитов
N2O в воздушном потоке приводит к уменьше-
на степень разложения N2O заметно влияет вре-
нию не только количества разложенного N2O, но и
мя контакта газового потока и твердой фазы. Чем
степени разложения с ~16 до ~5% (эксп. 25 и 27 в
больше время контакта, тем выше степень разло-
табл. 3). Это связано, по-видимому, с возрастанием
жения N2O. На примере Al2O3-7Cu-2Амк нами
конкурирующего действия кислорода воздуха при
исследована зависимость степени разложения N2O
уменьшении концентрации N2O в газовом потоке.
от времени контакта газовой фазы и композита.
В работах [18-21] приведены данные по пове-
Как видно из эксп. 3-5 в табл. 3, при одинаковой
дению оксидов металлов (NiO, Co3O4, CoO, CuO,
скорости газового потока с ростом высоты слоя
MgO), смешанных оксидов металлов (твердые
композита в реакторе и, следовательно, увеличе-
нием времени контакта возрастает степень разло-
растворы и шпинели), а также благородных ме-
жения N2O. Однако, если для слоев толщиной 2.7
таллов (Pt, Au, Ru, Rh) в процессах разложения
и 4.8 см степень разложения изменяется в 2 раза,
N2O. Установлено, что каталитическая активность
то дальнейшее увеличение высоты слоя до 9.0 см
в процессе разложения N2O в присутствии кис-
приводит лишь к незначительному росту степени
лорода изменяется в ряду: NiO > Co3O4 > CuO >
разложения N2O.
MnO2 ~ MgO > Fe3O4 > Al2O3. Исследование ката-
РАДИОХИМИЯ том 62 № 2 2020
138
КУЛЮХИН и др.
литической активности MgO, CaO, и SrO показа-
обладают относительно низкой эффективностью
ло, что полная конверсия N2O достигается при T >
разложения N2O в воздушном потоке при темпера-
673 К [22]. В работе [23] приведены температуры
туре ~(523-743) К (эксп. 52-59 в табл. 3). Степень
50%-ного разложения N2O, которые равны 573 К
разложения N2O в воздушном потоке не превыша-
для NiO, 655 К для Co3O4, 638 К для CuO, 773 К
ет ~25.0%. Следует отметить, что максимальное
для MgO, 773 К для Fe3O4, >773 К для Al2O3. При
значение, равное ~24.8%, получено при исполь-
этом в технологических процессах исследованы в
зовании композита Al2O3-10Fe2O3-10Co3O4-
основном катализаторы на инертных носителях, в
10MgO-700, имеющего температуру ~733 К.
том числе на Al2O3 (CuO/Al2O3 и CuAl2O4/Al2O3
Таким образом, использование композитов на
(BASF), CuO/Al2O3 (Asahi Chemical) [24], γ-Al2O3-
основе γ-Al2O3, содержащих оксиды Mg, Ni, Co
Fe2O3 [25]).
и Fe, не позволяет достигнуть максимальных сте-
В связи с этим представляло интерес исследо-
пеней разложения N2O в диапазоне температур до
вать возможность разложения N2O в воздушном
~743 К.
потоке в присутствии катализаторов на основе
Как показано в работах [30, 31], эффективны-
γ-Al2O3, содержащего оксиды Mg, Cu, Ni, Co и Fe.
ми катализаторами разложения N2O являются ма-
Причем, как показано в работе [26], прокаливание
териалы, содержащие Ru. В работе [31] описан
γ-Al2O3, содержащего оксиды Ni, Co и Cu, приво-
синтез катализатора на основе γ-Al2O3, содержа-
дит к образованию шпинели MAl2O4 на поверхно-
щего 0.4-1.0 мас% Ru в виде нанометровых частиц
сти гранул γ-Al2O3.
Ru0. Металлические частицы были синтезированы
В результате исследований установлено, что
путем восстановления Ru этиленгликолем (ЭГ).
все композиты состава Al2O3-10MOx (M = Mg, Ni,
Восстановление ЭГ позволяет получать практи-
Co, Fe), независимо от температуры кондициони-
чески сферические частицы металлического Ru с
рования прекурсоров, обладают низкой эффектив-
размером 1-3 нм и дисперсией 70-35%. Для дан-
ностью разложения N2O в воздушном потоке при
ного катализатора 100%-ная конверсия N2O дости-
температуре ~(523-723) К (эксп. 28-51 в табл. 3).
гается при 748 К. Отмечено, что увеличение коли-
Степень разложения N2O в воздушном потоке не
чества Ru с 0.38 мас% до 0.98 мас% незначительно
превышает ~17.0%.
увеличивает каталитическую активность материа-
Известно, что одним из катализаторов, име-
ла. В составе катализатора на основе γ-Al2O3 Ru
ющим высокую каталитическую активность в
может находиться в других химических формах,
исследованных условиях, является шпинель ко-
например RuO2. Данные о каталитических свой-
бальта [27]. Ее модифицирование путем замеще-
ствах композитов состава Al2O3-nRuO2 в процес-
ния кобальта другими переходными металлами
сах разложения N2O крайне ограничены. В связи с
(Zn, Ni, Cu, Mn, Al) или ионами ЩЗЭ (Mg, Ca, Sr)
этим представляло интерес исследовать каталити-
приводит к увеличению каталитической активно-
ческие свойства композитов состава Al2O3-nRuO2
сти Co3O4. В работах [28, 29] установлено, что
в процессах обезвреживания N2O.
частичная замена Co2+ в Co3O4 на Ni2+, Zn2+ или
Как видно из табл. 3, композиты Al2O3-nRuO2
Mg2+ заметно улучшает каталитические свойства
(n = 1, 4) способны участвовать в процессе ло-
шпинели кобальта. В связи с этим представляло
кализации N2O из воздушного потока. Так, при
интерес исследовать эффективность разложения
пропускании газового потока, содержащего 3.1-
N2O в воздушном потоке в присутствии компо-
3.3 ммоль/л N2O, через слой композита, имеющего
зитов, содержащих одновременно различные ок-
температуру 383-423 К, степень разложения N2O
сиды металлов. С целью проверки данного явле-
составляет ~(6-17)%, т.е. в условиях эксперимен-
ния нами исследованы композиты состава Al2O3-
та происходит разложение от ~0.2 до ~0.6 ммоль/л
10MOx-10Co3O4-700 и Al2O3-10MOx-10Co3O4-
N2O (эксп. 60-62, 64 в табл. 3). При увеличении
10MgO-700 (M = Ni, Fe).
температуры композита до ~523 К количество раз-
Установлено, что все исследованные ком-
ложившегося N2O возрастает в ~1.5 раза (эксп. 63
позиты состава Al2O3-10MOx-10Co3O4-700 и
в табл. 3), однако в этих условиях наблюдается за-
Al2O3-10MOx-10Co3O4-10MgO-700 (M = Ni, Fe)
метный унос Ru с катализатора. Это связано с пре-
РАДИОХИМИЯ том 62 № 2 2020
КАТАЛИТИЧЕСКОЕ РАЗЛОЖЕНИЕ N2O
139
вращением малолетучего RuO2 в хорошо летучий
343 K
RuO4 под действием кислорода воздуха. В связи
0
T
1000
423 K
с этим оптимальная температура для применения
-5
TG
данного композита составляет 423 К.
-10
800
593 K
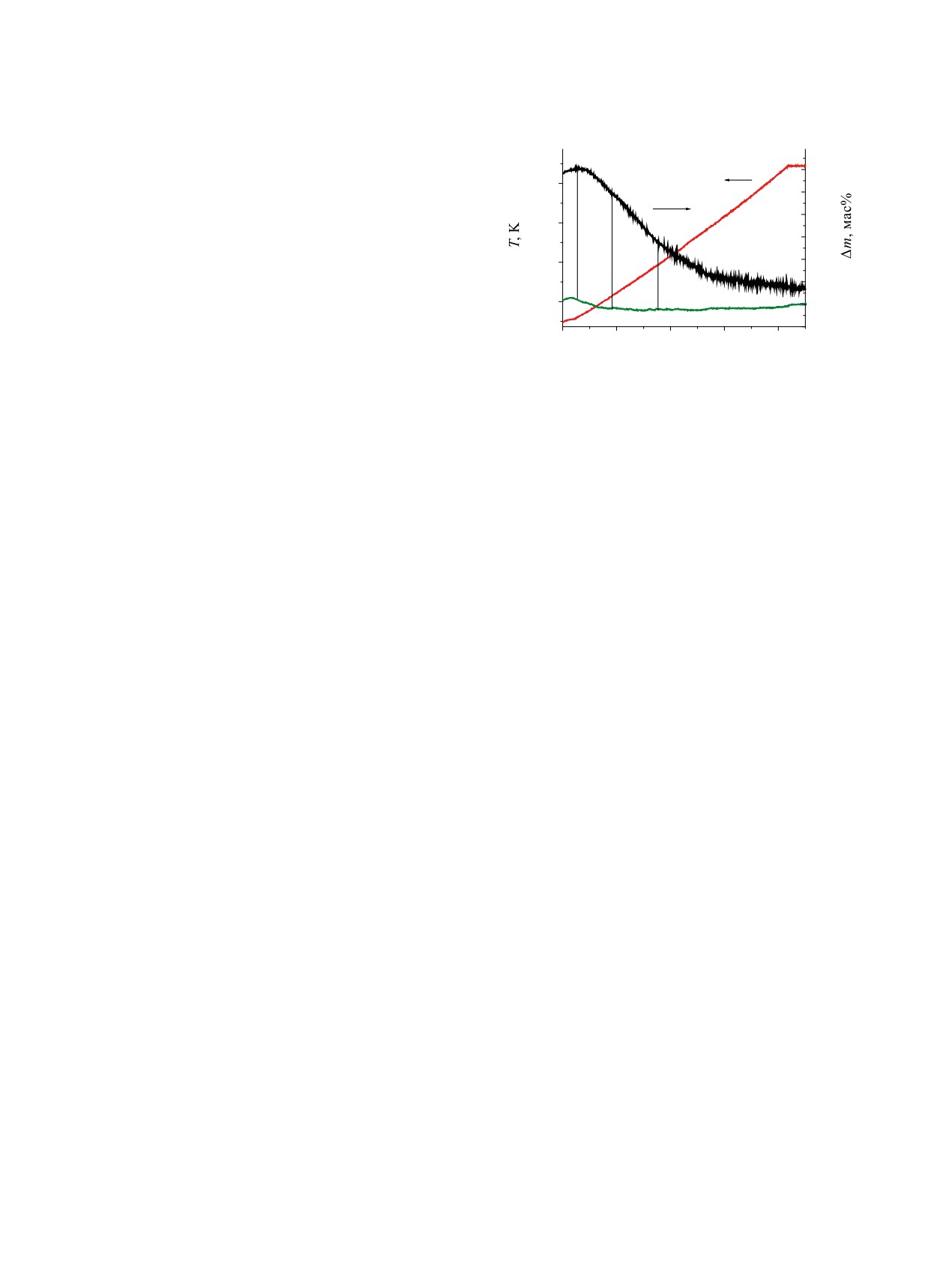
На рис. 4 представлены данные термогравиме-
–15
трического анализа композита Al2O3-4RuO2.
-20
600
Как видно из рис. 4, на кривой DTA отсутству-
-25
ют как эндо-, так и экзоэффекты. При нагревании
400
DTA
-30
образцов Al2O3-4RuO2 до температуры 1073 К
–35
0
20
40
60
80
происходит постепенная потеря массы, связан-
Время, мин
ная с протеканием различных процессов, плавно
переходящих друг в друга. Общая потеря массы
Рис. 4. Данные термогравиметрического анализа ком-
позита Al2O3-4RuO2 (навеска 269.0 мг).
составляет 24 мас%. Можно предположить, что в
интервале температур 343-423 К уменьшение мас-
нее 1 мм (m = 4.1 г, h = 2.7 см), а верхний - из
сы связано с потерей адсорбированной воды. В ин-
Al2O3-RuO2 (m = 10.9 г, h = 6.0 см) (верхний слой).
тервале температур 423-593 К происходит как по-
В результате общая высота композита в двух ко-
теря адсорбированной воды, так и частичная воз-
лонках составила 21.7 см. Газ в колонки поступал
гонка Ru в виде RuO4. Выше температуры 593 К,
снизу вверх со скоростью 0.24 л/мин. Время кон-
по-видимому, потеря массы связана только с воз-
такта газовой фазы с композитом в пересчете на
гонкой Ru в виде RuO4. Основная потеря массы
две колонки составило ~13.1 с. Температура ком-
композита (около 22 мас%) наблюдается при на-
позита равнялась 629±7 К.
гревании образца до 813 К.
Одновременное повышение температуры ком-
Следует отметить, что снижение концентрации
позита и времени контакта с ним газовой фазы по-
N2O в воздушном потоке с ~3.1 до ~1.0 ммоль/л
зволяет увеличить степень разложения N2O. Так,
при одинаковых экспериментальных условиях
в экспериментах с одинаковым количеством N2O
практически не вызывает снижения степени раз-
увеличение температуры с ~423 до ~628 К и вре-
ложения N2O (~17-19%), хотя абсолютное количе-
мени контакта с ~6.0 до ~13.1 с приводит к уве-
ство разложившегося N2O уменьшается с ~0.6 до
личению степени разложения N2O с ~18 до ~42%
~0.2 ммоль/л (эксп. 61 и 64 в табл. 3). Дальнейшее
(эксп. 61 и 65 в табл. 3).
снижение количества N2O в воздушном пото-
Как следует из эксп. 65 в табл. 3, одним из фак-
ке приводит к уменьшению не только абсолют-
торов, влияющих на степень разложения N2O в
ного количества разложившегося N2O с ~0.2 до
воздушном потоке, является температура компо-
~0.02 ммоль/л, но и степени разложения N2O с ~18
зита. Действительно, как следует из эксп. 66-68 в
до ~6% (эксп. 60 и 61 в табл. 3).
табл. 3, даже при времени контакта газового по-
Учитывая относительно высокие каталитиче-
тока с композитом 3-4 с увеличение температуры
ски свойства Al2O3-nRuO2 (n = 1, 4), мы прове-
композита Al2O3-2RuO2-400 с ~523 до ~728 К при-
ли эксперимент при повышенной температуре и
водит к возрастанию степени разложения N2O в
увеличенном времени контакта газового потока с
воздушном потоке с <0.001 до ~40.3%.
катализатором (эксп. 65 в табл. 3). Для этой цели
Анализируя данные табл. 3, можно сделать вы-
были использованы две последовательно соеди-
вод о том, что для разложения N2O в воздушном
ненные колонки, содержащие по 2 слоя композита.
потоке наиболее подходящими являются компо-
В первой колонке нижний слой состоял из свежего
зитные материалы на основе γ-Al2O3, содержащие
Al2O3-4RuO2 (m = 15.5 г, h = 6.0 см), а в верхнем
RuO2.
слое применяли Al2O3-4RuO2, который ранее ис-
пользовали в экспериментах по разложению N2O
Учитывая результаты эксп. 65 в табл. 3, с це-
(m = 15.1 г, h = 7.0 см). Во второй колонке исполь-
лью достижения более высокой степени разло-
зовали свежие сорбенты. При этом нижний слой
жения N2O в воздушном потоке были проведены
состоял из Al2O3-4RuO2 с диаметром частиц ме-
эксперименты с увеличенным количеством компо-
РАДИОХИМИЯ том 62 № 2 2020
140
КУЛЮХИН и др.
Таблица 4. Данные по разложению N2O в воздушном потоке в присутствии композита Al2O3-2RuO2-400 (vгаза =
0.4-0.6 л/мин, содержание влаги в воздухе = 3-4 об.%, hслоя композита = 15.0 см, Sреактора = 5.00 см2)
m(N2O), мМ
№ эксп.
Общее время эксперимента, сут
Ткомп, К
τ, c
α, %
исходная
конечная
1
0
698
11.5
1.21
0.65
~45.9
2
4
700
8.8
1.29
0.53
~59.0
3
6
716
14.7
1.07
0.28
~73.8
4
12
710
7.2
1.12
0.44
~60.4
5
17
715
9.6
1.16
0.23
~80.0
6
19
733
12.6
1.21
0.11
~91.3
7
24
720
10.7
1.25
0.14
~88.8
8
26
710
11.8
0.54
0.08
~85.9
9
28
722
12.3
0.49
0.05
~89.5
10
32
741
12.6
2.68
0.20
~92.6
11
34
722
13.1
2.63
0.46
~82.5
12
68
744
11.5
1.21
0.10
~92.0
13
73
743
11.8
1.21
0.15
~87.7
14
76
739
12.9
2.41
0.15
~93.9
15
80
738
14.5
2.46
0.17
~92.9
16
82
740
13.7
0.71
< 0.001
~99.9
17
89
731
14.2
0.71
0.06
~90.9
18
95
536
14.2
1.25
1.24
~1.1
19
97
628
13.9
1.43
1.33
~7.0
20
102
753
13.4
1.29
0.01
~99.0
зита Al2O3-2RuO2-400. В экспериментах навеска
при одинаковой температуре возрастает. Так, при
композита составляла 60 г, высота слоя компози-
температуре композита ~710 К при уменьшении
та в реакторе с площадью поперечного сечения
количества N2O в воздушном потоке с ~1.12 до
5.0 см2 равнялась 15.0 см. Скорость газового по-
~0.54 ммоль/л степень разложения N2O возраста-
тока составляла 0.4-0.6 л/мин, время контакта га-
ет с ~60 до ~86% (эксп. 4 и 8 в табл. 4). Следует
зовая фаза-композит изменялось в диапазоне от
отметить, что в диапазоне температур компози-
7 до 15 с. Все эксперименты проводили на одной
та от ~713 до ~753 К степень разложения ~(0.5-
2.7) ммоль/л N2O превышает ~80% (эксп. 5-17 и
и той же загрузке, т.е. композит между экспери-
20 в табл. 4). При этом, несмотря на то, что компо-
ментами не меняли, а только продували воздухом
зит постоянно испытывает чередующиеся процес-
для удаления следов N2O, оставшихся в системе
сы нагревания до заданной температуры и остыва-
от предыдущего эксперимента. Таким образом, в
ния до комнатной температуры, он сохраняет свои
процессе эксперимента композит подвергался пе-
каталитические свойства в отношении N2O.
риодическому циклу нагревание-остывание. Весь
Как следует из эксп. 18 в табл. 4, при температу-
эксперимент продолжался в течение 102 сут. При
ре композита ~433 К разложения N2O практически
этом в процессе эксперимента меняли как количе-
не происходит. Как отмечалось ранее, увеличение
ство N2O в воздушном потоке, так и температуру
температуры композита приводит к повышению
композита.
степени разложения N2O. Действительно, при тем-
В табл. 4 представлены данные по разложению
пературе композита ~628 К степень разложения
N2O в воздушном потоке в присутствии композита
N2O увеличивается, но незначительно (всего до
Al2O3-2RuO2-400.
~7%) (эксп. 19 в табл. 4). Однако дальнейшее по-
Как видно из табл. 4, при температуре компо-
вышение температуры композита до ~753 К при-
зита выше 708 К степень разложения N2O превы-
водит к резкому возрастанию его каталитической
шает ~60%. При этом с уменьшением количества
активности. Степень разложения N2O в этих усло-
N2O в газовом потоке степень его разложения
виях увеличивается до ~99% (эксп. 20 в табл. 4).
РАДИОХИМИЯ том 62 № 2 2020
КАТАЛИТИЧЕСКОЕ РАЗЛОЖЕНИЕ N2O
141
В заключение можно отметить, что в отличие
9.
Kaczmarczyk J., Zasada F., Janas J. et al. // ACS
от коммерчески доступных катализаторов, кото-
Catalysis. 2016. Vol. 6, N 2. P. 1235.
10.
Ivanova Yu.A., Sutormina E.F., Isupova I.A., Vovk E.I. //
рые, независимо от состава, начинают эффектив-
Kinet. Catal. 2017. Vol. 58, N. 6. P. 793.
но разлагать N2O только в основном в инертной
11.
Селиверстов А.Ф., Лагунова Ю.О., Кулюхин С.А.,
среде с низким содержанием кислорода и паров
Ершов Б.Г. // ЖПХ. 2017. Т. 90, № 3. С. 332.
воды при температурах выше 773 К, композит
12.
База данных ИК спектров. IR-Spektrensammlung der
Al2O3-2RuO2-400 при практически одинаковой
температуре (738-753 К) позволяет осуществить
щения: 10.02.2019 г.
практически полное разложение N2O в воздуш-
13.
База данных NIST Standard Reference Database
ном потоке. При этом время контакта воздушного
потока составляет всего 7-15 с. Данный композит
посещения: 10.02.2019.
может найти применение в системах газоочистки
14.
Леонтьев А.В., Фомичева О.А., Проскурнина М.В.,
установок денитрации высокоактивного рафината
Зефиров Н.С. // Успехи химии. 2001. Т. 70, № 2.
и кубового раствора, образовавшихся при упари-
C. 107.
15.
Энциклопедия знаний Pandia.ru. Азота окислы //
вании САО переработки высоковыгоревшего ни-
тридного ОЯТ реактора на быстрых нейтронах.
10.02.2019 г.
ФОНДОВАЯ ПОДДЕРЖКА
16.
Mateski A., Mateski B. // Thermochim. Acta. 2006.
Vol. 446. P. 113.
Работа выполнена при частичном финанси-
17.
Tada S., Yokoyama M., Kikuchi R. et al. // J. Phys.
ровании Министерством науки и высшего обра-
Chem. C. 2013. Vol. 117, N 28. P. 14652.
зования Российской Федерации (тема № АААА-
18.
Yan L., Ren T., Wang X. et al. // Appl. Catal. B. 2003.
А18-118021990023-6)».
Vol. 45. P. 85.
19.
Yan L., Zhang X., Ren T. et al. // Chem. Commun. 2002.
КОНФЛИКТ ИНТЕРЕСОВ
P. 860.
Авторы заявляют об отсутствии конфликта
20.
Dacquin J.P., Lancelot C., Dujardin C. et al. // Appl.
интересов.
Catal. B: Environmental. 2009. Vol. 91, N 3-4. P. 596.
21.
Wu Y., Dujardin C., Granger P. et al. // J. Phys. Chem.
СПИСОК ЛИТЕРАТУРЫ
C. 2013. Vol. 117, N 27. P. 13989.
1. Устинов О.А, Кулюхин С.А., Воскресенская Ю.А. и
22.
Piskorz W., Zasada F., Stelmachowski P. et al. // J. Phys.
др. // Атом. энергия. 2014. Т. 117, № 6. С. 329.
Chem. C. 2013. Vol. 117, N 36. P. 18488.
2. Kulyukhin S.A., Shadrin A.Yu., Voskresenskaya Yu.A.
23.
Ohnishi C., Asano K., Iwamoto S. et al. // Catal. Today.
et al. // J. Radioanal. Nucl. Chem. 2015. Vol. 304,
2007. Vol. 120. P. 145.
N 1. P. 425.
24.
Shimizu A., Tanaka K., Fujimori M. // Chemosphere.
3. Kosonen H., Heinonen M., Mikola A. et al. // Environ.
2000. Vol. 2. P. 425.
Sci. Technol. 2016. Vol. 50, N 11. P. 5547.
25.
Giecko G., Borowiecki T., Gac W., Kruk J. // Catal.
4. Зильберман Б.Я., Рябков Д.В., Мишина Н.Е. и др.
Today. 2008. Vol. 137. P. 403.
Способ концентрирования радиоактивных отходов //
26.
Gonçalves A.A.S., Costa M.J.F., Zhang L. et al. // Chem.
Патент РФ № 2596816. Заяв. 30.06.2015. Опубл.
Mater. 2018. Vol. 30, N 2. P. 436.
10.09.2016. Бюлл. № 25.
27.
Zasada F., Stelmachowski P., Maniak G. et al. // Catal.
5. Устинов О.А., Шадрин А.Ю., Баташов М.В. и др. //
Lett. 2009. Vol. 127, N 1-2. P. 126.
Атом. энергия. 2018. Т. 124, № 2. С. 86.
28.
Chellam U., Xu Z.P., Zeng H.C. // Chem. Mater. 2000.
6. Устинов О.А., Якунин С.А. // Атом. энергия. 2016.
Vol. 12. P. 650.
Т. 120, № 2. С. 112.
29.
Yan L., Ren T., Wang X. et al. // Catal. Comm. 2003.
7. Konsolakis M. // ACS Catalysis. 2015. Vol. 5, N 11.
Vol. 4. P. 505.
P. 6397.
30.
Спецов Е.А. // ЖПХ. 2015. Т. 88, № 9. С. 1233.
8. Cornelissen G., Rutherford D.W., Arp H.P.H. et al. //
31.
Komvokisa V.G., Martic M., Delimitis A. et al. // Appl.
Environ. Sci. Technol. 2013. Vol. 47, N 14. P. 7704.
Catal. B: Environmental. 2011. Vol. 103, N 1-2. P. 62.
РАДИОХИМИЯ том 62 № 2 2020