РАДИОХИМИЯ, 2020, том 62, № 2, с. 114-122
УДК 539.26+546.798.21
НИТРАТНЫЕ КОМПЛЕКСЫ НЕПТУНИЯ(V)
С КАТИОНАМИ ЩЕЛОЧНЫХ МЕТАЛЛОВ ВО
ВНЕШНЕЙ СФЕРЕ
© 2020 г. И. А. Чарушниковаa,*, М. С. Григорьевa, А. М. Федосеевa,
А. А. Бессоновa, К. А. Лысенкоb
a Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., 31, корп. 4;
b Институт элементоорганических соединений им. А. Н. Несмеянова РАН, 119071, Москва, ул. Вавилова, 28
*e-mail: charushnikovai@ipc.rssi.ru
Получена 05.03.2019, после доработки 19.04.2019, принята к публикации 20.04.2019
Выделены в кристаллическом виде и исследованы методом рентгеноструктурного анали-
за нитратные комплексы пятивалентного нептуния со щелочными катионами во внешней сфе-
ре состава Li[NpO2(NO3)2]·2H2O (I), Na[NpO2(NO3)2]·2H2O (II), Cs3[NpO2(NO3)2]3·H2O (III),
NaRb5[NpO2(NO3)2]6·4H2O (IV). В комплексах осуществляется катион-катионное (КК) взаимодействие
ионов NpO2+, приводящее к образованию квадратных (I, II) или тригонально-гексагональных (III, IV) ка-
тионных сеток. Атомы Np в структурах I-IV имеют координационное окружение в виде гексагональных
бипирамид, экваториальную плоскость которых формируют атомы кислорода двух бидентатно-цикли-
ческих нитрат-ионов и двух соседних катионов NpO2+. Высокое качество монокристалла соединения II
позволило провести прецизионный рентгенодифракционный эксперимент (2θmax = 120°) и впервые для
соединения Np осуществить исследование распределения электронной плотности ρ(r). Приведены ИК
и электронный спектр поглощения соединения II.
Ключевые слова: нептуний(V), синтез, кристаллическая структура, катион-катионное взаимодействие,
распределение электронной плотности, электронные спектры поглощения, ИК спектры
DOI: 10.31857/S0033831120020021
Нитратные соединения нептуния(V) ис-
лов от Li+ до Cs+ во внешней сфере. Были получе-
следованы довольно подробно, однако струк-
ны соединения состава Li[NpO2(NO3)2]·2H2O (I),
турно охарактеризованы всего пять со-
Na[NpO2(NO3)2]·2H2O (II), Cs3[NpO2(NO3)2]3·H2O
единений:
[(NpO2)2(NO3)2(H2O)4]·H2O
(III), NaRb5[NpO2(NO3)2]6·4H2O (IV).
[1],
[NpO2(CH3CONH2)2(NO3)]
[2],
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Cs4[(NpO2)2Cl4NpO2Cl2(NO3)(H2O)]
[3], анион-
Все соединения, за исключением II, были
ный нитратный комплекс La(NpO2)3(NO3)6∙nH2O
синтезированы по единой методике: к раствору
[4] и смешанно-элементный Th(IV)/Np(V) нитрат
~0.05 моль/л NpO2NO3, полученному растворени-
состава
[H3O][Th2(NpO2)3(H2O)9(NO3)12]∙2H2O
ем гидроксида нептуноила, осаждённого из запас-
[5]. Принимая во внимание, что в технологии и
ного раствора Np(V) раствором гидроксида натрия
лабораторной практике используются в основном
с последующей промывкой водой, в 0.3 моль/л
азотнокислые растворы нептуния, представляется
HNO3, добавляли нитрат соответствующего кати-
целесообразным расширить круг изученных ани-
она до концентрации последнего ~0.5-1.0 моль/л
онных нитратных комплексов нептуноила с внеш-
и оставляли при комнатной температуре для мед-
несферными катионами различной природы.
ленной кристаллизации. Цвет всех полученных
Была предпринята попытка выделить кристал-
комплексов с катионами щелочных металлов оха-
лы нитратов Np(V) с катионами щелочных метал-
рактеризовать как светло-желтый.
114
НИТР
АТНЫЕ КОМПЛЕКСЫ НЕПТУНИЯ(V)
115
Таблица 1. Кристаллографические данные и характеристики рентгеноструктурного эксперимента
Параметр
I
II
III
IV
Формула
H4N2O10LiNp
H4N2O10NaNp
H2N6O25Cs3Np3
H8N12O52NaRb5Np6
М
435.99
452.04
1595.81
2880.52
Сингония
Моноклинная
Моноклинная
Тригональная
Моноклинная
-
Пространственная группа.
C2/c
C2/c
P3
P21/n
Параметры ячейки:
a, Å
22.4581(8)
23.0536(5)
8.1654(1)
8.1743(2)
b, Å
5.8974(2)
6.0016(1)
8.1654(1)
20.6898(6)
c, Å
5.8124(2)
6.0159(1)
12.1520(4)
14.1987(3)
β, град
92.089(2)
91.1531(9)
90
90.083(2)
V, Å3; Z
769.31(5); 4
832.18(3); 4
701.67(3); 1
2401.35(10); 2
ρвыч., г/см3
3.764
3.608
3.777
3.984
μ(MoKα), мм-1
8.792
8.177
10.851
13.408
Количество измеренных/независимых
6385/1720
79480/5278
9825/1713
36630/10448
отражений
Количество независимых отражений
1542
4253
1311
7156
с I > 2σ(I)
Количество уточняемых параметров
72
73
58
322
R(F); wR(F2) [I > 2σ(I)]
0.0304; 0.0809
0.0098; 0.0217
0.0570; 0.1662
0.0630; 0.1428
R(F); wR(F2) [весь массив]
0.0327; 0.0827
0.0147; 0.0231
0.0738; 0.1821
0.1004; 0.1594
GOOF
1.120
1.066
1.059
1.050
Δρmax и Δρmin, e·Å-3
8.499; -2.964
2.153; -1.841
7.833; -4.893
5.852; -10.460
Монокристаллы натриевого соединения II по-
жащих Na[NpO2(NO3)2]·2H2O проводили на спек-
лучены при очень медленном испарении при ком-
торфотометре Shimadzu UV-3100. Регистрацию
натной температуре водного раствора, содержаще-
ИК спектров осуществляли при помощи спектро-
го эквимолярные количества NaNO3 и NpO2NO3,
метра Specord-M80.
(pH 6-7). Электронный спектр поглощения (ЭСП)
Рентгенодифракционные эксперименты про-
кристаллического II измеряли по стандартной ме-
ведены на автоматическом четырехкружном диф-
тодике [6], приготавливая спрессованные образцы
рактометре с двумерным детектором Bruker Kappa
с использованием предварительно плавленого для
Apex II (излучение MoKα) при 100 K. Измерены
удаления следов влаги NaCl в качестве материала
интенсивности рефлексов в полусфере обратно-
матрицы. Содержание Na[NpO2(NO3)2]·2H2O в об-
го пространства. Параметры элементарных яче-
разце составляло около 2.8 мас%. Поскольку при
ек уточнены по всему массиву данных. В экспе-
съёмке ЭСП кристаллических соединений важ-
риментальные интенсивности введены поправки
ным обстоятельством является достижение макси-
на поглощение с помощью программы SADABS
мально возможного равномерного распределения
[7]. Структуры расшифрованы прямым методом
вещества по объему таблетки, чтобы убедится в
(SHELXS97
[8]) и уточнены полноматричным
этом, производили несколько последовательных
методом наименьших квадратов (SHELXL-2014
измерений до получения воспроизводимого по
[9]) по F2 по всем данным в анизотропном при-
интенсивности светопоглощения спектра. После
ближении для всех неводородных атомов. Атомы
каждого измерения таблетку-образец соедине-
ния II возвращали в агатовую ступку, тщатель-
H молекул воды в структурах I и II локализованы
но растирали и заново спрессовывали образец.
из разностного Фурье-синтеза и уточнены с UН =
Параллельно регистрировали ИК спектры образца
1.5Uэкв(O) и ограничением расстояний O-H и
соединения II с целью убедиться в их идентично-
углов H-O-H. В кристалле соединения III катион
сти и, таким образом, в отсутствии твердофазного
цезия Cs2 и молекула воды (атом O1w) размещают-
взаимодействия исследуемого вещества с матери-
ся в одной и той же позиции. Уточнение их пози-
алом матрицы. Измерение ЭСП образцов, содер-
ционных и температурных параметров проводили
РАДИОХИМИЯ том 62 № 2 2020
116
ЧАРУШНИКОВА и др.
Таблица
2. Некоторые длины связей (d) и валентные углы (ω) в структурах Li[NpO2(NO3)2]·2H2O (I),
Na[NpO2(NO3)2]·2H2O (II) и Cs3[NpO2(NO3)2]3·H2O (III)a
Соединение
I
II
III
Соединение
I
II
III
Связь
d, Å
Угол
ω, град
Np1=O1
1.836(2)·2
1.8442(5)·2
1.835(6)·2
O1Np1O1a
180.0
180.0
180.0
Np1-O1b
2.440(2)·2
2.4673(5)·2
2.408(6)·2
O1bNp1O2
65.93(9)·2
66.269(16)·2
66.7(3)·2
Np1-O2
2.565(3)·2
2.6017(5)·2
2.527(13)·2
O1cNp1O3
66.64(8)·2
65.643(16)·2
65.2(4)·2
Np1-O3
2.628(3)·2
2.5847(5)·2
2.533(13)·2
O2Np1O3
48.85(8)·2
48.997(16)·2
50.3(4)·2
N1-O2
1.276(4)
1.2565(7)
1.254(16)
O2N1O3
116.1(3)
117.03(5)
117.8(17)
N1-O3
1.257(4)
1.2655(7)
1.257(16)
O2N1O4
121.7(3)
121.44(5)
121(2)
N1-O4
1.237(4)
1.2386(7)
1.205(17)
O3N1O4
122.2(3)
121.53(5)
121(2)
Np1···Np1d
4.1401
4.2488
4.0827
Np1O1Np1d
150.72(13)
160.22 (3)
148.1(3)
a Операции симметрии: I: a - (3/2-x, 3/2-y, 1-z); b - (3/2-x, y-1/2, 1/2-z); c - (x, 2-y, z+1/2); d - (3/2-x, y+1/2, 1/2-z). II: a - (1/2-x,
3/2-y, 1-z); b - (1/2-x, y+1/2, 3/2-z); c - (x, 1-y, z-1/2); d - (1/2-x, y-1/2, 3/2-z). III: a - (1-x, 1-y, 1-z); b - (y, -x+y, 1-z); c - (1-y,
1+x-y, z); d - (-x+y, 1-x, z)
Таблица 3. Длины связей (d) и валентные углы (ω) в КП атомов Np структуры NaRb5[NpO2(NO3)2]6·4H2O (IV)a
Связь
d, Å
Связь
d, Å
Связь
d, Å
Np1=O1
1.853(9)
Np2=O3
1.846(8)
Np3=O5
1.851(8)
Np1=O2
1.864(9)
Np2=O4
1.860(9)
Np3=O6
1.855(9)
Np1-O5a
2.415(8)
Np2-O1c
2.428(9)
Np3-O3d
2.409(9)
Np1-O6b
2.436(9)
Np2-O2
2.388(9)
Np3-O4
2.372(9)
Np1-O7
2.514(8)
Np2-O13
2.554(9)
Np3-O19
2.525(9)
Np1-O8
2.563(9)
Np2-O14
2.534(9)
Np3-O20
2.584(9)
Np1-O10
2.564(9)
Np2-O16
2.565(8)
Np3-O22
2.561(8)
Np1-O11
2.541(8)
Np2-O17
2.553(9)
Np3-O23
2.562(9)
Np1···Np2
4.0999
Np2···Np3
4.0728
Np3···Np1
4.1137(5)
Угол
ω, град
Угол
ω, град
Угол
ω, град
O1Np1O2
178.8(4)
O3Np2O4
178.4(4)
O5Np3O6
177.6(4)
O5aNp1O8
63.5(3)
O1cNp2O13
66.9(3)
O3dNp3O19
64.7(3)
O5aNp1O11
64.6(3)
O1cNp2O16
65.1(3)
O3dNp3O22
63.6(3)
O6bNp1O7
65.1(3)
O2Np2O14
65.8(3)
O4Np3O20
66.7(3)
O6bNp1O10
67.7(3)
O2Np2O17
64.5(3)
O4Np3O23
66.7(3)
O7Np1O8
50.3(2)
O13Np2O14
49.9(3)
O19Np3O20
49.5(3)
O10Np1O11
49.7(2)
O16Np2O17
49.5(2)
O22Np3O23
49.7(3)
Np1O1Np2b
147.0(5)
Np2O3Np3a
148.9(5)
Np3O5Np1d
148.5(5)
Np1O2Np2
149.0(5)
Np2O4Np3
148.2(5)
Np3O6Np1c
146.7(5)
a Операции симметрии: a - (1+x, y, z); b - (x+1/2, -y+1/2, z+1/2), c - (x-1/2, -y+1/2, z-1/2); d - (x-1, y, z).
с половинными кратностями, атомы H у молекулы
Основные кристаллографические данные и
воды III не локализовывали. В структуре IV пози-
характеристики рентгеноструктурного экспери-
ции атомов H у молекулы воды O1w локализованы
мента приведены в табл. 1. Длины связей и ва-
лентные углы в структурах I-IV приведены в
из Фурье-синтеза, у молекулы воды O2w найдены с
табл. 2, 3. Координаты атомов депонированы в
помощью программы [10].
Кембриджский центр кристаллографических дан-
Кристаллы нитрата Np(V) с катионами K+ во
ных, депоненты CCDC 1896397-1896400.
внешней сфере оказались сростками, что не по-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИE
зволило выделить подходящий для РСА кристалл.
Соединение с катионами Rb+ во внешней сфере
Строение комплексов Li[NpO2(NO3)2]·2H2O
рентгеноаморфно.
(I) и Na[NpO2(NO3)2]·2H2O (II). Нитраты
РАДИОХИМИЯ том 62 № 2 2020
НИТР
АТНЫЕ КОМПЛЕКСЫ НЕПТУНИЯ(V)
117
Na1
O1w
O4a
c
0
N1a
O2a
O1b
Np1c
O3a
Np
1
O1c
O1a
O1a
O1
Np1
b
1c
O
O1
O1b
Np1b
O2
O3
N1
O4
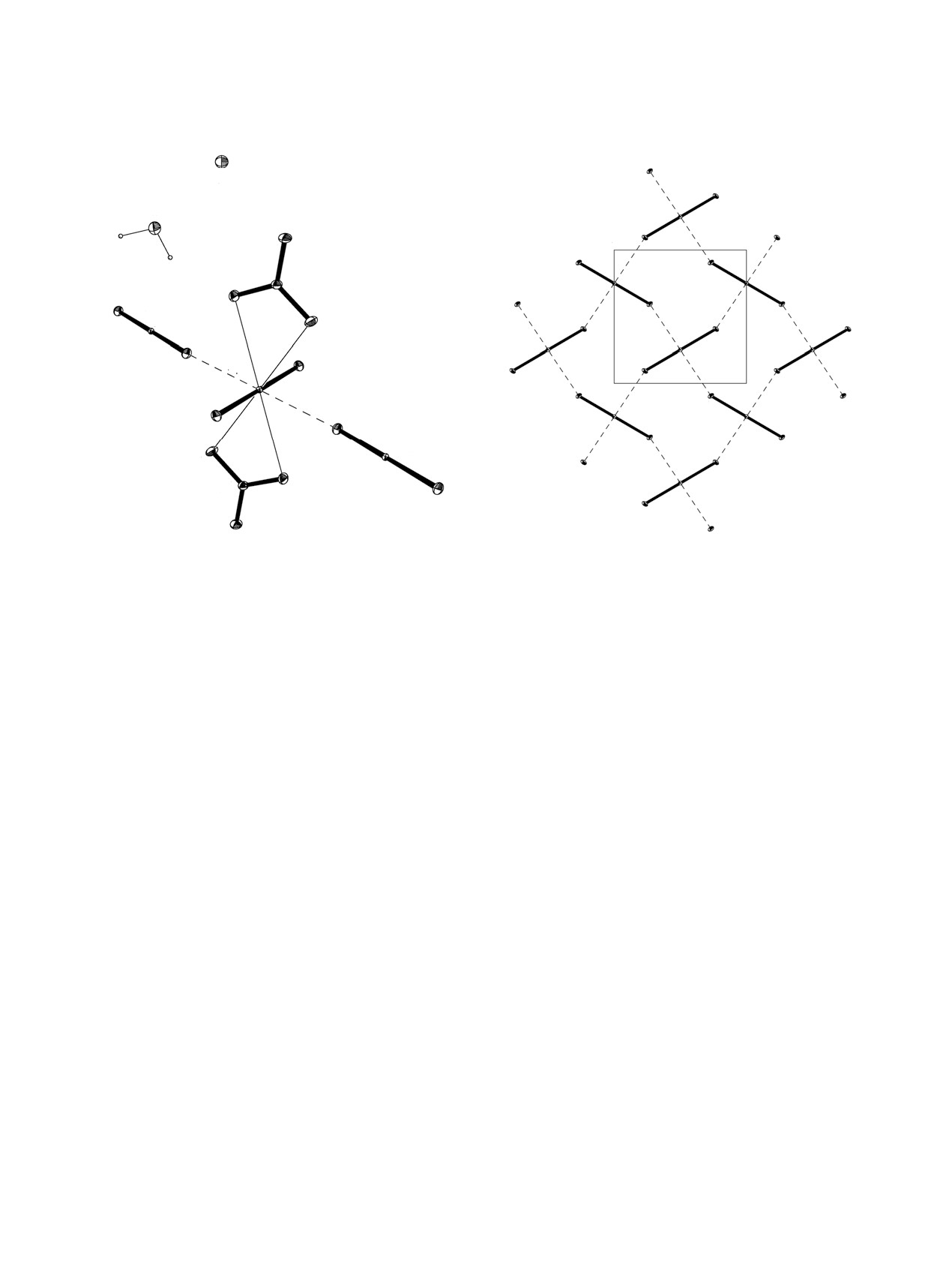
Рис. 1. Фрагмент структуры Na[NpO2(NO3)2]·2H2O
Рис. 2. Катионная сетка в структуре Li[NpO2(NO3)2]·
(II). Эллипсоиды температурных смещений даны с
2H2O (I). Проекция на плоскость (011). Пунктирными
вероятностью 50%. Пунктирными линиями показаны
линиями показаны КК связи. Операции симметрии:
КК связи. Операции симметрии: a - (1/2-x, 3/2-y, 1-z);
a - (3/2-x, 3/2-y, 1-z); b - (3/2-x, y-1/2, 1/2-z); c - (x,
b - (1/2-x, 1/2+y, 3/2-z); c - (x, 1-y, z-1/2).
2-y, 1/2+z).
Li[NpO2(NO3)2]·2H2O (I) и Na[NpO2(NO3)2]·2H2O
но-мостикового лиганда, связываясь в квадратные
(II) изоструктурны, они состоят из комплексных
сетки, представленные на рис. 2 на примере ли-
анионов [NpO2(NO3)2]-, катионов Li+ (или Na+) и
тиевого соединения. Подобные катионные сетки
молекул воды.
присутствуют во многих соединения пятивалент-
Атомы Np в обеих структурах расположены в
ного нептуния [11]. Бидентатно-циклические ни-
центрах инверсии (позиция 4c) и имеют коорди-
трат-ионы располагаются по обе стороны катион-
национное окружение в виде гексагональных би-
ных сеток, в результате образуются анионные слои
пирамид с атомами кислорода групп NpO2 в апи-
[NpO2(NO3)2]nn-, перпендикулярные направлению
кальных позициях. Экваториальную плоскость
[100] в кристаллах I и II.
бипирамид формируют атомы кислорода двух
Атомы Li (I) [или Na (II)] локализуются в част-
нитрат-ионов и двух соседних катионов NpO2+.
ных позициях на осях второго порядка, их окру-
Координационный полиэдр (КП) атомов Np и ну-
жение в виде искажённых октаэдров формируют
мерация атомов в структурах I и II показаны на
атомы кислорода четырёх молекул воды [длины
рис. 1 на примере натриевого соединения. Длины
связей Li-Ow 2.029(7) и 2.120(3) Å; длины свя-
связей внутри координационного окружения ато-
зей Na-Ow 2.3271(7) и 2.3467(6) Å] и двух атомов
мов Np представлены в табл. 2. Отклонения атомов
кислорода O4 нитрат-ионов из соседних слоёв
кислорода от среднеквадратичной плоскости эква-
[NpO2(NO3)2]nn- [длины связей Li-Onitr 2.378(8) Å,
ториального окружения диоксокатионов NpO2+ не
Na-Onitr 2.4360(6) Å]. Полиэдры Li и Na связывают-
превышают 0.184(2) Å (I), 0.1465(4) Å (II).
ся общими рёбрами [O1w···O1w] в зигзагообразные
В структурах I и II катионы NpO2+ участвуют в
цепочки вдоль направления [001], расположенные
катион-катионном (КК) взаимодействии, выступая
между слоями. Межатомные расстояния Li···Li в
одновременно в роли координационного центра
цепочках равны 3.039(6) Å, Na···Na - 3.2269(4) Å.
для двух соседних диоксокатионов и бидентат-
Водородные связи с участием молекул воды и ато-
РАДИОХИМИЯ том 62 № 2 2020
118
ЧАРУШНИКОВА и др.
Таблица 4. Водородные связи с молекулами воды в структурах I и II
D-H…A
D-H, Å
H…A, Å
D…A, Å
D-H…A, град
Операция симметрии для A
Li[NpO2(NO3)2]·2H2O (I)
O1w-H1···O2
0.843(19)
1.98(3)
2.770(4)
155(6)
O1w-H2···O4
0.850(19)
2.42(6)
2.982(4)
124(5)
1/2-x, 3/2+y, 3/2-z
Na[NpO2(NO3)2]·2H2O (II)
O1w-H1···O3
0.854(16)
2.039(17)
2.8142(8)
151(2)
1/2-x, 3/2+y, 1-z
O1w-H2···O4
0.843(16)
2.038(17)
2.8620(8)
165(3)
1/2-x, 1/2+y, 1-z
мов кислорода нитрат-ионов (табл. 4) связывают
ции 2c, атом Cs2 в позиции 2d. Атом Cs1 локали-
цепочки из КП атомов Li (или Na) и анионные
зуется в гексагональном канале, и его окружение
слои [NpO2(NO3)2]nn-.
формируют атомы кислорода одного анионного
слоя. Атом Cs2 локализуется между анионными
Следует отметить, что в структурах I, II водо-
слоями, его координационное окружение в виде
родное взаимодействие типа Ow-H···O заметно
тригональной призмы формируют по три конце-
влияет на длины связей N-O в анионах NO3- и
вых атома нитрат-ионов из соседних слоёв, дли-
длины связей Np-Onitr в КП атомов Np. Например,
ны связей Cs2-O4 равны 3.04(2) Å. Как отмечалось
в структуре I H-связи образуются между молеку-
выше, в кристалле этот катион Cs+ делит позицию
лами воды гидратной оболочки катионов Li+ и ни-
с молекулой воды, следовательно, она разупорядо-
трат-ионами. В анионе NO3- имеет место заметное
чена относительно оси 3. Молекула воды образует
различие в длинах связей N1-O2 и N1-O3 (табл. 2),
слабые водородные связи типа O1w-H···O4.
атом O2 как акцептор протона участвует в прочном
водородном связывании (табл. 4). Внутри КП ато-
Был проведён сравнительный анализ координа-
ма Np1 длина связи Np1-O2 заметно короче связи
ционного окружения катионов Cs+ в структуре с
Np1-O3. Иными словами, для атома кислорода O2
использованием программы TOPOS [12]. Анализ
ослабление ковалентной связи с атомом азота со-
подтвердил КЧ 6 для атома Cs2, вклад этих вза-
провождается упрочнением координационной свя-
имодействий составляет ~100%. Для Cs1 вклад
зи с атомом нептуния.
контактов с атомами O2 и O3 составляет ~59%. На
расстоянии 3.853(9) Å имеются шесть контактов с
Строение комплексов Cs3[NpO2(NO3)2]3·H2O
атомом кислорода O1, которые дают вклад ~22%.
(III), NaRb5[NpO2(NO3)2]6·4H2O (IV). В структу-
Ещё ~16% дают вклады шести контактов с атома-
рах III, IV катионы NpO2+ также участвуют в КК
ми кислорода O4 на расстояниях 4.43(3) Å, причём
взаимодействии и связываются КК связями в пло-
ские тригонально-гексагональные сетки (рис. 3).
Координационное окружение атома Np в струк-
туре III такое же, как в структуре I (рис. 1, табл. 2).
Отклонение атомов кислорода от экваториальной
0
b
плоскости гексагональной бипирамиды атома Np
не превышает 0.102(7) Å. Межатомное расстояние
O1c
Np···Np в тригонально-гексагональной катион-
Np1
ной сетке структуры III меньше, чем в квадрат-
O1b
ной сетке структур I и II (табл. 2). Бидентатно-
O1a
циклические нитрат-ионы располагаются по обе
a
стороны плоской катионной сетки, образуя анион-
ные слои [NpO2(NO3)2]nn-, параллельные плоско-
сти (110) в кристалле, катионы Cs+ располагаются
в каналах вдоль оси c.
·
Рис. 3. Катионная сетка в структуре Cs3[NpO2(NO3)2]3
В структуре III локализованы два независимых
H2O (III). Проекция на плоскость (110). Пунктирными
катиона Cs+. Оба атома щелочного металла нахо-
линиями показаны КК связи. Операции симметрии:
дятся на осях третьего порядка, атом Cs1 в пози-
a - (1-x, 1-y, 1-z); b - (1-y, 1+x-y, z); c - (y, -x+y, 1-z).
РАДИОХИМИЯ том 62 № 2 2020
НИТР
АТНЫЕ КОМПЛЕКСЫ НЕПТУНИЯ(V)
119
атомы O4 являются непрямыми соседями атома
O22
O19
Cs1.
N6
Np3
N5
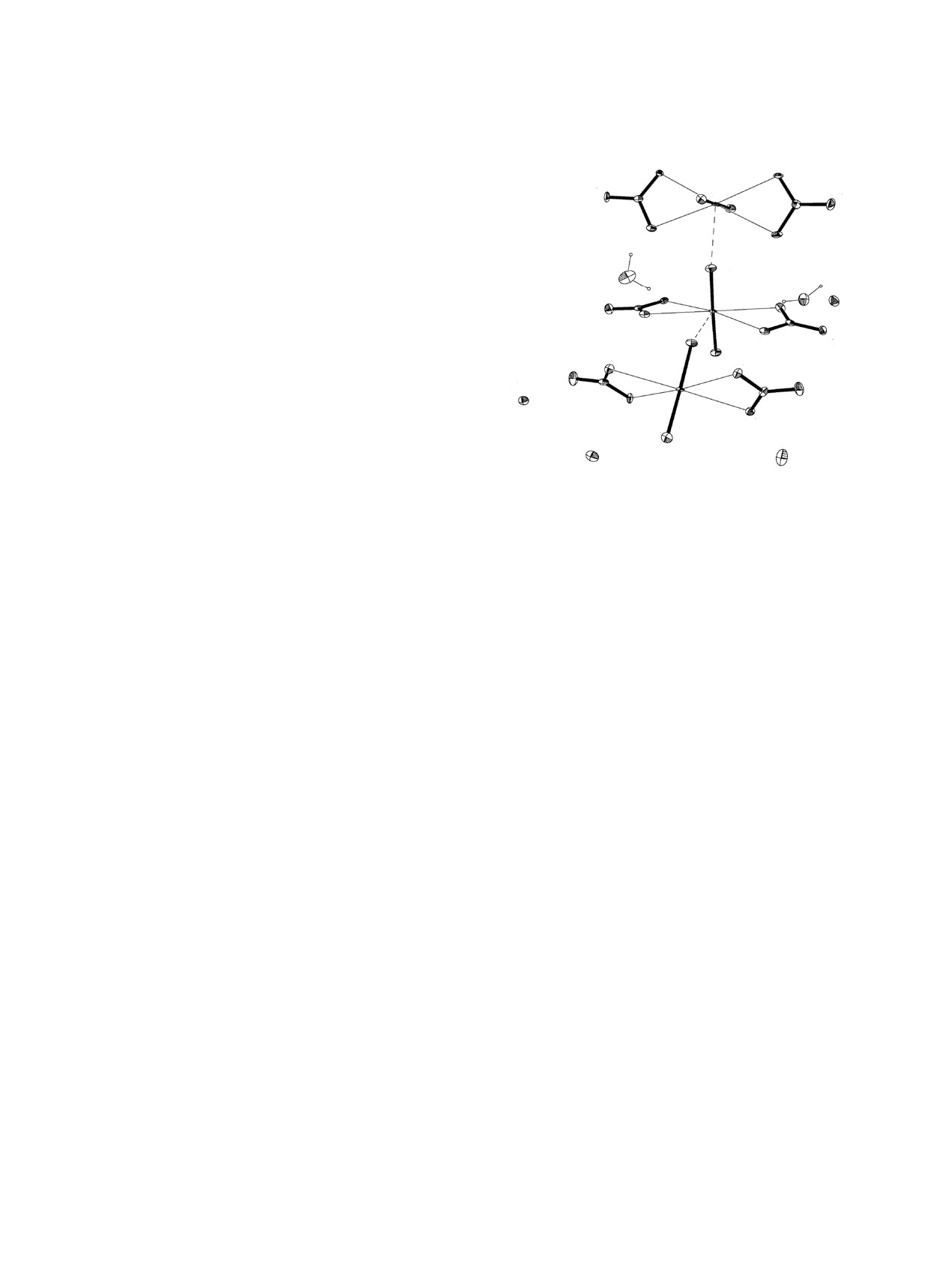
Структура IV состоит из комплексных анио-
O24
O5
O6
нов [NpO2(NO3)2]-, катионов Rb+, Na+ и молекул
O21
воды. Присутствие Na+ в составе комплекса, по
O23
O20
всей видимости, связано с недостаточно полным
O4
удалением гидроксида натрия из осадка гидрок-
O2w
O1w
O16
Na1
сида нептуноила путём промывки водой в данном
N4
Np2
O13
конкретном случае.
O18
O17
Три кристаллографически независимых ато-
O2
O3
O14 N3
O15
O10
ма нептуния имеют координационное окружение
O12
Np1
O9
O7 N1
в виде гексагональных бипирамид с двумя би-
N2
дентатно-циклическими нитрат-ионами и двумя
Rb1
O11
группами NpO2 в экваториальной плоскости. На
O8
рис. 4 представлено окружение атомов Np1, Np2
Rb3
Rb2
O24
и Np3 и нумерация атомов структуре, в табл. 3
приведены длины связей в КП атомов нептуния.
Рис. 4. Фрагмент структуры NaRb5[NpO2(NO3)2]6·4H2O
(IV). Эллипсоиды температурных смещений показаны
Максимальное отклонение атомов кислорода от
с 30% вероятностью. Пунктирными линиями показаны
среднеквадратичной плоскости экватора составля-
КК связи.
ет ±0.188(6), ±0.235(6), ±0.158(6) Å для полиэдров
Np1, Np2, Np3 соответственно.
трии в позиции 2d, его кислородное окружение в
Шесть кристаллографически независимых би-
виде искажённого октаэдра формируют концевые
дентатно-циклических анионов NO3- характеризу-
атомы кислорода нитрат-ионов O18, O24 и молеку-
ются такими же, как и в других соединениях, гео-
лы воды O1w. Длины связей внутри КП атома Na1
метрическими характеристиками. Средняя для ше-
лежат в пределах 2.383(9)-2.482(10) Å (среднее
сти анионов длина связей N-O с координационно
значение 2.446 Å).
связанными атомами кислорода равна 1.265(14) Å,
Катионы Na+ и Rb+ в кристалле соединения IV
для концевых атомов кислорода средняя длина
образуют катионные прослойки между анионны-
связей равна 1.227(14) Å. Бидентатные анионы,
ми слоями [NpO2(NO3)2]nn-. Две кристаллографи-
располагаясь по обе стороны тригонально-гекса-
ческии независимые молекулы воды включены в
гональной катионной сетки, образуют анионные
координационное окружение катионов Na+ и Rb+
слои [NpO2(NO3)2]nn-.
и являются донорами протонов в очень слабом во-
В структуре IV присутствуют три кристалло-
дородном связывании, в котором контакты Ow···O
графически независимых катиона Rb+. Атом Rb1
превышают 3 Å. Анализ свободного пространства
локализуется в центре симметрии в позиции 2c,
в кристалле показал, что в структуре IV нет места
атомы Rb2 и Rb3 - в общем положении. В целом
для размещения дополнительных молекул воды.
это даёт 5 атомов рубидия на одну формульную
КК взаимодействие в нитратах Np(V).
единицу. Координационное окружение атома Rb1 -
Распределение электронной плотности в струк-
12-вершинник, длины связей внутри полиэдра
туре Na[NpO2(NO3)2]·2H2O (II). Взаимная ко-
лежат в пределах 2.981(10)-3.424(10) Å (среднее
ординация катионов NpO2+ весьма часто наблю-
значение 3.137 Å). КП атома Rb2 - 14-вершин-
дается в структурах нитратов пятивалентного
ник, длины связей лежат в пределах 2.931(10)-
нептуния разного состава. Например, в нитрате
3.617(10) Å (среднее значение 3.283 Å). КП атома
состава [(NpO2)2(NO3)2(H2O)4]·H2O [1] КК вза-
Rb3 - 9-вершинник, длины связей изменяются от
имодействие приводит к образованию бесконеч-
2.812(9) до 3.774(9) Å (среднее значение 3.145 Å).
ных лент, содержащих два типа катионов NpO2+.
Недостаток положительного заряда компенси-
Катионы первого типа являются бидентатными
руется включением в структуру IV маленького ка-
лигандами с пентагонально-бипирамидальным
тиона Na+. Атом Na1 локализуется в центре симме-
кислородным окружением, второго типа - моно-
РАДИОХИМИЯ том 62 № 2 2020
120
ЧАРУШНИКОВА и др.
дентатными лигандами с гексагонально-бипира-
но выделить слои [Th2(NpO2)3(H2O)9(NO3)12]nn-,
мидальным окружением. В кристалле соединения
в которых осуществляется два типа катионных
[NpO2(CH3CONH2)2(NO3)] [2] образуются зигзаго-
связей: NpO2+···Th4+ и NpO2+···NpO2+, и КК взаимо-
образные цепочки, в которых катионы NpO2+ явля-
действие также является основным структурооб-
ются монодентатными лигандами с пентагональ-
разующим фактором. Трёхмерная сетка H-связей
но-бипирамидальным кислородным окружением.
дополнительно стабилизирует кристаллическую
В кристалле Cs4[(NpO2)2Cl4NpO2Cl2(NO3)(H2O)]
упаковку этого соединения, ионы оксония H3O+ и
[3] один из двух независимых катионов NpO2+ яв-
молекулы воды являются донорами протонов в во-
ляется бидентатным лигандом с пентагонально-
дородном связывании.
бипирамидальным кислородным окружением,
Исходя из корреляции длина связи-прочность
он скрепляет анионные цепочки состава
связи, можно сделать вывод, что катион-катион-
[(NpO2)2Cl4]n2n- в анионные слои. Нитрат-ион
ные связи в данных соединениях прочнее, чем ко-
входит в координационное окружение кати-
ординационные связи между атомом Np и атомами
она, образующего КК связи. Отметим, что
O нитрат-ионов. Высокое качество монокристалла
КК взаимодействие наблюдается и в смешан-
натриевого нитрата II позволило провести преци-
но-элементном Th(IV)/Np(V) нитрате
[H3O]
зионный рентгенодифракционный эксперимент
[Th2(NpO2)3(H2O)9(NO3)12]∙2H2O [5].
(2θmax = 120°) и впервые для пятивалентного неп-
туния провеcти рентгенодифракционные исследо-
Ранее исследовалось строение нитрата пя-
вания распределения электронной плотности ρ(r).
тивалентного нептуния с лантаном состава
La[NpO2(NO3)2]3·nH2O [4], в структуре которого
Для аналитического представления ρ(r) c учё-
впервые были найдены тригонально-гексагональ-
том её асферичности нами использовалась муль-
ные катионные сетки. Длины связей в гексагональ-
типольная модель Хансена-Коппенса, в рамках
ной бипирамиде атома Np равны: Np=O 1.852(4) Å,
которой электронная плотность каждого атома
представляется в виде суммы сферически симме-
Np-Oyl 2.417(4) Å, Np-Onitr 2.548(6) Å. Межатомное
тричных хартри-фоковских остовных и валентных
расстояние Np···Np равно 4.199 Å, угол Np-O-Np -
плотностей электронов, а также асферических
149.3(2)°. Все эти параметры близки к найден-
гармоник, описывающих деформацию валентной
ным в структурах III, IV. Особенностью строения
оболочки при образовании атомами химической
La[NpO2(NO3)2]3·nH2O является то, что катионы
связи:
La3+, расположенные между анионными слоями
at
3
[NpO2(NO3)2]nn-, окружены на расстоянии 2.45(4) Å
ρ
=
P
ρ (r)+κ'
P
ρ (κ'r)
core core
val val
+lmax
шестью разупорядоченными по двум позициям
max
l
l
κ ''R
(κ''r)
P
Y
(θφ),
молекулами воды. Концевые атомы кислорода би-
kl
lm m
+∑
∑
l
=0
m l
max
дентатных нитрат-ионов из окружения атома неп-
где Pcore, Pval, Plm - уточняемые методом наи-
туния в координации с атомом La не участвуют.
меньших квадратов коэффициенты заселенностей
Из вышеизложенного ясно, что КК взаимо-
мультиполей. Полное число электронов, связан-
действие играет важную роль в образовании кри-
ных с одним атомом, равно Pcore+Pval+Plm, (члены
сталлов нитратов пятивалентного нептуния, в
с l ≠ 0 при интегрировании по всему пространству
некоторых соединениях оно является основным
становятся равными нулю). Функции ρcore и ρval
структурообразующим фактором. Например, в
строятся из хартри-фоковских атомных орбиталей,
нитрате (NpO2)2(NO3)2·5H2O благодаря КК вза-
а в качестве радиальных выбраны слейтеровские
имодействию образуются электронейтральные
функции. В мультипольной модели уточняются
ленты состава
[Np1O2Np2O2(NO3)(H2O)4]n, ко-
торые связываются в кристалле H-связями. В
параметры расширения-сжатия валентной оболоч-
нитрате La[NpO2(NO3)2]3·nH2O анионные слои
ки (κ') и мультиполей (κ''), заселенности валентной
[NpO2(NO3)2]nn- связываются в кристаллическую
оболочки и мультипольные заселенности, а также
упаковку благодаря электростатическому взаи-
тепловые и позиционные параметры. Характер хи-
модействию с высокозарядными катионами La3+,
мической связи в данном соединении исследова-
расположенными в межслоевом пространстве. В
ли в рамках топологической теории Р. Ф. Бейдера
смешанно-элементном Th(IV)/Np(V) нитрате мож-
«Атомы в молекуле» [13]. Для оценки энергии
РАДИОХИМИЯ том 62 № 2 2020
НИТР
АТНЫЕ КОМПЛЕКСЫ НЕПТУНИЯ(V)
121
взаимодействий, образованных атомом метал-
ла, была использована эмпирическая корреляция
Эспинозы-Лекомта [14].
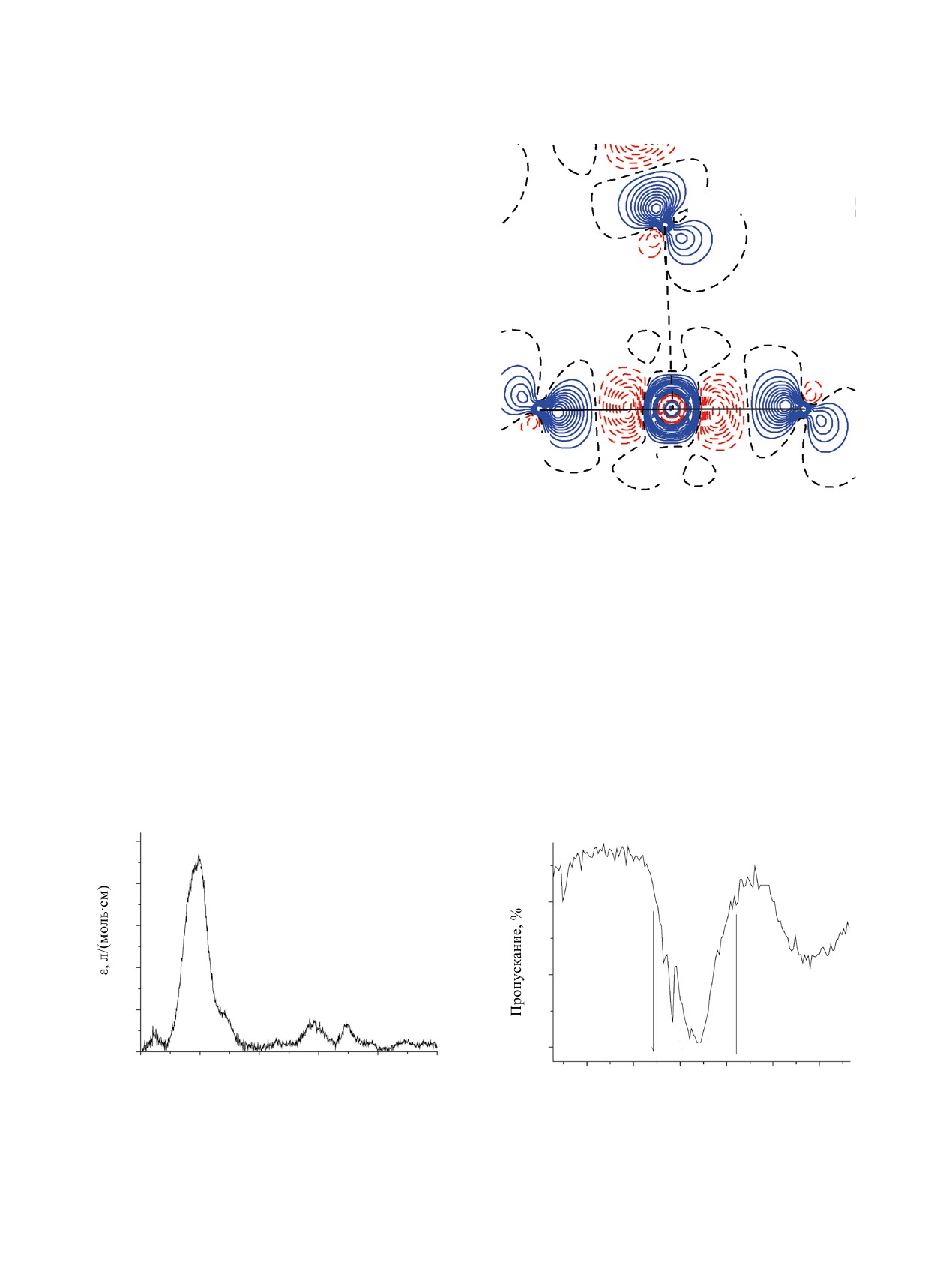
O1A
Анализ критических точек показал, что контакт
Np1-O1A отвечает связывающему взаимодействию
(рис. 5). Энергии взаимодействия Np1-O1A, со-
гласно корреляции Эспинозы-Лекомта, составила
17.2 ккал/моль. Энергия связи с нитратом равна
14.2 ккал/моль, что подтверждает данные корреля-
ций длина связи-прочность связи.
ЭСП и ИК спектр кристаллического ком-
плекса Na[NpO2(NO3)2]·2H2O (II). К особенно-
стям ЭСП (рис. 6) следует отнести весьма незна-
чительную величину максимальной оптической
O1
плотности в диапазоне длин волн 950-1050 нм,
Np1
несмотря на высокое содержание исследуемого
вещества в спрессованной таблетке. Оно замет-
но превышало нормальные для таких измерений
Рис. 5. Сечение деформационной электронной плотно-
значения, поскольку обычно для подобных изме-
сти в области КК взаимодействия Np1-O1A в структуре
рений достаточным оказывается 0.5-1.5 % иссле-
Na[NpO2(NO3)2]·2H2O (II).
дуемого вещества от массы материала матрицы
и при этом молярный коэффициент погашения
1030 в спектре II также сильно ослаблена и прояв-
находится на уровне его значений для растворов
ляется в виде плеча невысокой интенсивности. К
пятивалентного нептуния, т.е. составляет 380-
настоящему времени известно, что наиболее часто
400 л/(моль·см). Рассчитанный молярный коэффи-
встречающимся координационнным окружением
циент экстинкции в случае исследуемых кристал-
нептуния(V) в кристаллах (и растворах) считает-
лов оказался менее 50 л/(моль·см). Фактически
ся пентагонально-бипирамидальное кислородное
можно констатировать ослабление характерной
окружение, хотя известны и исключения из это-
для нептуноил-иона NpO2+ f-f-полосы поглощения
го правила [11]. Как видно из приведенных выше
в области 980 нм почти на порядок. Обычно наблю-
описаний новых и исследованных ранее структур
даемая в ЭСП иона нептуноила сателлитная поло-
нитратных соединений Np(V), в них часто наблю-
са поглощения меньшей интенсивности в области
дается гексагональное кислородное окружение
50
40
40
30
20
20
10
816
755
0
780762
680
0
860
950
1000
1050
1100
1150
1200
1000
900
800
700
600
500
λ, нм
ν, cм-1
Рис. 6. ЭСП кристаллического Na[NpO2(NO3)2]·2H2O
Рис. 7. Фрагмент ИК спектра кристаллического
(II) (4.43 мг/155 мг NaCl плавл.)
Na[NpO2(NO3)2]·2H2O (II) (NaCl плавл.).
РАДИОХИМИЯ том 62 № 2 2020
122
ЧАРУШНИКОВА и др.
катиона NpO2+. Очевидно, что особенность кри-
динения к той или иной группе КК сеток. Впервые
сталлического строения натриевого комплекса
для соединений Np проведено прецизионное рент-
II как раз и относится к таким исключениям, где
генодифракционное исследование распределения
координационное окружение центрального атома
электронной плотности, позволившее оценить
нептуния близко к центросимметричному и где
энергию КК взаимодействия в кристалле. Для со-
из-за выполнения правила Лапорта оказываются
единенния II измерены оптические и ИК спектры,
запрещенными f-f-переходы и, как следствие, в
отражающие центросимметричное строение ко-
ЭСП не проявляются характерные узкие полосы
ординационного окружения центрального атома и
поглощения.
систему КК связей в структуре.
Необходимо добавить также, что косвенным
Рентгенодифракционные эксперименты выпол-
указанием на такую особенность кристаллическо-
нены в Центре коллективного пользования физи-
го строения соединения II можно считать и цвет
ческими методами исследования ИФХЭ РАН.
самих его кристаллов: вместо обычно характерно-
ФОНДОВАЯ ПОДДЕРЖКА
го для кристаллических соединений пятивалент-
Работа выполнена при частичном финанси-
ного нептуния насыщенного зеленого эти кристал-
ровании Министерством науки и высшего обра-
лы были окрашены в светло-серый цвет со слабым
зования Российской Федерации (тема № АААА-
зеленоватым оттенком.
А18-118040590105-4).
Был измерен ИК спектр соединения II (рис. 7).
КОНФЛИКТ ИНТЕРЕСОВ
Максимум полосы антисимметричных валентных
колебаний диоксокатиона нептуноила смещен в
Авторы заявляют об отсутствии конфликта
область низких значений волновых чисел, что,
интересов.
как правило, проявляется при сильном комплек-
СПИСОК ЛИТЕРАТУРЫ
сообразовании или при КК взаимодействии неп-
1. Григорьев М.С.,Чарушникова И.А., Крот Н.Н. и др. //
туноильных групп. Обращает на себя внимание
ЖНХ. 1994. Т. 39, N 3. С. 179.
существенное расщепление полосы антисимме-
2. Андреев Г.Б., Буданцева Н.А., Антипин М.Ю.,
тричных валентных колебаний диоксокатионов.
Крот Н.Н. // Координац. химия. 2002. Т. 28, N 11.
С. 465.
Объяснением этому, очевидно, служит как раз об-
3. Томилин С.В., Волков Ю.Ф., Мелкая Р.Ф. и др. // Ра-
наруженная в ходе рентгеноструктурного исследо-
диохимия. 1986. Т. 28, N 3. С. 304.
вания кристаллов Na[NpO2(NO3)2]·2H2O сетчатая
4. Григорьев М.С., Чарушникова И.А., Крот Н.Н. //
система КК связей в структуре соединения.
Радиохимия. 2005. Т. 47, N 6. С. 504.
5. Чарушникова И.А., Крот Н.Н. // Радиохимия. 2015.
Таким образом, исследовано строение нитрат-
Т. 57, N 4. С. 324.
ных комплексов пятивалентного нептуния с ще-
6. Бессонов А.А., Буданцева Н.А., Федосеев А.М., Афо-
лочными катионами во внешней сфере. В ком-
насьева Т.В., Крот Н.Н. // Радиохимия. 1990. Т. 32,
плексах с катионами щелочных металлов (I-IV)
N 5. С. 24.
осуществляется КК взаимодействие ионов NpO2+,
7. Sheldrick G.M. SADABS. Madison, Wisconsin (USA):
Bruker AXS, 2008.
приводящее к образованию квадратных (I, II) или
8. Sheldrick G.M. // Acta Crystallogr. Sect. A. 2008.
тригонально-гексагональных (III, IV) катионных
Vol. 64, N 1. P. 112.
сеток. Размер внешнесферного однозарядного ка-
9. Sheldrick, G.M. // Acta Crystallogr. Sect. C. 2015.
тиона определяет вид катионной сетки. Большие
Vol. 71, N 1. P. 3.
полости в структуре с тригонально-гексагональ-
10. Nardelli M. // J. Appl. Crystallogr. 1999. Vol. 21, N 3.
ными катионными сетками непригодны для ма-
P. 563.
11. Крот Н.Н., Григорьев М.С. // Успехи химии. 2004.
леньких катионов щелочных металлов. Как уже
Т. 73, N 1. С. 94.
упоминалось выше, пригодные для структурных
12. Blatov V.A. // IUCr CompComm Newslett. 2006.
исследований нитраты пятивалентного нептуния с
N 7. P. 4.
катионами K+ и Rb+ во внешней сфере выделить
13. Bader R.F.W. // Atoms in Molecules: A Quantum Theory.
не удалось. Не удалось также сделать рентгено-
Oxford University Press, USA, 1994.
фазовый анализ калиевого нитрата нептуноила,
14. Espinosa E., Alkorta I., Rozas I., Elguero J., Molins E. //
чтобы подтвердить принадлежность данного сое-
Chem. Phys. Lett. 2001. Vol. 336. P. 457.
РАДИОХИМИЯ том 62 № 2 2020