РАДИОХИМИЯ, 2020, том 62, № 1, с. 38-50
УДК: 546.791:[574.63+544.723]
ИЗВЛЕЧЕНИЕ U(VI) ИЗ ВОДНЫХ СРЕД Zn,Al И Mg,Al
СЛОИСТЫМИ ДВОЙНЫМИ ГИДРОКСИДАМИ,
ИНТЕРКАЛИРОВАННЫМИ ЦИТРАТ-ИОНАМИ,
И ИХ МАГНИТНЫМИ НАНОКОМПОЗИТАМИ
© 2020 г. Л. Н. Пузырнаяa, Г. Н. Пшинкоa,*, Б. П. Яцикa, В. Я. Зубб, А. А. Косорукова
а Институт коллоидной химии и химии воды им. А. В. Думанского НАН Украины,
03680, Киев, бульв. Акад. Вернадского, д. 42
б Киевский национальный университет им. Т. Г. Шевченко, 01601, Киев, ул. Владимирская, д. 64
* e-mail: pshinko@ukr.net
Получена 19.04.2019; после доработки 03.07.2019; принята к публикации 04.07.2019
Описаны методы получения и фазовый состав Zn,Al и Mg,Al cлоистых двойных гидроксидов, интер-
калированных цитрат-ионами, и их магнитных нанокомпозитов. Показано, что обработка магнитных
сорбентов ультразвуком приводит к упорядочению структуры межслоевых промежутков. Исследование
сорбционного извлечения U(VI) указанными материалами показало, что типичные для природных вод
катионы (Na+, K+, Са2+, Mg2+) практически не влияют на извлечение U(VI) из водных сред в отличие от
HCO3--анионов и гумусовых кислот. Наиболее эффективное удаление U(VI) из водных сред наблюдается
для цитратной формы Mg,Al-сорбента в широкой области рН 2.5-9.0.
Ключевые слова: очистка воды, сорбция, уран(VI), слоистый двойной гидроксид, цитрат-ион, нано-
композит, магнитная сепарация
DOI: 10.31857/S0033831120010062
В сегодняшних условиях мировой энергетиче-
даже после полного закрытия ураноперерабаты-
ский дефицит, спровоцированный всевозрастаю-
вающих предприятий [1], что обусловлено преи-
щими масштабами потребления электроэнергии и
мущественно анионными формами нахождения
критическим уменьшением невозобновляемых ее
U(VI) в сточных и природных водах в виде кар-
источников, способствует устойчивому развитию
бонатных комплексов, не сорбирующихся мине-
ядерной энергетики. Однако деятельность в обла-
ральными и органоминеральными взвесями и дон-
сти ее промышленного использования сопряжена
ными осадками. Это существенно затрудняет его
с высоким риском для экологической безопасно-
извлечение из водных сред катионообменниками
сти. Поэтому главным условием использования
и, соответственно, способствует повышению ми-
ядерной энергетики является обеспечение умень-
грации в окружающей среде.
шения влияния идентифицированных угроз окру-
В последние годы среди методов извлечения
жающей среде.
U(VI) из вод широкое распространение получила
Добыча и переработка минерального сырья,
сорбция за счет ее универсальности и доступно-
содержащего уран, являющийся важным элемен-
го аппаратурного оформления. Однако процесс
том ядерной энергетики и военно-промышленного
отделения радиоактивно загрязненных сорбентов
комплекса, привели к значительному ухудшению
(шламов водоочистки) от водной среды является
качества поверхностных и подземных вод как
преимущественно сложным. Поэтому вызывают
источников питьевого водоснабжения. Следует
значительный интерес сорбционные материалы,
отметить, что шахтные воды еще долго остаются
обладающие магнитными свойствами, позволяю-
чрезвычайно опасными для окружающей среды
щие легко, быстро и эффективно отделять твердую
38
ИЗВЛЕЧЕНИЕ U(VI) ИЗ ВОДНЫХ СРЕД Zn,Al И Mg,Al
39
фазу от жидкой с использованием магнитной сепа-
на отделение отработанного сорбента (шлама) от
рации [2-5].
водной фазы и повысить технологичность процес-
сов сорбции, а также степень безопасности пер-
Одними из наиболее перспективных являются
сонала при работе с радиоактивно загрязненными
магнитные нанокомпозиты на основе слоистых
водными средами, что является актуальной зада-
двойных гидроксидов (СДГ). Предложено удале-
ние U(VI) из водных растворов магнитным ком-
чей экологической безопасности.
позиционным сорбентом на основе Ni,Al-СДГ [6]:
Ранее авторами работы [8] методом ионного об-
максимальная сорбция U(VI) достигается при рН
мена получен магнитный Mg,Al-СДГ, интеркали-
6.0 и времени контакта фаз 180 мин. Однако при
рованный Cit-анионами; авторы использовали ни-
рН > 7.0 наблюдается резкое снижение адсорб-
тратную форму указанного сорбента и защитную
ционной способности данного материала, что об-
атмосферу (N2). Установлено, что на магнитном
условлено отрицательным зарядом поверхности
Mg,Al-СДГ, содержащем Cit-анионы, достигают-
сорбента и образованием анионных карбонатных
ся большие величины сорбции U(VI) из водных
комплексов уранила. Кроме того, широкое исполь-
растворов при рН 6.0 по сравнению с его магнит-
зование данного сорбента на практике ограничено
ной нитратной формой, что преимущественно
достаточно сложным процессом его получения в
обусловлено образованием хелатного комплекса
несколько этапов, в том числе из-за применения
урана(VI) с органическим лигандом. Однако при
гидротермального синтеза. Авторами работы [7]
рН > 6.0 адсорбционные способности магнитно-
исследованы сорбционные свойства нитратной и
го Mg,Al-СДГ, интеркалированного Cit-анионами,
цитратной форм магнитного Mg,Al-СДГ по отно-
снижаются, что, вероятно, связано с поверхност-
шению к U(VI) и показано, что наличие лиганда,
ным зарядом сорбента и увеличением доли ани-
способного к образованию хелатных комплексов с
онных форм U(VI). Следует отметить, что катион-
радионуклидом в межслоевом пространстве СДГ,
ный и анионный состав матрицы СДГ, в том числе
увеличивает его сорбционную способность. В
ее исходных форм, применяемых для синтеза, а
работах [8-13] показано, что интеркалированные
также метод синтеза существенно влияют на заряд
карбоксилат-анионами, в том числе этилендиа-
поверхности сорбента и количество активных сор-
минтетраацетат-, гексаметилендиаминтетрааце-
бционных центров.
тат-, диэтилентриаминпентаацетат-, малат-, тар-
Основными методами получения СДГ, содер-
трат- и цитрат-анионами СДГ обладают высокой
жащих в межслоевом пространстве карбоксилат-
эффективностью к U(VI) и многим другим метал-
анионы, являются метод соосаждения, ионного
лам-комплексообразователям благодаря их проч-
обмена и восстановления структуры гидроталь-
ному связыванию с функциональными группами
китоподобных материалов [16]. СДГ можно по-
как реакционными центрами матрицы сорбентов.
лучить осаждением при постепенном добавлении
Известно [14, 15], что цитрат-ионы (Cit) спо-
смешанного раствора некоторых солей Ме(II) и
собны образовывать достаточно стабильные
Me(III) к щелочному раствору карбоновых кислот
моно- и полиядерные комплексы с катионами
при постоянном рН. Для предотвращения загряз-
многих элементов и обладают хелатирующим эф-
нения получаемого продукта карбонат-ионами
фектом благодаря наличию гидроксильной и трех
необходимо через реакционную смесь пропускать
карбоксильных групп в их структуре. Кроме того,
защитный газ. Продукты реакции также могут
Cit-анионы являются экологически безопасными,
быть загрязнены анионами исходных солей ме-
что позволяет их применять в пищевой и фарма-
таллов. Однако метод осаждения для получения
цевтической промышленности, в процессах дезак-
СДГ, интеркалированных карбоксилат-анионами,
тивации; также они находятся в окружающей сре-
применяется значительно чаще. Метод анионного
де (растениях, корнях, листьях, природных водах,
обмена для получения СДГ с межслоевыми кар-
почвах) в результате жизнедеятельности микроор-
боксилат-ионами не используется из-за неполно-
ганизмов. Композиты с магнитными свойствами
го обмена неорганических межслоевых анионов.
на основе интеркалированных Cit-ионами СДГ
После прогрева СДГ при 400-500°С образуется
позволяют уменьшить эксплуатационные затраты
смешанный оксид, который при взаимодействии
РАДИОХИМИЯ том 62 № 1 2020
40
ПУЗЫРНАЯ и др.
с водой в присутствии карбоновых кислот пере-
250 см3 дистиллированной воды без СО2, предва-
ходит в СДГ с межслоевыми карбоксилатными
рительно подкисленной 2 см3 концентрированной
анионами. Важными в способе восстановления
HCl, добавляли 13.9 г (0.05 моля) FeSO4·7H2O и
структуры СДГ являются условия разложения ис-
28.1 г (0.05 моля) Fe2(SO4)3·9H2O. Полученный
ходного синтетического гидроталькита, которые
раствор добавляли со скоростью 4 см3/мин в колбу
могут привести к образованию нерастворимых
емкостью 1 дм3 с 400 см3 дистиллированной воды
продуктов, загрязнению полученных материалов
при перемешивании смеси магнитным стержнем
(поглощению СО2) и образованию плохо окри-
в слабом токе азота. При этом поддерживали pH
сталлизованных СДГ.
реакционной среды 10.0, добавляя по каплям 30%-
ный раствор NaOH. Осадок Fe3O4 cобирали Nd-
Поэтому цель данной работы - исследование
магнитом и отмывали дистиллированной водой до
влияния природы катионов (Zn,Al и Mg,Al) бру-
отрицательной реакции на SO42--ионы с раствором
ситоподобных слоев СДГ, интеркалированных Cit-
BaCl2. Суспензию Fe3O4 хранили до использова-
ионами, и их магнитных нанокомпозитов на сор-
ния в виде дисперсии в 400 см3 воды в закрытой
бционное извлечение U(VI) из водных сред. Для
посуде.
получения данных сорбционных материалов нами
Методика синтеза Mg,Al-Cit. Карбонатную
использован предложенный авторами работы [17]
форму Mg,Al-СДГ (Mg,Al-CO3) получали при со-
простой метод, включающий растворение карбо-
вместном осаждении 1 моль/дм3 хлоридов Mg(II)
натной формы Mg,Al- или Zn,Al-СДГ в карбоно-
и Al(III), приготовленных из MgO и Al в HCl, из
вых кислотах и последующее осаждение щелоч-
раствора NaOH, содержащего Na2СО3, согласно
ными растворами данного материала. При этом не
методике [18].
требуется защитная атмосфера, а получаемые про-
Цитратную форму Mg,Al-СДГ (Mg,Al-Cit) по-
дукты содержат в межслоевом пространстве толь-
лучали при растворении Mg,Al-CO3 в растворе
ко карбоксилат-анионы. Отсутствие посторонних
лимонной кислоты с последующим осаждением
анионов, по-видимому, обусловлено высокой кон-
щелочью [17]. К 400 см3 горячей воды (50°С), со-
центрацией органических лигандов в реакцион-
держащей 20 г Mg,Al-CO3, постепенно добавля-
ной смеси, а также тем, что при низких рН кати-
ли 44.1 г (0.21 моль) лимонной кислоты при пе-
оны, входящие в состав СДГ, связываются карбок-
ремешивании на магнитной мешалке до полного
силат-анионами в комплексные соединения, а при
растворения гидроталькита. Полученный про-
повышении концентрации ОН--ионов - разруша-
зрачный раствор прикапывали при перемешива-
ются, и катионы металлов поглощаются образую-
нии в слабом токе азота со скоростью 5 см3/мин к
щимися слоями СДГ. Освобождающиеся при этом
300 см3 раствора, содержащего
20 г NaOH
органические анионы заполняют межслоевую
(0.5 моль). Приготовленную таким образом смесь
область образующихся структур и не позволяют
(рН 8.5-9.0) кипятили с обратным холодильни-
таким образом другим содержащимся в растворе
ком в течении 10 ч, затем осадок переносили на
анионам входить в межслоевое пространство СДГ.
стеклянный фильтр № 4 и отмывали дистиллиро-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ванной водой. Полученный продукт сушили при
60-70°С в течение 8-10 ч, определяли его состав
Исследовали сорбцию U(VI) на образцах сор-
и использовали его как в качестве сорбента, так и
бентов Zn,Al-СДГ и Mg,Al-СДГ, интеркалирован-
для получения композиционного магнитного сор-
ных Cit-ионами, состава [Zn4Al2(ОН)11](Cit)·8Н2О
бционного материала.
(Zn,Al-Сit) и [Mg4Al2(ОН)11](Cit)·8Н2О (Mg/Al-
Получение магнитного нанокомпози-
Сit) и магнитных нанокомпозитов на их основе
та Fe3O4/Mg,Al-Cit. Дисперсию Fe3O4 (5.6 г) в
Fe3O4/Zn,Al-Сit) и (Fe3O4/Mg,Al-Сit).
200 см3 и суспензию Mg,Al-Cit (24.3 г) в 400 см3
Получение магнитного носителя (нанома-
дистиллированной воды обрабатывали в течение
териала) Fe3O4. Дисперсия магнетита получена
1 ч в ультразвуковой ванне УЗВ-28 (частота 40 кГц,
осаждением растворов сульфатов Fe(II) и Fe(III)
мощность 100 Вт). Далее растворы объединяли,
щелочью в защитной атмосфере азота. Для этого к
перемешивали с помощью магнитной мешалки
РАДИОХИМИЯ том 62 № 1 2020
ИЗВЛЕЧЕНИЕ U(VI) ИЗ ВОДНЫХ СРЕД Zn,Al И Mg,Al
41
в течение 10 мин и вновь обрабатывали ультраз-
9.2-9.5. Далее колбу закрывали пробкой и выдер-
вуком 30 мин. При этом образовывался медленно
живали при 60°С 24 ч; осадок отмывали дистил-
стареющий коллоид, выделявший около 5% воды
лированной водой на центрифуге и сушили при
в сутки. Не наблюдалось выделения осадка вбли-
60-70°С в течение ночи.
зи полюсов сильного Nd-магнита, что указывало
Получение магнитного нанокомпозита
на устойчивую структуру коллоида. В мощном
Fe3O4/Zn,Al-Cit. Колбы, содержащие 24.3 г Zn,Al-
гравитационном поле этот коллоид разрушается с
Cit в 400 см3 воды и 5.8 г коллоидной взвеси Fе3O4
образованием осадка, который выделяли центри-
в 200 см3 воды, обрабатывали в течение 1 ч в уль-
фугированием. Осадок высушивали в сушильном
тразвуковой ванне (40 кГц, 100 Вт). Полученные
шкафу при 70°С. Полученный магнитный сорбент
взвеси смешивали 10 мин на магнитной мешалке
содержал 18.79% Fe3O4.
и вновь подвергали ультразвуковой обработке в те-
Методика синтеза Zn,Al-Cit. Карбонатную
чение 30 мин. Выделенный центрифугированием
форму Zn,Al-CO3 с мольным соотношением Zn/Al,
при 4500 об/мин осадок сушили при 60°С в тече-
равным 2, использовали для получения Zn,Al-Cit.
ние 16 ч.
Образец Zn,Al-CO3 был получен осаждением из
Идентификацию полученных продуктов син-
растворов хлоридов Zn(II) и Al(III) при pH 9. Для
теза проводили на основании данных химическо-
этого предварительно готовили два раствора по
го анализа. Навеску 0.1000 г синтезированных
1 дм3: первый, содержащий 2 моля NaOH и
сорбентов растворяли в 15-20 мл разбавленной
1 моль Na2CO3, и второй - ZnCl2 (0.67 моля) и AlCl3
(1 : 1) HCl, а далее добавляли дистиллированную
(0.33 моля) с pH 2 (второй раствор был получен
бескарбонатную воду до объема пробы 100 см3.
растворением точных навесок металлов Zn и Al в
Количество Zn, Mg, Al и Fe определяли атомно-аб-
HCl в колбе с обратным холодильником для пре-
сорбционным методом, а общего органического
дотвращения потерь реагирующих веществ). С
углерода для оценки содержания цитрат-ионов -
помощью перистальтического насоса оба раство-
хроматографическим методом [10]. Содержание
ра по двум параллельным линиям добавляли со
ОН--ионов определяли исходя из нейтральности
скоростью 5 см3/мин в полипропиленовую ем-
сорбента, а количество молекул кристаллизацион-
кость с 400 см3 дистиллированной воды при ин-
ной воды - по разнице общей массы сорбента и мас-
тенсивном перемешивании. В процессе синтеза
сы отдельных его компонентов. Установленные на
pH поддерживали в интервале 8-9, добавляя при
основании результатов анализа по мольному содер-
необходимости HCl или NaOH. После смешивания
жанию Zn, Mg, Al, Fe, а также Cit-анионов форму-
растворов сосуд с реакционной смесью закрывали
лы сорбентов [Me(II)0.58Me(III)0.29(ОН)1.6](Cit)0.145·
и выдерживали в течение 3 сут при 60-70°С в су-
1.16Н2О соответствуют следующему примерно-
шильном шкафу. После старения осадок отделяли
му целочисленному соотношению компонентов:
на центрифуге и промывали дистиллированной во-
Me(II)/Me(III) = 2; Me(II)/Cit = 4; Me(III)/Cit = 2, т.е.
дой до отрицательной пробы с раствором AgNO3 и
формулы синтезированных сорбентов имеют
сушили при 60°С в течение суток.
вид
[Me(II)4Me(III)2(ОН)11](Cit)·8Н2О,
где Ме(II)
- Zn, Mg, a Ме(III)
- Al.
Zn,Al-Сit получали при растворении Zn,Al-CO3 в
Аналогично определены формулы для магнитных
растворе лимонной кислоты с последующим осаж-
сорбентов: [Me(II)0.417Me(III)0.208(ОН)1.15](Cit)0.104·
дением щелочью [19]. К взвеси 26.05 г Zn,Al-CO3
1.15Н2О·(Fe3O4)0.105 -
[Me(II)4Me(III)2(ОН)11](Cit)·
в 300 см3 теплой дистиллированной воды при пе-
8Н2О·Fe3O4.
ремешивании с помощью магнитной мешалки по-
степенно добавляли 44.125 г сухой лимонной кис-
Фазовый состав исследуемых сорбентов опре-
лоты и перемешивали до образования прозрачного
деляли с помощью рентгеновского дифрактометра
ДРОН-2.0 с фильтрованным кобальтовым излучением.
раствора (около 0.5 ч). Полученный раствор пери-
стальтическим насосом со скоростью 7 см3/мин
Инфракрасные (ИК) спектры были получены
добавляли к
300 см3 раствора, содержащего
с использованием спектрометра Spectrum BX FT-
20 г NaOH; pH раствора после реакции составлял
IR (Perkin-Elmer) в области 4000-400 см-1 (мето-
РАДИОХИМИЯ том 62 № 1 2020
42
ПУЗЫРНАЯ и др.
дика таблетирования прессованием при давлении
HNO3 и NaOH. Значения рН0 и рН раствора по-
1700 кг/см2 с KBr).
сле сорбции (рНр) измеряли с помощью иономера
И-160 М со стеклянным электродом. Точность из-
Для приготовления модельных водных раство-
ров ионов U(VI), Na+, K+, Ca2+, SO42- и HCO3- ис-
мерения ±0.01 рН (20°C).
пользовали соответствующие соли: UO2SO4·3H2O,
Для определения значения рН точки нулевого
NaCl, KCl, CaCl2·6H2O и NaHCO3 квалифика-
заряда (рНТНЗ) исследуемых СДГ использовали
ции х.ч., также применяли гуминовые (ГК) и
методику [20]: навеску сорбента 0.025 г смешива-
фульвокислоты (ФК), выделенные из сапропелей
ли с 25 см3 водного раствора с различным значе-
Святошинских озер (Киев). Методом обратного
нием рН0 (2.0-10.0) и непрерывно перемешивали
потенциометрического титрования была определе-
в течение 24 ч. После этого проводили измерение
на сумма кислотных групп: для ГК - 9.5, для ФК -
значений рНр. Значению рНТНЗ соответствовало
12.0 мг-экв/г. Исследовали также сорбционное из-
плато на графике зависимости рН0-рНр.
влечение U(VI) из реальных водных сред - при-
Сорбционные свойства исследуемого материа-
родной поверхностной и сточной шахтной вод, в
ла оценивали величиной сорбции (as, мкмоль/г), и
которые дополнительно вводили 1×10-4 моль/дм3
степенью извлечения (R, %), которые рассчитыва-
U(VI), что позволяло надежно определять спек-
ли по формулам: as = (С0 - Ср)V/m, R = [(С0 - Ср)/
трофотометрически его концентрацию после со-
С0]×100, где С0, Ср - исходная и равновесная кон-
рбции. Состав природной подземной воды по ма-
центрации U(VI) в водном растворе, мкмоль/дм3;
крокомпонентам следующий, мг/дм3 (мг-экв/дм3,
V - объём водной фазы, дм3; m - навеска сорбента, г.
цифры отмечены звездочкой): солесодержание
При исследовании кинетики сорбции применяли
1820, общая жесткость 28*, Cl- ≈ 280, SO42- > 269,
модели псевдопервого и псевдовторого порядков,
NO3- ≈ 470, Ca2+ ≈ 410, Mg2+ ≈ 90, Na+ ≈ 90, рН ≈
предложенные авторами работы [21]. Графическая
6.9; сточной шахтной воды - солесодержание
обработка интегральных кинетических кривых
1500, общая жесткость 12.95*, Cl- ≈ 278, HCO3- ≈
приведена в координатах log(ap - at)-t и t/at-t
234.5, SO42- > 467, Ca2+ ≈ 170, Mg2+ ≈ 53.4, Na+ ≈
(согласно линейным формам уравнений псевдо-
240, Uприрод ≈ 0.85, рН ≈ 8. Образец природной
первого и псевдовторого порядков).
подземной воды был использован в качестве при-
мера реальной водной системы, содержащей ти-
Кинетическая модель псевдопервого порядка
пичные макрокомпоненты (Cl-, SO42-, NO3-, Ca2+,
основана на уравнении Лагергрена [21]
Mg2+, Na+), которые могут оказывать конкурирую-
log(ap - at) = lgap - k1t/2.303,
(1)
щее влияние на извлечение U(VI).
где k1 - константа скорости реакции, мин-1, t -
Сорбционные эксперименты проводили в ста-
время, мин, ар и at - величины сорбции U(VI),
тических условиях при непрерывном встряхи-
достигнутые при равновесии и в момент времени
вании на аппарате АВУ-6С в течение 1 ч. Объём
t, ммоль/г.
водной фазы составлял 50 см3, навеска сорбента -
Линеаризованная форма кинетического уравне-
0.025-0.300 г, исходная концентрация U(VI) в мо-
ния псевдовторого порядка [21]:
дельных растворах - 1×10-4 моль/дм3. Водную
t/at = t/ap +1/(k2ap2),
(2)
фазу после сорбции отделяли магнитной сепара-
цией и определяли в ней концентрацию U(VI) в
где k2 - константа скорости реакции, мин-1·г·ммоль-1,
сильнокислой среде (5-7 моль/дм3 HNO3) спек-
t - время, мин, ар и at - величины сорбции U(VI),
трофотометрическим методом с арсеназо III при
достигнутые при равновесии и в момент времени
λ = 656 нм [10]. Молярный коэффициент свето-
t, ммоль/г.
поглощения комплекса в такой среде составляет
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
6.0×104. Предел определения U(VI) 5 мкг; ошибка
измерений ±5%.
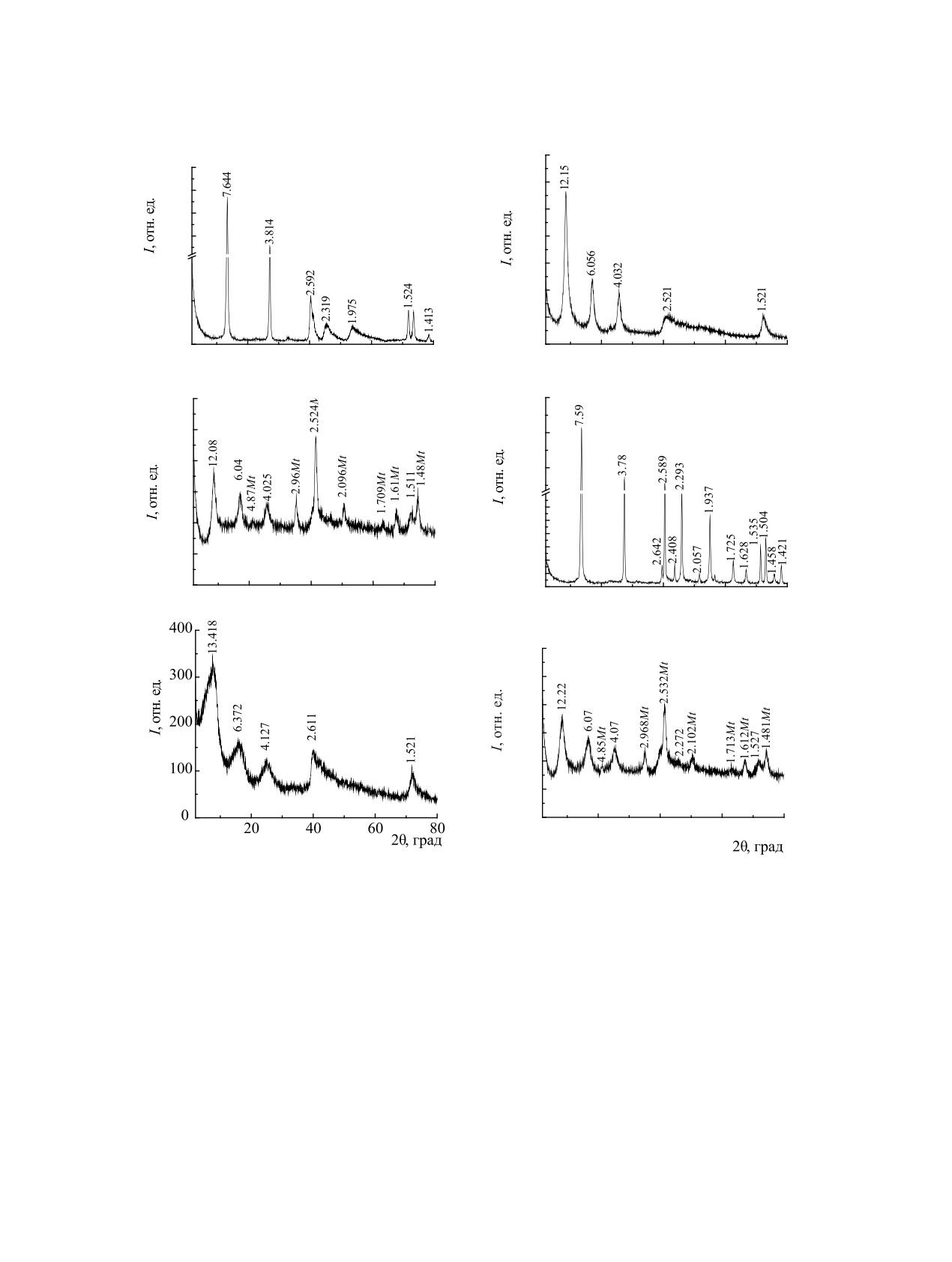
Рентгенографические исследования сор-
Необходимые значения рН исходного раствора
бентов. Порошковые рентгенограммы карбонат-
(рН0) создавали введением растворов 0.1 моль/дм3
ной, цитратной и магнитной форм Mg,Al-СДГ
РАДИОХИМИЯ том 62 № 1 2020
ИЗВЛЕЧЕНИЕ U(VI) ИЗ ВОДНЫХ СРЕД Zn,Al И Mg,Al
43
(а)
700
(б)
2500
600
2000
500
1500
1000
400
300
200
100
0
0
20
40
60
80
20
40
60
80
2ș ɝɪɚɞ
2ș ɝɪɚɞ
600
(в)
6000
(г)
500
4000
400
2000
300
200
500
300
100
100
0
0
20
40
60
80
20
40
60
80
2ș ɝɪɚɞ
2ș ɝɪɚɞ
(д)
(е)
600
500
400
300
200
100
0
20
40
60
80
Рис. 1. Порошковые рентгенограммы Mg,Al-CO3 (а), Mg,Al-Сit (б), Fe3O4/Mg,Al-Сit (в), Zn,Al-CO3 (г), Zn,Al-Сit (д) и Fe3O4/
Zn,Al-Сit (е), где Mt -фаза магнетита.
(рис. 1а-в) и Zn,Al-СДГ (рис. 1г-е) показали, что
(11.8-12.2 Å), приведенными в литературе [22]. На
после замещения карбонатных межслоевых ионов
порошковой рентгенограмме магнитного сорбци-
на цитратные наблюдаются смещения базальных
онного материала Fe3O4/Mg,Al-Сit наблюдаются
рефлексов 7.64 и 3.814 Å (рис. 1а-в), 7.59 и 3.78 Å
дифракционные линии только магнетита и ци-
(рис. 1г-е) в сторону меньших углов двойного от-
тратной формы СДГ - Mg,Al-Сit. Для Zn,Al-СДГ
ражения. Базальные отражения для Mg,Al-СДГ
базальные отражения увеличиваются до 13.41 и
увеличиваются до 12.15 и 6.06 Å за счет замеще-
6.37 Å также за счет замещения CO32--ионов более
ния карбонат-ионов более крупными цитрат-ани-
крупными Cit-анионами. Уменьшение интенсив-
онами. Наблюдаемые значения базальных отраже-
ности дифракционных отражений и увеличение
ний находятся в хорошем соответствии с данными
ширины наблюдаемых дифракционных линий свя-
РАДИОХИМИЯ том 62 № 1 2020
44
ПУЗЫРНАЯ и др.
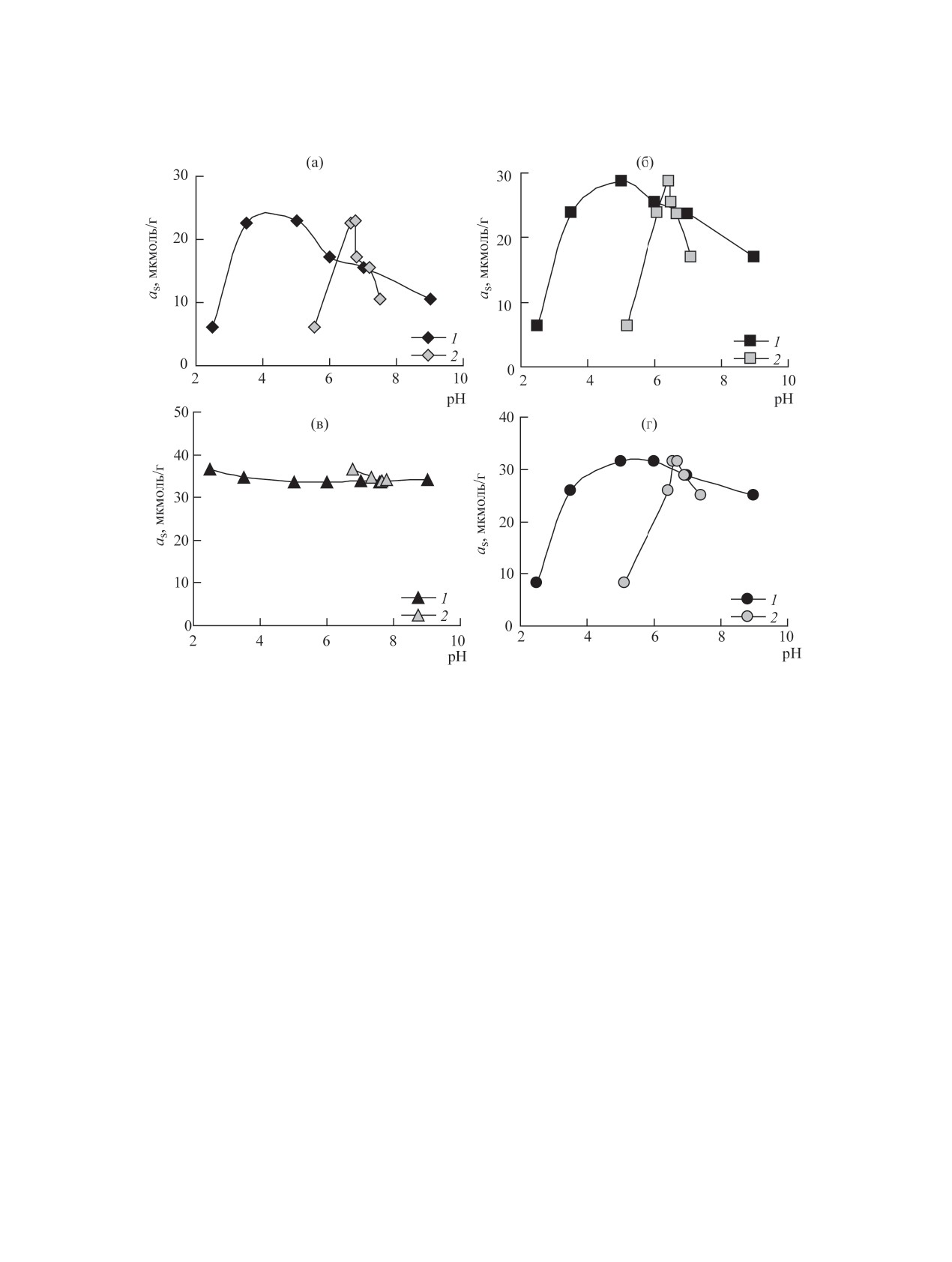
Рис. 2. Влияние рН на сорбцию U(VI) разными формами СДГ из водных растворов: а - Zn,Al-Сit, б - Fe3O4/Zn,Al-Сit, в -
Mg,Al-Сit, г - Fe3O4/Mg,Al-Сit. CU(VI) = 1×10-4 моль/дм3, V = 50 см3, m = 0.100 г, tсорб = 1 ч. 1 - рН0; 2 - рНр.
заны с меньшими областями когерентного рассея-
извлечение U(VІ) из водных растворов образца-
ния и более дефектной структурой Zn,Al-СДГ по-
ми Zn/Al- и Mg/Al-СДГ, интеркалированных Сit-
сле замещения карбонатных межслоевых анионов
ионами, а также их композитами с магнитными
на цитратные. На дифрактограмме образца Fe3O4/
свойствами приведены на рис. 2. Как видно, сор-
Zn,Al-Сit наблюдаются дифракционные отраже-
бционная способность Zn,Al-Сit, Fe3O4/Zn,Al-Сit
ния Zn,Al-СДГ с межслоевыми цитрат-анионами
и Fe3O4/Mg,Al-Сit по отношению к U(VІ) резко
(12.22, 6.07, 4.07 и 1.527 Å) и дифракционные ли-
возрастает с увеличением рН0, что подтвержда-
нии магнетита. Следует отметить, что после ульт-
ет механизм его сорбции за счет образования в
развуковой обработки дифракционные линии ис-
межслоевом пространстве сорбентов комплекс-
следуемых СДГ стали более узкими и сместились
ных уранилцитратных соединений - [UO2Сit]- и
в сторону больших углов двойного отражения, что,
[(UO2)2(Сit)2]2-, которое характерно для этой об-
очевидно, привело к упорядочению структуры
ласти рН водного раствора, а также снижением
межслоевых промежутков. Гидроксильные груп-
пы поверхности Zn,Al- и Mg,Al-СДГ имеют потен-
частичного растворения СДГ и конкурирующего
циальную способность связывать ионы металлов,
влияния Н+-ионов с уранил-ионами. Приведенные
поэтому ионы Fe2+ и Fe3+ могут закрепляться на
формы существования являются доминирующими
поверхности образцов магнитных СДГ координа-
в области рН 3.5-7.0, что согласуется с данными
ционно, как показано авторами работы [5].
потенциометрических и спектрофотометрических
Влияние рН водного раствора на извлечение
исследований авторов работы [15] (константы об-
U(VІ). Результаты исследования влияния рН на
разования комплексов для [UO2Сit]- - logβ = 3.16-
РАДИОХИМИЯ том 62 № 1 2020
ИЗВЛЕЧЕНИЕ U(VI) ИЗ ВОДНЫХ СРЕД Zn,Al И Mg,Al
45
6.69, [(UO2)2(Сit)2]2- - logβ = 15.25-19.26) и под-
тверждается рассчитанными формами нахождения
U(VІ) в водном растворе в присутствии карбокси-
лат- и карбонат-ионов (рис. 3).
При рН0 ≥ 6.0 (рНравн: Zn,Al-Сit ≥ 7.2, Fe3O4/
Zn,Al-Сit ≥7.1, Mg,Al-Сit ≥ 7.6, Fe3O4/Mg,Al-Сit ≥
7.75) наблюдается снижение сорбции U(VІ) на
исследуемых материалах, что обусловлено по-
явлением анионных форм U(VІ) - [UO2(ОН)3]-,
[UO2(CO3)2]2- и [(UO2(СО3)3]4-, образующихся
при контакте исследуемого водного раствора с воз-
духом, содержащим СО2 [23], конкурентным вли-
янием ОН--ионов и величиной рНТНЗ сорбентов.
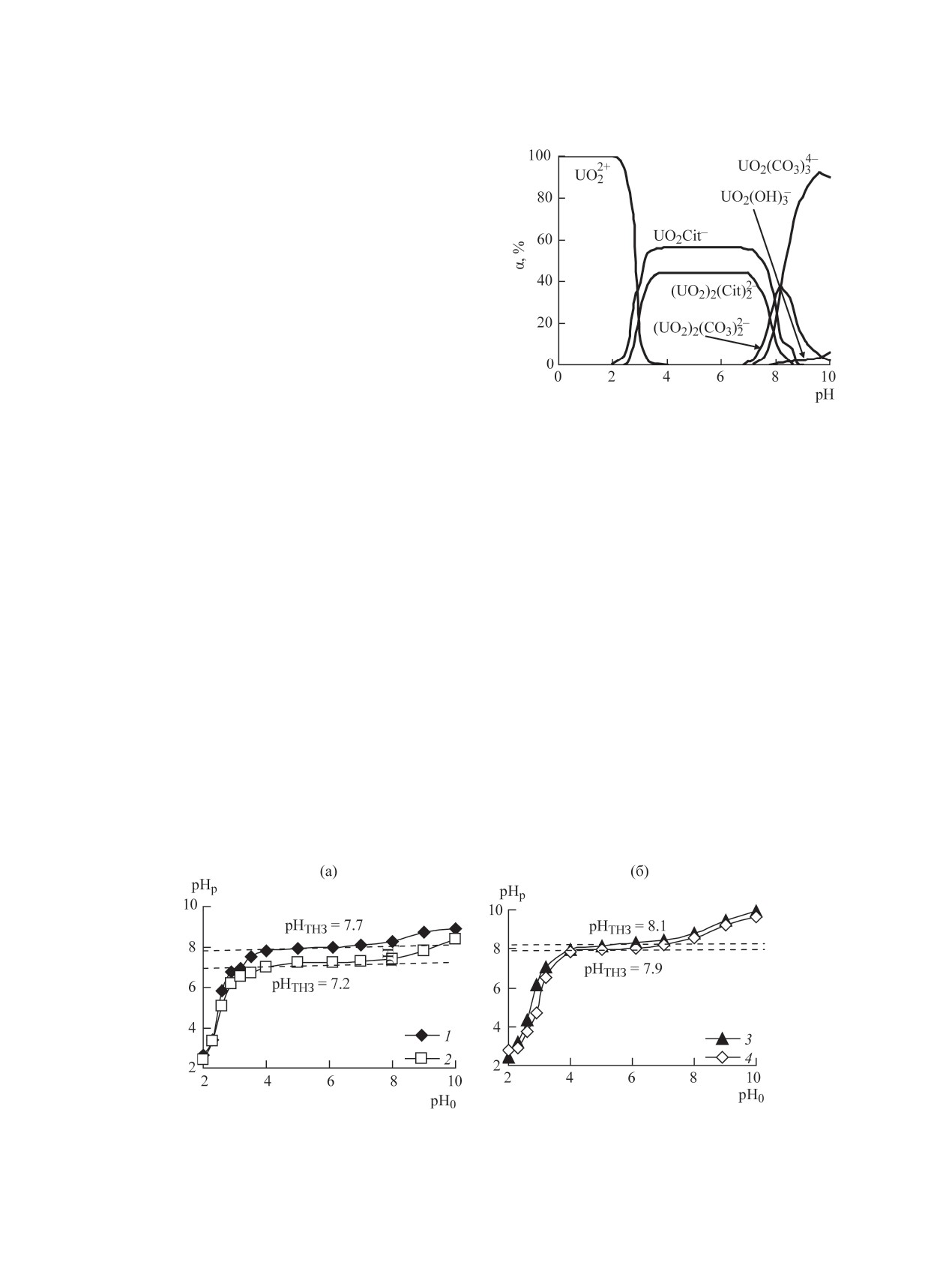
Рис. 3. Формы нахождения U(VI) в водном растворе
Постепенное депротонирование функциональных
в присутствии цитрат- и карбонат-анионов. CU(VI) =
групп сорбентов с увеличением рН водного рас-
1×10-4, с(Cit3-) = 1×10-3, с(CO32-) = 1×10-3 моль/дм3.
твора приводит к росту отрицательного заряда по-
ское взаимодействие анионных форм U(VI) с по-
верхности бруситоподобных слоев СДГ.
ложительно заряженной поверхностью СДГ.
Таким образом, можно сделать вывод, что из-
Таким образом, сорбционная способность СДГ,
влечение U(VI) исследуемыми формами СДГ осу-
интеркалированных цитрат-ионами, и их маг-
ществляется за счет внешнего комплексообразова-
нитных нанокомпозитов по отношению к U(VІ)
ния с гидроксильными группами на поверхности
предопределена, очевидно, внутренней диффу-
бруситоподобных слоев, а в случае магнитных
зией U(VІ), обусловленной физическими свой-
нанокомпозитов - еще и частично доступными
ствами СДГ (размерами межслоевого простран-
ферринольными группами магнетита. Кроме того,
ства) и диффузионным расстоянием до интер-
в результате связывания U(VI) с функциональны-
калированного C6H5O73--иона, его ориентацией
ми группами лиганда в межслоевом пространстве
в межслоевом пространстве, т.е. доступностью
СДГ происходит образование хелатных соедине-
функциональных групп, а также зарядом поверх-
ний, что полностью коррелирует с данными авто-
ности сорбентов. Как видно из рис. 4, для магнит-
ров работы [11] и устойчивостью соответствую-
ных нанокомпозитов на основе Zn,Al- и Mg,Al-
щих комплексов (рис. 3). Также в кислой и слабо-
СДГ характерны более низкие значения рНТНЗ
кислой областях рН возможны изоморфные заме-
(Fe3O4/Zn,Al-Сit - 7.2, Fe3O4/Mg,Al-Сit - 7.9) по
щения UО22+-ионов на Zn(II) или Mg(II) в составе
сравнению с исходными цитратными формами
СДГ, в нейтральной и щелочной - электростатиче-
(Zn,Al-Сit - 7.7, Mg,Al-Сit - 8.1).
Рис. 4. Определение значения рНТНЗ сорбентов: (а) 1 - Zn,Al-Сit, 2 - Fe3O4/Zn,Al-Сit, (б) 3 - Mg,Al-Сit, 4 - Fe3O4/Mg,Al-Сit.
РАДИОХИМИЯ том 62 № 1 2020
46
ПУЗЫРНАЯ и др.
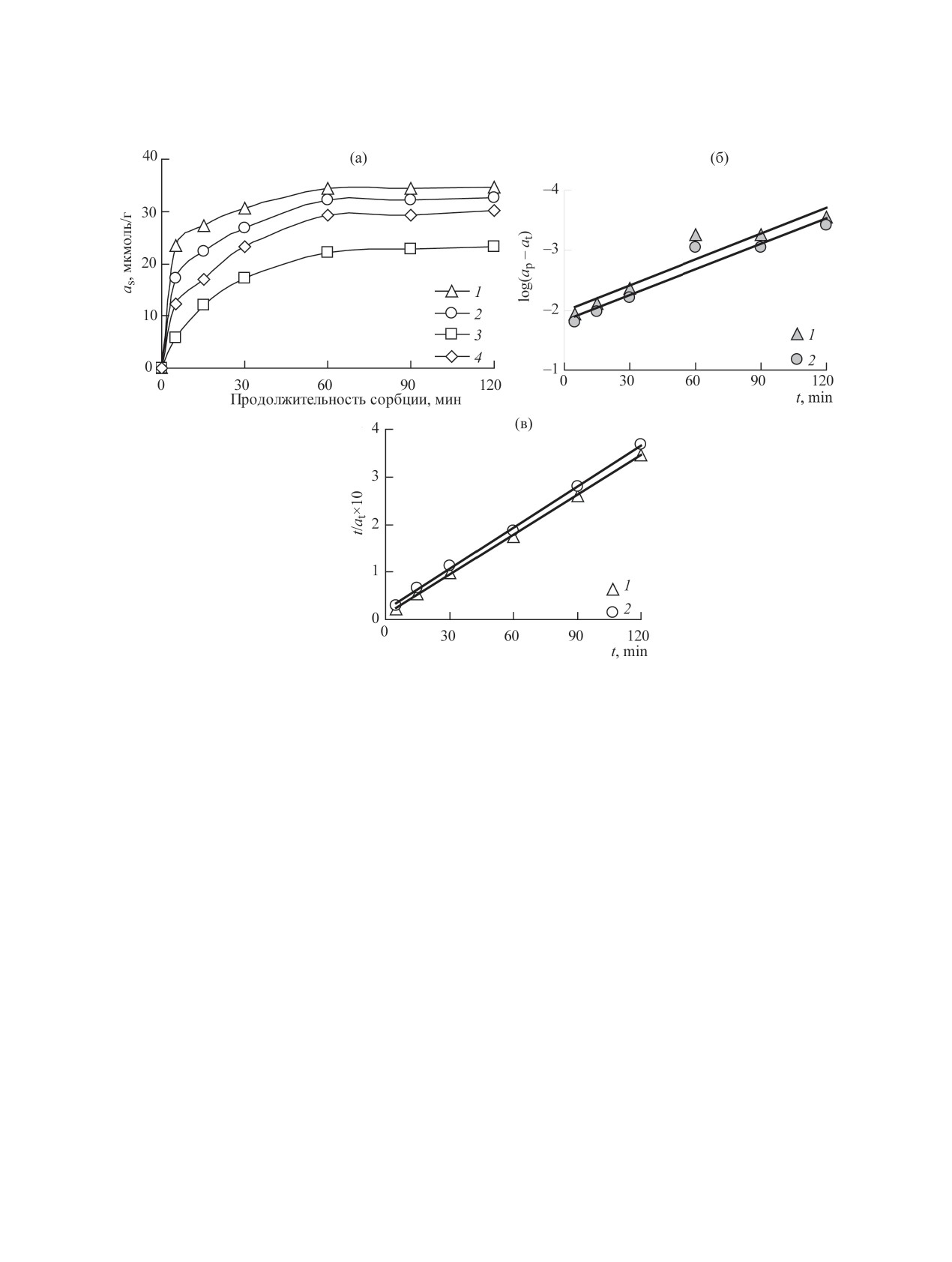
Рис. 5. Влияние продолжительности контакта твердой и жидкой фаз на извлечение U(VI) СДГ (1 - Mg,Al-Сit, 2 - Fe3O4/
Mg,Al-Сit, 3 - Zn,Al-Сit, 4 - Fe3O4/Zn,Al-Сit) (а) и модели кинетики псевдопервого (б) и псевдовторого порядка (в) сорбции
на образцах Mg,Al-СДГ: 1 - Mg,Al-Сit, 2 - Fe3O4/Mg,Al-Сit. рН0 5.0, CU(VI) = 1×10-4 моль/дм3, V/m = 500 см3/г.
Влияние продолжительности сорбции на из-
видно (рис. 5б, в), сорбция U(VI) наиболее досто-
влечение U(VІ). На рис. 5а показана зависимость
верно описывается моделью псевдовторого поряд-
степени извлечения U(VI) на Zn,Al- и Mg,Al-СДГ,
ка во всем диапазоне продолжительности сорбции
интеркалированных цитрат-ионами, и их магнит-
в отличие от модели псевдопервого порядка. Это
ных нанокомпозитах от продолжительности кон-
указывает на преобладающий механизм извлече-
такта твердой и жидкой фаз при рН0 5.0, V/m =
ния U(VI) за счет хемосорбции [11]. Значения рав-
500 см3/г. Видно, что основная часть U(VI) сорби-
новесной адсорбции, рассчитанные теоретически
руется уже в первые 30 мин и через 1 ч достига-
на основе модели псевдовторого порядка, хоро-
ется максимальное извлечение, т.е. наблюдается
шо согласуются с полученными эксперименталь-
сорбционное равновесие.
но, а константы скорости реакции k2 для образца
На примере образцов Mg,Al-Сit и Fe3O4/Mg,Al-
Mg,Al-Сit (5.21 мин-1·г·ммоль-1) выше, чем для
Fe3O4/Mg,Al-Сit (3.32 мин-1·г·ммоль-1).
Сit проведена обработка полученных данных со-
гласно моделям кинетики сорбции псевдопервого
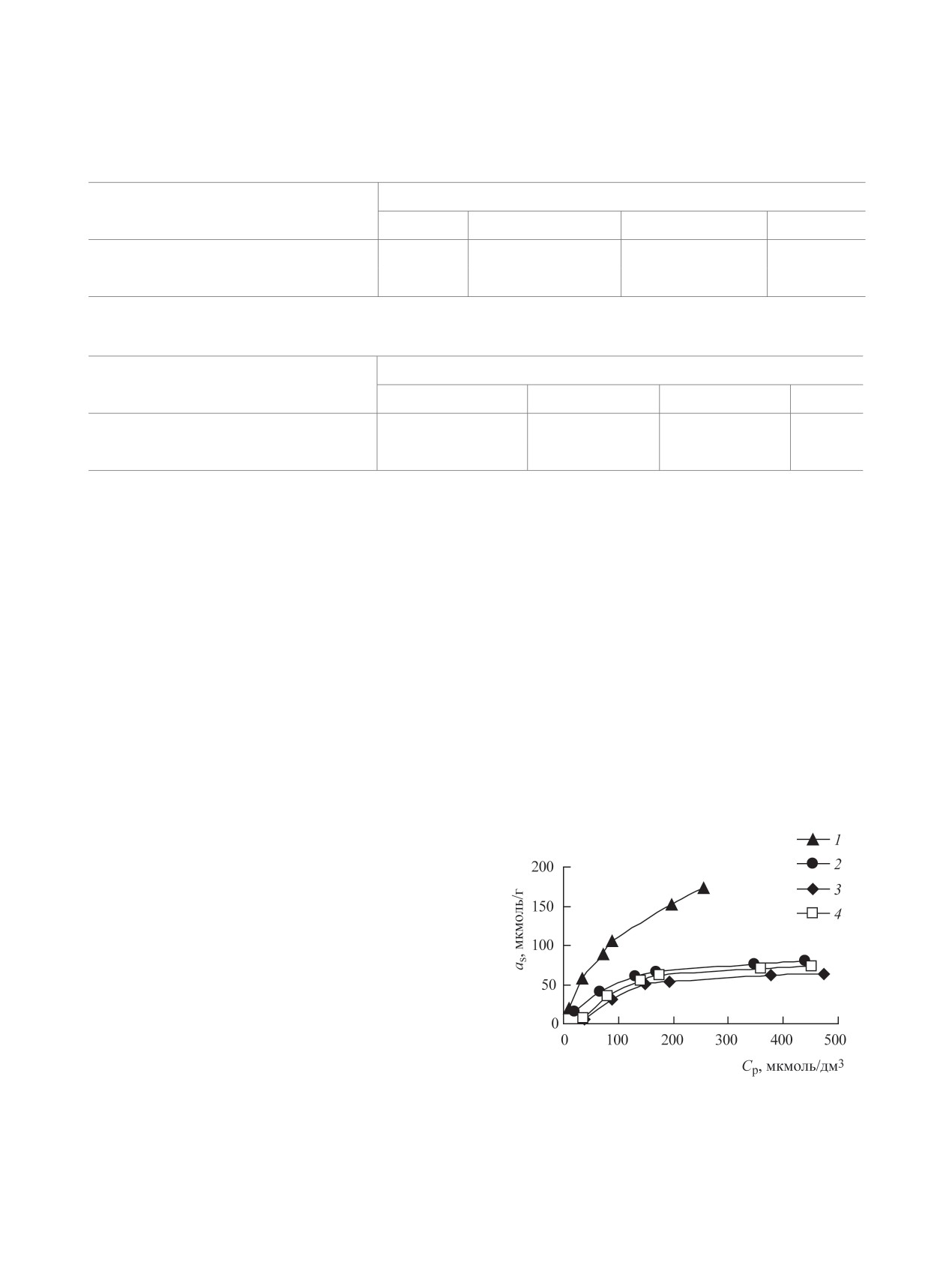
Изотермы сорбции U(VІ). Получены изотер-
и псевдовторого порядков, предложенных авто-
мы сорбции U(VІ) из водных растворов для СДГ,
рами работы [21]. Параметры кинетических мо-
интеркалированных Сit-ионами, и их магнитных
делей и коэффициенты линейной корреляции для
форм (рис. 6). Проведена их обработка в соот-
данных форм СДГ представлены в табл. 1, 2. Как
ветствии с моделями Ленгмюра и Фрейндлиха
РАДИОХИМИЯ том 62 № 1 2020
ИЗВЛЕЧЕНИЕ U(VI) ИЗ ВОДНЫХ СРЕД Zn,Al И Mg,Al
47
Таблица 1. Кинетические характеристики извлечения U(VI) из водного раствора СДГ для модели сорбции псевдо-
первого порядка при рН0 5.0, CU(VI) = 1×10-4 моль/дм3, V/m = 500 см3/г
Параметры модели псевдопервого порядка
Сорбент
k
, мин-1
ар(эксп.), ммоль/г
ар(теор.), ммоль/г
R2
1
Mg,Al-Сit
0.015
0.035
0.011
0.9064
Fe3O4/Mg,Al-Сit
0.014
0.032
0.015
0.9237
Таблица 2. Кинетические характеристики сорбции U(VI) из водного раствора СДГ для модели псевдовторого поряд-
ка при рН0 5.0, CU(VI) = 1×10-4 моль/дм3, V/m = 500 см3/г
Параметры модели псевдовторого порядка
Сорбент
k
, мин-1·г·ммоль-1
ар(эксп.), ммоль/г
ар(теор.), ммоль/г
R2
2
Mg,Al-Сit
7.27
0.035
0.036
0.9995
Fe3O4/Mg,Al-Сit
4.28
0.032
0.035
0.9986
(табл. 3). Как видно, для всех исследуемых сорбен-
онным колебаниям СОО--группы. Интенсивная
тов характерны достаточно высокие значения ко-
широкая полоса поглощения при 3440 см-1 отно-
эффициентов линейной корреляции. Коэффициент
сится к валентным колебаниям межплоскостных
1/n в уравнении Фрейндлиха находится в диапазо-
молекул воды и гидроксильных групп сорбента.
не от 0.185 для Zn,Al-Сit до 0.661 для Mg,Al-Сit,
Деформационные колебания молекул воды зама-
что свидетельствует о более однородной поверх-
скированы более интенсивной полосой поглоще-
ности образца Mg,Al-Сit.
ния при 1570 см-1. Поскольку содержание U(VІ)
Значения предельной адсорбции U(VI), рассчи-
достаточно низкое, нельзя оценить образование
танные на основании уравнения Ленгмюра, со-
его координационных соединений с Сit-ионами на
ставляют, мкмоль/г: Zn,Al-Сit - 70.9, Mg,Al-Сit -
основании полученных ИК спектров.
250.0, Fe3O4/Zn,Al-Сit - 92.6, Fe3O4/Mg,Al-Сit -
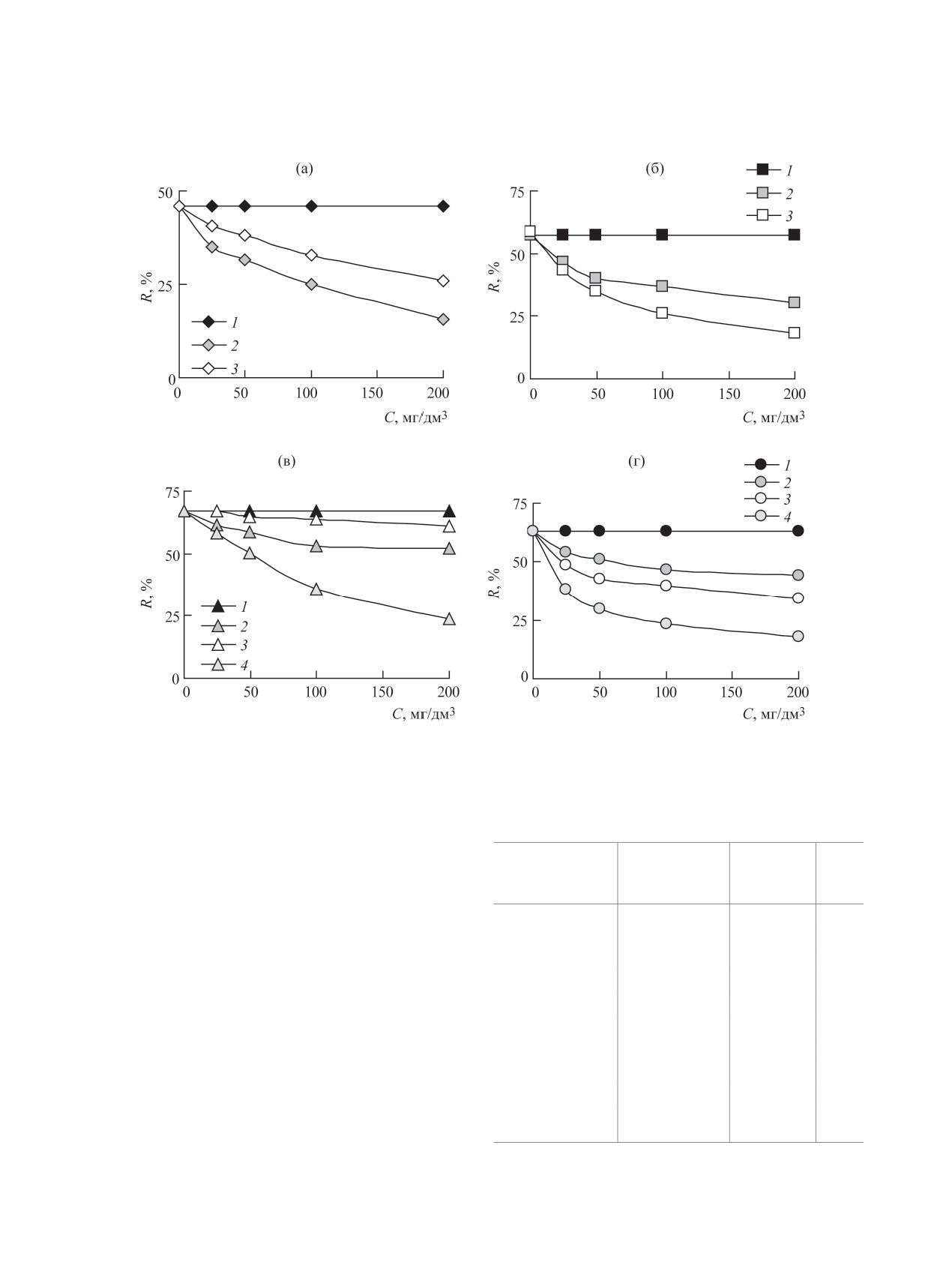
Влияние макрокомпонентов вод на извлече-
97.1. Как видно, введение нанодисперсных окси-
ние U(VІ). При исследовании влияния концентра-
дов железа в состав композиционных сорбентов
ции основных макрокомпонентов природных вод -
приводит как к снижению сорбционной емкости
катионов Na+, K+, Са2+, Mg2+ - на извлечение
для образца Fe3O4/Mg,Al-Сit в ≈ 2.5 раза, так и
к увеличению количества извлекаемого U(VI) в
1.3 раза для образца Fe3O4/Zn,Al-Сit.
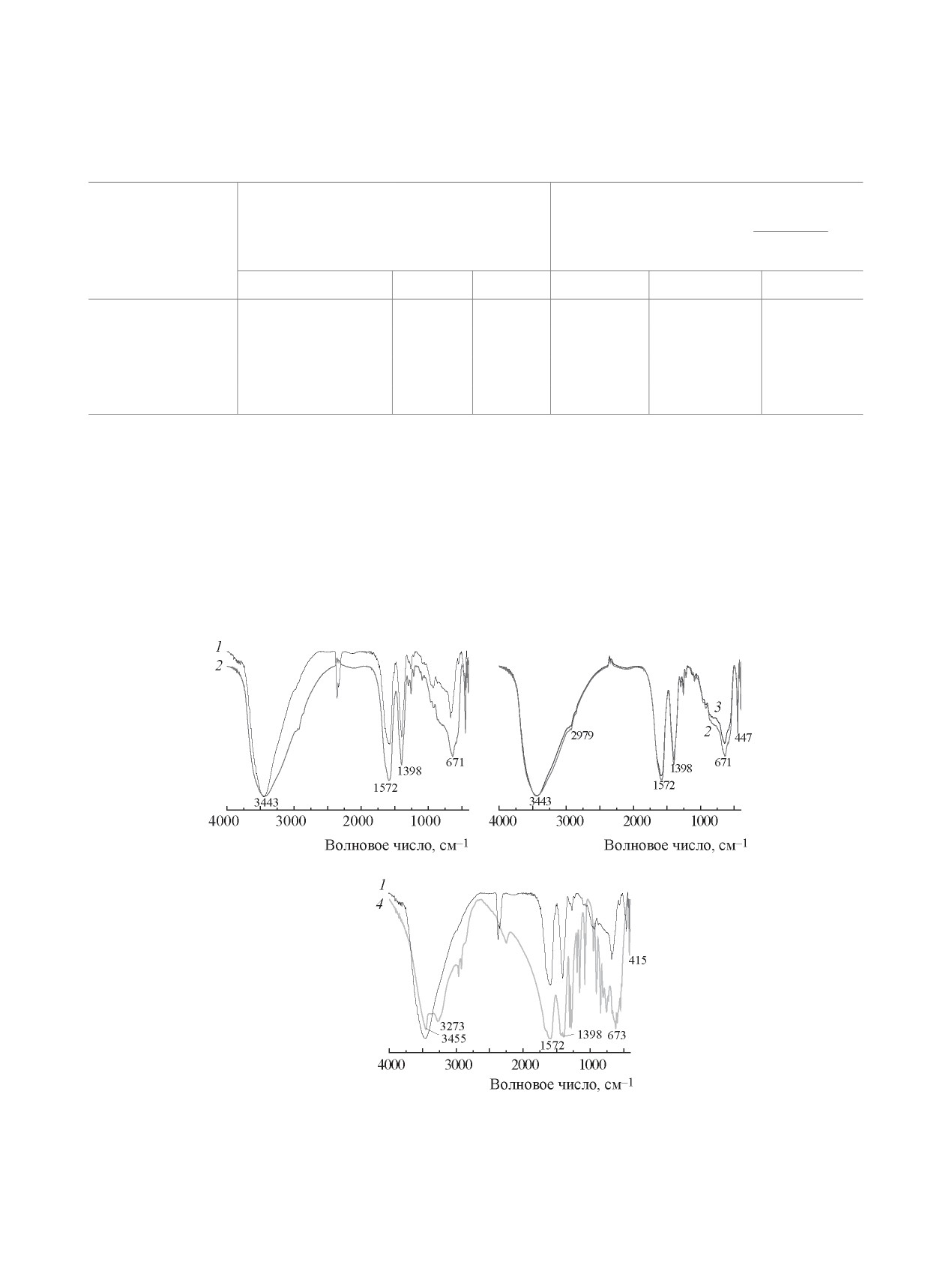
В ИК спектрах СДГ, интеркалированных Сit-
ионами (рис. 7), наблюдаются две полосы погло-
щения при 1570 и 1400 см-1, которые можно от-
нести соответственно к асимметричным и симме-
тричным валентным колебаниям ионизированных
СОО--групп. Отсутствие полосы поглощения в
области около 1700 см-1 свидетельствует об от-
сутствии в составе сорбентов протонированных
СООН-групп. Кроме того, в спектре этих сорбен-
тов также отсутствуют полосы СО32--ионов, ко-
торые наблюдаются в ИК спектрах карбонатной
формы СДГ, что дополнительно подтверждает
Рис. 6. Изотермы сорбции U(VI) из водных растворов
наличие только Сit-ионов в сорбенте. Полоса по-
(рН0 5.0, V/m = 500 см3/г) на СДГ: 1 - Mg,Al-Сit, 2 -
глощения при 670 см-1 относится к деформаци-
Fe3O4/Mg,Al-Сit, 3 - Zn,Al-Сit, 4 - Fe3O4/Zn,Al-Сit.
РАДИОХИМИЯ том 62 № 1 2020
48
ПУЗЫРНАЯ и др.
Таблица 3. Коэффициенты уравнений сорбции U(VI) из водных растворов на исследуемых сорбентах при рН0 5.0,
V/m = 500 см3/г
KL·af·Cp
По Фрейндлиху, as = KF·Cp1/n
По Ленгмюру,
as
=
Сорбент
1 + KL·Cp
KF
1/n
R2 a
KL
a∞, мкмоль/г
R2
Zn,Al-Сit
20.3
0.185
0.9932
0.017
70.9
0.9999
Fe3O4/Zn,Al-Сit
17.5
0.237
0.9297
0.009
92.6
0.9853
Mg,Al-Сit
4.93
0.661
0.9823
0.008
250.0
0.9954
Fe3O4/Mg,Al-Сit
3.93
0.524
0.9231
0.011
97.1
0.9966
a R2 -коэффициент линейной корреляции.
U(VI) исследуемыми сорбентами установлено, что
([UO2(CO3)2]2-, [(UO2(СО3)3]4-), а также гумусо-
указанные катионы не уменьшают сорбцию U(VI)
вых комплексов U(VI) ([UO2L]) [24]. Следует от-
в исследуемом водном растворе в широком диа-
метить, что для образца Mg,Al-Сit сорбционная
пазоне их концентраций (25-200 мг/дм3) (рис. 8).
способность по отношению к U(VI) в присутствии
С ростом концентрации HCO3--анионов и гу-
значительных количеств макрокомпонентов выше,
мусовых кислот (ГК и ФК) наблюдается посте-
чем для других форм исследуемых СДГ.
пенное снижение степени извлечения U(VI) в
Влияние дозы сорбента на извлечение U(VІ).
результате образования анионных карбонатных
Расход сорбционных материалов влияет на эконо-
Рис. 7. ИК спектры образцов: 1 - Mg,Al-Сit, 2 - Fe3O4/Mg,Al-Сit, 3 - Fe3O4/Mg,Al-Сit после сорбции U(VI), 4 - лимонная
кислота.
РАДИОХИМИЯ том 62 № 1 2020
ИЗВЛЕЧЕНИЕ U(VI) ИЗ ВОДНЫХ СРЕД Zn,Al И Mg,Al
49
Рис. 8. Влияние неорганических и органических компонентов природных вод на извлечение U(VI) СДГ: а - Zn,Al-Сit, б -
Fe3O4/Zn,Al-Сit, в - Mg,Al-Сit, г - Fe3O4/Mg,Al-Сit. CU(VI) = 1×10-4 моль/дм3, рН0 5.0, V/m = 500 см3/г, tсорб = 1 ч. 1 - Na+,
K+, Ca2+, Mg2+; 2 - HCO3-; 3 - фульвокислоты; 4 - гуминовые кислоты.
Таблица 4. Влияние дозы исследуемых сорбентов на
мическую и экологическую целесообразность их
степень извлечения U(VI) из реальных водных сред
применения при дезактивации водных сред. Для
оценки эффективности исследуемых сорбентов
Доза сорбента,
Образец
Сорбент
R, %
на примере образцов Mg,Al-Сit и Fe3O4/Mg,Al-
г/дм3
воды
Сit нами рассмотрена возможность очистки ре-
Mg,Al-Сit
1
Природная
47.8
альных водных сред - природной поверхностной
6
95.1
(рН0 ≈
6.9) и сточной шахтной (рН0 ≈
8.0) вод
1
Шахтная
32.5
составов, приведенных выше. Определена степень
извлечения U(VI) при дозах материалов 1 и 6 г/дм3
6
77.8
и продолжительности сорбции 1 ч (табл. 4). Как
Fe3O4/Mg,Al-Сit
1
Природная
36.7
видно, максимальное поглощение U(VI) из при-
6
69.2
родной подземной воды (95.1%) наблюдается для
1
Шахтная
20.8
Mg,Al-Сit при 6 г/дм3. Применение Mg,Al-Сit и
6
53.3
Fe3O4/Mg,Al-Сit в количестве 6 г/дм3 для извле-
Природный
1
Шахтная
1.9
чения U(VI) из сточной шахтной воды позволяет
алюмосиликат
5
8.4
достигать 77.8 и 53.3%, соответственно, что зна-
[37]
РАДИОХИМИЯ том 62 № 1 2020
50
ПУЗЫРНАЯ и др.
чительно выше, чем при использовании природно-
2013. Vol. 52. P. 10152.
го алюмосиликата (монтмориллонита) (1.9% при
8. Zhang X., Ji L., Wang J. et al. // Colloids Surf. A. 2012.
дозе 5 г/дм3) [25].
Vol. 414. P.220.
На основании полученных данных можно за-
9. Kameda T., Takeuchi H., Yoshioka T. // Colloids Surf.
ключить, что, учитывая доступность синтеза ис-
A. 2010. Vol. 355. P. 172.
следованных сорбционных материалов на основе
10. Пшинко Г.Н., Косоруков А.А. Пузырная Л.Н., Гон-
цитратных форм Zn,Al- и Mg,Al-СДГ и их магнит-
чарук В.В. // Радиохимия. 2011. Т. 53, № 3. С. 257.
ных нанокомпозитов методом соосаждения, эколо-
11. Kosorukov A.A., Pshinko G.N., Puzyrnaya L.N., Ko-
гическую безопасность и эффективность, а также
bets S.A. // J. Water Chem.Technol. 2013. Vol. 35,
возможность полной автоматизации технологиче-
N 3. Р. 104.
ского процесса за счет применения магнитной сепа-
12. Кулюхин С.А., Красавина Е.П., Гредина И.В., Ми-
рации (для магнитных форм), использование дан-
зина Л.В. // Радиохимия. 2010. T. 52, № 6. С. 553.
ных сорбентов в отличие от традиционных (ионо-
13. Кулюхин С.А., Красавина Е.П., Румер И.А. и др. //
обменных смол, природных алюмосиликатов) яв-
Радиохимия. 2011. T. 53, № 5. С. 427.
ляется перспективным для дезактивации от U(VI)
14. Apelblat A. Citric Acid. Heidelberg: Springer, 2014.
больших объемов радиоактивно загрязненных
357 p.
вод даже при высоком содержании ионов щелоч-
15. Berto S., Crea F., Daniele P.G. et al. // Radiochim. Acta.
ных и щелочноземельных металлов (до 200 мг/дм3).
2012. Vol. 100. Р. 13.
16. Carlino S. // Solid State Ionics. 1997. Vol. 98. P. 73.
КОНФЛИКТ ИНТЕРЕСОВ
17. Zhang J., Zhang F., Ren L. et al. // Mater. Chem. Phys.
Авторы заявляют об отсутствии конфликта
2004. Vol. 85, N 1. P. 207.
интересов.
18. Reichle W.T., Kang S.Y., Everhardt D.S. // J. Catal. 1986.
Vol. 101. P. 352.
СПИСОК ЛИТЕРАТУРЫ
19. Tronto J., Crepaldi E.L., Pavan P.C. et al. // Mol. Cryst.
1. Cánovas C.R., Olías M., Nieto J.M. et al. // Sci. Total
Liq. Cryst. 2001. Vol. 356. P. 227.
Environ. 2007. Vol. 373. P. 363.
20. Li R., Wang J.J., Zhou B. et al. // Sci. Total Environ.
2. Fan F.L., Qin Z., Bai J. et al. // J. Environ. Radioact.
2016. Vol. 559. Р. 121.
2012. Vol. 106. P. 40.
21. Ho Y.S., McKay G. // Water Res. 2000. Vol. 34, N 3. P.
3. Qiao W, Bai H., Tang T. et al. // Colloids Surf. A. 2019.
735-742.
Vol. 577. P. 118.
22. Tronto J., Reis M.J.D., Silverio F. et al. // J. Phys. Chem.
4. Пузырная Л.Н., Шунков В.С., Пшинко Г.Н. и др. //
Solids. 2004. Vol. 65. P. 475-480.
Радиохимия. 2018. Т. 60, № 3. С. 245-249.
23. Kobets S.A., Pshinko G.N., Puzyrnaya L.N. // J. Water
5. Shou J., Jiang С., Wanga F. et al. // J. Mol. Liq. 2015.
Chem. Technol. 2012. Vol. 34, N 6. P. 277.
Vol. 207. P. 216.
24. Pshinko G.N. // J. Water Chem. Technol. 2009. Vol. 31,
6. Koilraj P., Sasaki K. // J. Environ. Chem. Eng. 2016.
N 3. P. 163.
Vol. 4, N 1. P. 984.
25. Пшинко Г.Н., Пузырная Л.Н., Косоруков А.А., Гон-
7. Zhang X., Wang J., Li R. et al. // Ind. Eng. Chem. Res.
чарук В.В. // Радиохимия. 2010. Т. 52, № 3. С. 247.
РАДИОХИМИЯ том 62 № 1 2020