РАДИОХИМИЯ, 2020, том 62, № 1, с. 20-23
УДК 546.798.22
КИНЕТИКА РЕАКЦИИ Pu(VI)
C ЭТИЛЕНДИАМИНТЕТРАУКСУСНОЙ КИСЛОТОЙ
© 2020 г. А. М. Федосеевa, В. П. Шиловa,*
a Институт физической химии и электрохимии им. А. Н. Фрумкина РАН, 119071, Москва, Ленинский пр., д. 31, стр. 4
*e-mail: ShilovV@ipc.rssi.ru
Получена 10.01.2019, после доработки 21.09.2019, принята к публикации 21.09.2019
Спектрофотометрическим методом изучена стехиометрия реакции восстановления Pu(VI) ионами ЭДТА
в растворах 0.05-0.5 моль/л HClO4 при температуре 23°С. При избытке Pu(VI) 1 моль ЭДТА восстанав-
ливает 2.5±0.5 моля Pu(VI) в атмосфере воздуха, причём основным продуктом реакции является Pu(V).
При рН раствора 4.5 1 моль ЭДТА восстанавливает 5±0.5 моля Pu(VI). В 0.1 моль/л HClO4 в инертной
атмосфере реакция восстановления Pu(VI) ионами ЭДТА практически не идёт, тогда как при рН 4.5 ре-
акция проходит в течение ~1 мин. В растворах 0.05-0.5 моль/л HClO4 (ионную силу 1.0 поддерживали
добавлением LiClO4) при температуре 23-45°С Pu(VI) расходуется по закону скорости первого порядка.
Скорость реакции имеет первый порядок по ЭДТА и порядок -2 по ионам Н+. Активированный комплекс
образуется с потерей 2 протонов. Энергия активации равна 128±10 кДж/моль. Высказаны предположения
о возможном участии кислорода в механизме реакции.
Ключевые слова: плутоний(VI), этилендиаминтетрауксусная кислота, восстановление, кинетика
DOI: 10.31857/S0033831120010037
Взаимодействие этилендиаминтетрауксусной
PuO2+ на 200 мВ. Поэтому представляется инте-
кислоты и её анионов с ионами плутония в раз-
ресным изучить более детально кинетику реакции
личных степенях окисления изучается достаточ-
Pu(VI) с ЭДТА и устойчивость Pu(VI) в растворах
но длительное время, и основные усилия были
ЭДТА при различных значениях рН и температу-
направлены на определение состава и прочности
ры, чему и посвящена настоящая работа.
комплексов в системах с участием этих частиц
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
[1-4]. В вышеуказанных работах было установле-
но, что плутоний в степенях окисления III, IV, V
Работу выполняли с 239Pu, очищенным анионо-
и VI образует весьма прочные комплексы с ани-
обменным способом. Из азотнокислого раствора
онами ЭДТА различной степени протонирования,
Pu(VI), десорбированного с колонки, осаждали
а также что Pu(VI) и Pu(V) восстанавливаются
оксалат Pu(IV), который промывали, растворяли
ЭДТА в широком диапазоне рН растворов, при-
в HNO3 и упаривали до влажных солей; остаток
чем и Pu(V), и даже Pu(VI) не восстанавливаются
растворяли в 3 моль/л HNO3. Полученный раствор
полностью до более низких степеней окисления
служил в качестве запасного. Аликвоту запасного
[4]. Полярографическим и спектрофотометриче-
раствора упаривали досуха с концентрированной
ским методами [3] изучено взаимодействие Pu(VI)
хлорной кислотой и растворяли в бидистилляте.
с ЭДТА при рН более 1 и показано, что скорость
Полученный раствор использовали в течение одно-
восстановления Pu(VI) возрастает с увеличением
го дня. Спектры регистрировали в диапазоне длин
рН и концентрации ЭДТА, однако число ионов
волн 350-1300 нм с использованием спектрофото-
PuO22+, реагирующих с 1 молем ЭДТА, определено
метра Shimadzu-PC 3100 (Япония). Концентрацию
равным 7. Это представляется довольно неожи-
Pu(VI) определяли спектрофотометрически в 0.1-
данным, поскольку стехиометрический коэффи-
1.0 моль/л HClO4 с использованием значения ε830 =
циент в реакции NpO22+ с ЭДТА найден равным 4
500 л·моль-1·см-1. В растворах 0.05-0.5 моль/л
[5], принимая во внимание, что потенциал пары
HClO4 в изученных условиях в присутствии раз-
NpO22+/NpO2+ превышает потенциал пары PuO22+/
личных концентраций HnY(4-n)- спектр Pu(VI) не
20
КИНЕТИКА РЕАКЦИИ Pu(VI) C ЭТИЛЕНДИАМИНТЕТР
АУКСУСНОЙ КИСЛОТОЙ
21
меняется и не наблюдается сдвига максимума по-
ров, помещённых в стеклянные ампулы, удаляли
глощения при λ = 830 нм. Растворы ЭДТА готови-
барботированием азота, и ампулы запаивали в
ли, как описано в работе [5].
токе азота. Раствор содержал 0.056 моль/л Pu(VI),
0.056 моль/л ЭДТА и 0.1 моль/л HClO4; через 6 сут
Комплекс Na[PuO2(CH3COO)3] готовили введе-
цвет раствора из оранжево-бежевого стал коричне-
нием в раствор 1 моль/л CH3COONa, перекристал-
ватым. Раствор выдерживали при 45°С в течение
лизованного из воды, раствор ~0.1 моль/л перхло-
7 ч, заметных изменений не обнаружено. Через
рата плутонила. Реакционную смесь выдерживали
9 сут начал выпадать очень мелкий осадок. После
при температуре ~6°С в течение нескольких часов
вскрытия ампулы аликвоту 0.02 мл раствора внес-
для получения относительно крупных кристаллов
ли в кювету, содержащую 1 мл 1 моль/л HClO4; из
соединения. Перед использованием комплекс про-
полученного спектра расчёт концентрации Pu(VI)
мывали водой и высушивали на воздухе.
даёт величину 0.036 моль/л. Осадок отделили цен-
В опытах по кинетике пробирку с раствором
трифугированием, промыли водой и растворили в
HClO4, LiClO4 и ЭДТА помещали в термостати-
1 мл 1 моль/л HClO4; спектр полученного раствора
рованный закрытый сосуд в воду, уровень которой
указывает на присутствие в растворе четырёхва-
превышал уровень раствора в пробирке. Через
лентного плутония, но оценить его концентрацию
~5 мин после установления термического равнове-
достаточно сложно из-за её низкой величины.
сия в раствор вносили аликвоту раствора перхло-
Таким образом, можно сделать вывод, что реакция
рата плутонила, перемешивали и отбирали из по-
восстановления Pu(VI) ЭДТА в слабокислых рас-
лученного раствора аликвоты 0.02-0.2 мл и вно-
творах идёт очень медленно и при таких высоких
сили в кварцевую кювету с l = 1 см, содержащую
концентрациях в отсутствие кислорода воздуха за-
0.8-0.9 мл 1 моль/л HClO4.
метный вклад в изучаемое взаимодействие могут
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
вносить радиолитические процессы.
Сначала была оценена стехиометрия реакции
Для оценки стехиометрии восстановления
Pu(VI) с ЭДТА при температуре 45°С в растворе
Pu(VI) ЭДТА при более высоких значениях рН про-
0.1 моль/л HClO4, содержащем 20 ммоль/л Pu(VI)
вели следующий опыт. Навеску твёрдого комплек-
и 3 ммоль/л Na2H2Y; результаты опытов представ-
са Na[PuO2(CH3COO)3] растворили в воде и полу-
лены ниже.
чили раствор с содержанием Pu(VI) 5.5 ммоль/л.
Добавили аликвоту 0.5 моль/л уксусной кислоты
Время, мин
[Pu(VI)], ммоль/л
до концентрации, равной содержанию натрия для
1
15
поддержания величины рН ~4.5, через этот рас-
12
12
твор и раствор 3.43 ммоль/л Na2H2Y барботиро-
32
10
вали азот для удаления из них кислорода воздуха.
Аликвоту дезаэрированного раствора 3.43 ммоль/л
54
9
Na2H2Y для получения содержания Na2H2Y
82
8.8
0.5 ммоль/л внесли в раствор Pu(VI) и из реакцион-
132
7.4
ной смеси сразу отобрали аликвоту для определе-
ния концентрации Pu(VI). Содержание Pu(VI) сни-
По этим данным можно оценить значение
зилось приблизительно в два раза. При последую-
Δ[Pu(VI)]/Δ[Y], которое близко к 2.5. Раствор
щем контроле содержания Pu(VI) в барботируемой
был оставлен на ночь при комнатной температуре
азотом реакционной смеси было установлено, что
(23°С), и на следующий день концентрация Pu(VI)
его концентрация не меняется, по меньшей мере,
была найдена равной 10 ммоль/л. Этот результат
в течение 30 мин. На основании полученных дан-
позволяет предположить, что возможно проте-
ных расчёт Δ[Pu(VI)]/Δ[Y] даёт величину 5±0.5.
кание реакций с участием кислорода, поскольку
все опыты проводили на воздухе. Для выяснения
В более концентрированном (0.2 моль/л) рас-
возможности влияния кислорода воздуха на про-
творе Na2H2Y c pH 4.5 реакция восстановления
цессы, протекающие в системе Pu(VI)-ЭДТА,
Pu(VI) протекает очень быстро. Так, например,
были выполнены следующие опыты в запаянных
в ампулу с 0.5 мл раствора 0.2 моль/л Na2H2Y
стеклянных ампулах. Кислород воздуха из раство-
в атмосфере азота добавили 0.07 мл раствора
РАДИОХИМИЯ том 62 № 1 2020
22
ФЕДОСЕЕВ, ШИЛОВ
0.25
0.20
0.15
0.10
0.05
0.00
ȼɪɟɦɹ ɦɢɧ
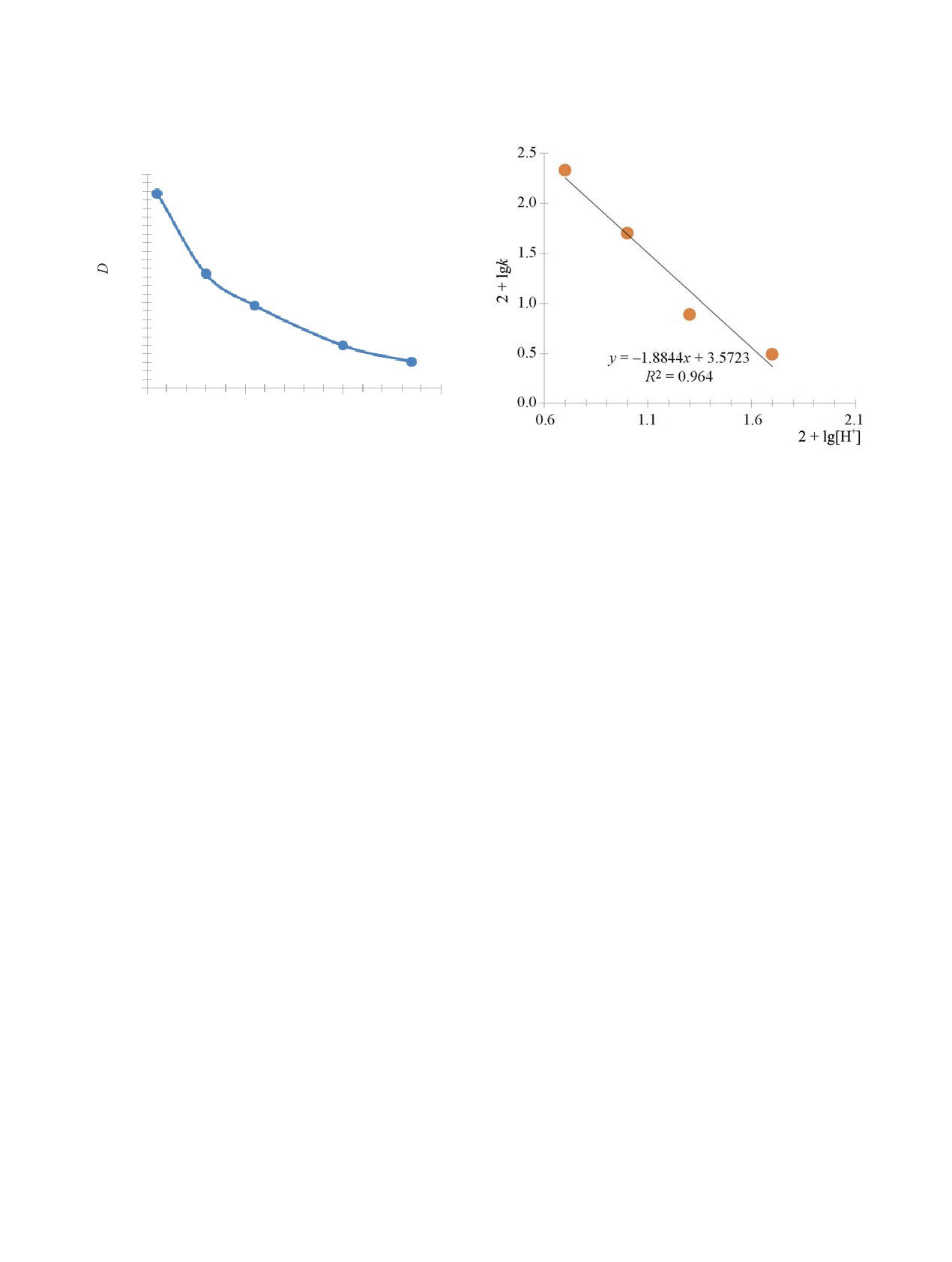
Рис. 1. Кинетическая кривая восстановления Pu(VI)
ионами ЭДТА. [HClO4] = 0.1 моль/л, [LiClO4] =
Рис. 2. Влияние концентрации ионов Н+ на константу
0.9 моль/л, [H4Y] = 20 ммоль/л, T = 30°C, [Pu(VI)] =
скорости восстановления Pu(VI) ионами ЭДТА в рас-
3 ммоль/л.
творе с ионной силой 1 при 45°С.
0.12 моль/л Pu(VI), раствор стал соломенно-жёл-
порядок реакции по Pu(VI). Кинетическое уравне-
тым после смешивания. Через 1-2 мин раствор
ние имеет вид -d[Pu(VI)]/dt = k'[Pu(VI)], где k' -
обесцветился, через ~5 мин стал сиреневатым, а
константа скорости первого порядка. В интеграль-
через 3 ч - коричневато-оранжевым. Через 2 дня
ной форме после замены [Pu(VI)] на пропорцио-
ампулу вскрыли, осадок не образовался. Аликвоту
нальную ей величину D данное уравнение пере-
0.1 мл раствора ввели в кювету, содержащую 1 мл
ходит в выражение 2.3lgD = k't + const. Константа
1 моль/л HClO4, В спектре наблюдаются полосы по-
скорости первого порядка увеличивается с ростом
глощения только Pu(IV), причём максимум харак-
концентрации ЭДТА, как видно из таблицы.
теристической полосы Pu(IV) сдвинут до 494 нм,
Постоянство константы скорости k = k'/[Y] в
что свидетельствует об образовании прочных ком-
0.1 моль/л HClO4 свидетельствует о первом поряд-
плексов.
ке реакции по восстановителю. В таблице приве-
Полагая, что в выбранных условиях (темпе-
дены значения k в разных условиях. Из данных та-
ратура, концентрации ионов водорода) наиболее
блицы видно, что с ростом концентрации ионов Н+
быстрой реакцией является взаимодействие ком-
скорость восстановления Pu(VI) замедляется. На
плексона с Pu(VI) и сопутствующие процессы с
рис. 2 приведена зависимость k от концентрации
возможным участием кислорода воздуха и ионов
Н+ в логарифмических координатах. При 45°С экс-
плутония в более низких степенях окисления про-
периментальные точки лежат на прямой с угловым
текают несколько медленнее, изучили кинети-
коэффициентом -1.9.
ку реакции Pu(VI) + HnY(4-n)- в растворах 0.05-
Следовательно, восстановление идёт через об-
0.5 моль/л HClO4. На рис. 1 приведена кине-
разование активированного комплекса с отщепле-
тическая кривая в координатах D-время при
нием двух протонов. Так как для H4Y pK1 = 2.0 [4],
T
=
30°C для раствора
0.1 моль/л HClO4
+
в изученных хлорнокислых растворах комплексо
0.86 моль/л LiClO4 + 0.04 моль/л NaClO4, содер-
существует в форме H4Y и H3Y-. Активированный
жащего 3 ммоль/л Pu(VI) и 20 ммоль/л ЭДТА.
комплекс возникает в результате реакции PuO22+ +
Кинетическая зависимость в полулогарифмиче-
H4Y = PuO2H2Y + 2H+. Далее происходит внутри-
ских координатах представляет собой прямую
молекулярный перенос заряда, возникают Pu(V) и R.
вплоть до протекания реакции на 75%.
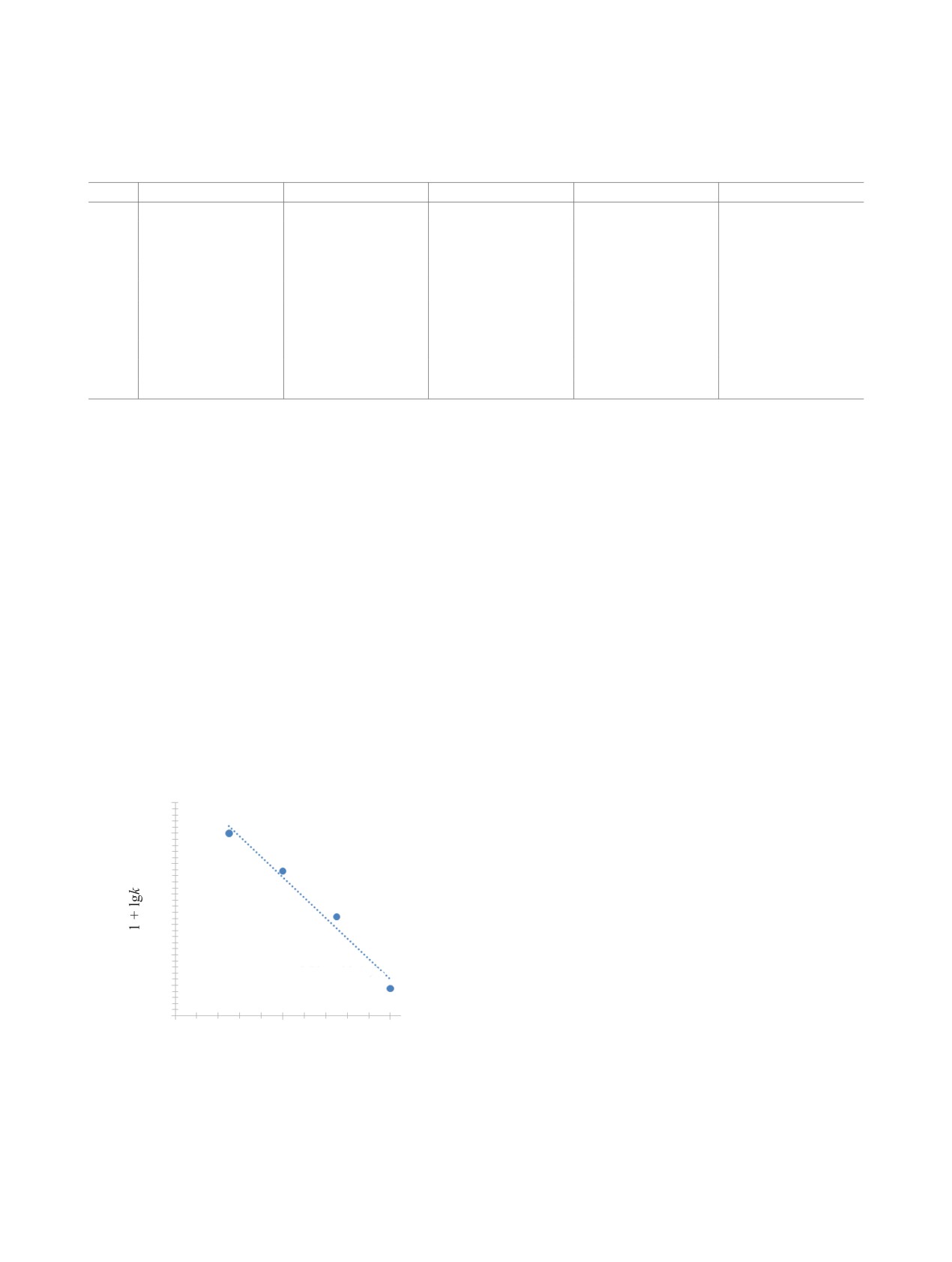
Из температурной зависимости k в координа-
Спрямление кинетических кривых в полулога-
тах 103/T-lgk (рис. 3) была найдена энергия ак-
рифмических координатах указывает на первый
тивации, равная 128±10 кДж/моль. Влияние ион-
РАДИОХИМИЯ том 62 № 1 2020
КИНЕТИКА РЕАКЦИИ Pu(VI) C ЭТИЛЕНДИАМИНТЕТР
АУКСУСНОЙ КИСЛОТОЙ
23
Влияние условий реакции Pu(VI) + H4Y на константу скорости первого порядка k' и константу k бимолекулярной
реакции
T, °C
[HClO4], моль/л
[LiClO4], моль/л
[ЭДТА], ммоль/л
k'×102, мин-1
k, л·моль-1·мин-1
45
0.50
0.80
20
0.20
0.10
0.20
0.50
20
0.50
0.25
0.10
0.90
10
1.20
1.20
0.10
0.90
40
5.30
1.30
0.10
0.90
20
3.20
1.60
0.10
20
4.10
2.00
0.05
0.95
20
12.70
6.80
40
0.10
0.90
20
1.80
0.90
35
0.10
0.90
20
0.90
0.45
30
0.10
0.90
20
0.29
0.15
ной силы незначительное. При 45°С в растворе
менее чем за 1 мин на воздухе и в инертной ат-
0.1 моль/л HClO4 k = 1.6 л·моль-1·мин-1, в рас-
мосфере, и конечным продуктом восстановления
творе 0.1 моль/л HClO4 + 0.9 моль/л LiClO4 k =
является Pu(IV). Это можно объяснить тем, что
2.0 л·моль-1·мин-1. Это является подтверждением
кислород участвует в сложном механизме реак-
факта, что в образовании активированного ком-
ции. Так, можно предположить, что O2 вступает
плекса принимает участие и H4Y.
в реакцию с первичными продуктами окисления
Таким образом, изучено восстановление Pu(VI)
ЭДТА плутонием(VI), давая продукты, которые
ионами ЭДТА в растворах 0.05-0.5 моль/л HClO4
могут взаимодействовать с Pu(VI) с более высокой
при температуре 23-45°С. При избытке Pu(VI)
скоростью по сравнению с исходной ЭДТА. С дру-
1 моль ЭДТА восстанавливает около 3.5±0.5 моля
гой стороны, в этих условиях может существовать
Pu(VI) в атмосфере воздуха, причём основным
равновесие пары Pu(VI)/Pu(V) с кислородом, т.е.
продуктом реакции является Pu(V). При рН рас-
при накоплении в растворе Pu(V) кислород может
твора 4.5 1 моль ЭДТА восстанавливает около
его окислять. Нам представляется, что этим можно
5±0.5 моля Pu(VI). В 0.1 моль/л HClO4 в инертной
объяснить результаты, полученные в работе [4] и в
атмосфере реакция восстановления Pu(VI) иона-
ми ЭДТА практически не идёт, тогда как при рН
настоящей работе, свидетельствующие о том, что
4.5 реакция проходит очень быстро, практически
исследуемая реакция восстановления в слабокис-
лых растворах не проходит до конца на воздухе.
1.4
КОНФЛИКТ ИНТЕРЕСОВ
1.2
1.0
Авторы заявляют об отсутствии конфликта
интересов.
0.8
0.6
СПИСОК ЛИТЕРАТУРЫ
0.4
1. Kabanova O.L., Danuschenkova M.A., Paley P.N. //
y = -6.72x + 22.417
Anal. Chim. Acta. 1960. Vol. 22. P. 66.
0.2
R2 = 0.9778
2. Кабанова О.Л. // ЖНХ. 1961. Т. 6, № 4. С. 786.
0.0
3. Cauchetier P., Guichard C. // J. Inorg. Nucl. Chem.
3.1
3.2
3.3
1975. Vol. 37, N 7-8. P. 1771.
103/T, K-1
4. AlMahamid I., Becraft K.A., Hakem N.L., Gatti R.C.,
Рис. 3. Зависимость логарифма константы скорости
Nitsche H. // Radiochim. Acta. 1996. Vol. 74. P. 129.
восстановления Pu(VI) от обратной температуры в
5. Шилов В.П., Федосеев А.М. // Радиохимия. 2015.
растворах 0.1 моль/л HClO4 + 0.9 моль/л LiClO4.
Т. 57, № 3. С. 218-220.
РАДИОХИМИЯ том 62 № 1 2020