Радиохимия, 2019, т. 61, N 6, c. 489-494
489
Экстракция РЗЭ(III), U(VI) и Th(IV) из азотнокислых растворов
дифенил(дибутилкарбамоилметил)фосфиноксидом
в присутствии бис[(трифторметил)сульфонил]имидов четвертичных
аммониевых оснований
© А. Н. Туранов*а, В. К. Карандашевб, А. Н. Яркевичв, В. А. Хвостиковб
а Институт физики твердого тела РАН, 142432, Черноголовка Московской обл., ул. Акад. Осипьяна, д. 2;
* e-mail: turanov@issp.ac.ru
б Институт проблем технологии микроэлектроники и особо чистых материалов РАН,
142432,Черноголовка Московской обл., ул. Акад. Осипьяна, д. 6
в Институт физиологически активных веществ РАН, 142432, Черноголовка Московской обл., Северный проезд, д. 1
Получена 29.10.2018, после доработки 24.01.2019, принята к публикации 24.01.2019
УДК 542.61: 546.442
Установлено, что экстракция РЗЭ(III), U(VI) и Th(IV) из азотнокислых растворов растворами дифе-
нил(дибутилкарбамоилметил)фосфиноксида значительно возрастает в присутствии ионных жидкостей с
анионом бис[(трифторметил)сульфонил]имида и катионами четвертичных аммониевых оснований. Оп-
ределена стехиометрия извлекаемых комплексов. Рассмотрено влияние концентрации HNO3 в водной
фазе и природы катионной части ионной жидкости и органического растворителя на эффективность
извлечения ионов РЗЭ(III), U(VI) и Th(IV) в органическую фазу.
Ключевые слова: экстракция, синергизм, редкоземельные элементы(III), уран(VI), торий(IV), кар-
бамоилметилфосфиноксид, ионные жидкости.
DOI: 10.1134/S003383111906008X
Известно, что бидентатные фосфорорганиче-
приведены в обзорах [13-15]. Установлено, что для
ские соединения, в частности, диарил(диалкилкар-
эффективного извлечения РЗЭ(III) из растворов
бамоилметил)фосфиноксиды (КМФО), обладают
HNO3 и HCl достаточно даже относительно не-
высокой экстракционной способностью по отноше-
большой концентрации ИЖ в органическом рас-
нию к актинидам и редкоземельным элементам
творителе, содержащем КМФО [16, 17]. Это позво-
(РЗЭ) и используются для извлечения и концентри-
ляет рассматривать ИЖ как активный компонент
рования этих элементов в экстракционных [1, 2] и
синергетической смеси. Рассмотрено влияние при-
сорбционных [3] системах. Эффективность экс-
роды катионной и анионной частей ИЖ на величи-
тракции актинидов и РЗЭ(III) растворами КМФО
ну синергетического эффекта при экстракции акти-
из азотнокислых растворов существенно повыша-
нидов, РЗЭ(III) и Sr(II) из азотнокислых растворов.
ется в присутствии хлорированного дикарболлида
Увеличение гидрофобности анионной части приво-
кобальта (ХДК) в органической фазе [4], а также
дит к увеличению экстракции ионов металлов рас-
HClO4 или перхлоратов щелочных металлов в вод-
творами КМФО, а катионной - к ее уменьшению
ной [5, 6].
[10, 18].
В последнее время значительно возрос интерес
Использование бис[(трифторметил)сульфонил]-
к использованию ионных жидкостей (ИЖ) в экс-
имида в качестве анионного компонента ИЖ опре-
тракционной практике концентрирования и разде-
деляется его высокой гидрофобностью и устойчи-
ления органических и неорганических соединений
востью в азотнокислых средах по сравнению с
в качестве несмешивающейся с водой фазы [7-10].
анионом гексафторфосфата [13]. В большинстве
Было показано, что экстракция актинидов и
опубликованных работ по экстракции ионов метал-
РЗЭ(III) растворами КМФО в ИЖ - гексафторфос-
лов в качестве ИЖ использовали в основном ИЖ
фатах и бис[(трифторметил)сульфонил]имидах 1-ал-
на основе катионов 1-алкил-3-метилимидазолия.
кил-3-метилимидазолия - значительно возрастает
Однако в последнее время возрос интерес к ис-
по сравнению с экстракцией растворами КМФО в
пользованию в экстракционной практике ИЖ с ка-
традиционных органических растворителях
[11,
тионами четвертичных аммониевых оснований
12]. Примеры использования ИЖ в процессах из-
(ЧАО), что связано с их большей доступностью и
влечения и концентрирования РЗЭ(III) и актинидов
меньшей токсичностью [19].
490
А. Н. Туранов и др.
В настоящей работе исследовано влияние при-
зе. Коэффициенты распределения элементов рас-
роды катионной части ИЖ на эффективность экс-
считывали как отношение их концентраций в рав-
тракции РЗЭ(III), U(VI) и Th(IV) из азотнокислых
новесных фазах. Погрешность определения коэф-
растворов растворами КМФО в органических рас-
фициентов распределения не превышала 5%. Кон-
творителях. Для этого рассмотрено межфазное рас-
центрацию ионов Tf2N- в равновесных водных рас-
пределение РЗЭ(III), U(VI) и Th(IV) между раство-
творах определяли атомно-эмиссионным методом с
рами HNO3 и органической фазой, содержащей
ионизацией пробы в индуктивно связанной плазме
дифенил(дибутилкарбамоилметил)фосфиноксид
с использованием спектрометра ICAP-61 (Thermo
Ph2P(O)CH2C(O)NBu2 и бис[(трифторметил)
Jarrell Ash, США) по содержанию серы. Концен-
сульфонил]имиды тетраэтиламмония (Et4NTf2N),
трацию HNO3 в равновесных водных фазах опреде-
триэтилбензиламмония (Et3BnNTf2N), тетрабути-
ляли потенциометрическим титрованием раство-
ламмония (Bu4NTf2N) и триоктилметиламмония
ром NaOH.
(Oct3MeNTf2N).
Результаты и обсуждение
Экспериментальная часть
Предварительно установлено, что растворы иссле-
дованных ИЖ в дихлорэтане не экстрагируют
Дифенил(дибутилкарбамоилметил)фосфинок-
РЗЭ(III), U(VI) и Th(IV) из азотнокислых растворов
сид (КМФО Ph2Bu2) получали известным методом
(величины D не превышают 10-2). Однако при экс-
[20]. Ионные жидкости Et4NTf2N, Et3BnNTf2N,
тракции РЗЭ(III) смесями КМФО и ИЖ в дихлорэта-
Bu4NTf2N и Oct3MeNTf2N получали обменной ре-
не происходит значительное увеличение извлечения
акцией литиевой соли бис[(трифторметил)суль-
РЗЭ(III) в органическую фазу (рис. 1). Наблюдаемый
фонил]имида (Sigma-Aldrich) с бромидами тетра-
синергетический эффект может быть связан с вхож-
этиламмония, триэтилбензиламмония, тетрабути-
дением гидрофобных анионов Tf2N- в состав экстра-
ламмония и хлоридом триоктилметиламмония
гируемых комплексов, приводящим к увеличению их
(Aliquat 336, Sigma-Aldrich) соответственно. В ка-
гидрофобности по сравнению с координационно-
честве органического растворителя использовали
сольватированными нитратами РЗЭ(III). Протекани-
1,2-дихлорэтан, нитробензол и о-ксилол марки х.ч.
ем подобного процесса объясняется значительное
без дополнительной очистки. Растворы КМФО и
увеличение экстракции РЗЭ(III) и Am(III) растворами
ИЖ в органических растворителях готовили по
КМФО в присутствии гидрофобных пикрат-анионов
точным навескам.
[22] или анионов ХДК [23].
Распределение РЗЭ(III), U(VI) и Th(IV) в экс-
Величина синергетического эффекта S = D/D0
тракционных системах изучали на модельных рас-
(D и D0 - коэффициенты распределения в присут-
творах 0.1-7.0 моль/л HNO3. Исходные водные
ствии и в отсутствие ИЖ в органической фазе со-
растворы с концентрацией каждого элемента 2×
ответственно) увеличивается в ряду ИЖ
10-6 моль/л готовили растворением соответствую-
Oct3MeNTf2N < Bu4NTf2N < Et3BnNTf2N < Et4N·
щих нитратов в воде с последующим добавлением
Tf2N (рис. 1) по мере снижения гидрофобности ка-
HNO3 до требуемой концентрации. Используемые
тиона ИЖ. Ранее отмечалось снижение эффектив-
реактивы соответствовали марке х.ч.
Опыты по экстракции проводили в пробирках с
притертыми пробками при температуре 20 ± 2°С и
соотношении объемов органической и водной фаз
1 : 1. Контакт фаз осуществляли на роторном аппа-
рате для перемешивания со скоростью 60 об/мин в
течение 1 ч. Предварительно установлено, что это-
го времени достаточно для установления постоян-
ных значений коэффициентов распределения (D).
Содержание РЗЭ(III), U(VI) и Th(IV) в исходных
и равновесных водных растворах определяли мето-
дом масс-спектрометрии с ионизацией пробы в ин-
дуктивно связанной плазме с использованием масс-
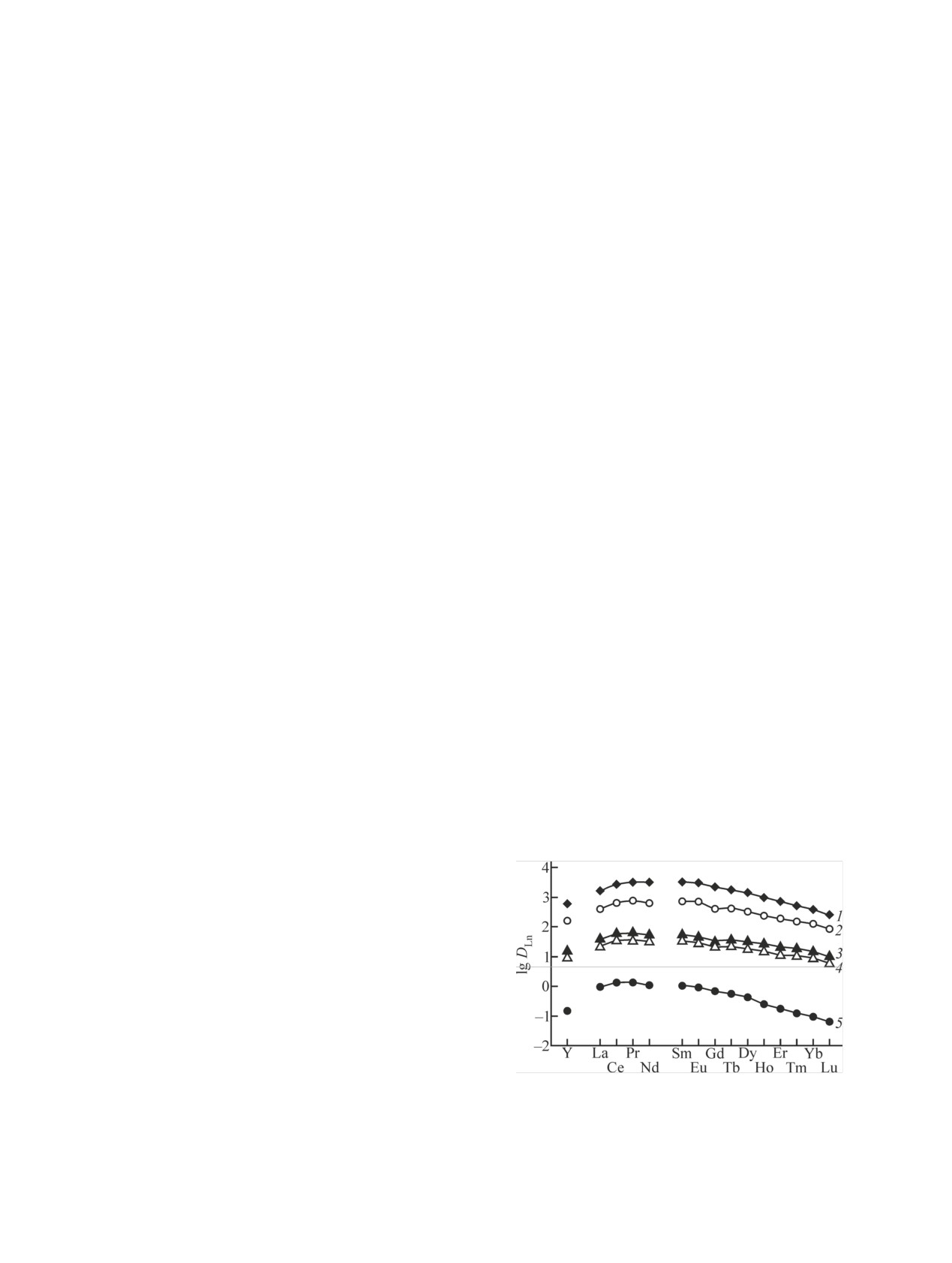
Рис. 1. Экстракция РЗЭ(III) и Y(III) из растворов 3 моль/л
спектрометра X-7 (Thermo Electron, США) по ранее
HNO3 растворами 0.05 моль/л КМФО в дихлорэтане, содержа-
описанной методике [21]. Содержание элементов в
щем 0.1 моль/л Et4NTf2N (1), Et3BnNTf2N (2), Bu4NTf2N (3),
органической фазе определяли по разнице их ис-
Oct3MeNTf2N (4), и раствором 0.05 моль/л КМФО в дихлорэта-
ходных и равновесных концентраций в водной фа-
не без добавок (5).
Экстракция РЗЭ(III), U(VI) и Th(IV) из азотнокислых растворов
491
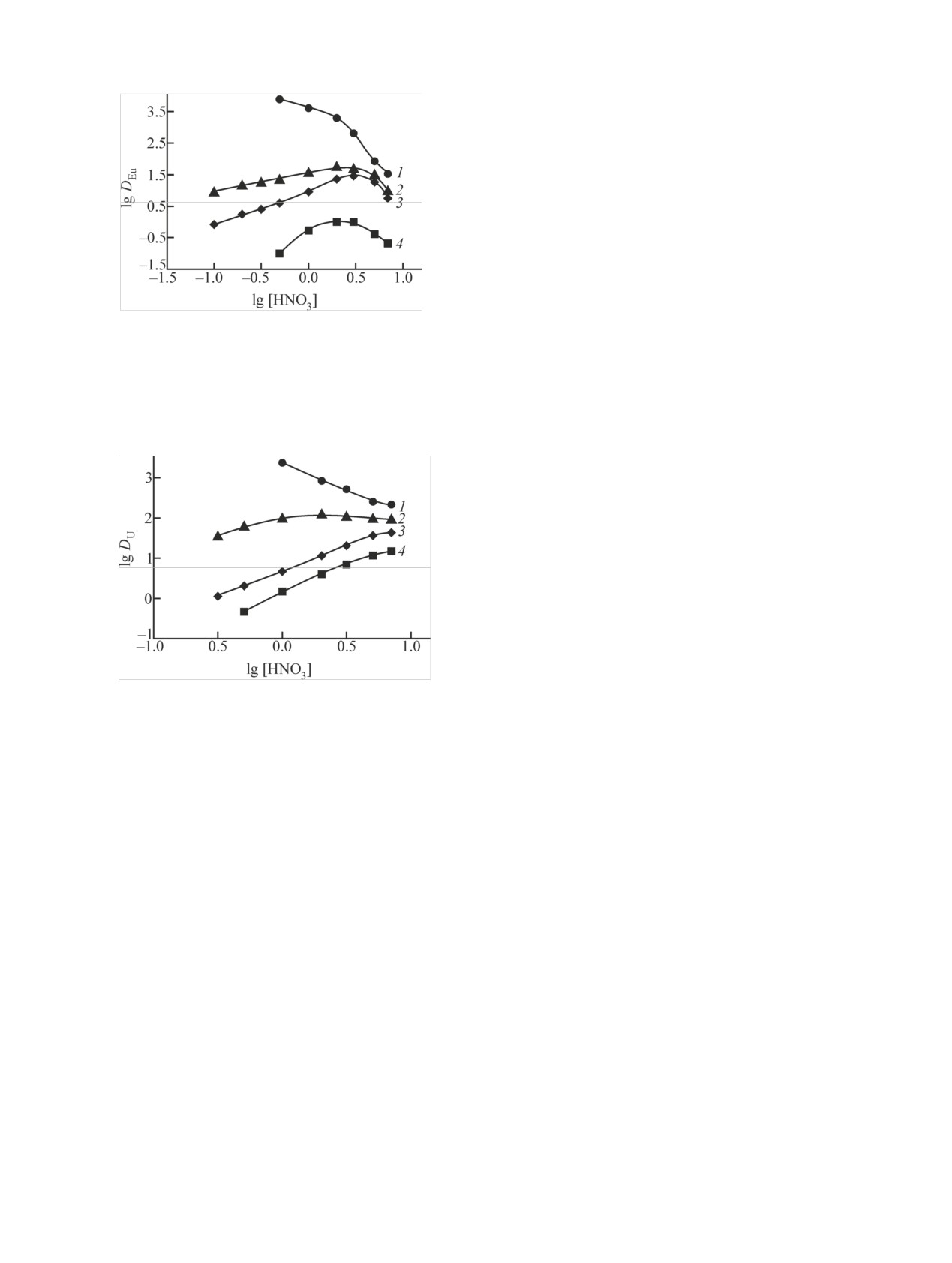
Присутствие ИЖ в органической фазе сущест-
венно изменяет характер зависимости эффективно-
сти экстракции Eu(III) и U(VI) растворами КМФО
от концентрации HNO3 в водной фазе (рис. 2, 3). В
присутствии менее гидрофобных ИЖ Et4NTf2N и
Et3BnNTf2N наблюдается снижение DEu и DU с рос-
том [HNO3], которое отмечалось ранее и при экс-
тракции растворами КМФО в ИЖ с катионом 1-бу-
тил-3-метилимидазолия (bmimTf2N) [16, 17]. При-
чины такого характера зависимости D-[HNO3] в
системах с ИЖ обсуждались в предыдущих рабо-
тах [15, 16]. В системах с более гидрофобными ИЖ
Рис. 2. Зависимость коэффициентов распределения Eu(III) от
(Oct3MeNTf2N и Bu4NTf2N) наблюдаются зависи-
концентрации HNO3 в равновесной водной фазе при экстрак-
мости D-[HNO3] с максимумами (рис. 2, 3). Веро-
ции растворами 0.05 моль/л КМФО в дихлорэтане, содержа-
ятно, это связано с неполным замещением анионов
щем
0.1 моль/л Et3BnNTf2N
(1), Bu4NTf2N
(2), Oct3Me·
NO– в экстрагируемых комплексах РЗЭ(III) и U(VI)
NTf2N (3), и раствором 0.05 моль/л КМФО в дихлорэтане без
на гидрофобные ионы Tf2N-, т.е. участием ионов
добавок (4).
в образовании экстрагируемых комплексов в
NO–
таких системах. Снижение DEu и DU с ростом
[HNO3] связано со снижением концентрации сво-
бодного экстрагента в органической фазе вследст-
вие соэкстракции HNO3 [26] и HTf2N [18]. Положе-
ние максимумов на кривых зависимостей D-
[HNO3] в системе с Bu4NTf2N смещается в область
меньшей кислотности по сравнению с системой с
Oct3MeNTf2N (рис. 2, 3). Это связано с тем, что
концентрация ионов Tf2N- в водной фазе системы с
Bu4NTf2N выше, чем в системе с Oct3MeNTf2N, т.е.
-
соэкстракция HTf2N оказывает более заметное
влияние на экстракцию ионов металлов в присутст-
Рис. 3. Зависимость коэффициентов распределения U(VI) от
вии Bu4NTf2N.
концентрации HNO3 в равновесной водной фазе при экстрак-
Известно, что экстракция ионов металлов ней-
ции растворами 0.005 моль/л КМФО в дихлорэтане, содержа-
щем 0.1 моль/л Et3BnNTf2N (1), Bu4NTf2N (2), Oct3MeNTf2N
тральными экстрагентами в присутствии ИЖ со-
(3), и раствором 0.005 моль/л КМФО в дихлорэтане без доба-
провождается заметным переходом ионов ИЖ в
вок (4).
водную фазу [27]. Коэффициенты распределения
иона Tf2N- между растворами 0.1 моль/л ИЖ в ди-
ности экстракции ионов металлов растворами ней-
хлорэтане и раствором 3 моль/л HNO3 возрастают
тральных донорно-активных экстрагентов в ИЖ на
в ряду Et4NTf2N
(1.6)
< Et3BnNTf2N
(9.5)
<
основе катионов 1-алкил-3-метилимидазолия при
Bu4NTf2N (89) < Oct3MeNTf2N (>200) по мере уве-
увеличении длины алкильной цепочки в катионе
личения гидрофобности катионной части этих ИЖ.
ИЖ [24].
Следует отметить, что хотя в системе с
При экстракции из раствора 3 моль/л HNO3 ве-
Oct3MeNTf2N увеличение эффективности экстрак-
личины S увеличиваются в ряду РЗЭ(III) от La(III)
ции РЗЭ(III), U(VI) и Th(IV) раствором КМФО из
до Lu(III) (рис. 1) по мере уменьшения ионных ра-
азотнокислых растворов наблюдается в меньшей
диусов ионов Ln3+ и увеличения их энергии гидра-
степени, чем в системах с менее гидрофобными
тации [25]. По-видимому, замещение в экстраги-
Et4NTf2N и Et3BnNTf2N, а также bmimTf2N [16, 17],
руемом комплексе анионов NO– на более гидро-
использование Oct3MeNTf2N позволяет существен-
фобные Tf2N- оказывает большее влияние на экс-
но снизить потери этой ИЖ в процессе экстракции.
тракцию более гидратированных ионов РЗЭ(III).
Кроме того, снижение коэффициентов распределе-
Это приводит к снижению фактора разделения
ния ионов металлов с уменьшением [HNO3] (рис. 2,
La/Lu (βLa/Lu = DLa/DLu) от 14.8 при экстракции рас-
3) позволяет значительно упростить процесс их
твором КМФО до 3.6 при экстракции этим экстра-
реэкстракции. После экстракции РЗЭ(III) из рас-
гентом в присутствии Oct3MeNTf2N в органиче-
твора
3 моль/л HNO3 растворами
0.05 моль/л
ской фазе (рис. 1).
КМФО и 0.1 моль/л Oct3MeNTf2N или Et3BnNTf2N
492
А. Н. Туранов и др.
Коэффициенты распределения Eu(III), U(VI) и Th(IV)
при их экстракции из раствора 3 моль/л HNO3 раствора-
ми КМФО в дихлорэтане без добавок (D0) и в дихлорэ-
тане, содержащем 0.1 моль/л Oct3MeNTf2N (D)
Ион
[КМФО], моль/л
lgD0
lgD
S
Th(IV)
0.005
2.43
2.62
1.55
U(VI)
0.005
0.83
1.30
2.95
Eu(III)
0.05
-0.02
1.47
30.9
в дихлорэтане была проведена реэкстракция
РЗЭ(III) водой. В системе с Oct3MeNTf2N степень
реэкстракции РЗЭ(III) превышает 90%, тогда как в
системе с Et3BnNTf2N РЗЭ(III) практически не пе-
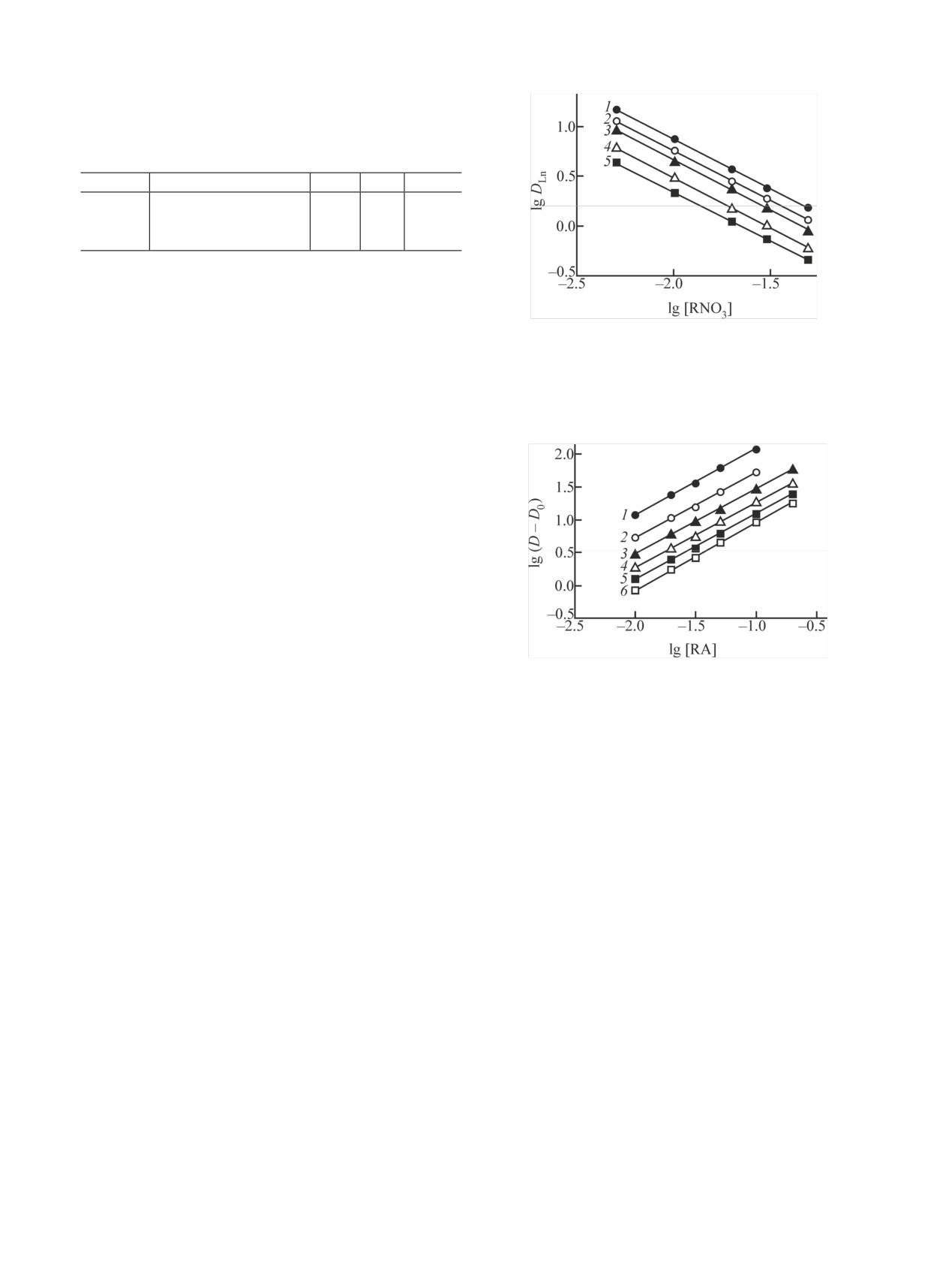
Рис. 4. Зависимость коэффициентов распределения Pr (1),
реходят в водную фазу. Поэтому в дальнейшем
Eu (2), Tb (3), Ho (4) и Tm (5) от концентрации Oct3MeNNO3 в
рассмотрены равновесия при межфазном распреде-
дихлорэтане, содержащем 0.05 моль/л КМФО и 0.1 моль/л
лении РЗЭ(III), U(VI) и Th(IV) между растворами
Oct3MeNTf2N, при экстракции из растворов 3 моль/л HNO3.
HNO3 и органической фазой, содержащей КМФО и
Oct3MeNTf2N.
Из таблицы видно, что при экстракции Eu(III)
величина синергетического эффекта значительно
выше, чем при экстракции U(VI) и Th(IV).
Синергетическая экстракция РЗЭ(III), U(VI) и
Th(IV) из азотнокислых растворов растворами
КМФО (L) в присутствии гидрофобной ИЖ Oct3Me·
NTf2N (RA) может быть описан уравнением
Mn(в) + nNO–(в) + sL(о) + pRA(о) ⇄ MLs(NO3)(n-p)Ap(о) +
+ pRNO3(о),
(1)
где символы (в) и (о) относятся к компонентам
Рис. 5. Зависимость коэффициентов распределения Th (1),
водной и органической фаз, соответственно, с кон-
U (2), Eu (3), Dy (4), Er (5) и Yb (6) от концентрации Oct3Me·
стантой экстракции K. Как следует из этого уравне-
NTf2N в дихлорэтане, содержащем 0.05 (3-6), 0.01 (2) или
0.005 (1) моль/л КМФО, при экстракции из растворов 3 моль/л
ния, экстракция ионов металлов смесью КМФО и
HNO3.
Oct3MeNTf2N из азотнокислых растворов сопрово-
ждается образованием нитрата триоктилметилам-
Выражение (2) в логарифмической форме было
мония (RNO3) в органической фазе. Добавка RNO3
использовано для определения стехиометрических
в органическую фазу, содержащую смесь КМФО и
коэффициентов s и p при экстракции РЗЭ(III), U(VI)
Oct3MeNTf2N, приводит к сдвигу равновесия (1)
и Th(IV) из азотнокислых растворов. При постоян-
влево, т.е. к уменьшению экстракции ионов метал-
ной концентрации КМФО в органической фазе тан-
лов. При постоянных концентрациях КМФО и
генс угла наклона зависимости lg(D - D0)-lg[RA]
Oct3MeNTf2N в органической фазе тангенс угла
близок к 1 (рис. 5), что соответствует переходу
наклона зависимости lgDLn-lg[RNO3] близок к -1
РЗЭ(III), U(VI) и Th(IV) в органическую фазу в виде
(рис. 4).
комплексов с соотношением Mn+ : Tf2N- = 1 : 1.
Поскольку экстракция ионов металлов смесью
Стехиометрическое соотношение РЗЭ(III) : L в
КМФО и Oct3MeNTf2N из азотнокислых растворов
комплексах, экстрагируемых в присутствии ИЖ,
в виде комплексов MLs(NO3)(n-p)Ap сопровождается
близко к 1 : 3 (рис. 6), тогда как в отсутствие ИЖ
экстракцией координационно-сольватированных
КМФО извлекает РЗЭ(III) из азотнокислых раство-
, коэффициент распределения
нитратов MLq(NO3)n
ров в виде комплексов с соотношением РЗЭ(III) : L =
оп-
иона металла в виде комплекса MLs(NO3)(n-p)Ap
1 : 2 и 1 : 3 [29]. Повышение сольватного числа в
от
ределяется как D - D0 [28]. Зависимость D - D0
системе с ИЖ связано со слабой координирующей
концентраций компонентов органической и водной
способностью ионов Tf2N- [29], которые находятся,
фаз может быть выражена как
по-видимому, во внешней координационной сфере
экстрагируемого комплекса LnL3(NO3)2(Tf2N). В от-
D - D0 = K[L](о)[NO–](в)[RA](о)[RNO3]-
(о).
(2)
сутствие ИЖ ионы РЗЭ(III) экстрагируются раство-
Экстракция РЗЭ(III), U(VI) и Th(IV) из азотнокислых растворов
493
полярности органического разбавителя и его сольва-
тирующей способности. Однако в системе с
Oct3MeNTf2N увеличение DLn в этом ряду менее вы-
ражено, чем при экстракции растворами КМФО в
отсутствии ИЖ (рис. 7). Это может быть связано с
более высокой гидрофобностью комплексов LnL3·
(NO3)2(Tf2N) по сравнению c таковой координацион-
но-сольватированных нитратов LnLq(NO3)3 (q = 2, 3).
Величина синергетического эффекта увеличива-
ется по мере снижения полярности органического
растворителя. Так, при экстракции Eu(III) смесями
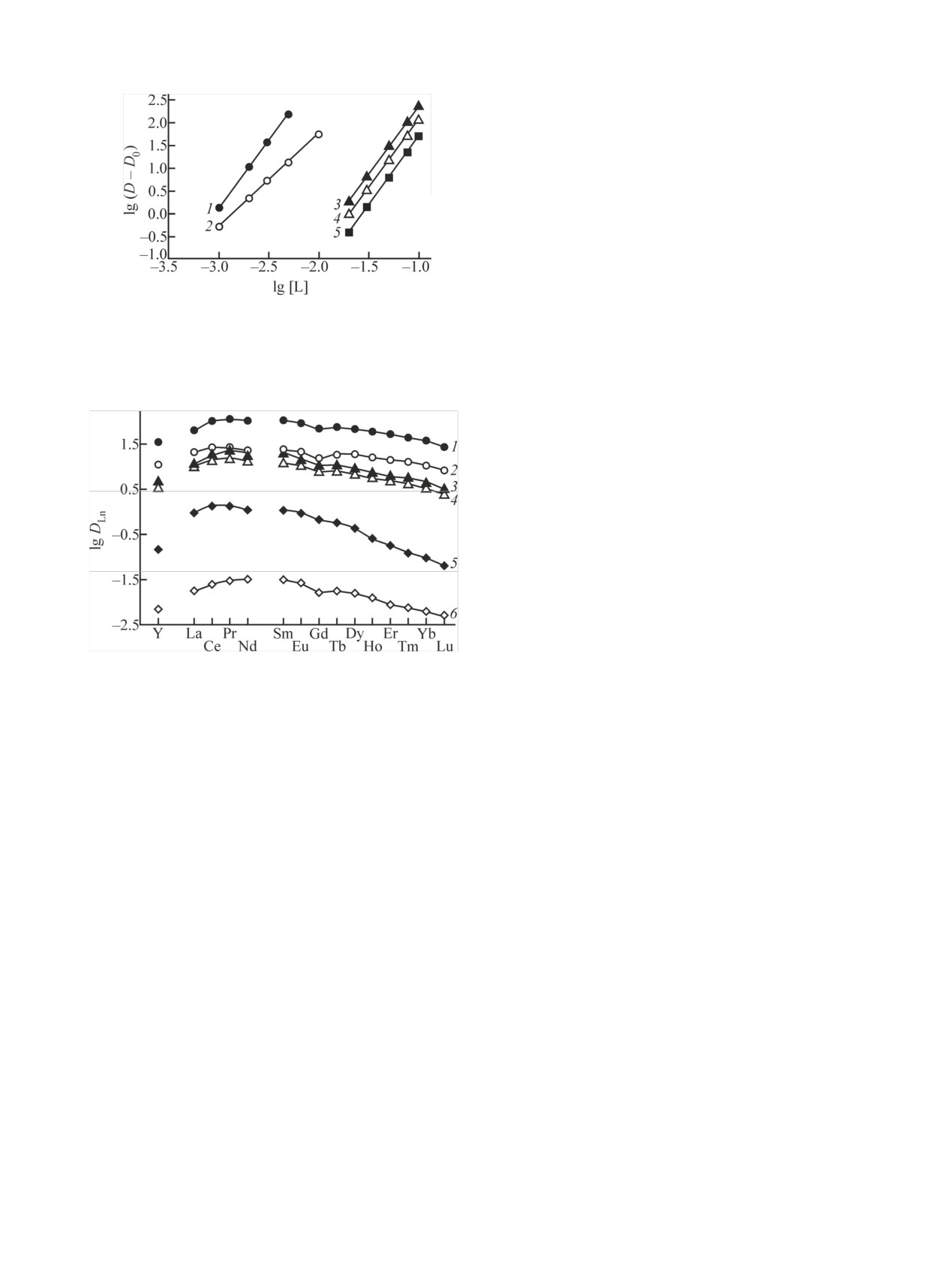
Рис.
6. Зависимость коэффициентов распределения U (1),
КМФО и Oct3MeNTf2N величина S возрастает в ряду
Th (2), Eu (3), Ho (4) и Lu (5) от концентрации КМФО в дихло-
нитробензол (4.5) < дихлорэтан (15.5) < о-ксилол
рэтане, содержащем 0.1 моль/л Oct3MeNTf2N, при экстракции
(407). Подобная тенденция наблюдалась также при
из растворов 3 моль/л HNO3.
экстракции РЗЭ(III) смесями хелатообразующих
экстрагентов и нейтральных фосфорорганических
соединений [35-37].
Представленные данные показали, что эффектив-
ность экстракции РЗЭ(III), U(VI) и Th(IV) из азотно-
кислых растворов растворами КМФО значительно
возрастает в присутствии бис[(трифторметил)
сульфонил]имидов ЧАО. Величина синергетическо-
го эффекта уменьшается с ростом гидрофобности
катиона ИЖ. Однако использование гидрофобной
ИЖ Oct3MeNTf2N позволяет существенно снизить
потери ИЖ в процессе экстракции и значительно
упростить процесс реэкстракции экстрагированных
ионов металлов.
Работа выполнена в рамках Государственного
Рис. 7. Экстракция РЗЭ(III) и Y(III) из растворов 3 моль/л
задания ИФТТ РАН, ИПТМ РАН и ИФАВ РАН.
HNO3 растворами 0.05 моль/л КМФО в нитробензоле (1), ди-
хлорэтане (3) и о-ксилоле (4), содержащими 0.05 моль/л
Oct3MeNTf2N, и растворами КМФО в нитробензоле (2), дихло-
Список литературы
рэтане (5) и о-ксилоле (6) без добавок.
[1] Розен А. М., Крупнов Б. В. // Успехи химии. 1996. Т. 65,
N 11. С. 1052-1079.
рами КМФО в виде координационно-сольватиро-
[2] Чмутова М. К., Литвина М. Н., Прибылова Г. А. и др. //
ванных нитратов LnLq(NO3)3 (q = 2, 3) [30], в кото-
Радиохимия. 1999. Т. 41, N 4. С. 331-335.
рых ионы NO– участвуют в координации ионов Ln3+
[3] Мясоедова Г. В. // Рос. хим. журн. 2005. Т. 49, N 2. С. 72-
75.
[31]. U(VI) и Th(IV) экстрагируются из азотнокис-
[4] Romanovskiy V. N., Smirnov I. V., Babain V. A. et al. // Sol-
лых растворов растворами КМФО в присутствии
vent Extr. Ion Exch. 2001. Vol. 19, N 1. P. 1-21.
Oct3MeNTf2N в виде комплексов с соотношением
[5] Chmutova M. K., Litvina M. N., Nesterova N. P. et al. //
Mn+ : L = 1 : 2 и 1 : 3 соответственно (рис. 6). При
Solvent Extr. Ion Exch. 1992. Vol. 10. P. 439-458.
этом также наблюдается повышение сольватных
[6] Смирнов И. В. // Радиохимия. 2007. Т. 49, N 1. С. 40-49.
[7] Visser A. E., Swatloski R. P., Reichert W. M. et al. // Ind. Eng.
чисел: из азотнокислых растворов U(VI) экстрагиру-
Chem. Res. 2000. Vol. 39. P. 3596-3604.
ется растворами КМФО в виде комплексов с соотно-
[8] Koel M. // Crit. Rev. Anal. Chem. 2005. Vol. 35. P. 177-192.
шением U(VI) : L = 1 : 1 и 1 : 2 [2], а Th(IV) - с соот-
[9] Zhao H., Xia S., Ma P. // J. Chem. Technol. Biotechnol. 2005.
ношением Th(IV) : L = 1 : 2 [32].
Vol. 80. P. 1089-1096.
[10] Dietz M. L. // Sep. Sci. Technol. 2006. Vol. 41. P. 2047-2063.
Природа органического растворителя существен-
[11] Nakashima K., Kubota F., Maruyama T., Goto M. // Anal. Sci.
но влияет на экстракцию РЗЭ(III) растворами
2003. Vol. 19. P. 1097-1098.
КМФО. Увеличение полярности органического раз-
[12] Visser A. E., Rogers R. D. // J. Solid State Chem. 2003.
бавителя и его сольватирующей способности спо-
Vol. 171. P. 109-113.
[13] Kolarik Z. // Solvent Extr. Ion Exch. 2013. Vol. 31. P. 24-60.
собствует увеличению DLn [33, 34]. При экстракции
[14] Kubota F., Baba Y., Goto M. // Solvent Extr. Res. Dev. Jpn.
РЗЭ(III) смесями КМФО и Oct3MeNTf2N также на-
2012. Vol. 19. P. 17-28.
блюдается увеличение DLn в ряду о-ксилол < дихло-
[15] Billard I. // Handbook on the Physics and Chemistry of Rare
рэтан < нитробензол (рис. 7) по мере увеличения
Earths. 2013. Vol. 43, Ch. 256. P. 213-273.
494
А. Н. Туранов и др.
[16] Туранов А. Н., Карандашев В. К., Баулин В. Е. // Радиохи-
Радиохимия. 1995. Т. 37, N 5. С. 422-426.
мия. 2008. Т. 50, N 3. С. 229-235.
[27] Mazan V., Billard I., Papaiconomou N. // RSC Adv. 2014.
[17] Туранов А. Н., Карандашев В. К., Яркевич А. Н. // Радио-
Vol. 4. P. 13371-13384.
химия. 2013. Т. 55, N 4. С. 314-318.
[28] Atanassova M., Kurteva V. // RSC Adv. 2016. Vol.
6.
[18] Туранов А. Н., Карандашев В. К., Баулин В. Е., Носен-
P. 11303-11324.
ко С. В. // Радиохимия. 2010. Т. 52, N 5. С. 415-419.
[29] Литвина М. Н., Чмутова М. К., Мясоедов Б. Ф., Кабач-
[19] Bell T. J., Ikeda Y. // Dalton Trans. 2011. Vol. 40. P. 10125-
ник М. И. // Радиохимия. 1996. Т. 38, N 6. С. 525-530.
10130.
[30] Binnemans K. // Chem. Rev. 2007. Vol. 107. P. 2593-2614.
[20] Туранов А. Н., Карандашев В. К., Харитонов А. В. и др. //
[31] Шарова Е. В., Артюшин О. И., Нелюбина Ю. В. и др. //
ЖОХ. 1999. Т. 69, N 7. С. 1109-1115.
Изв. АН. Сер. хим. 2008. N 9. С. 1856-1862.
[21] Туранов А. Н., Карандашев В. К., Баулин В. Е., Цвет-
[32] Туранов А. Н., Карандашев В. К., Яркевич А. Н. // Радио-
ков Е. Н. // ЖНХ. 1995. Т. 40, N 11. С. 1926-1930.
химия. 2018. Т. 60, N 2. С. 153-158.
[22] Naganawa H., Suzuki H., Tachimori S. et al. // Phys. Chem.
[33] Розен А. М., Никифоров А. С., Николотова З. И., Карта-
Chem. Phys. 2001. Vol. 3. P. 2509-2517.
шева Н. А. // ДАН СССР. 1986. Т. 286, N 3. С. 667-670.
[23] Rais J., Tachimori S. // J. Radioanal. Nucl. Chem. Lett. 1994.
[34] Шадрин А. Ю., Бабаин В. А., Киселева Р. Н. // Радиохи-
Vol. 188, N 2. P. 157-162.
мия. 1993. Т. 35, N 1. С. 45-50.
[24] Dai S., Ju Y. H., Barnes C. E. // J. Chem. Soc., Dalton Trans.
[35] Akiba K., Wada M., Kanno T. // J. Inorg. Nucl. Chem. 1981.
1999. P. 1201-1202.
Vol. 43. P. 1031-1034.
[25] Яцимирский К. Б., Костромина Н. А., Шека З. А. и др.
[36] Bond A. H., Dietz M. L., Chiarizia R. // Ind. Eng. Chem. Res.
Химия комплексных соединений редкоземельных элемен-
2000. Vol. 39. P. 3442-3464.
тов. Киев: Наук. думка, 1966. 494 с.
[37] Petrova M. A., Lachkova V. I., Vassilev N. G., Varba-
[26] Чмутова М. К., Иванова Л. А., Кочеткова Н. Е. и др. //
nov S. G. // Ind. Eng. Chem. Res. 2010. Vol. 49. P. 6189-6195.