420
Радиохимия, 2019, т. 61, N 5, c. 420-422
Определение Th(IV) в природных водах после концентрирования
хелатообразующим сорбентом
© Ф. Н. Бахманова*a, С. Р. Гаджиеваa, Ф. М. Чыраговa
a Бакинский государственный университет, AZ1148, Баку, ул. Акад. З. Халилова, д. 23;
*e-mail: fidan_chem@rambler.ru
Получена 17.10.2018, после доработки 19.11.2018, принята к публикации 20.11.2018
УДК 543.42:546.791
Модификацией сополимера малеинового ангидрида со стиролом аминами были синтезированы
хелатообразующие сорбенты, содержащий фрагмент норсульфазола и сульфадимезина. Были исследо-
ваны условия сорбции Th(IV) с этими сорбентами. Максимальная сорбция наблюдается при pH 5. Так-
же было исследовано влияние различных кислот на десорбцию Th(IV) из сорбентов. Разработанная ме-
тодика была применена для определения Th(IV) в воде путем концентрирования.
Ключевые слова: сорбент, концентрирование, торий(IV), вода.
DOI: 10.1134/S0033831119050101
Для определения Th(IV) чаще всего используют
2,2',3,4-Тетрагидрокси-3'-сульфо-5'-хлоразобен-
флотационно-фотометрический [1, 2] и электрохими-
зол получали азосочетанием диазотированного ами-
ческие методы [3]. Однако в первом из них требуют-
на с пирогаллолом в слабокислой среде по методике
ся большие объемы органических экстрагентов, а во
[12].
втором, как правило, открытой ртути, что не удовле-
В качестве твердой фазы использовали сорбенты,
творяет возросшим требованиям к экологической
содержащие фрагменты норсульфазола (С1) и суль-
безопасности анализа. Другие методы определения
фадимезина (С2). Сорбенты синтезировали по мето-
Th(IV) - нейтронно-активационный и масс-спектро-
дике [13]. Для применения в анализе гранулы сор-
метрия с индуктивно связанной плазмой - использу-
бента растирали в агатовой ступке и просеивали че-
ют редко из-за высокой стоимости анализа [4-6].
рез сито (0.14 мм).
В последние времена представляют большой ин-
Аппаратура. Кислотность раствора контролиро-
терес комбинированные методы, сочетающие в од-
вали стеклянным электродом на рН-метре PHS-25.
ном приеме тестирование на присутствие Th(IV) по
Оптическую плотность измеряли на фотоколоримет-
образованию окрашенных соединений и их концен-
ре КФК 2 (l = 1 cм).
трирование на различных сорбентах. С этой целью
широко применяют сорбционно-фотометрические
Методика эксперимента. Сорбцию изучали в
статических условиях. В градуированную пробирку
методы, особенно с использованием полимерных
хелатных сорбентов (ПХС) [7-10].
с притертой пробкой вводили раствор Th, добавляли
аммиачно-ацетатный буферный раствор для созда-
В развитие этих работ предложена новая избира-
ния необходимой кислотности до объема 20 мл. Вно-
тельная, экспрессная и простая методика сорбцион-
сили 0.05 г сорбента, пробирку закрывали пробкой и
но-спектрофотометрического определения микроко-
оставляли на 3.0 ч, затем раствор декантировали.
личеств Th(IV) в воде. Методика основана на пред-
Разработанная схема предусматривает использо-
варительном концентрировании Th(IV) из объекта с
применением полимерных хелатных сорбентов, со-
вание различных методов конечного определения
держащих фрагменты норсульфазола (С1) и сульфа-
Th(IV). Авторы применили спектрофотометриче-
ский метод. Концентрацию Th(IV) рассчитывали с
димезина (С2).
использованием градуировочного графика, получен-
Экспериментальная часть
ные результаты обрабатывали статистически [14].
Растворы и реагенты. Использованы реактивы
Результаты и обсуждение
квалификации х.ч. Раствор Th(IV) (10-2 моль/л) гото-
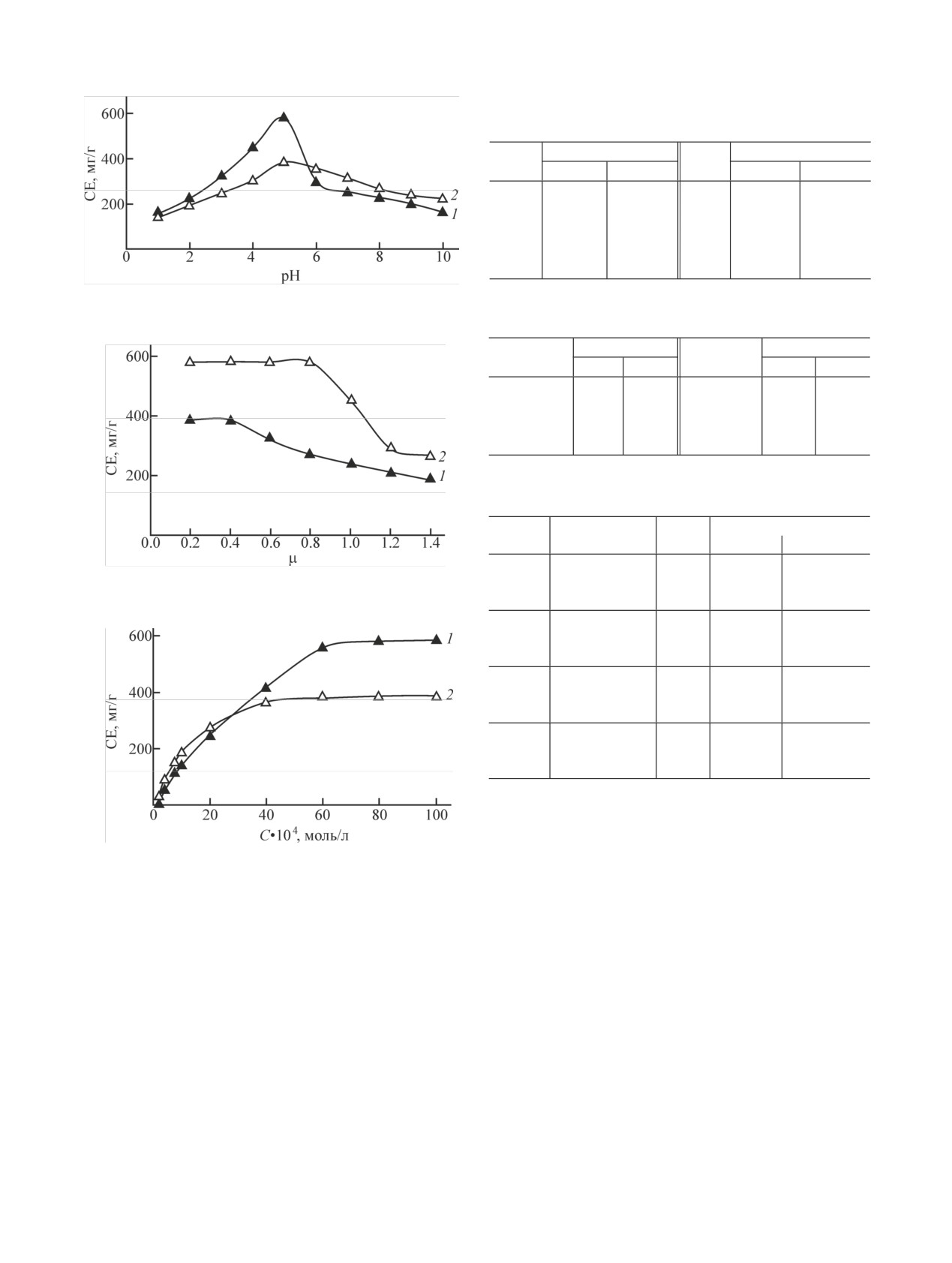
Влияние рН на сорбцию. Влияние pH на кон-
вили растворением в дистиллированной воде точной
центрирование Th(IV) с хелатообразующим сорбен-
навески Th(NO3)4·4H2O (х.ч.) [11]. Рабочие растворы
том изучено в диапазоне pH 1-10. Количественное
получали разбавлением исходного. Необходимые
извлечение достигается при рН 5. В водной среде
значения рН поддерживали растворами НСl, NaOH
гидролиз ионов Th уменьшается при увеличении
и аммиачно-ацетатными буферными растворами.
ионной силы раствора (≥0.05) [14].
Для поддержания постоянной ионной силы исполь-
зовали раствор KCl.
Сорбционную способность сорбента исследовали
Определение Th(IV) в природных водах после концентрирования хелатообразующим сорбентом
421
Таблица 1. Влияние рН водной среды на сорбцию
Th(IV)
CE, мг/г
CE, мг/г
pH
pH
С1
С2
С1
С2
1
160
141
6
300
354
2
226
196
7
255
315
3
325
250
8
231
267
4
449
306
9
201
238
5
580
387
10
166
222
Рис. 1. Влияние кислотности среды на сорбцию Th(IV). 1 - С1,
Таблица 2. Влияние ионной силы раствора на сорбцию
2 - С2; mсорб = 50 мг, Vр-ра = 20 мл; то же на рис. 2, 3.
Th(IV) (mсорб = 30 мг, Vр-ра = 20 мл, pH 5)
CE, мг/г
CE, мг/г
μ, моль/л
μ, моль/л
С1
С2
С1
С2
0.2
580
387
1.0
451
240
0.4
580
386
1.2
290
210
0.6
580
319
1.4
267
184
0.8
580
270
Таблица 3. Влияние концентрации кислот на десорбцию
Th(IV) (mсорб = 50 мг, Vр-ра = 60 мл, время контакта 3 ч)
Концентрация,
Объем,
Степень десорбции, %
Кислота
моль/л
мл
С1
С2
0.5
10
85
84
Рис. 2. Влияние ионной силы раствора на сорбцию Th(IV)
HCl
1.5
10
89
90
(pH 5).
2.0
5
94
95
0.5
10
82
80
HClО4
1.0
10
87
90
2.0
5
91
90
0.5
10
76
79
HNО3
1.0
10
81
83
2.0
5
87
88
0.5
10
81
80
H2SО4
1.5
10
85
86
2.0
5
90
89
растворов, содержащих 0.1-1.4 моль/л KCl. Полу-
ченные данные представлены на рис. 2 и в табл. 2.
Видно значительное уменьшение сорбции металла
Рис.
3. Изотерма сорбции Th(IV) полученным сорбентом
из растворов KCl с концентрацией более 1.0 (с С1) и
(pH 5).
0.6 моль/л (с С2).
Влияние концентрации Th(IV). С увеличением
в статических условиях. К 50 мг сорбента прибавля-
концентрации Th(IV) в растворе увеличивается его
ли 2 мл раствора 10-2 моль/л Th(NO3)4 и оставляли в
сорбция и при концентрации 6·10-3 моль/л становит-
буферной среде при pH 1-8. Смесь отфильтровыва-
ся максимальной (pH 5, СT4+ = 8·10-3 моль/л, Vр-ра =
ли и измеряли оптическую плотность при λ =
20 мл, mсорб = 0.05 г, статическая емкость 580 мг/г
490 нм. Количество оставшегося металла в растворе
для С1 и 387 мг/г для С2) (рис. 3).
находили на основе кривой зависимости оптической
Исследована возможность и определены усло-
плотности от концентрации и рассчитывали количе-
вия десорбции Th(IV) разными минеральными ки-
ство сорбированных ионов Th(IV). Полученные ре-
слотами (HClО4, H2SО4, HNО3, HCl) после концен-
зультаты при различных значениях рН приведены на
трирования на предлагаемом сорбенте (табл. 3). Из
рис. 1 и в табл. 1. Все дальнейшие исследования
табл. 3 видно, что Th(IV) количественно десорби-
проводили при pH 5.
руется 2 моль/л HCl. При контакте сорбента с рас-
Влияние ионной силы раствора изучено фото-
творами сильных кислот химического разрушения
метрическим методом. Торий(IV) сорбировали из
не происходит. Возможно многократное использо-
422
Ф. Н. Бахманова и др.
вание регенерированного сорбента для концентри-
джанской Республики (грант N EIF-KETPL-2-2015-1
рования.
(25)-56/19/4).
После определения оптимальных условий кон-
Список литературы
центрирования разработанный метод успешно
применен для определения микроколичеств Th(IV)
[1] Khan M. H., Muhammad H., Bukhari S. M. H., Akbar A. //
в воде, изъятой из скважины Балаханынского неф-
J. Radioanal. Nucl. Chem. 2014. Vol. 301, N 3. P. 703-709.
[2] Shiri S., Delpisheh A., Haeri A. et al. // Anal. Chem. Insights.
тегазодобывающего департамента (Азербайджан) с
2011. Vol. 6. P. 1-6.
предварительным концентрированием. 30 мл от-
[3] Tzortzis M., Tsertos H. // J. Environ. Radioact. 2004. Vol. 77,
фильтрованной анализируемой пробы доводили до
N 3. P. 325-338.
нужного значения pH добавлением HNO3 и оставля-
[4] Deb S. B., Saxena M. K., Nagar B. K., Ramakumar K. L. // At.
ли на 3 часа в круглодонной колбе со 100 мг сорбен-
Spectrosc. 2008, Vol. 29, N 2. P. 39-44.
[5] Hou X., Roos P. // Anal. Chim. Acta. 2008. Vol. 608. P. 105-
та. Сорбированные ионы металлов элюировали 5 мл
139.
2 моль/л HCl. Концентрацию Th(IV) в элюате опре-
[6] Ticianelli R. B., Figueiredo A. M. G., Zahn G. S. et al. // 2011
деляли фотометрическим методом. Расчет проводи-
Int. Nuclear Atlantic Conf. INAC 2011. Belo Horizonte (MG,
ли в предположении 100%-ного извлечения Th(IV).
Brazil), Oct. 24-28, 2011.
[7] Магеррамов А. М., Гаджиева С. Р., Бахманова Ф. Н. и
Получены следующие результаты (λ = 490 нм, l =
др. // ЖАХ. 2011. Т. 66, N 5. C. 480-483.
1 см, p = 0.95, n = 5). Определено предлагаемым ме-
[8] Басаргин Н. Н., Магеррамов А. М., Гаджиева С. Р. и др. //
тодом, ¯ ± tPs/n1/2, мг/л: 103.4 ± 0.6. Определено ме-
ЖАХ. 2013. Т. 68, N 2. C. 136-139.
тодом α-спектрометрии (Alpha Analyst, Canberra),
[9] Гаджиева С. Р., Бахманова Ф. Н., Алирзаева Э. Н. и др. //
мг/л: 103.8 ± 1.6.
Радиохимия. 2018. T. 60, N 2. C. 175-179.
[10] Магеррамов А. М., Алева Р. А., Алиева З. М. и др. // Завод.
Таким образом, нами продемонстрирована воз-
лаб. Диагностика матер. 2018. Т. 84, N 3. C. 21-24.
можность использования матрицы сополимера ма-
[11] Коростелев П. П. Приготовление растворов для химико-
аналитических работ. М.: Наука, 1964. 261 с.
леинового ангидрида со стиролом, модифицирован-
[12] Нагиев Х. Д. Закономерности образования и аналитиче-
ной норсульфазолом и сульфадимезином, для сорб-
ское применение разнолигандных комплексов азосоеди-
ционно-фотометрического определения Th(IV). Сор-
нений на основе пирогаллола и триарилметановых краси-
бент, примененный для определения микроколи-
телей: Дис
д.х.н. Баку, 2011. 429 с.
честв Th(IV), обладает более высокими сорбционны-
[13] Алиева Р. А., Чырагов Ф. М., Гамидов С. З. // Kim. Probl.
2006. N 4. C. 161-163.
ми свойствами по сравнению с известными в литера-
[14] Булатов М. И., Калинкин И. П. Практическое руководство
туре. Его можно повторно использовать после реге-
по фотометрическим и спектрофотометрическим методом
нерации.
анализа. Л.: Химия, 1972. 407 с.
[15] Назаренко В. А., Антонович В. П., Навская Е. М. Гидро-
Работа выполнена при финансовой поддержке
лиз ионов металлов в разбавленных растворах. М.: Атом-
Фонда развития науки при Президенте Азербай-
издат, 1979. 192 с.