368
Радиохимия, 2019, т. 61, N 5, c. 368-375
Состояние уранованадатов d-переходных элементов
в гетерогенных водно-солевых системах
© О. В. Нипрук*а, Н. Г. Чернорукова, К. А. Чаплиёваа, Г. Н. Чернорукова, Р. В. Абражеева
а Нижегородский государственный университет им. Н. И. Лобачевского,
603950, Нижний Новгород, пр. Гагарина, д. 23; *e-mail: nipruk@yandex.ru
Получена 17.10.2018, после доработки 10.01.2019, принята к печати 10.01.2019
УДК 546.791.6
Исследовано состояние уранованадатов состава АII(VUO6)2·nH2O (АII = Mn, Fe, Co, Ni, Cu, Zn, Cd) в
водных растворах в широком интервале кислотности среды. Установлены кислотно-основные интерва-
лы существования соединений в водных растворах, идентифицированы продукты конверсии, определе-
на растворимость АII(VUO6)2·nH2O. На основании полученных данных вычислены произведения рас-
творимости, функции Гиббса образования уранованадатов, рассчитаны кривые растворимости иссле-
дуемых соединений, построены диаграммы состояния U(VI) и V(V) в водных растворах и в равновес-
ных твердых фазах.
Ключевые слова: уранованадаты, d-переходные элементы, растворимость, диаграммы состояния,
конверсия.
DOI: 10.1134/S0033831119050022
Представленное сообщение является продолже-
Экспериментальная часть
нием публикаций, посвященных исследованию ми-
Синтез соединений АII(VUO6)2·nH2O. Уранова-
нералоподобных соединений урана с общей фор-
надаты d-переходных элементов состава AII(VUO6)2·
мулой Аk(UO2An)k·nH2O, где Аk - элементы в сте-
nH2O (АII = Mn, Fe, Co, Ni, Cu, Zn, Cd) синтезировали
пени окисления +1, +2, +3; An = VO3-, AsO43-, PO3-,
путем взаимодействия кристаллического пирована-
HSiO3-, HGeO3- [1-6]. Уранованадаты щелочных и
дата уранила (UO2)2V2O7 с водным раствором нитра-
щелочноземельных элементов Аk(VUO6)k·nH2O ши-
та соответствующего металла AII(NO3)2 (или хлори-
роко распространены в природе [7, 8]. В лаборатор-
да) в молярном соотношении 1 : 5 при рН ~3
ных условиях получены их синтетические аналоги,
функцию Аk в которых выполняют катионные фор-
(UO2)2V2O7(к) + AII(NO3)2 + (n + 1)H2O →
мы d-переходных элементов [9]. Все известные
→ AII(VUO6)2·nH2O(к) + 2HNO3.
(1)
уранованадаты имеют подобную слоистую струк-
Реакцию проводили кипячением полученного
туру, что и обусловливает аналогичные свойства
раствора с осадком в круглодонной колбе с обрат-
соединений рассматриваемого ряда. В состав ура-
ным холодильником в течение суток. Полученные
нованадатных слоев [VUO6]2n- входят пентагональ-
образцы твердой фазы промывали 1·10-3 моль/л
ные бипирамиды урана UO7 и квадратные пирами-
HNO3, дистиллированной водой и высушивали на
ды ванадия VO5. Отрицательно заряженные слои
воздухе. Методика получения (UO2)2V2O7 приведена
объединены в трехмерную кристаллическую ре-
в работе [11].
шетку посредством гидратированных ионов Аk+,
которые определяют компоновку слоев в структуре
Полноту протекания реакции (1) и образование
исследуемых соединений и влияют на их химиче-
соединений АII(VUO6)2·nH2O подтверждали рентге-
скую устойчивость.
нографически. Содержание Н2О в уранованадатах
Поскольку уранованадаты являются одной из
устанавливали весовым методом, прокаливая иссле-
основных форм практически значимых минераль-
дуемые образцы при температуре 600°С в течение
ных сырьевых форм урана и служат источником
2 ч. Элементный анализ полученных соединений
радиоактивного загрязнения окружающей среды,
проводили методом рентгенофлуоресцентной спек-
то их всестороннее исследование имеет не только
трометрии. Массовую долю U, V и d-переходного
важное научное, но и практическое значение [10].
элемента в твердых фазах определяли методом фун-
Любое направление использования этих соедине-
даментальных параметров с поправочными коэффи-
ний затрагивает вопросы их состояния в водных
циентами чувствительности. Величины последних
растворах. В этой связи в данном сообщении пред-
устанавливали предварительно с использованием
ставлены результаты исследования состояния ура-
образцов сравнения, приготовленных смешиванием
нованадатов с общей формулой АII(VUO6)2·nH2O
и растиранием UO3, V2O5, АIIO в молярном соотно-
(АII = Mn, Fe, Co, Ni, Cu, Zn, Cd) в водных раство-
шении 2 : 1 : 1. Определяемое содержание элементов
рах в широком интервале кислотности среды.
твердой фазы совпадало с теоретическими значения-
Состояние уранованадатов d-переходных элементов в гетерогенных водно-солевых системах
369
ми в пределах относительной погрешности 0.5%.
водных растворах существуют в виде различных ион-
но-молекулярных форм, представленных в табл. 1
Исследование состояния соединений АII(VUO6)2·
[15-19]. Коэффициенты активности ионов рассчиты-
nH2O в водных растворах. Для изучения химиче-
вали по уравнению Дебая-Хюкеля с учетом теории
ской устойчивости уранованадатов, навеску вещест-
специфического ионного взаимодействия [16]
ва массой 0.1-0.3 г заливали дистиллированной во-
дой или растворами HClO4/NaOH с концентрацией
lgγz± = -z2·0.5090I1/2/(1 + 1.5I1/2) + ∑ε(z±,m,I)Cm,
от 10-3 до 1 моль/л объемом 0.005-0.1 л. Экспери-
m
(4)
менты проводили в герметичных пластиковых емко-
стях с минимальным свободным объемом для ис-
где I - ионная сила раствора, ε(z±,m,I) - коэффициент
ключения контакта растворов с углекислым газом
ионного взаимодействия иона с зарядом z± с проти-
атмосферы. Содержимое емкостей периодически
воионами (общее число учтенных ионов m) [16], Сm -
перемешивали в течение нескольких месяцев и из-
молярная концентрация m-го противоиона в раство-
меряли pH для наблюдения за состоянием системы.
ре.
После достижения постоянного значения рН осадок
Коэффициенты активности молекулярных форм
отделяли от раствора центрифугированием. Твер-
принимали равными единице.
дую фазу промывали дистиллированной водой, вы-
сушивали при комнатной температуре и исследова-
Расчет кривых растворимости AII(VUO6)2·
ли методами рентгенофазового анализа и рентгеноф-
nH2O и диаграмм состояния U(VI), V(V) и А(II).
луоресцентной спектрометрии. Концентрацию U(VI)
Расчет кривых растворимости уранованадатов в вод-
и V(V) определяли с использованием фотометриче-
ных растворах и диаграмм состояния U(VI), V(V) и
ских методик, приведенных ниже. Отсутствие взве-
d-переходных элементов A(II) в гетерогенных водно-
шенных и коллоидных частиц контролировали мето-
солевых системах проводили с использованием по-
дами турбидиметрии и нефелометрии.
лученных значений KS. При вычислении учитывали,
что равновесные гетерогенные системы наряду с пер-
Фотометрические методики анализа раство-
вичными соединениями AII(VUO6)2·nH2O могут содер-
ров. Концентрацию U(VI) в анализируемых водных
жать соединения вторичного происхождения, такие
растворах определяли по поглощению его комплек-
как V2O5·H2O, AII(OH)2, Na2U2O7. Для расчетов была
са с арсеназо III (λмакс = 650 нм, рН 3) [12]. Анализ
составлена система уравнений, в которой можно выде-
водных растворов на содержание V(V) проводили по
лить три блока. Первый блок включает уравнения (5)-
реакции с ксиленоловым оранжевым при λмакс =
(8), которые представляют собой константы равнове-
580 нм, рН 4 [13]. Стандартный раствор U(VI) с кон-
сия гетерогенных реакций растворения соединений
центрацией 1·10-2 моль/л готовили растворением
первичного и вторичного происхождения
навески UO2(NO3)2·6Н2О в дистиллированной воде.
Для приготовления стандартного раствора V(V) та-
KS[AII(VUO6)2·nH2O] = a(A2+)a(UO2+)2a(VO3-)2 =
кой же концентрации NH4VO3 растворяли в 3 моль/л
= a(A2+)a(UO22+)2[KV104a(VO+)/a(H+)4]2,
(5)
Н2SО4. Растворы меньших концентраций, необходи-
KS(V2O5·H2O) = a(VO+)2a(H+)-2 =
мые для построения градуировочных графиков, го-
= [KV104a(VO+)/a(H+)4]2a(H+)-2,
(6)
товили из этих растворов путем последовательного
KS[AII(OH)2] = a(A2+)a(OH-)2,
(7)
разбавления.
KS(Na2U2O7) = a(Na+)2a(UO2+)2a(OH-)6.
(8)
Расчет произведений растворимости AII(VUO6)2·
nH2O. Произведения растворимости труднораство-
Уравнения второго блока (9)-(11) учитывают рав-
римых уранованадатов рассчитывали с использова-
новесия между различными ионно-молекуляр-ными
нием полученных данных о растворимости. Переход
формами U(VI), V(V) и A(II) в водных растворах
труднорастворимого соединения в раствор был
C
U = a(UO22+)/γ2 + ∑{KUija(UO2+)i/[a(H+)jγ(2i-j)±]},
представлен следующим уравнением реакции:
i
(9)
AII(VUO6)2·nH2O(к) ⇄ A2+ + 2UO2+ + 2VO3- + nH2O.
(2)
CV = a(VO+)/γ1 + ∑{KVjhla(VO+)j/[a(H+)2l-4j-hγ(h+5j-2l)±]},
j
(10)
Константа равновесия этой реакции с учетом
постоянства активности соединения в твердой фазе
CA = a(A2+)/γ2 + ∑{KA2ija(A2+)i/[a(H+)jγ(2i-j)±]}.
i
(11)
и молекул воды является произведением раствори-
мости KS [14]
Третий блок состоит из уравнений баланса (12)-
(14), которые учитывают распределение первоначаль-
KS[AII(VUO6)2·nH2O] = a(A2+)a(UO2+)2a(VO3-)2.
(3)
ного взятого количества U(VI), V(V) и А(II) между
При расчете активностей ионов, фигурирующих в
различными компонентами твердой фазы и раство-
этом уравнении, учитывали, что U(VI), V(V) и A(II) в
ром в равновесной гетерогенной системе
370
О. В. Нипрук и др.
Таблица 1. Константы равновесия реакций U(VI), V(V) и d-переходного элемента AII в водных растворах
Константа равновесия
Уравнение реакции
Ссылка
обозначение
значение
Гомогенные равновесия
Общее уравнение реакции iUO2+ + jH2O ⇄ (UO2)i(OH)j(2i-j) + jH+, константа равновесия KUij
UO2+ + H2O ⇄ UO2OH+ + Н+
KU11
5.62·10-6
UO2+ + 2H2O ⇄ UO2(OH)20 + 2Н+
KU12
7.08·10-13
UO2+ + 3H2O ⇄ UO2(OH)– + 3Н+
KU13
5.62·10-21
UO2+ + 4H2O ⇄ UO2(OH)42- + 4Н+
KU14
3.98·10-33
-3
2UO2+ + 2H2O ⇄ (UO2)2OH3+ +Н+
KU21
2.00·10
[15-17]
2UO2+ + 2H2O ⇄ (UO2)2(OH)2+ +2Н+
KU22
2.40·10-6
3UO2+ + 5H2O ⇄ (UO2)3(OH)+ + 5Н+
KU35
2.82·10-16
3UO22+ + 7H2O ⇄ (UO2)3(OH)7- + 7Н+
KU37
6.31·10-33
4UO22+ + 7H2O ⇄ (UO2)4(OH)+ + 7Н+
KU47
1.26·10-22
Общее уравнение реакции jVO+ + (l - 2j)H2O ⇄ HhVjOl(h + 5j - 2l) + (2l - 4j - h)H+, константа равновесия KVjhl
VO+ + 2H2O ⇄ H3VO40 + H+
KV134
2.04·10-3
VO+ + 2H2O ⇄ H2VO4- + 2H+
KV124
1.61·10-7
VO+ + 2H2O ⇄ HVO42- + 3H+
KV124
2.79·10-16
VO+ + 2H2O ⇄ VO43- + 4H+
KV104
1.54·10-30
2VO+ + 3H2O ⇄ H2V2O72- + 4H+
KV227
4.97·10-12
[15, 19]
2VO+ + 3H2O ⇄ HV2O73- + 5H+
KV217
1.24·10-21
2VO2+ + 3H2O ⇄ V2O74- + 6H+
KV207
6.48·10-33
4VO+ + 4H2O ⇄ V4O14- + 8H+
KV4012
2.85·10-20
10VO+ + 8H2O ⇄ H2V10O284- + 14H+
KV10228
1.47·10-10
10VO+ + 8H2O ⇄ HV10O285- + 15H+
KV10128
9.18·10-15
Общее уравнение реакции iA2+ + jH2O ⇄ Ai(OH)j(2i-j) + jH+, константа равновесия KA2ij
Mn2+ + H2O ⇄ MnOH+ + H+
KA211
1.80·10-11
Mn2+ + 2H2O ⇄ Mn(OH)0 + 2H+
KA212
1.07·10-28
Mn2+ + 3H2O ⇄ Mn(OH)– + 3H+
KA213
7.12·10-35
Mn2+ + 4H2O ⇄ Mn(OH)42- + 4H+
KA214
9.95·10-51
Fe2+ + H2O ⇄ FeOH+ + H+
KA211
1.90·10-7
Fe2+ + 2H2O ⇄ Fe(OH)20 + 2H+
KA212
1.07·10-28
Co2+ + H2O ⇄ CoOH+ + H+
KA211
6.54·10-12
Co2+ + 2H2O ⇄ Co(OH)20 + 2H+
KA212
1.07·10-28
[15-18]
Ni2+ + H2O ⇄ NiOH+ + H+
KA211
1.77·10-11
Ni2+ + 2H2O ⇄ Ni(OH)20 + 2H+
KA212
1.07·10-28
Cu2+ + H2O ⇄ CuOH+ + H+
KA211
4.77·10-8
Cu2+ + 2H2O ⇄ Cu(OH)20 + 2H+
KA212
1.07·10-28
Zn2+ + H2O ⇄ ZnOH+ + H+
KA211
1.14·10-9
Zn2+ + 2H2O ⇄ Zn(OH)20 + 2H+
KA212
1.07·10-28
Zn2+ + 3H2O ⇄ Zn(OH)3- + 3H+
KA213
4.38·10-29
Zn2+ + 4H2O ⇄ Zn(OH)2- + 4H+
KA214
6.98·10-42
Гетерогенные равновесия
Mn(OH)2(т) ⇄ Mn2+ + 2OH-
1.44·10-13
Fe(OH)2(т) ⇄ Fe2+ + 2OH-
7.33·10-16
Co(OH)2(т) ⇄ Co2+ + 2OH-
1.49·10-15
Ni(OH)2(т) ⇄ Ni2+ + 2OH-
5.86·10-18
[15-18]
Cu(OH)2(т) ⇄ Cu2+ + 2OH-
4.39·10-20
Zn(OH)2(т) ⇄ Zn2+ + 2OH-
2.67·10-16
V2O5·H2O(т)+ 2H+ ⇄ 2VO2+ + 2H2O
1.60·10-2
Na2U2O7(к) + 3H2O ⇄ 2UO22+ + 2Na+ + 6ОН-
3.98·10-57
2m0[AII(VUO6)2·nH2O]/M[AII(VUO6)2·nH2O] = CUV +
2m0[AII(VUO6)2·nH2O]/M[AII(VUO6)2·nH2O] = CVV +
+ ∑mLωU,L/M(U),
+ ∑mLωV,L/M(V),
L
(12)
L
(13)
Состояние уранованадатов d-переходных элементов в гетерогенных водно-солевых системах
371
Таблица 2. Кислотно-основные интервалы существова-
m0[AII(VUO6)2·nH2O]/M[AII(VUO6)2·nH2O] = CAV +
ния уранованадатов d-переходных элементов AII(VUO6)2·
+ ∑mLωA,L/M(A),
4H2O в насыщенных водных растворах
L
(14)
Интервал рН
где KUij, KVihl, KA2ij, KS - константы равновесия (табл. 1);
Соединение
граница
ширина
m0[AII(VUO6)2·nH2O] - начальная масса уранованадата;
Mn(VUO6)2·4H2O
1.6-11.6
10.0
V - объем раствора HClO4, H2O или NaOH; М - моле-
Co(VUO6)2·4H2O
1.8-11.2
9.4
кулярная масса; mL - масса вторичной донной фазы;
L = V2O5, AIIU2O7; ωU,L, ωV,L, ωA,L - массовые доли
Ni(VUO6)2·4H2O
2.0-11.0
9.0
U(VI), V(V) и элемента A(II) в L.
Cu(VUO6)2·4H2O
1.6-11.0
9.4
Zn(VUO6)2·4H2O
1.8-11.2
9.4
В целом предложенная нами система, состоящая
Cd(VUO6)2·4H2O
1.4-11.8
10.4
из трех блоков уравнений, позволяет производить
расчеты различных параметров равновесных гетеро-
Приборы и оборудование. Рентгенограммы ис-
генных водно-солевых систем соединений U(VI) в
следуемых соединений и равновесных донных фаз
широком интервале кислотности среды. Так, при
записывали на дифрактометре XRD-6000 (Shimadzu,
заданных значениях рН равновесного раствора, его
излучение CuKα). Элементный анализ твердых образ-
объема V и массы исходного соединения в донной
цов проводили с использованием рентгенофлуорес-
фазе m0[AII(VUO6)2·nH2O] были вычислены активно-
центного спектрометра с энергетической дисперсией
сти ионно-молекулярных форм a(UO2+), a(VO2+),
EDX-900 фирмы Shimadzu. Значения рН растворов
a(A2+) и аналитические концентрации U(VI), V(V) и
измеряли рН-метром рН 410 (Аквилон) со стеклян-
A(II) в растворе - CU, CV, CA, а также массы компо-
ным электродом ЭСК-10601/7. Все синтезированные
нентов твердой фазы первичного и вторичного про-
соединения и реактивы, используемые в данной рабо-
исхождения: m[AII(VUO6)2·nH2O], m(V2O5·H2O),
те, соответствовали квалификации х.ч. В эксперимен-
m[АII(OH)2], m(Na2U2O7). На базе вычисленных зна-
чений масс были построены диаграммы состояния
тах использовали дистиллированную воду и раство-
ры NaOH без примеси СО2 [19]. Для отделения твер-
соответствующих элементов в равновесной твердой
дой фазы от насыщенного раствора использовали
фазе и установлены кислотно-основные интервалы
существования ее отдельных компонентов. Расчет-
центрифугу ЦЛН-2. Центрифугирование проводили
ные величины концентраций использованы для по-
при скорости 9000 об/мин. Оптическую плотность
окрашенных растворов измеряли на спектрофотомет-
строения кривых растворимости. Активности ионов
в водных растворах использованы для расчета диа-
ре Shimadzu UV-1650. Интенсивность рассеянного
грамм состояния U(VI), V(V) и A(II) в насыщенных
излучения оценивали с помощью нефелометра НФМ
водных растворах.
(Россия). Статистическую обработку результатов и
математическое моделирование состояния гетероген-
Расчет стандартных функций Гиббса образо-
ных систем проводили с помощью программы Math-
вания. Полученные значения произведений раство-
cad 2000 Professional.
римости использовали для расчета стандартных
функций Гиббса образования уранованадатов d-пе-
реходных элементов. Вычисления проводили с ис-
Результаты и обсуждение
пользованием следующих уравнений:
Кислотно-основные интервалы существова-
ΔGr = -RTln KS,
(15)
ния и конверсия соединений АII(VUO6)2·nH2O
ΔG0[AII(VUO6)2·nH2O] = ΔG0(A2+) + 2ΔG0(UO22+) +
(AII = Mn, Fe, Co, Ni, Cu, Zn, Cd) в водных раство-
+ 2ΔG0(VO3-) + nΔG0[H2O(l)] - ΔGr0,
(16)
рах. Проведенные исследования гетерогенных сис-
тем АII(VUO6)2·nH2O(к)-водный раствор показали,
где ΔG0 - стандартная функция Гиббса образования
что наиболее существенное влияние на химическую
ионов или молекул [15-19], ΔGr0 - стандартная функ-
устойчивость уранованадатов d-переходных элемен-
ция Гиббса реакции (2).
тов оказывает кислотность водного раствора. В зави-
Полученные значения и известные стандартные
симости от pH изменяется состав и структура соеди-
функции Гиббса образования уранованадатов d-пе-
нений донной фазы, а также ионно-молекулярные
реходных элементов позволили провести термодина-
формы и концентрации U(VI), V(V) и d-переходных
мическую оценку процессов конверсии исследуемых
элементов в водном растворе. В целом уранованада-
соединений в различные вторичные донные фазы.
ты d-переходных элементов сохраняют состав и
строение при контакте с водными растворами в ши-
Расчеты проводили с помощью следующего урав-
роком интервале рН от 2 до 11. При этом устойчи-
нения:
вость АII(VUO6)2·nH2O несущественно зависит от
ΔG0 = ∑ΔG0(продукты реакции) - ∑ΔG0(исходные
природы межслоевого атома (табл. 2), что обуслов-
вещества).
(17)
лено подобием строения исследуемых соединений и
372
О. В. Нипрук и др.
Таблица 3. Константы равновесия и стандартные функ-
Ni(VUO6)2·4H2O
ции Гиббса реакции конверсии уранованадатов d-пе-
реходных элементов AII(VUO6)2·4H2O
Реакция (18)
Реакция (19)
Соединение
ΔrG0,
ΔrG0,
K
S
KS
кДж/моль
кДж/моль
Mn(VUO6)2·4H2O
5.3·102
-15.5
3.4·1010
-60.1
Fe(VUO6)2·4H2O
2.6·103
-19.5
3.3·1013
-77.1
Co(VUO6)2·4H2O
5.1·103
-21.2
3.2·1013
-77.1
Ni(VUO6)2·4H2O
5.2·104
-26.9
8.2·1016
-96.5
Cu(VUO6)2·4H2O
3.3·102
-14.4
7.0·1016
-96.2
Zn(VUO6)2·4H2O
1.0·104
-22.9
3.6·1014
-83.1
Cd(VUO6)2·4H2O
1.5·101
-6.7
6.9·109
-56.1
вание этой фазы методом рентгенофлуоресцентного
анализа показало отсутствие в ней значительных
количеств урана и элемента AII. Это дало основание
полагать, что в кислых средах уранованадаты разру-
шаются с образованием гидратированного оксида
V(V) по реакции
AII(VUO6)2·nH2O(к) + 6H+ ⇄ A2+ + 2UO2+ + V2O5·H2O(ам) +
+ (n + 2)H2O.
(18)
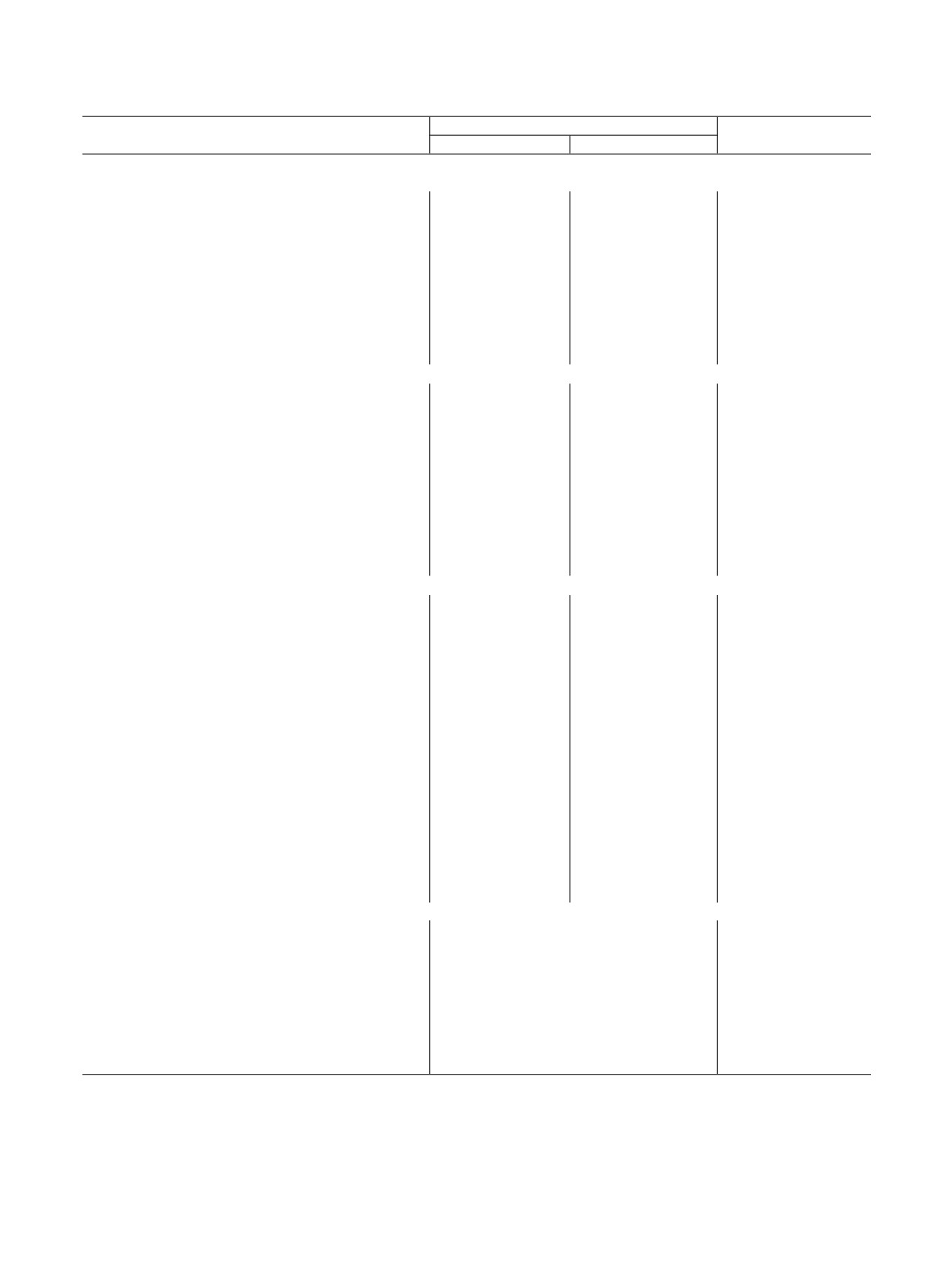
Рис. 1. Состояние равновесной гетерогенной системы Ni(VUO6)2·
4H2O(к)-водный раствор (сплошные линии - расчетные кривые,
В пользу этой реакции свидетельствуют и мно-
точки - экспериментальные значения). а - зависимость массо-
гочисленные литературные данные о низкой рас-
вой доли ω компонентов донной фазы от кислотности среды;
б
- зависимость концентраций U(VI) (квадрат), V(V)
творимости V2O5 в рассматриваемых условиях [13,
(треугольник) в растворе от кислотности среды.
20, 21]. В качестве иллюстрации на рис. 2 представ-
лены кривые растворимости Ni(VUO6)2·4H2O и
V2O5·H2O, которые вычислены из предположения
конгруэнтного растворения соединений и устойчи-
вости их структуры в широком интервале кислот-
ности. Из этого рисунка видно, что растворимость
V2O5·H2O
оксида V(V) в кислых средах ниже, чем прогнози-
руемая растворимость уранованадатов. Это и обу-
Ni(VUO6)2·4H2O
словливает протекание процесса конверсии иссле-
дуемых соединений по реакции (18).
Возможность образования оксида ванадия в кис-
лых средах в исследуемых гетерогенных системах
Рис. 2. Расчетные кривые растворимости Ni(VUO6)2·4H2O,
V2O5·H2O, Ni(OH)2, Na2U2O7 (расчет проведен без учета кон-
подтверждают и результаты термодинамических
версии).
расчетов. Значения констант равновесия и стан-
дартных функций Гиббса реакции (18), представ-
близостью кристаллохимических характеристик
ленные в табл. 3, согласуются с экспериментальны-
межслоевых атомов.
ми данными и интервалами существования урано-
В сильнокислых и сильнощелочных средах за
ванадатов в водных растворах (табл. 2, 4).
пределами интервала устойчивости уранованадатов
В щелочных средах исследуемые соединения
их структура разрушается и в донной фазе образу-
превращаются в смесь диураната натрия и трудно-
ются соединения вторичного происхождения. Диа-
растворимого гидроксида AII(OH)2 согласно сле-
граммы состояния твердой фазы гетерогенных вод-
но-солевых систем уранованадатов идентичны для
дующему уравнению реакции:
всех производных d-переходных элементов. На
АII(VUO6)2·nH2O(к) + 2Na+ + 8OH- ⇄ Na2U2O7(к) +
рис. 1 в качестве примера представлена зависимость
+ AII(OH)2 + 2VO3- + (n + 3)H2O.
(19)
массовой доли компонентов твердой фазы от рН
насыщенного раствора для соединения Ni.
Процесс конверсии начинается уже в слабощелоч-
В кислых средах при рН < 2 в равновесии с вод-
ных растворах, где растворимость соответствующих
ным раствором находится аморфная фаза. Исследо-
гидроксидов становится заметно ниже, чем исследуе-
Состояние уранованадатов d-переходных элементов в гетерогенных водно-солевых системах
373
Таблица 4. Концентрации U(VI), V(V) и А(II) в насыщенных водных растворах соединений АII(VUO6)2·nH2O (AII =
Mn, Co, Ni, Cu, Zn, Cd) (25°С)
Растворитель
Параметр
Mn
Co
Ni
Cu
Zn
Cd
рH
1.32
1.19
1.17
1.25
1.18
1.22
1·10-1 моль/л HClO4
CU·102
9.5 ± 0.3
1.98 ± 0.08
5.4 ± 0.3
4.20 ± 0.25
8.6 ± 0.3
1.01 ± 0.04
CV·102
0.72 ± 0.03
0.91 ± 0.04
0.81 ± 0.04
0.92 ± 0.05
1.15 ± 0.06
1.23 ± 0.05
рH
2.26
2.61
2.65
2.34
2.52
2.61
1·10-2 моль/л HClO4
CU·103
1.36 ± 0.07
0.76 ± 0.03
0.52 ± 0.03
0.25 ± 0.02
1.95 ± 0.10
0.20 ± 0.01
CV·103
0.76 ± 0.04
0.22 ± 0.01
0.30 ± 0.01
0.37 ± 0.04
0.17 ± 0.01
0.12 ± 0.01
рH
3.24
3.10
3.20
3.19
3.12
3.22
1·10-3 моль/л HClO4
CU·105
2.29 ± 0.12
5.84 ± 0.23
12.8 ± 0.6
9.3 ± 0.4
7.4 ± 0.4
1.32 ± 0.07
CV·105
2.51 ± 0.17
5.59 ± 0.22
5.00 ± 0.19
4.88 ± 0.24
5.2 ± 0.3
1.16 ± 0.07
рH
6.55
6.21
6.68
6.49
6.92
6.75
H2O
CU·107
1.66 ± 0.17
2.27 ± 0.23
4.7 ± 0.6
1.0 ± 0.3
4.0 ± 0.6
3.9 ± 0.5
рH
7.58
7.18
7.32
7.67
7.68
7.88
1·10-3 моль/л NaOH
CU·107
2.57 ± 0.20
0.68 ± 0.15
4.8 ± 0.5
3.3 ± 0.3
4.6 ± 0.4
4.7 ± 0.6
рH
9.23
9.42
9.58
9.33
9.74
9.67
1·10-2 моль/л NaOH
CU·107
7.7 ± 0.6
3.26 ± 0.16
25.1 ± 2.1
12.6 ± 0.6
21.5 ± 1.7
11.6 ± 0.6
CV·106
1.00 ± 0.12
1.55 ± 0.14
6.6 ± 0.8
4.47 ± 0.22
8.2 ± 0.4
3.75 ± 0.25
рH
13.00a
13.00a
13.00a
13.00a
13.00a
13.00a
1·10-1 моль/л NaOH
CU·104
1.12 ± 0.03
0.83 ± 0.03
0.92 ± 0.05
0.46 ± 0.03
1.12 ± 0.06
1.32 ± 0.06
CV·102
1.18 ± 0.06
0.96 ± 0.05
0.84 ± 0.04
1.47 ± 0.07
1.45 ± 0.05
1.79 ± 0.09
рH
14.00a
14.00a
14.00a
14.00a
14.00a
14.00a
1 моль/л NaOH
CU·104
2.16 ± 0.11
1.65 ± 0.08
2.91 ± 0.15
3.26 ± 0.16
4.58 ± 0.25
0.73 ± 0.04
CV·102
2.48 ± 0.10
2.15 ± 0.10
3.35 ± 0.17
4.73 ± 0.24
2.36 ± 0.12
2.09 ± 0.12
a Рассчитано по концентрации NaOH.
мых уранованадатов (рис. 2). Однако вследствие не-
творе существенно превышает концентрацию вана-
значительной растворимости этих соединений в ука-
дия. Это обусловлено образованием труднораствори-
занных условиях массовая доля образующегося
мого V2O5 в кислых средах, растворимость которого
AII(OH)2 мала (рис. 1, а). Конверсия становится замет-
и лимитирует концентрацию ванадия в водных рас-
ной лишь в более щелочных растворах и приводит к
творах. Уран при этом полностью переходит в вод-
полному разрушению структуры уранованадатов при
ный раствор и его концентрация практически не из-
рН 11 и выше. Термодинамическая оценка процесса
меняется в зависимости от рН раствора.
конверсии исследуемых соединений также свидетель-
В щелочных средах напротив, концентрация вана-
ствует о самопроизвольном протекании реакции (19)
дия превышает концентрацию урана, что вызвано
в щелочной среде и разрушении структуры уранова-
образованием труднорастворимого диураната натрия
надатов d-переходных элементов в этих условиях
в этих условиях. При этом образование даже неболь-
(табл. 3).
ших количеств гидроксида d-переходного элемента
Растворимость соединений АII(VUO6)2·nH2O
AII(OH)2 приводит к резкому уменьшению концен-
(AII = Mn, Fe, Co, Ni, Cu, Zn, Cd). Концентрации
трации A(II) в растворе уже в слабощелочных средах.
U(VI) и V(V) в насыщенных водных растворах урано-
Растворимость уранованадатов существенно изме-
ванадатов d-переходных элементов приведены в
няется в зависимости от кислотности среды. Она ми-
табл. 4. Расчетные кривые растворимости исследуе-
нимальна в нейтральных растворах при рН 6-8. Уве-
мых соединений изображены на рис. 1, б. Из всех
личение или уменьшение кислотности приводит к
представленных результатов видно, что уран и другие
возрастанию растворимости исследуемых соедине-
структурообразующие элементы переходят в водный
ний на несколько порядков до 10-4-10-2 моль/л в
раствор в стехиометрическом соотношении в широ-
сильнокислых и сильнощелочных растворах (табл. 4).
ком интервале кислотности. Это свидетельствует о
При одинаковой кислотности среды растворимость
конгруэнтном растворении соединений и согласуется
уранованадатов d-переходных элементов слабо зави-
с устойчивостью структуры уранованадатов в уста-
сит от природы межслоевого атома и изменяется в
новленных интервалах кислотности.
ряду исследуемых соединений не более чем в 5-
При образовании в донной фазе соединений вто-
10 раз.
ричного происхождения даже в небольших количест-
вах стехиометрическое соотношение концентраций
В табл. 5 представлены значения логарифмов про-
элементов в растворе нарушается. Так, в кислых сре-
изведений растворимости уранованадатов d-пере-
дах при рН < 1-2 содержание урана в водном рас-
ходных элементов, вычисленные по эксперименталь-
374
О. В. Нипрук и др.
Таблица 5. Произведения растворимости, стандартные
функции Гиббса растворения и образования уранована-
датов d-переходных элементов AII(VUO6)2·4H2O
ΔrG0,
∆fG0,
Соединение
lg KS
кДж/моль
кДж/моль
Mn(VUO6)2·4H2O
-58.7 ± 0.5
335 ± 12
5202 ± 30
Fe(VUO6)2·4H2O
-58.0 ± 0.7
331 ± 12
5046 ± 30
Co(VUO6)2·4H2O
-57.7 ± 0.5
329 ± 12
5019 ± 30
Ni(VUO6)2·4H2O
-56.7 ± 0.5
323 ± 12
5005 ± 30
Cu(VUO6)2·4H2O
-58.9 ± 0.5
336 ± 12
4907 ± 30
Zn(VUO6)2·4H2O
-57.4 ± 0.5
328 ± 12
5111 ± 30
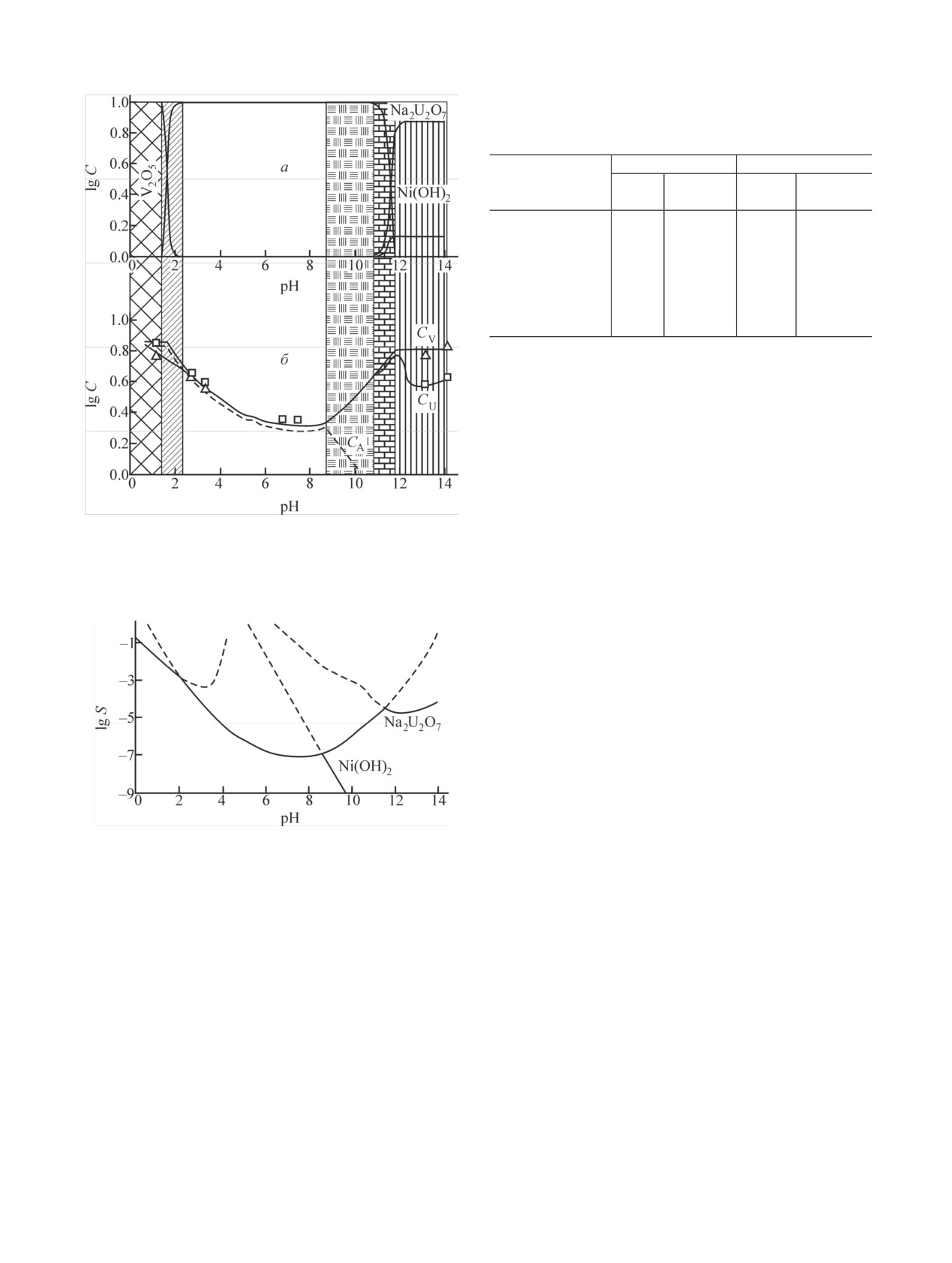
Рис. 3. Зависимость логарифма произведения растворимости
AII(VUO6)2·4H2O от ионного радиуса A2+. Уравнение регрес-
Cd(VUO6)2·4H2O
-60.3 ± 0.5
344 ± 12
5057 ± 30
сии: y = -14.12x - 47.02, R2 = 0.980.
ным данным об их растворимости в водных раство-
рах. Зависимость lgKS от ионных радиусов межслое-
вых атомов показана на рис. 3. Она с достаточно вы-
сокой степенью корреляции описывается линейным
уравнением, что дало нам возможность оценить про-
изведение растворимости Fe(VUO6)2·4H2O, экспери-
ментальное исследование которого не проводилось
по причине неустойчивости ионов Fe(II) в условиях
окислительной атмосферы. Из представленных дан-
ных видно, что значения KS уранованадатов d-пе-
реходных элементов уменьшаются с увеличением
радиуса межслоевого атома, что хорошо согласуется
с увеличением устойчивости соединений в этом на-
правлении. Эта тенденция может быть обусловлена
увеличением энергии кристаллической решетки ура-
нованадатов в ряду Ni < Zn < Co < Mn вследствие
возрастания ионной составляющей связи AII-O. Со-
единение меди выпадает из этой зависимости в соот-
ветствии с эффектом Яна-Теллера [17].
Вычисленные значения произведений растворимо-
сти были использованы для расчета термодинамиче-
ских функций образования и растворения исследуе-
мых уранованадатов. Расчетные данные представле-
ны в табл. 5. Большие положительные значения
ΔG0(298) хорошо согласуются с низкой растворимо-
стью и высокой устойчивостью уранованадатов d-пе-
реходных элементов.
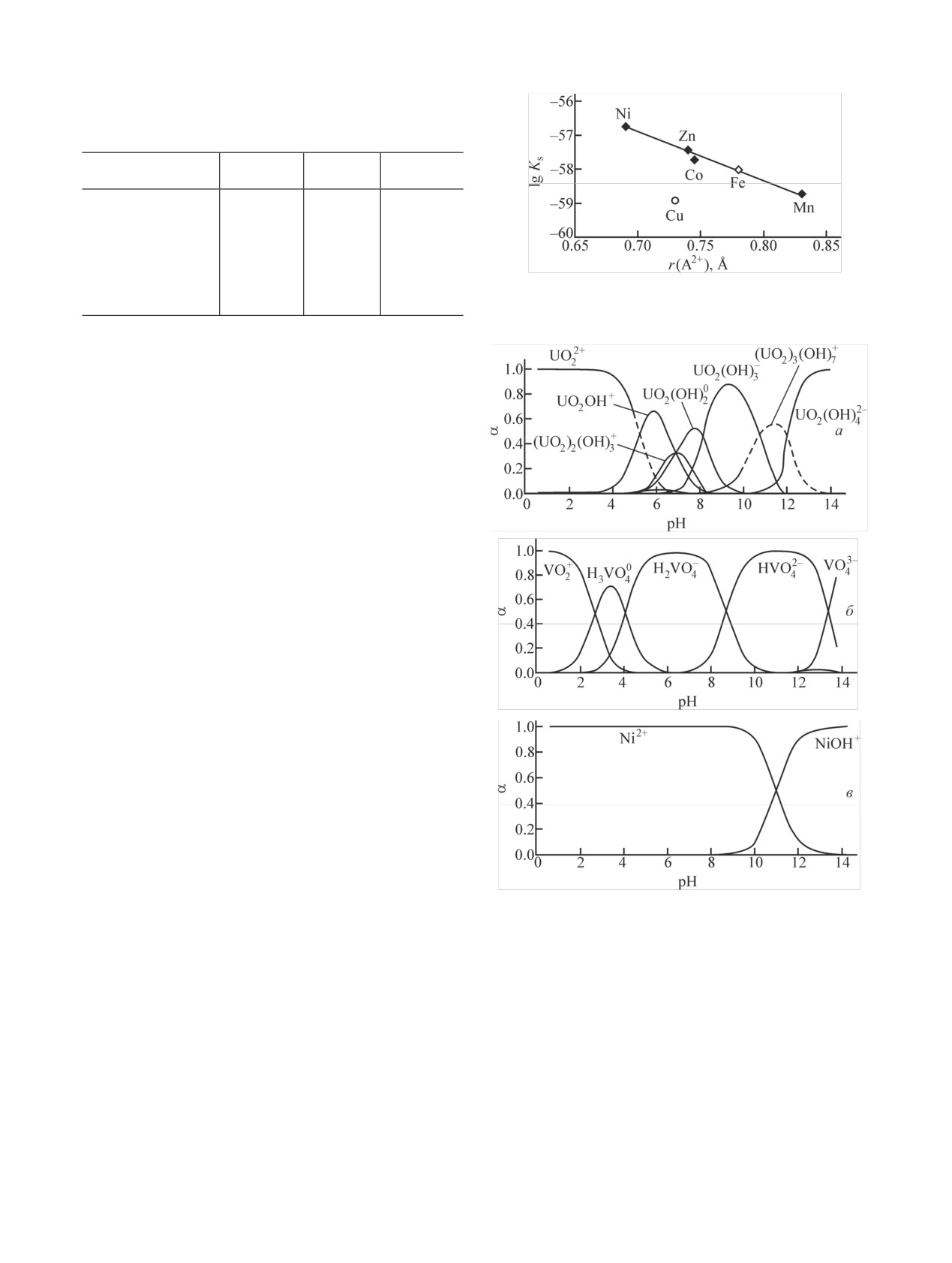
Ионно-молекулярный состав насыщенных вод-
ных растворов соединений АII(VUO6)2·nH2O (AII =
Рис. 4. Диаграммы состояния U(VI), V(V) и Ni(II) в на-
Mn, Fe, Co, Ni, Cu, Zn, Cd). Немаловажным аспек-
сыщенных водных растворах Ni(VUO6)2·4H2O.
том в изучении состояния соединений является ис-
следование ионно-молекулярного состава водных
Отсутствие коллоидных частиц в системе подтвер-
растворов. На рис. 4 представлены диаграммы со-
ждено результатами нефелометрического и турбиди-
стояния U(VI), V(V) и Ni(II) в насыщенном водном
метрического исследования, которые свидетельству-
растворе уранованадата никеля. Из этого рисунка
ют об истинности растворов во всем интервале ки-
видно, что в достаточно широком интервале кислот-
слотности.
ности ванадий присутствует в виде ванадиевой ки-
При рН 6-8, где наблюдается минимум раствори-
слоты и ее диссоциированных форм. Образование
мости уранованадатов, в растворе одновременно при-
полимерных ионов и молекул в насыщенных водных
сутствуют ионно-молекулярные формы урана и вана-
растворах не происходит, несмотря на то, что о суще-
дия с наименьшим зарядом. Это и обусловливает ми-
ствовании таких форм известно в литературе и их
нимальное взаимодействие молекул растворителя с
образование было учтено при расчете диаграммы.
кристаллическим веществом в рассматриваемых ус-
Состояние уранованадатов d-переходных элементов в гетерогенных водно-солевых системах
375
Список литературы
ловиях. При увеличении и уменьшении рН в растворе
появляются ионы с бóльшим зарядом и раствори-
мость соединений увеличивается.
[1] Нипрук О. В., Черноруков Н. Г., Еремина А. А. и др. // Ра-
диохимия. 2014. Т. 56, N 4. С. 332.
Обращает на себя внимание образование ванадил-
[2] Нипрук О. В., Черноруков Н. Г., Годованова Н. С., Аро-
ионов VO+ в кислых средах. Их наличие является
ва М. И. // Радиохимия. 2012. Т. 54, N 6. С. 514.
следствием способности H3VO4 в данных условиях
[3] Черноруков Н. Г., Нипрук О. В., Пыхова Ю. П., Годовано-
отщеплять молекулы воды и образовывать устойчи-
ва Н. С. // ЖОХ. 2012. Т. 82, N 8. С. 1263.
вые положительно заряженные частицы VO+, подоб-
[4] Черноруков Н. Г., Нипрук О. В., Еремина А. А. // ЖНХ.
ные UO2+. Появление этих ионов в водных растворах
2013. Т. 58, N 11. С. 1432.
[5] Nipruk O. V., Chernorukov N. G., Zakharycheva N. S., Kos-
совпадает с образованием в твердой фазе оксида
trova E. L. // J. Radioanal. Nucl. Chem. 2013. Vol. 298.
V(V). Это подтверждает взаимосвязь состава водного
P. 519.
раствора и твердой фазы, а также всех процессов,
[6] Nipruk O. V., Chernorukov N. G., Zakharycheva N. S., Kos-
происходящих в гетерогенной системе.
trova E. L. // J. Radioanal. Nucl. Chem. 2017. Vol. 311, N 1.
P. 519.
Таким образом, наиболее существенное влияние
[7] Соболева М. В., Пудовкина И. А. Минералы урана. М.:
на состояние исследуемых соединений в гетероген-
Госгеолтехиздат, 1957. 407 с.
ных водно-солевых системах оказывает кислотность
[8] Наумов Г. Б. // Химия урана / Под ред. Б. Н. Ласкорина.
среды. Величина рН водного раствора определяет
М.: Наука, 1981. С. 5.
кислотно-основные границы существования уранова-
[9] Черноруков Н. Г., Сулейманов Е. В., Князев А. В., Суч-
надатов в водных растворах, природу вторичных дон-
ков А. И. // ЖНХ. 1999. Т. 44, N 6. С. 874.
ных фаз и их растворимость. В целом АII(VUO6)2·
[10] Tokunaga T. K., Kim Y., Wan J. // Environ. Sci. Technol.
2009. Vol. 43. P. 5467.
nH2O характеризуются высокой химической устойчи-
[11] Черноруков Н. Г., Сулейманов Е. В., Князев А. В., Кли-
востью, что подтверждается сохранением состава и
мов Е. Ю. // Радиохимия. 1999. Т. 41, N 6. С. 481.
строения при контакте с водными растворами в ши-
[12] Марков В. К., Верный Е. А., Виноградов А. В. и др. Уран.
роком интервале рН от 2 до 11. За пределами этого
Методы его определения. М.: Атомиздат, 1964. 502 с.
интервала соединения АII(VUO6)2·nH2O трансформи-
[13] Музгин В. Н., Хамзина Л. Б., Золотавин В. Н., Безру-
руются в соединения иного состава и строения. Рас-
ков И. Я. Аналитическая химия ванадия. М.: Наука, 1981.
215 с.
творимость уранованадатов d-переходных элементов
[14] Кумок В. Н. Произведения растворимости. Новосибирск:
в зависимости от кислотности среды изменяется на
Наука, 1983. 267 с.
несколько порядков. Гораздо меньшее влияние на
[15] Термические константы веществ / Под ред. В. П. Глушко.
величину растворимости оказывает природа меж-
М.: Изд-во АН СССР, 1965-1981. Вып. IX.
слоевого атома. Показано, что ионно-молекулярный
[16] Grenthe I., Fuger J., Koning R. et al. Chemical Thermody-
состав насыщенных водных растворов уранованада-
namics of Uranium. Amsterdam: Elsevier, 2004. 715 p.
[17] Guillaumont R., Fanghänel T., Fuger J. et al. Update on the
тов во многом обусловливает закономерности раство-
Chemical Thermodynamics of Uranium, Neptunium, and
рения и конверсию исследуемых соединений в вод-
Plutonium. Amsterdam: Elsevier, 2003.
ных растворах. Экспериментальные данные исполь-
[18] Larson J. W. // J. Chem. Eng. Data. 1995. Vol. 40. P. 1276.
зованы для расчета произведений растворимости и
[19] Киселева Е. К., Сусленникова В. М. Справочное руково-
термодинамических функций образования и раство-
дство по приготовлению титрованных растворов и уста-
рения.
новке их титров. Л.: Типолитография ЛКВВИА им. А. Ф.
Можайского, 1959. 197 с.
Работа выполнена при финансовой поддержке
[20] Коттон Ф., Уилкинсон Дж. Современная неорганическая
Министерства образования и науки РФ (грант
химия. М.: Мир, 1969. 592 с.
N 4.5706.2017/БЧ в рамках базовой части государст-
[21] Trypuc M., Kielkowska U., Chalat M. // J. Chem. Eng. Data.
венного задания).
2002. Vol. 47. P. 765.