Радиохимия, 2019, т. 61, N 3, c. 231-233
231
Восстановление Np(VI) карбогидразидом
в растворах хлорной кислоты
© В. П. Шилов*a, А. М. Федосеевa
а Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4; * e-mail: shilovV@ipc.rssi.ru
Получена 23.05.2018, после доработки 23.05.2018, принята к публикации 19.06.2018
УДК 546.799.3
Спектрофотометрическим методом изучена стехиометрия реакции Np(VI) + карбогидразид (NH2NH)2CO
в растворе 0.02 моль/л HClO4. При избытке Np(VI) 1 моль карбогидразида восстанавливает 5 молей
Np(VI) до Np(V). В растворах 0.1-2.0 моль/л HClO4 (ионную силу 2.0 поддерживали добавлением
LiClO4), содержащих 3-100 ммоль/л (NH2NH)2CO, при температуре 20-45°С Np(VI) с концентраций
1 ммоль/л расходуется по закону скорости первого порядка до момента, когда остается менее
0.2 ммоль/л Np(VI). Далее реакция замедляется. Скорость реакции имеет первый порядок по карбогид-
разиду и порядок -1.45 по ионам Н+. Активированный комплекс образуется с потерей 1 и 2 ионов Н+.
Энергия активации равна 86 ± 5 кДж/моль.
Ключевые слова: нептуний(VI), карбогидразид, стехиометрия, хлорная кислота, кинетика.
DOI: 10.1134/S0033831119030043
Экстракционная переработка облученного ядер-
воде готовили по навеске препарата (Acros Organ-
ного топлива на основе диоксида урана с высокой
ics, США), содержащего не менее 97% основного
степенью выгорания, а также на основе нитрида ура-
вещества.
на - топлива для реактора на быстрых нейтронах -
Хлорная кислота и перхлорат лития были квали-
требует использования для восстановления Pu(IV,
фикации х.ч., последний для дополнительной очи-
VI), Np(VI), Tc(VII) реагентов, образующих в итоге
стки перекристаллизовывали из воды и сушили на
минимальное количество минеральных солей. В ка-
воздухе при 190°C. Запасные и рабочие растворы
честве одного из таких реагентов предполагается
готовили с использованием дважды дистиллиро-
использовать карбогидразид (NH2NH)2CO [1]. Одна-
ванной воды. Концентрацию HClO4 определяли
ко следует иметь в виду, что карбогидразид с неко-
титрованием стандартным раствором NaOH. Рас-
торыми ионами металлов образует взрывчатые со-
твор LiClO4 готовили из навески безводного пере-
единения. Например, у перхлоратного комплекса
кристаллизованного препарата.
карбогидразида с железом(II) обнаружена способ-
Методика опытов была следующая. При изуче-
ность к бризантному взрыву [2]. Тем не менее при
нии стехиометрии реакции в термостатированную
рациональной организации технологического про-
кварцевую кювету (l = 1 cм) помещали около 3 мл
цесса можно избежать неприятных инцидентов. По-
раствора Np(VI) в 0.02 моль/л HClO4 и регистриро-
этому вполне оправдано исследование реакций акти-
вали спектр поглощения в диапазоне 950-990 нм с
нидов(VI, V, IV) и Tc(VII) с карбогидразидом. В ра-
помощью спектрофотометра Shimadzu PC
3100
боте [1] изучено взаимодействие Np(VI) и Np(V) с
(Япония) или СФ-46 (ЛОМО, Россия), затем вноси-
карбогидразидом в растворах HNO3. Отмечается,
ли аликвоту (NH2NH)2CO и периодически измеря-
что Np(VI) с высокой скоростью при комнатной тем-
ли поглощение при длине волны 980.8 нм, отве-
пературе переходит в Np(V). Однако кинетика этой
чающей главной полосе поглощения Np(V). При
реакции подробно не изучена.
изучении кинетики реакции в кювету помещали
В настоящей работе исследованы стехиометрия и
раствор HClO4, LiClO4 и (NH2NH)2CO и выдержи-
кинетика реакции Np(VI) с карбогидразидом в рас-
вали 10-15 минут при заданной температуре. По-
творах HClO4 и намечен механизм процесса.
сле внесения аликвоты запасного раствора Np(VI)
следили за накоплением Np(V). Каждый опыт вы-
Экспериментальная часть
полняли не менее 3 раз.
Очистку препарата 237Np, приготовление запас-
Результаты и обсуждение
ного раствора NpO2(ClO4)2 в 0.02 моль/л HClO4,
определение концентрации Np и контроль валент-
Стехиометрия реакции была изучена при 25-
ных форм проводили по методикам, использован-
28°С. В растворе 0.02 моль/л HClO4, содержащем
ным ранее [3]. Запасной раствор карбогидразида в
2 ммоль/л Np(VI), после добавления (NH2NH)2CO
232
В. П. Шилов, А. М. Федосеев
Таблица 1. Результаты кинетических экспериментов в
растворе 2 моль/л HClO4, содержащем 1 ммоль/л Np(VI)
[(NH2NH)2CO],
T, °C
k'·103, с-1
k1, л·моль-1·с-1
ммоль/л
3
0.157
0.0523
6
0.32
0.0533
10
0.51
0.051
25
20
1.02
0.051
40
2.04
0.051
100
5.97
0.060
3
0.312
0.104
10
1.057
0.106
30
20
2.034
0.102
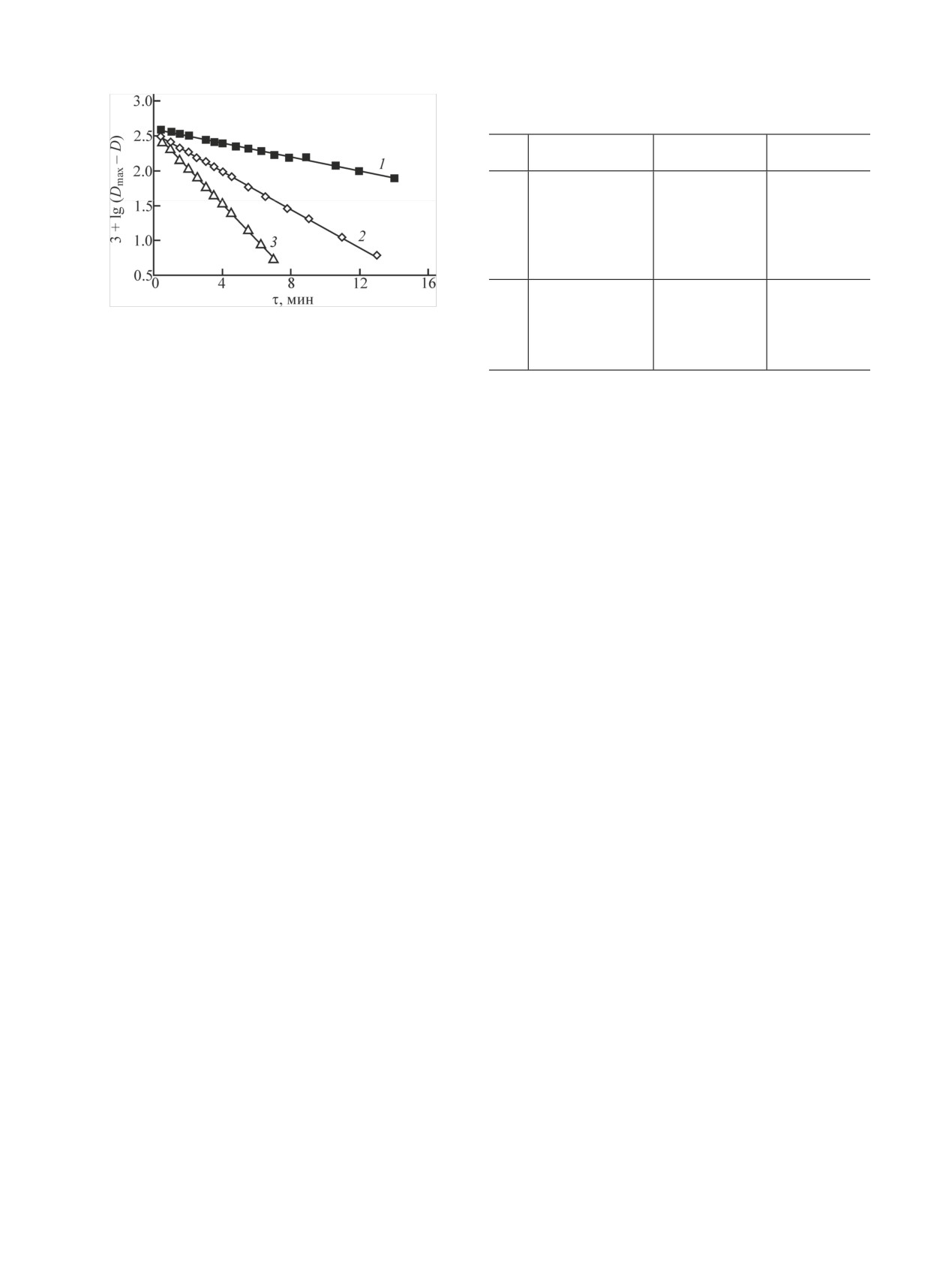
Рис. 1. Анаморфозы кинетических кривых восстановления Np(VI)
50
5.5
0.11
карбогидразидом. [HClO4] = 2 моль/л, [Np(VI)] = 1 ммоль/л, T =
100
9.91
0.099
30°C, l = 1 см; [(NH2NH)2CO], ммоль/л: 1 - 20, 2 - 50, 3 - 100.
1 ммоль/л Np(VI) и 100 ммоль/л карбогидразида,
до концентрации 0.2 ммоль/л наблюдалось накоп-
кинетическая зависимость представляет собой пря-
ление Np(V). По начальной скорости рассчитывали
мую вплоть до протекания реакции на 95%. В рас-
бимолекулярную константу скорости реакции и оце-
творах, содержащих 50 и 20 ммоль/л карбогидрази-
нивали время завершения реакции на 99.9%. Оно
да, наблюдается замедление реакции после проте-
должно было составлять 10-11 мин. Фактически рост
кания ее на 86 и 77%. Причину этого определить не
оптического поглощения прекратился через 16 мин.
удалось.
За последующие 3 ч оптическая плотность увеличи-
лась на 0.010. Концентрацию Np(V) рассчитывали с
Спрямление кинетических кривых в полулога-
использованием молярного коэффициента погашения
рифмических координатах свидетельствует о пер-
Np(V), равного 410 л·моль-1·см-1 [4]. В трех опытах
вом порядке реакции по Np(VI). Поэтому кинети-
было получено Δ[Np(VI)]/Δ[(NH2NH)2CO] = 5.
ческое уравнение может быть представлено в виде
Гидразин в кислой среде существует в виде ка-
–d[Np(VI)]/dt = k'[Np(VI)] = k'([Np(V)]∞ - [Np(V)]), (6)
тиона. Можно предположить, что и карбогидразид
присоединяет в растворе HClO4 один или два про-
где k' - константа скорости первого порядка. В ин-
тона. Поэтому между Np(VI) и карбогидразидом
тегральной форме после замены [Np(V)] на про-
имеют место реакции
порциональную ей величину D уравнение (6) пере-
ходит в выражение
NpO2+ + Hn(NH2NH)2COn+ → NpO+ + H+ + R1,
(1)
NpO2+ + R1 → NpO+ + R2,
(2)
2.303lg(D∞ - D) = k't + const.
(7)
NpO2+ + R2 → NpO2+ + R3,
(3)
Здесь D и D∞ - текущая и конечная оптическая
NpO2+ + R3 → NpO+ + R4,
(4)
плотность соответственно.
NpO2+ + R4 → NpO2+ + продукты.
(5)
Константа скорости первого порядка увеличива-
ется прямо пропорционально концентрации карбо-
Отмечается [5], что при избытке карбогидразида
гидразида. Данные, полученные в растворе 2 моль/л
его реакция с Np(VI) протекает с образованием га-
HClO4, содержащем 1 ммоль/л Np(VI), приведены в
зовой фазы, содержащей N2, CO2 небольшое коли-
табл. 1.
чество N2O. Следовательно, на каком-то этапе ре-
акций (2)-(5) происходит гидролиз радикала, в ре-
Постоянство бимолекулярной константы скоро-
зультате отщепляются группы N2Hx и H2CO3.
сти k1 = k'[(NH2NH)2CO] свидетельствует о первом
порядке реакции по восстановителю, здесь k1 вклю-
Кинетику реакции Np(VI) + Hn(NH2NH)2COn+
чает константу скорости реакции (1) и последующих
изучали в растворах 0.1-2.0 моль/л HClO4 при ион-
быстрых реакций радикалов с Np(VI). В табл. 2 при-
ной силе I = 2.0, которую поддерживали добавле-
ведены значения k1 в разных условиях.
нием LiClO4. Стехиометрия реакции позволила
проводить исследования при концентрации карбо-
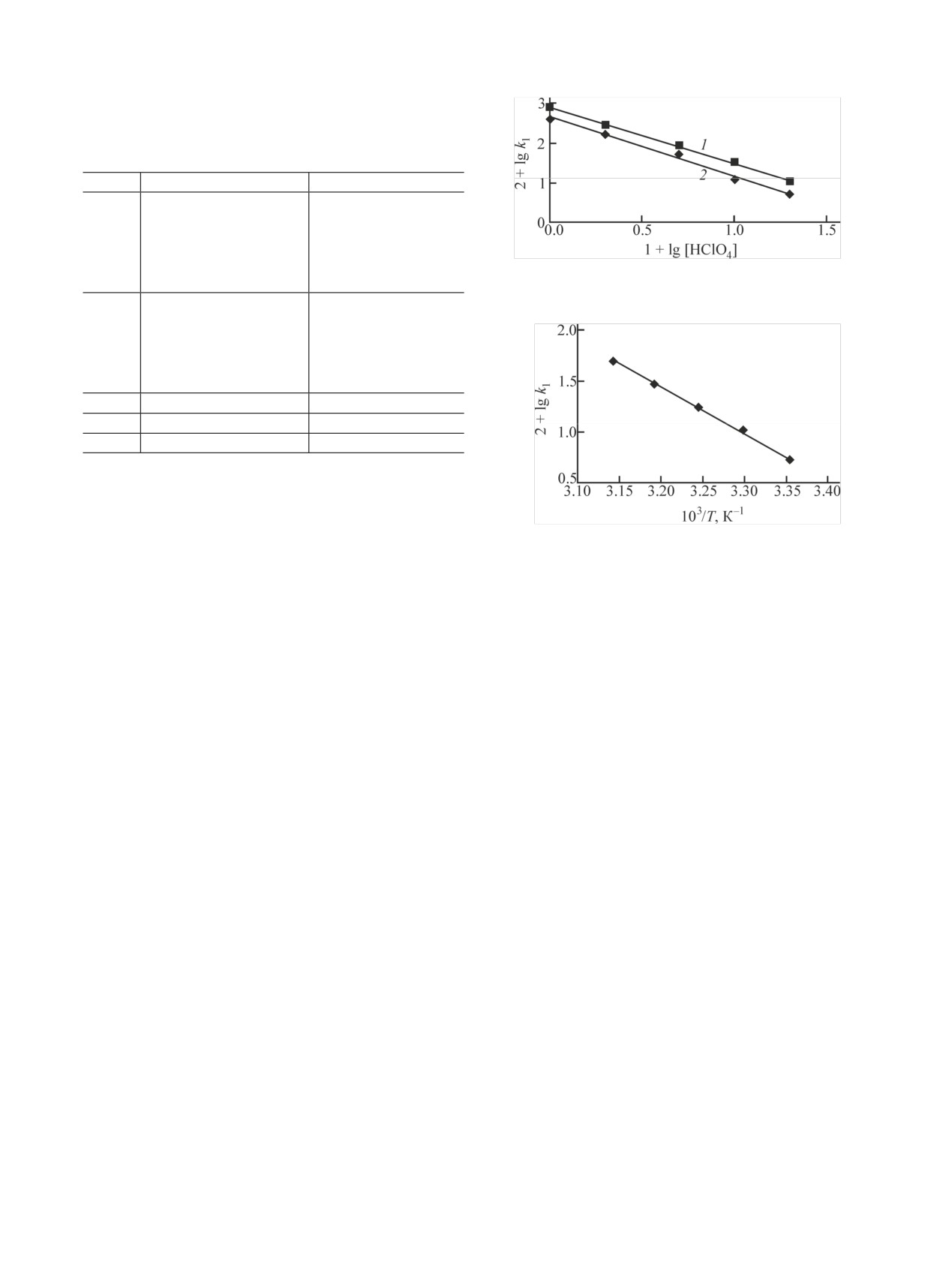
Из табл. 2 видно, что с ростом концентрации
гидразида, лишь в 3 раза превышающей концентра-
ионов H+ восстановление Np(VI) резко замедляет-
цию Np(VI). На рис. 1 приведены кинетические
ся. На рис. 2 приведены зависимости k1 от [H+] в
кривые в координатах lg(D∞ - D)-время при T =
логарифмических координатах. При 25 и 30°C экс-
30°C. Для раствора 2 моль/л HClO4, содержащего
периментальные точки лежат на прямых с угловым
Восстановление Np(VI) карбогидразидом в растворах хлорной кислоты
233
Таблица 2. Влияние условий на бимолекулярную кон-
станту скорости реакции Np(VI) + (NH2NH)2CO. I =
2 моль/л, [Np(VI)] = 1 ммоль/л, [(NH2NH)2CO] = 3-
100 ммоль/л
T, °C
[HClO4], моль/л
k1, л·моль-1·с-1
2
0.052
1
0.12
25
0.5
0.54
0.2
1.76
Рис. 2. Влияние концентрации ионов H+ на бимолекулярную
0.1
4.06
константу скорости восстановления Np(VI) карбогидразидом в
2
0.104
растворе с ионной силой I = 2 моль/л. T, °C: 1 - 25, 2 - 30.
1
0.345
30
0.5
0.857
0.2
2.79
0.1
8.03
35
2
0.176
40
2
0.296
45
2
0.495
коэффициентом -1.45. Следовательно, восстанов-
ление идет через образование активированного
комплекса с отщеплением одного и двух протонов.
Рис. 3. Зависимость lgk1 реакции восстановления Np(VI) кар-
Активированный комплекс возникает в результате
богидразидом от обратной температуры. [HClO4] = 2 моль/л,
реакций
[(NH2NH)2CO] = 3 ммоль/л.
103/T (К-1)-lgk1 (рис. 3) найдена энергия актива-
NpO2+ + H(NH2NH)2CO+ ⇄ NpO2(NH2NH)2CO2+ + H+,
ции, равная 86 ± 5 кДж/моль.
NpO22+ + Н2(NH2NH)2CO2+ ⇄ NpO2(NH2NH)2CO2+ + 2H+.
Список литературы
Далее происходит внутримолекулярный пере-
[1] Волк В. И., Марченко В. И., Двоеглазов К. Н. и др. // Ра-
нос заряда, возникают NpO+ и R.
диохимия. 2012. Т. 54, N 2. С. 133-138.
Кинетическое уравнение, учитывающее всех
[2] Riu Liu, Zunning Zhou, Shuykan Qi et al. // Centr. Eur. J.
Energet. Mater. 2013. Vol. 10, N 1. P. 17-36.
участников процесса восстановления Np(VI) карбо-
[3] Шилов В. П., Федосеев А. М. // Радиохимия. 2015. T. 57,
гидразидом в растворе HClO4 + LiClO4, запишется
N 3. С. 218-220.
в виде
[4] Шилов В. П., Федосеев А. М., Гоголев А. В. // Радиохимия.
2017. T. 59, N 3. С. 201-203.
-d[Np(VI)]/dt = k'[NpO22+][(NH2NH)2CO][H+]-1.45,
[5] Dvoeglazov K. N., Bessonov A. A., Fedosseev A. M., Mitri-
cas P. V. Study of the gas phase composition formed during
где k = 0.12 л-0.45·моль0.45·с-1 при [H+] = 1 моль/л и
oxidation-reduction reactions of hydrazine organic deriva-
T =25°C.
tives // Sixth Int. Conf. on Radiation and Applications in Vari-
ous Fields of Research. Ohrid, Macedonia (FYROM), June
Из температурной зависимости k1 в координатах