142
Радиохимия, 2019, т. 61, N 2, c. 142-147
Термодинамическое моделирование термических процессов
с участием радионуклидов хлора, кальция, бериллия, никеля, цезия
при нагреве радиоактивного графита в парах воды
© Н. М. Барбин*а-в, А. М. Кобелева, Д. И. Терентьева, С. Г. Алексеева,г
а Уральский институт Государственной противопожарной службы МЧС России,
620062, Екатеринбург, ул. Мира, д. 22; * e-mail: NMBarbin@mail.ru
б Уральский государственный аграрный университет, 620075, г. Екатеринбург, ул. Карла Либкнехта, д. 42
в Уральский федеральный университет им. Б. Н. Ельцина, 620002, Екатеринбург, ул. Мира, д. 19
г Научный-инженерный центр «Надежность и ресурс больших систем и машин» УрО РАН,
620049, Екатеринбург, ул. Студенческая, д. 54а
Получена 27.02.2018, после доработки 13.06.2018, принята к публикации 20.06.2018
УДК 541.13+11
Методом термодинамического моделирования исследовано поведение радионуклидов Cl, Ca, Be, Ni,
Cs при нагревании радиоактивного графита в парах воды. При помощи программы TERRA проведен
полный термодинамический анализ в интервалах температур от 373 до 3273 К с целью установления
возможного состава газовой фазы. Установлено, что хлор в интервале температур от 873 до 1973 К на-
ходится в виде газообразного HCl, при температуре от 1973 до 3273 К - в виде газообразных HCl, Cl.
Кальций в диапазоне температур от 1973 до 3273 К находится в виде газообразных Ca(OH)2, Ca, CaOH
и ионизированных CaOH+, Ca+. Бериллий в интервале температур от 1873 до 3273 К находится в виде
газообразных Be(OH)2, BeOH, Be, BeOH. Никель при температуре от 1673 до 2173 К находится в виде
газообразных NiH, Ni(OH)2, NiOH, Ni, в интервале температур от 2173 до 3273 К - в виде газообразных
NiH, NiOH, Ni. Цезий в области температур от 973 до 1473 К находится в виде газообразных CsCl,
CsOH, ионизированного Cs+, при температуре от 1473 до 3273 К - в виде ионизированного Cs+. Уста-
новлены основные реакции внутри отдельных фаз и между конденсированными и газовой фазами. Рас-
считаны их константы равновесия.
Ключевые слова: термодинамическое моделирование, радионуклиды, пары воды, константы равно-
весия, радиоактивный графит.
DOI: 10.1134/S0033831119020096
В России и странах мирового сообщества сущест-
тодом термодинамического моделирования [4].
вует проблема обращения с облученным графитом
Целью работы является определение равновесно-
активных зон уран-графитовых реакторов после вы-
го состава газовой фазы при взаимодействии радио-
ведения их из эксплуатации. Вcего в России накоп-
активного графита с парами воды в широком темпе-
лено около 60 тысяч тонн облученного графита [1].
ратурном диапазоне. Задача работы состоит в прове-
В настоящий момент в мире не существует окон-
дении термодинамического моделирования рассмат-
чательного принятого решения по проблеме утили-
риваемой системы и определении констант равнове-
зации отработанного графита [2]. Одним из решений
сия основных реакций, протекающих при нагреве
данной проблемы является его сжигание [1].
радиоактивного графита, содержащего радионукли-
ды Cl, Ca, Be, Ni и Cs.
Предлагаются разные способы сжигания графита:
традиционный, в кипящем слое, газификация графи-
Методика расчета
та с помощью водяного пара (пиролиз). По оценке
специалистов, сжигание отработанного графита даст
При исследовании сложных по химическому
в итоге твердые радиоактивные отходы, готовые для
составу многофазных систем в условиях высоких
длительного захоронения, объемом 1-2% от перво-
температур применяют модель термодинамическо-
начального объема графита. При сжигании образует-
го моделирования. Проведение натурных экспери-
ся газообразный радиоактивный продукт - 14CO2.
ментов при высоких температурах не всегда позво-
14CO2 можно превратить в инертные соединения на
ляет получить достоверные сведения в связи с их
основе карбонатов кальция и магния [3].
сложностью и ошибками измерений [5]. Метод
Ранее было изучено поведение U, Am, Pu при
термодинамического моделирования успешно при-
нагреве радиоактивного графита в парах воды ме- меняли в химии и металлургии [4, 6-11].
Термодинамическое моделирование термических процессов
143
Таблица 1. Состав исходной системы
Фаза
Фазовый состав
Содержание, мас%
Газовая (75%)
H2O
100
C
99.98
U
1.15·10-2
Cl
1.88·10-3
Конденсированная
Ca
2.69·10-4
(25%)
Be
1.19·10-5
Ni
7.99·10-6
Cs
3.99·10-6
Расчет реализован с помощью программы
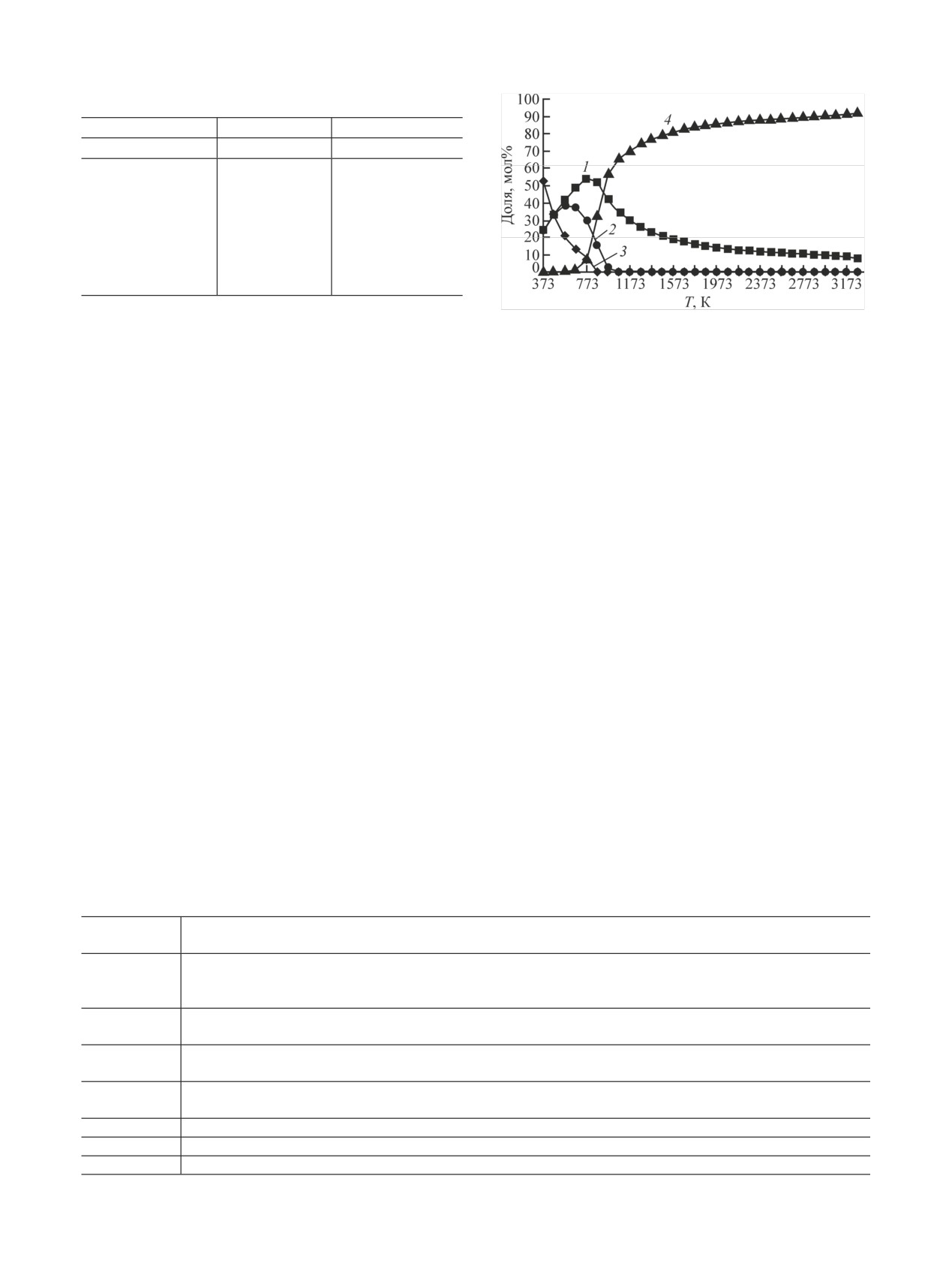
Рис. 1. Распределение С по фазам: 1 - CO2(г); 2 - CH4(г), 3 - С(к),
4 - CO(г).
TERRA [5, 12]. Данная программа предназначена для
расчета состава фаз, термодинамических и транс-
773 К содержание газа CH4 уменьшается до
портных свойств произвольных систем с химически-
~30 мол% по реакции (4). В диапазоне температур
ми и фазовыми превращениями. Теоретические осно-
от 573 до 973 К содержание газа CH4 уменьшается
вы, заложенные в программный комплекс, приведены
до
~2 мол%, а газа CO
- увеличивается до
в работах [5, 12]. Расчет равновесного состава фаз и
~57 мол% в соответствии с реакцией (5). Конден-
параметров равновесия проводили с использованием
сированный C при температуре ~873 К переходит
справочной базы данных свойств индивидуальных
в газовую фазу в виде CH4
(~16 мол%), CO
веществ (ИВТАНТЕРМО, HSC и др.). Информация
(~32 мол%) и CO2 (~52 мол%). При повышении
об исходном составе радиоактивного графита взята
температуры до ~1073 К содержание газообразного
из работ [13, 14] и приведена в табл. 1. Предпола-
CH4 уменьшается до нуля. В диапазоне температур
гаемые формы существования радионуклидов в
от 773 до 3273 К содержание газа CO2 уменьшается
данной системе приведены в табл. 2.
до
~8 мол%, а газа CO
- увеличивается до
~92 мол% по реакциям (6)-(8).
Результаты и обсуждение
Распределение хлора по фазам показано на рис. 2.
Распределение углерода по фазам представлено
До температуры 573 К хлор находится в виде кон-
на рис. 1. В диапазоне температур от 373 до 573 К
денсированного UO2Cl2. При температуре от 573
содержание конденсированного C уменьшается до
до 873 К хлор из конденсированного UO2Cl2 пере-
~20 мол% и содержание газа CH4
увеличивается до
ходит в газообразный HCl. Конденсированный
~38 мол% по реакции (1) (табл. 3). В области тем-
UO2Cl2 разлагается при температуре ~873 К. В ин-
ператур от 573 до 873 К содержание конденсиро-
тервале температур от 873 до 1973 К хлор находит-
ванного углерода уменьшается до нуля с образова-
ся в виде газообразного HCl. В области температур
нием газа CO (~32 мол%) в соответствии с реакци-
от 1973 до 3273 К содержание газообразного HCl
ей (2). При температуре от 373 до 773 К содержа-
уменьшается до ~70 мол%, а газообразного Cl -
ние газа CO2
увеличивается до ~54 мол% согласно
увеличивается до ~30 мол% в соответствии с реак-
реакции (3). В интервале температур от 573 до
цией (9).
Таблица 2. Предполагаемые формы существования радионуклидов
Радионуклид
Тип соединения в равновесной системе
в графите
С(к), С(г), СО(г), СО2(г), С2О(г), С3О2(г), СH(г), СH2(г), СH3(г), CH4(г), C2H(г), C2H2(г), C2H4(г), C2H5(г), C2H6(г),
12С, 14С
C3H8(г), CHO(г), CHO2(г), CH2O(г), CH2O2(г), CH3O(г), C2H4O2(г), C3H6O(г), Ni3C(к), NiCO3(к), ClCO(г), CH3Cl(г),
HClCO(г), BeCO3(к), CaCO3(к), Cs2CO3(к), CO+, CO+, CHO+
238U, 236U,
U(г), UO(г), UO2(к), UO2(г), UO3(к), UO3(г), U3O8(к), U4O9(к), UOCl(к), UO2Cl2(к), CaUO4(к), U+, UO+, UO+, UO2-,
235U
UO3-
Cl(г), ClO(г), HCl(г), HOCl(г), UO2Cl2(к), ClCO(г), CH3Cl(г), HClCO(г), NiCl(г), UOCl(к), UO2Cl2(к), BeCl(г),
36Cl
BeOHCl(г), CaCl(г), CaCl2(к), CaCl2(г), CaOHCl(г), CsCl2(к), CsCl(г), Cl-, CaCl+
Ca(г), CaO(к), CaO(г), CaH(г), CaOH(г), Ca(OH)2(к), Ca(OH)2(г), CaCl(г), CaCl2(к), CaCl2(г), CaUO4(к), CaOHCl
41Ca
(г), CaCO3(к), Ca+, CaO+, CaOH+, CaCl+
10Be
Be(г), BeO(к), BeO(г), BeH(г), BeH2(г), Be(OH)(г), Be(OH)2(к), Be(OH)2(г), BeCl(г), BeOHCl(г), BeCO3(к), Be+
59Ni
Ni3C(к), NiCO3(к), Ni(г), NiO(к), NiO(г), NiH(г), NiOH(г), Ni(OH)2(к), Ni(OH)2(г), NiCl(г), Ni+
137Cs, 134Cs
Cs(г), CsO(г), CsH(г), CsOH(г), CsCl2(к), CsCl(г), Cs2CO3(к), Cs+
144
Н. М. Барбин и др.
Таблица 3. Основные реакции и соответствующие им константы равновесия
Номер
Реакция
ΔT, К
a
b
Δa
Δb
реакции
1
2C(к) + 2H2O = CH4 + CO2
373-573
0.7
-1.6·103
0.06
27.1
2
C(к) + H2O = CO + H2
573-873
14.04
-1.4·104
0.5
403.3
3
C(к) + 2H2O = CO2 + 2H2
373-873
12.366
-11338.7
0.129386
67.11184
4
CH4 + 2H2O = CO2 + 4H2
573-773
25.1
-2.1·104
0.1
118.3
5
CH4 + H2O = CO + 3H2
573-973
29.7
-2.6·104
0.1
82.7
6
CO2 + CH4 = 2CO + 2H2
773-973
34.09
-3.1·104
0.01
16.4
7
CO2 + H2 = CO + H2O
873-2573
2.3362
-4161.41
0.044432
65.33821
8
CO2 + H2O = CO + 2OH
2573-3273
-2.9526
27095.62
0.42412
1228.228
9
HCl + CO2 = Cl + CO + OH
1973-3273
18.2
-6.4·104
0.01
28.2
10
CaCO3(к) + C(к) = CaO(к) + 2CO
873-1273
22.079
-26287.5
0.972157
1015.665
11
CaUO4(к) + H2 = CaO(к.) + UO2(к.) + H2O
1173-1473
1.2
-2.4·103
0.03
46.9
12
CaO(к) + H2 + CO2 = Ca(OH)2 + CO
1473-1873
10.8
-3.5·104
0.03
54.4
13
Ca(OH)2 = CaOH+ + OH-
1973-3073
12.5
-9.5·104
0.01
42.4
14
Ca(OH)2 = CaOH + OH
1973-3073
14.2
-5.4·104
0.01
38.5
15
Ca(OH)2 = Ca + 2OH
1973-3273
25.7
-105
0.01
48.8
16
Ca(OH)2 = Ca+ + HO– + H
1973-3273
24
-1.7·105
0.01
25.36
17
CaOH+ = Ca+ + OH
3073-3273
12.551
-55465.9
0.000842
2.670339
18
CaOH = Ca+ + OH-
3073-3273
10.8
-9.6·104
6·10-5
0.193
19
CaOH = Ca + OH
3073-3273
11.5
-4.6·104
0.001
5.4
20
BeO(к) + CO2 + H2 = Be(OH)2 + CO
973-1873
10.508
-30154.6
0.028792
38.39083
21
Be(OH)2 = BeOH + OH
2173-3273
15.9
-6.6·104
0.02
65.2
22
Be(OH)2 = Be + 2OH
2873-3273
28.157
-121399
0.017407
53.32269
23
Be(OH)2 = BeO + 2H + O
3073-3273
42.945
-177785
0.015332
48.60161
24
2Ni(OH)2(к) + 2C(к) = 2NiO(к) + CH4 + CO2
373-573
35.7
-1.3·104
0.04
21.8
25
NiCO3(к) = NiO(к) + CO2
373-573
19.7
-7.3·103
0.01
6.4
26
3NiO(к) + 4CH4 = Ni3C(к) + 8H2 + 3CO
673-973
117.1
-9.5·104
0.1
129.3
27
Ni3C(к) + 4CO2 = 3NiO(к) + 5CO
973-1173
19
-2.9·104
0.03
40.8
28
2Ni3C(к) + 3H2 + 2CO2 = 6NiH + 4CO
1173-1373
104.8
-2.6·105
0.02
27.5
29
2NiO(к) + H2 = Ni(OH)2 + Ni
1173-1473
27.914
-77484.8
0.056078
73.39391
30
2NiO(к) + 3H2 = 2NiH + 2H2O
1273-1473
28.7
-7.5·104
0.07
108.8
31
2NiO(к) + H2 = 2NiOH
1273-1473
28.6
-8·104
0.05
81.2
32
NiO(к) + H2 = Ni + H2O
1273-1673
20.1
-4.8·104
0.05
84.05
33
2NiH + CO2 = 2Ni + H2O + CO
1473-2573
14.5
-2.3·104
0.06
123.6
34
Ni(OH)2 + H2 = Ni + 2H2O
1473-2173
12.2
-1.8·104
0.04
81.17
35
2NiOH + H2 = 2Ni + 2H2O
1573-2573
11.1
-1.5·104
0.05
107.6
36
NiH = Ni + H
2573-3273
12.6
-3.6·104
0.01
36.1
37
NiOH = Ni + OH
2573-3273
13.7
-4.1·104
0.02
60.5
38
CsCl(к) = CsCl
573-973
16.1
-2.2·104
0.3
234.7
39
CsCl + CO2 + H2 = CsOH + CO + HCl
973-1273
4.6
-2·104
0.009
11.03
40
CsCl = Cs+ + Cl-
973-1573
8.7
-5.6·104
0.01
13.8
41
CsOH = Cs+ + OH-
1273-1573
10.03
-6.9·104
0.009
13.1
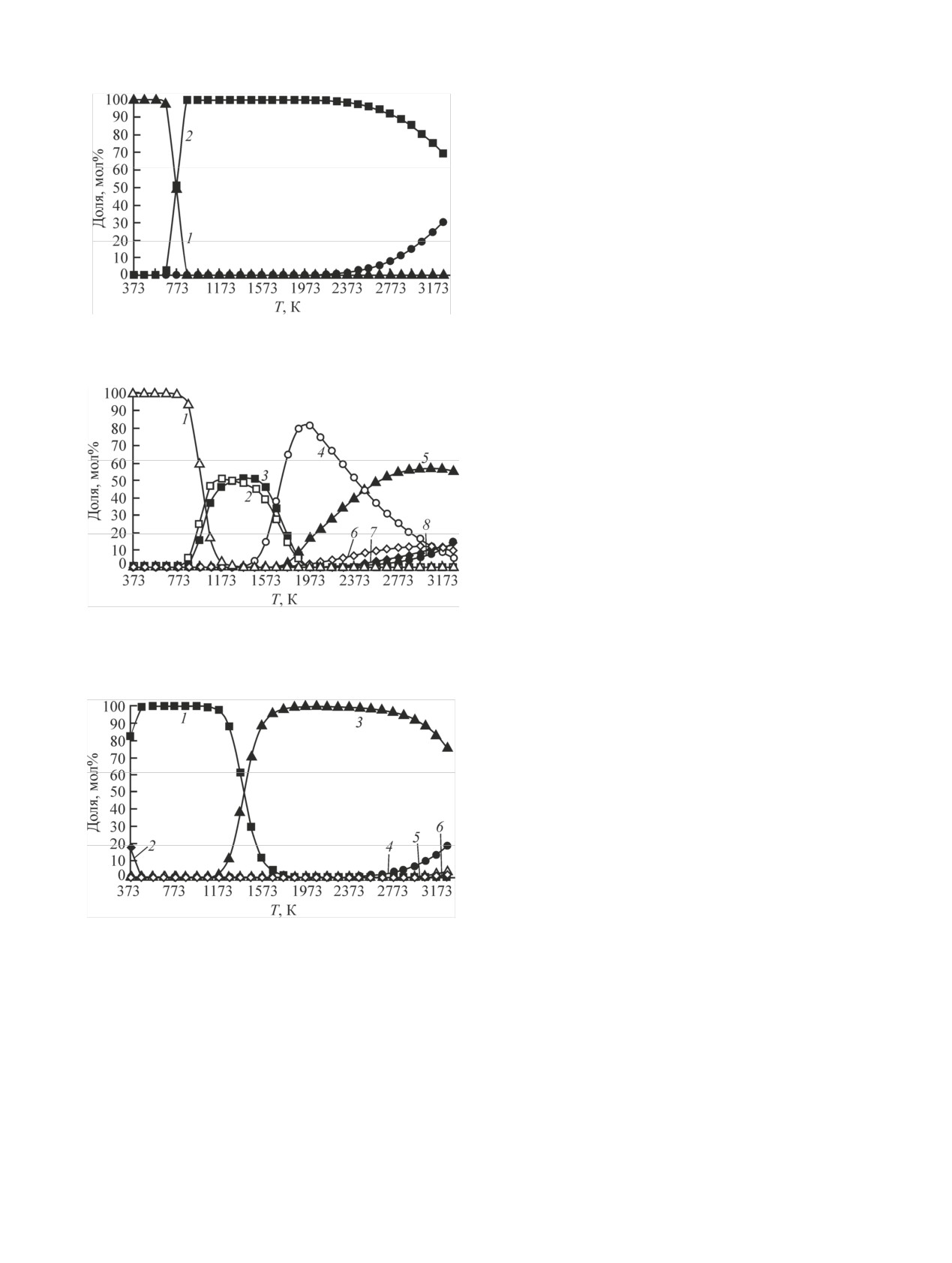
Распределение кальция по фазам представлено
до ~1 мол%, а конденсированного CaO - увеличи-
на рис. 3. Кальций до температуры 673 К находит-
вается до ~49 мол% по реакции (10). В диапазоне
ся в виде конденсированного CaCO3. В диапазоне
температур от 1173 до 1473 К содержание конден-
температур от 673 до 1173 К содержание конденси-
сированного CaUO4 уменьшается до ~45 мол%, а
рованного CaCO3 уменьшается до ~4 мол%, а кон-
конденсированного CaO
- увеличивается до
~
денсированного CaUO4
- увеличивается до
51 мол% в соответствии с реакцией (11). В области
~50 мол%. При температуре от 873 до 1273 К со-
температур от 1473 до 1873 К содержание конден-
держание конденсированного CaCO3 уменьшается
сированного CaO уменьшается до ~6 мол%, а газо-
Термодинамическое моделирование термических процессов
145
Ca(OH)2 уменьшается до ~6 мол% и увеличивается
содержание газообразного Ca до ~13, ионизирован-
ного Ca+ - до ~14 мол% согласно реакциям (15),
(16). При температуре от 3073 до 3273 К содержа-
ние ионизированного CaOH+ уменьшается до ~56,
газообразного CaOH - до ~10 мол% в соответствии
с реакциями (17)-(19).
3
Распределение бериллия по фазам показано на
рис. 4. При температуре 473 К содержание конден-
сированного Be(OH)2 уменьшается до нуля, а кон-
денсированного BeO
- увеличивается до
~100 мол%. Состав данной фазы не меняется до
, 3 -
Рис. 2. Распределение Cl по фазам: 1 - UO2Cl2(к), 2 - HCl(г)
температуры 973 К. В интервале температур от 973
Cl(г)
до 1873 К содержание конденсированного BeO
уменьшается до нуля, а газообразного Be(OH)2 -
увеличивается до ~100 мол% по реакции (20). В
области температур от 1873 до 2373 К в газовой фазе
присутствует Be(OH)2 (~100 мол%).При увеличении
температуры от 2373 до 3273 К содержание газооб-
разного Be(OH)2 уменьшается до ~76 мол% и уве-
личивается содержание газообразных BeOH до
~19, Be до ~4, BeO до ~1 мол% в соответствии с
реакциями (21)-(23).
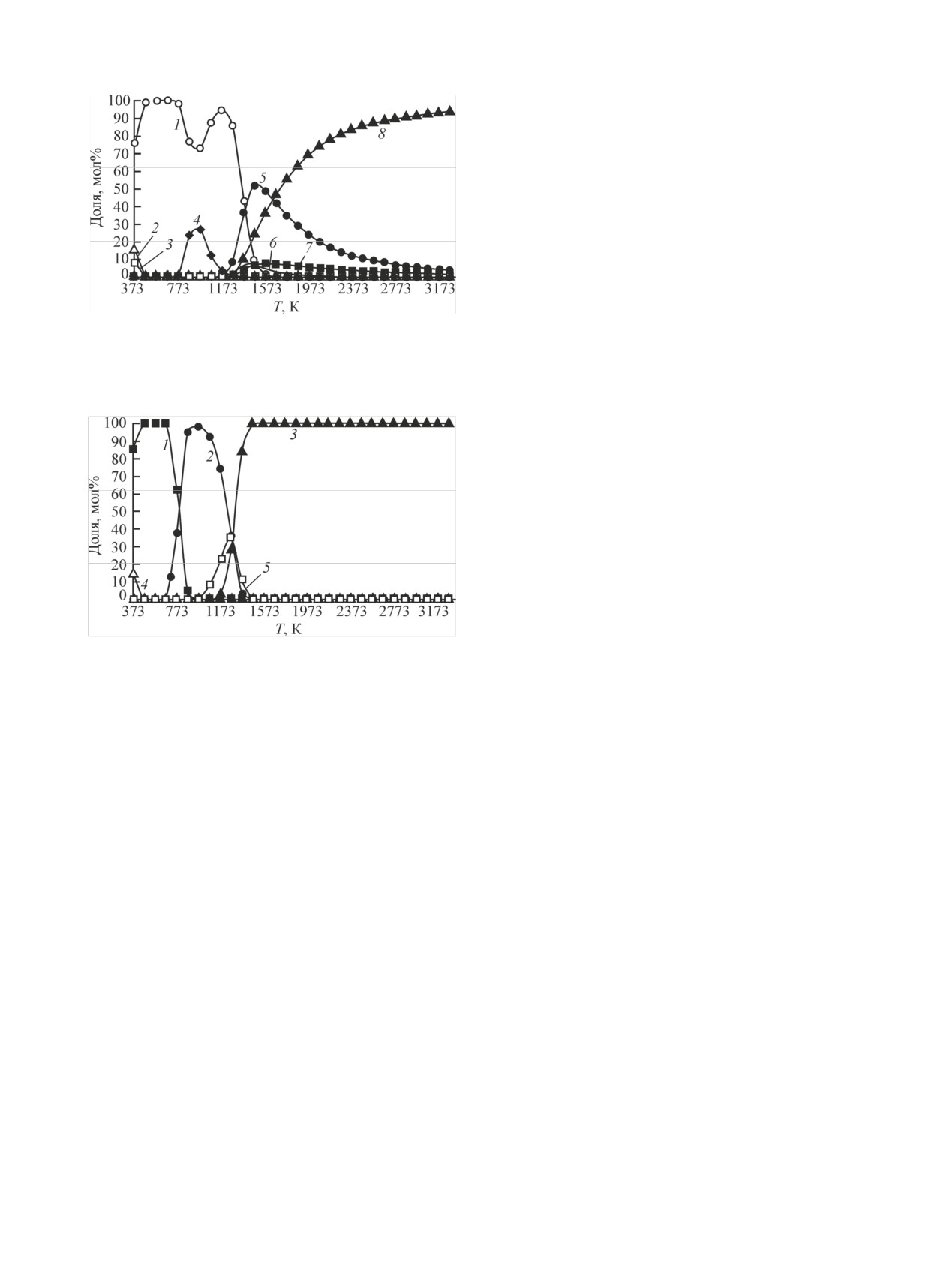
Распределение никеля по фазам представлено
на рис. 5. При температуре от 373 до 573 К содер-
жание конденсированных Ni(OH)2, NiCO3 умень-
шается до нуля, а конденсированного NiO - увели-
Рис. 3. Распределение Ca по фазам: 1 - CaCO3(к), 2 - CaUO4(к),
3 - CaO(к), 4 - Ca(OH)2(г), 5 - CaOH+, 6 - CaOH(г), 7 - Ca(г),
чивается до ~100 мол% по реакциям (24), (25). В
8 - Ca+.
области температур от 673 до 973 К содержание
конденсированного NiO уменьшается до ~73 мол%,
а конденсированного Ni3C
- увеличивается до
~27 мол% в соответствии с реакцией (26). В интер-
вале температур от 973 до 1173 К содержание кон-
денсированного Ni3C уменьшается до ~5 мол%, а
конденсированного NiO
- увеличивается до
~95 мол% согласно реакции (27). При температуре
от 1173 до 1373 К уменьшается содержание кон-
денсированного Ni3C до нуля и увеличивается со-
держание газообразного NiH до ~36 мол% по реак-
ции (28). В интервале температур от 1173 до 1473 К
уменьшается содержание конденсированного NiO
до ~10 мол% и увеличивается содержание газооб-
Рис. 4. Распределение Be по фазам: 1 - BeO(к), 2 - Be(OH)2(к),
разного Ni(OH)2 до ~7 мол% согласно реакции (29).
3 - Be(OH)2(г), 4 - BeOH(г), 5 - Be(г), 6 - BeO(г)
В диапазоне температур от 1273 до 1473 К уве-
личивается содержание газообразных NiH до
образного Ca(OH)2 - увеличивается до ~80 мол%
~52 мол%, NiOH до ~7 мол% в соответствии с ре-
по реакции (12). Конденсированные CaO, CaUO4
акциями (30), (31). В области температур от 1273
исчезают при температуре ~1973 К. В интервале
до 1673 К уменьшается содержание конденсиро-
температур от 1973 до 3073 К содержание газооб-
ванного NiO до нуля и увеличивается содержание
разного Ca(OH)2 уменьшается до ~12 мол% и уве-
газообразного Ni до ~47 мол% по реакции (32).
личивается содержание ионизированного CaOH+ до
При температуре от 1473 до 2173 К в газовой фазе
~57, газообразного CaOH - до ~12 мол% в соответ-
содержание газообразного Ni(OH)2 уменьшается
ствии с реакциями (13), (14). В области температур
до нуля, NiOH - до ~5, NiH - до ~17 мол%, а газо-
от
1973 до
3273 К содержание газообразного
образного Ni - увеличивается до ~78 мол% соглас-
146
Н. М. Барбин и др.
ся до ~37 мол%, а газообразного CsOH - увеличи-
вается до ~35 мол% в соответствии с реакцией (39).
Содержание Cs+ увеличивается до ~28 мол%. В ин-
тервале температур от 973 до 1573 К содержание га-
зообразного CsCl уменьшается до нуля, а ионизиро-
ванного Cs+ - увеличивается до ~100 мол% согласно
реакции (40). В диапазоне температур от 1273 до
1573 К содержание газообразного CsOH уменьшается
до нуля в соответствии с реакцией (41). При темпера-
туре от 1573 до 3273 К состав газовой фазы не из-
меняется.
На рис. 1-6 не приведены соединения, присутст-
вующие в равновесной системе в концентрациях
Рис. 5. Распределение Ni по фазам: 1 - NiO(к), 2 - Ni(OH)2(к),
,
3 - NiCO3(к), 4 - Ni3C(к), 5 - NiH(г), 6 - Ni(OH)2(г), 7 - Ni(OH)(г)
менее 10-2 мол%.
8 - Ni(г).
По результатам термодинамического моделиро-
вания были определены основные реакции и их
константы равновесия (табл. 3). Константы равно-
весия представлены аналитическими уравнениями
вида
ln Ki = ai + bi /T.
В работе [4] рассчитанные с использованием
метода термодинамического моделирования кон-
станты реакций испарения UO2 и PuO2 сопоставле-
ны c экспериментальными данными, приведенны-
ми в справочниках. Результаты расчета близки к
экспериментальным данным. Это позволяет пред-
положить, что термодинамическое моделирование
Рис. 6. Распределение Cs по фазам: 1 - CsCl(к), 2 - CsCl(г), 3 -
приемлемо для изучения поведения радионуклидов
Cs+, 4 - Cs2CO3(к), 5 - CsOH(г).
в системе радиоактивный графит-пары воды.
Окисление графита происходит с образованием
но реакции (34). В интервале температур от 1473
CH4 до температуры ~573 К, CO и CO2 до темпера-
до 2573 К уменьшается содержание газообразного
туры ~873 К. При температуре >873 К конденсиро-
NiH до ~9 мол% и увеличивается содержание газо-
ванный графит в системе отсутствует. Обогащен-
образного Ni до ~87 мол% в соответствии с реак-
ная радионуклидами оксидно-солевая конденсиро-
цией (33). В области температур от 1573 до 2573 К
ванная фаза исчезает при температуре ~1973 К.
содержание газообразного NiOH уменьшается до
Определено, что содержащиеся в радиоактивном
~3 мол%, а газообразного Ni - увеличивается до
графите в виде примесей Cl и Cs начинают перехо-
~87 мол% в соответствии с реакцией (35). В интер-
дить в газовую фазу при температуре ~573 К, Be -
вале температур от 2573 до 3273 К содержание га-
при ~ 973 К, Ni - при ~1173 К, Ca - при ~1373 К.
зообразных NiH и NiOH уменьшается до ~4 и
~2 мол% соответственно, а газообразного Ni - уве-
Список литературы
личивается до ~94 мол% по реакциям (36), (37).
[1] Скачек М. А. Радиоактивные компоненты АЭС: обраще-
Распределение Cs по фазам показано на рис. 6.
ние, переработка, локализация: учеб. пособие для вузов.
В области температур от 373 до 473 К содержание
М.: МЭИ, 2014.
[2] Кондиционирование реакторного графита выводимых из
конденсированного Cs2CO3 уменьшается до нуля,
эксплуатации уран-графитовых реакторов для целей захоро-
а конденсированного CsCl
- увеличивается до
~100 мол%. В интервале температур от 473 до 573 К
articles/2016/06/08/66585 (дата обращения 14.05.2018).
цезий находится в виде конденсированного CsCl.
[3] Цыганов А. А., Хвостов В. И., Комаров Е. А. и др. // Изв.
При температуре от 573 до 973 К содержание кон-
Томского политех. ун-та. 2007. Т. 310, N 2. С. 94-98.
[4] Барбин Н. М., Кобелев А. М., Терентьев Д. И., Алексе-
денсированного CsCl уменьшается до нуля, а газо-
ев С. Г. //Радиохимия. 2017. Т. 59, N 5. С. 445-448.
образного CsCl - увеличивается до ~100 мол% по
[5] Белов Г. В., Трусов Б. Г. Термодинамическое моделирова-
реакции (38). В интервале температур от 973 до
ние химически реагирующих систем. М.: МГТУ им. Н. Э. Ба-
1273 К содержание газообразного CsCl уменьшает-
умана, 2013.
Термодинамическое моделирование термических процессов
147
[6] Барбин Н. М., Кобелев А. М., Терентьев Д. И., Алексе-
[11] Барбин Н. М., Шавалеев М. Р., Терентьев Д. И., Алексе-
ев С. Г. // Изв.вузов. Химия и хим. технология. 2016.
ев С. Г. // Прикл. физика. 2015. N 6. С. 42-48.
Т. 59, N 9. С. 16-20.
[12] Ватолин Н. А., Моисеев Г. К., Трусов Б. Г. Термодинами-
[7] Barbin N., Kobelev A., Terent’ev D., Alekseev S. MATEC
ческое моделирование в высокотемпературных неоргани-
Web of Conf. 2017. Vol. 115. Paper 04005. DOI: 10.1051/
ческих системах. М.: Металлургия, 1994.
matec-conf/20171150400.
[13] Роменков А. А., Туктаров М. А., Карлина О. К. и др.
[8] Кобелев А. М., Барбин Н. М., Терентьев Д. И., Алексе-
Опытная установка для окисления графитовых РАО в
ев С. Г. // Всерос. конф. «XXXI Сибирский теплофизиче-
расплаве солей: результаты испытаний // Годовой отчет
ский семинар». Новосибирск: Ин-т теплофизики СО РАН
НИКИЭТ. М., 2010. С. 171-173.
им. С. С. Кутателадзе, 2014. С. 525-527.
[14] Шидловский В. В., Роменков А. А., Хаттарова Е. А. и др.
[9] Барбин Н. М., Кобелев А. М., Терентьев Д. И., Алексе-
ев С. Г. // IX семинар вузов по теплофизике и энергетике.
Анализ радиационной опасности графитовых кладок ос-
Казань: КГЭУ, 2015. С. 71-78.
тановленных промышленных уран-графитовых реакторов
[10] Барбин Н. М., Овчинникова И. В., Терентьев Д. И., Алек-
ФГУП «ПО «Маяк» // Годовой отчет НИКИЭТ. М., 2010.
сеев С. Г. // Прикладная физика. 2014. N 3. С. 8-12.
С. 178-180.