Радиохимия, 2019, т. 61, N 2, c. 117-121
117
Экстракция РЗЭ(III), U(VI) и Th(IV) диоксидом тетрафенил(о-окси-
фениленметилен)дифосфина из перхлоратных растворов
© А. Н. Туранов*а, В. К. Карандашевб,в, В. Е. Баулинг,д, Д. В. Баулинд
а Институт физики твердого тела РАН, 142432, Черноголовка Московской обл., ул. Акад. Осипьяна, д. 2;
* e-mail: turanov@issp.ac.ru
б Институт проблем технологии микроэлектроники и особо чистых материалов РАН,
142432, Черноголовка Московской обл., ул. Академика Осипьяна, д. 6
в Национальный исследовательский технологический университет «МИСиС», 119991, Москва, Ленинский пр., д. 4
г Институт физиологически активных веществ РАН, 142432, Черноголовка Московской обл., Северный проезд, д. 1
д Институт физической химии и электрохимии им. А. Н. Фрумкина РАН, 119991, Москва, Ленинский пр., д. 31, корп. 4
Получена 17.04.2018, после доработки 22.05.2018, принята к публикации 23.05.2018
УДК 542.61:546.65/66
Изучена экстракция микроколичеств РЗЭ(III), U(VI) и Th(IV) из перхлоратных растворов раствора-
ми диоксида тетрафенил(о-оксифениленметилен)дифосфина (I) в 1,2-дихлорэтане. Определена стехио-
метрия экстрагируемых комплексов, рассмотрено влияние состава водной фазы на эффективность и
селективность извлечения U(VI), Th(IV) и РЗЭ(III) в органическую фазу. Показано, что при переходе от
азотнокислых к хлорнокислым средам эффективность экстракции РЗЭ(III), U(VI) и Th(IV) растворами
соединения I значительно снижается. При этом возрастает селективность разделения U(VI) и РЗЭ(III).
Ключевые слова: экстракция, уран(VI), торий(IV), редкоземельные элементы(III), диоксид тетрафе-
нил(о-оксифениленметилен)дифосфина.
DOI: 10.1134/S0033831119020047
Бидентатные нейтральные фосфорорганические
сти соответствующих фосфорилсодержащих по-
соединения (БНФОС), такие как диоксиды заме-
дандов по отношению к РЗЭ(III) [12]. Особенно
щенных алкилендифосфинов (ДОДФ) и оксиды ди-
высокой экстракционной способностью по отноше-
арил(диалкилкарбамоилметил)фосфинов (КМФО),
нию к РЗЭ(III) и Am(III) обладают диоксиды о-ок-
обладают высокой экстракционной способностью
сифениленметилендифосфинов [13-16]. Арилзаме-
по отношению к актинидам и редкоземельным эле-
щенные диоксиды о-оксифениленметилендифос-
ментам (РЗЭ) в азотнокислых средах и использу-
финов по эффективности экстракции РЗЭ(III) и
ются для их концентрирования и разделения в экс-
Am(III) из азотнокислых растворов значительно
тракционных [1-3] и сорбционных системах [4].
превосходят КМФО [17].
Эффективность экстракции актинидов и РЗЭ этими
Было показано, что при переходе от азотнокис-
соединениями из азотнокислых растворов значи-
лых к хлорнокислым средам экстракция
тельно увеличивается при замене в молекуле экст-
U(VI), Am(III) и РЗЭ(III) диоксидами тетраалкил-
рагента алкильных радикалов при одном или двух
[18] и тетрафенилметилендифосфинов [19], КМФО
атомах фосфора на арильные. Причины такого яв-
[20, 21], другими БНФОС [22], а также замещенны-
ления, известного как эффект аномального ариль-
ми дигликольамидами [22, 23] значительно возрас-
ного упрочнения экстрагируемых комплексов
тает. Возможные причины такого «перхлоратного»
(ЭААУ) [5], неоднократно обсуждались в литера-
эффекта обсуждались в ряде работ [19, 25, 26].
туре [5-10]. Увеличение длины алкиленового мос-
Этот эффект использован для увеличения эффек-
тика в молекулах диоксидов тетрафенилалкиленди-
тивности концентрирования U(VI), Am(III) и
фосфинов сопровождается снижением их экстрак-
РЗЭ(III) из растворов азотной и фосфорной кислот
ционной способности по отношению к Am(III) и
при добавке небольших количеств HClO4 или
легким РЗЭ(III) [5], а также изменением порядка
перхлоратов щелочных металлов в водную фазу
экстрагируемости в ряду РЗЭ(III), что приводит к
[20, 21].
изменению внутригрупповой селективности этих
Влияние строения БНФОС на величину
реагентов [11]. В ряде случаев замена алкиленово-
«перхлоратного» эффекта рассмотрено в работах
го мостика в молекулах диоксидов тетрафенилал-
[26, 27]. Исследованию влияния иона ClO4- на эф-
килендифосфинов на этиленгликолевые фрагменты
фективность и селективность фосфорилсодержа-
приводит к повышению экстракционной способно-
щих подандов (ФСП) уделялось меньше внимания.
118
А. Н. Туранов и др.
С целью выяснения влияния иона ClO– на эффек-
нием спектрофотометра UNICO 1201 (United Prod-
тивность и селективность экстракции ионов метал-
ucts & Instruments, США). Параллельно определяли
лов в настоящей работе рассмотрены некоторые за-
содержание HClO4 в органической фазе при экс-
кономерности распределения ионов U(VI), Th(IV)
тракции чистым дихлорэтаном (холостой опыт).
и РЗЭ(III) между водными растворами HClO4 и
Результаты холостого опыта учитывали при расче-
NH4ClO4 и растворами соединений I и II в
те общей концентрации комплексов экстрагентов с
1,2-дихлорэтане.
HClO4 в органической фазе.
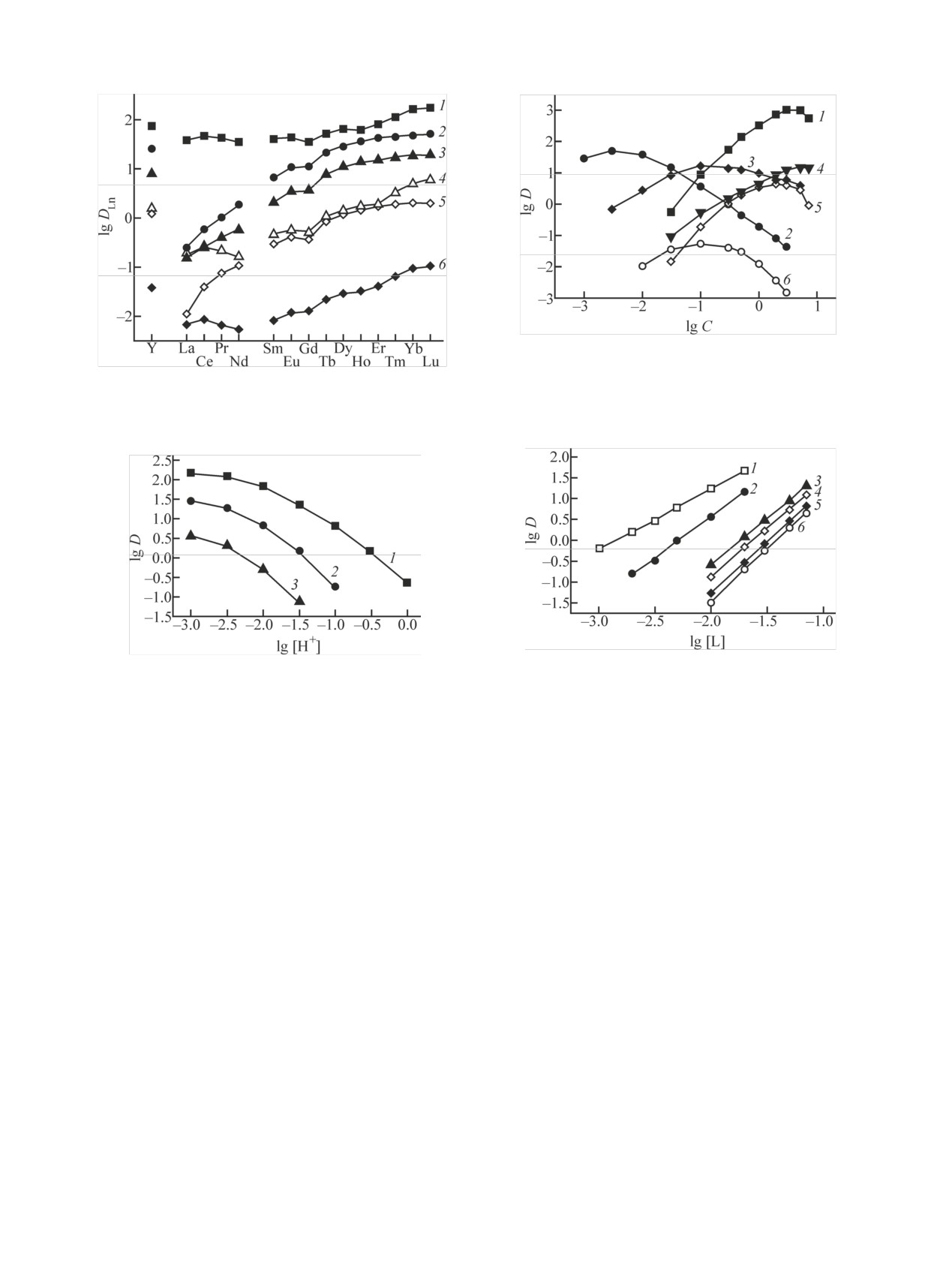
Результаты и обсуждение
Сопоставление эффективности экстракции
РЗЭ(III) соединениями I и II в перхлоратных и нит-
ратных средах показало (рис. 1), что соединение I
по эффективности экстракции РЗЭ(III) из ней-
тральных перхлоратных и нитратных растворов
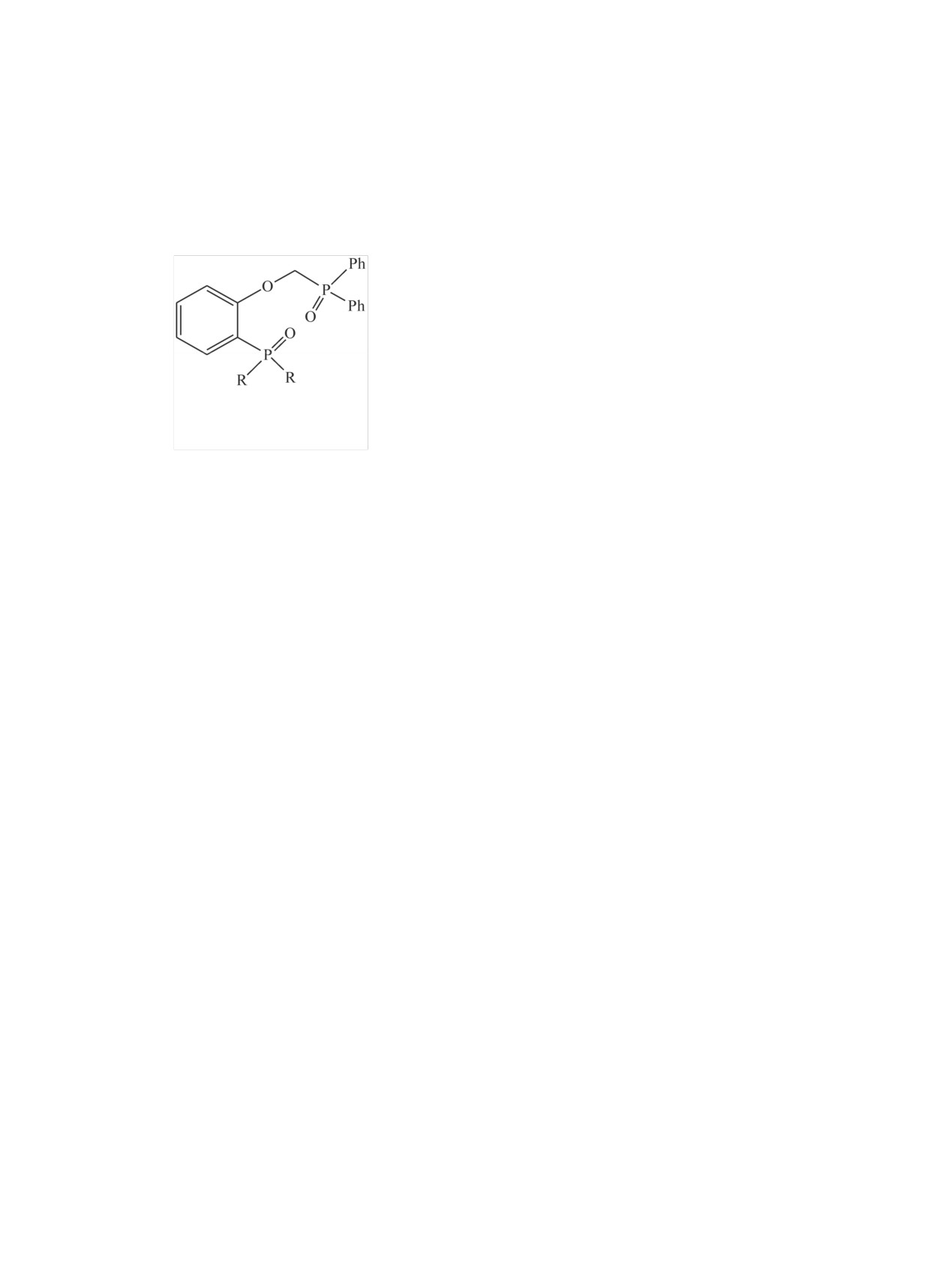
I, II
значительно превосходит соединение II с бутиль-
ными заместителями при атоме фосфора, что сви-
I, R = Ph; II, R = Bu
детельствует о проявлении ЭААУ в таких систе-
мах. РЗЭ(III) экстрагируются соединениями I и II
из нейтральных растворов NH4ClO4 с более высо-
Экспериментальная часть
кими значениями DLn, чем из растворов NH4NO3
Синтез соединений I и II описан ранее [28, 29].
(рис. 1). «Перхлоратный» эффект, величину кото-
В качестве органического растворителя использо-
рого обычно выражают как отношение коэффици-
вали 1,2-дихлорэтан х.ч. без дополнительной очи-
ентов распределения ионов при экстракции из рас-
стки. Растворы экстрагентов готовили по точной
творов, содержащих ионы ClO– и NO–, в сопостави-
навеске.
мых условиях, K(ClO–/NO–) = DLn(ClO–)/DLn(NO–),
проявляется наиболее заметно при экстракции лег-
Исходные водные растворы U(VI), Th(IV) и
ких РЗЭ(III) соединением I. В ряду РЗЭ(III) значе-
РЗЭ(III) готовили растворением соответствующих
ния K(ClO–/NO–) уменьшаются от 155 для La(III)
перхлоратов в воде с последующим добавлением
до 1.6 для Ho(III) с увеличением атомного номера
HClO4 или NH4ClO4. Исходная концентрация ионов
(Z) РЗЭ, а затем незначительно возрастают до 3.5
металлов составляла 2·10-6 моль/л. Контакт фаз
при экстракции Lu(III). При экстракции РЗЭ(III)
осуществляли при комнатной температуре на аппа-
соединением II из нейтральных растворов «пер-
рате для перемешивания со скоростью 60 об/мин в
хлоратный» эффект проявляется в меньшей степе-
течение 1 ч, что достаточно для установления по-
ни, чем при экстракции соединением I (рис. 1).
стоянных значений коэффициентов распределения.
Увеличение концентрации ионов H+ в водной
Концентрацию РЗЭ(III), U(VI) и Th(IV) в исход-
фазе сопровождается снижением DLn при экстрак-
ных и равновесных водных растворах определяли
ции РЗЭ(III) соединением I из нитратных и перхло-
методом масс-спектрометрии с ионизацией пробы
ратных растворов (рис. 1). Особенно это заметно в
в индуктивно связанной плазме (ИСП-МС) с ис-
перхлоратных средах, когда значения DLn при экс-
пользованием масс-спектрометра X-7 (Thermo Ele-
тракции из раствора 1 моль/л HClO4 более чем на
mental, США) по ранее описанной методике [30].
3 порядка ниже, чем при экстракции из раствора
Содержание элементов в органической фазе опре-
1 моль/л NH4ClO4. Еще более значительное сниже-
деляли после реэкстракции раствором 0.1 моль/л
ние DLn отмечено при экстракции РЗЭ(III) соедине-
оксиэтилидендифосфоновой кислоты. Коэффици-
нием II из раствора 1 моль/л HClO4 (DLn < 1·10-3).
енты распределения элементов (D) рассчитывали
как отношение их концентраций в равновесных
Рассмотрено влияние концентрации HClO4 в
органической и водной фазах. Погрешность опре-
равновесной водной фазе на коэффициенты рас-
деления коэффициентов распределения не превы-
пределения U(VI), Th(IV) и Eu(III) при экстракции
шала 5%. Концентрацию HClO4 в равновесной вод-
раствором соединения I в дихлорэтане (рис. 2). Для
ной фазе определяли потенциометрическим титро-
сравнения приведены также данные по экстракции
ванием стандартным раствором NaOH. Концентра-
этих ионов из растворов HNO3 этим реагентом [13,
цию ионов ClO4- в органической фазе определяли
32]. Зависимости D-[HClO4] проходят через макси-
экстракционно-фотометрическим методом с мети-
мумы при [HClO4] = 0.003, 0.1 и 0.3 моль/л при экс-
леновым синим при λ = 655 нм [31] с использова-
тракции Th(IV), Eu(III) и U(VI) соответственно.
Экстракция РЗЭ(III), U(VI) и Th(IV) диоксидом тетрафенил(о-оксифениленметилен)дифосфина
119
Рис. 2. Зависимость коэффициентов распределения Th(IV) (1,
2), U(VI) (3, 4) и Eu(III) (5, 6) от концентрации HClO4 (2, 3, 6) и
Рис. 1. Экстракция РЗЭ(III) растворами 0.01 моль/л соедине-
HNO3 (1, 4, 5) [13, 32] в водной фазе при экстракции раствора-
ний I (1-3, 6) и II (4, 5) в дихлорэтане из растворов 1 моль/л
ми 0.01 моль/л соединения I в дихлорэтане.
NH4ClO4 (1, 4), 1 моль/л NH4NO3 (2, 5), 1 моль/л HNO3 (3) и
1 моль/л HClO4 (6).
Рис. 3. Зависимость коэффициентов распределения U(VI) (1),
Рис.
4. Зависимость коэффициентов распределения U (1),
Th(IV) (2) и Eu(III) (3) от концентрации H+ в водной фазе при
Th (2), Lu (3), Tm (4), Eu(5) и La (6) от концентрации соедине-
постоянной концентрации ионов ClO4-. Концентрация соеди-
ния I в дихлорэтане при экстракции из растворов 0.1 моль/л
нения I в дихлорэтане, моль/л: 0.001 (1, 2), 0.005 (3).
HClO4.
Такой характер зависимости D-[HClO4] соответст-
моно- и дисольватов, а РЗЭ(III) - в виде дисольва-
вует экстракции ионов металлов в виде координа-
тов. Различие в стехиометрии комплексов, экстра-
ционно сольватированных перхлоратов и связан с
гируемых из растворов HClO4 и HNO3, связано со
высаливающим действием ионов ClO– и связыва-
слабой координирующей способностью ионов
нием экстрагента хлорной кислотой. Увеличение
ClO–, что исключает их непосредственную коорди-
кислотности водной фазы при постоянной концен-
нацию с ионами экстрагируемых металлов. Это
трации в ней ионов ClO– приводит к снижению
приводит к повышению стехиометрического соот-
экстракции U(VI), Th(IV) и Eu(III) соединениями I
ношения металл : экстрагент и гидрофобности экс-
и II (рис. 3), что связано со снижением концентра-
трагируемых комплексов, положительно влияюще-
ции свободного экстрагента в органической фазе
му на их переход в органическую фазу.
вследствие взаимодействия его с HClO4.
Межфазное распределение ионов металлов при
Стехиометрическое соотношение металл : экст-
их экстракции соединением I (L) из растворов
рагент в экстрагируемых комплексах определено
HClO4 может быть описано уравнением
методом сдвига равновесия. Полученные данные
Mn+ + nClO– + sL(o) ⇄ MLs(ClO4)n(o),
(1)
(рис. 4) показали, что соединение I в дихлорэтане
экстрагирует U(VI) из растворов HClO4 в виде мо-
где символом (о) обозначены компоненты органи-
но- и дисольватов, Th(IV) - в основном в форме
ческой фазы, s - стехиометрическое соотношение
дисольватов, а РЗЭ(III) - в виде ди- и трисольва-
Mn+ : L в экстрагируемом комплексе. Зависимость
тов. В предыдущих работах [13, 32] было показано,
коэффициентов распределения ионов металлов от
что из азотнокислых растворов соединение I в ди-
концентрации компонентов органической и водной
хлорэтане экстрагирует U(VI) и Th(IV) в форме
фаз может быть выражена как
120
А. Н. Туранов и др.
DM = Ks[ClO4-]n[L]s(1 + K(HClO4)[H+][ClO4-])-s,
(2)
где Ks и K(HClO4) - константы экстракции иона
металла и HClO4 соответственно.
Константы экстракции хлорной кислоты соеди-
нениями I и II в виде моносольватов LHClO4 (без
учета их гидратации в органической фазе) опреде-
ляли, исходя из данных по распределению HClO4
между фазами (рис. 5), используя соотношение
y = K(HClO4)([L]0 - y)([HClO4]0 - y)2γ2,
(3)
Рис. 5. Экстракция HClO4 растворами 0.005 моль/л соедине-
ний I и II в дихлорэтане.
где y - равновесная концентрация ионов ClO– в ор-
ганической фазе, [L]0 и [HClO4]0 - исходные кон-
лический комплекс, в котором осуществляется коо-
центрации экстрагента и хлорной кислоты, γ± - ко-
перативное взаимодействие донорных центров ор-
эффициент активности хлорной кислоты в водной
ганического реагента с катионом (H3O)+ [28]. Экс-
фазе. Полученные значения K(HClO4) (96 ± 5 и
тракционная способность таких протонированных
370 ± 25 для соединений I и II соответственно) зна-
комплексов, образуемых соединением I, по отно-
чительно выше констант экстракции HNO3 этими
шению к анионам кислот возрастает в ряду NO3- <
соединениями (2.7 и 8.03 [13]), что указывает на
ClO4- < ReO4- по мере увеличения их гидрофобно-
более эффективную экстракцию HClO4 соединени-
сти [34]. Отметим, что экстракционная способ-
ем I по сравнению с HNO3.
ность соединения I по отношению к HClO4 значи-
тельно превышает таковую оксида дифенил(дибу-
При сопоставлении зависимостей D-[HClO4] и
тилкарбамоилметил)фосфина (КМФО Ph2Bu2): при
D-[HNO3] (рис. 2) видно, что соединение I экстра-
равной кислотности водной фазы концентрация
гирует U(VI), Th(IV) и Eu(III) более эффективно из
HClO4 в равновесной органической фазе, содержа-
растворов HClO4 только в области низкой кислот-
щей соединение I, существенно выше, чем при экс-
ности водной фазы. По мере увеличения концен-
тракции растворами КМФО Ph2Bu2 [21, 35]. Сопос-
трации кислот «перхлоратный» эффект проявляет-
тавление данных по экстракции Eu(III) растворами
ся в меньшей степени. Уже при концентрациях ки-
0.01 моль/л соединения I и КМФО Ph2Bu2 в дихло-
слот выше 0.05, 0.08 и 1.8 моль/л ионы Th(IV),
рэтане из растворов 3 моль/л HNO3 и HClO4 пока-
Eu(III) и U(VI) экстрагируются соединением I из
зало, что соединение I экстрагирует Eu(III) из азот-
растворов HClO4 менее эффективно, чем из раство-
нокислых растворов значительно более эффектив-
ров HNO3 (рис. 2). При экстракции U(VI), Eu(III) и
но, чем КМФО Ph2Bu2, однако практически не из-
Th(IV) из растворов 3 моль/л HClO4 наблюдается
влекает его из раствора HClO4:
снижение DU в 2 раза, а DEu и DTh - более чем на 3
и 4 порядка по сравнению с величинами D при экс-
Экстрагент lgDEu(HNO3) lgDEu(HClO4) lgK(ClO–/NO–)
тракции из растворов 3 моль/л HNO3. Можно отме-
I
0.63 [13]
-2.85
-3.48
Ph2Bu2
-1.70 [17]
3.75
5.5
тить, что при переходе от азотнокислых растворов
к хлорнокислым значительно возрастает селектив-
Резкое различие в экстракционном поведении
ность экстракции U(VI) и Eu(III): значения фактора
соединений I и КМФО Ph2Bu2 в растворах HClO4
разделения (βU/Eu = DU/DEu) при экстракции из рас-
может быть связано с более высокой устойчиво-
творов 3 моль/л HNO3 и HClO4 составляют 2.3 и
стью протонированного комплекса, образуемого
4170 соответственно. Напротив, при экстракции
соединением I, приводящей к более заметному
растворами КМФО [33] или фосфорилзамещенных
снижению DEu в результате соэкстракции HClO4
бутилфенилфосфинатов [22] значения βU/Eu заметно
[уравнение (2)]. Отмечалось, что изменение струк-
уменьшаются при переходе от азотнокислых к
туры БНФОС, например, при замене фенильных
хлорнокислым растворам.
радикалов в молекуле диоксида тетрафенилмети-
Одной из возможных причин полного исчезно-
лендифосфина или КМФО Ph2Bu2 на алкильные, а
вения «перхлоратного» эффекта при экстракции
также при увеличении длины алкиленового мости-
ионов металлов из растворов HClO4 в системах с
ка между группами Р(О) молекулы ДОДФ, приво-
соединением I может быть его высокая экстракци-
дящее к увеличению основности реагента [6], спо-
онная способность по отношению к HClO4. Это
собствует повышению экстракции HNO3 и HClO4
связано с возможностью гибкой молекулы ФСП
[6, 21]. Это приводит, помимо уменьшения значе-
образовывать протонированный псевдомакроцик-
ний DLn в хлорнокислых средах, к значительному
Экстракция РЗЭ(III), U(VI) и Th(IV) диоксидом тетрафенил(о-оксифениленметилен)дифосфина
121
снижению величины «перхлоратного» эффекта [26,
Solvent Extr. Ion Exch. 2009. Vol. 27, N 4. P. 551-578.
[12] Туранов А. Н., Карандашев В. К., Баулин В. Е. // ЖНХ.
27].
2006. Т. 51, N 11. С. 1942-1948.
Представленные данные показали, что эффек-
[13] Туранов А. Н., Карандашев В. К., Евсеева Н. К. и др. //
Радиохимия. 1999. Т. 41, N 3. С. 219-224.
тивность экстракции РЗЭ(III), U(VI) и Th(IV) рас-
[14] Turanov A. N., Karandashev V. K., Baulin V. E. et al. //
творами диоксида тетрафенил(о-оксифениленмети-
Solvent Extr. Ion Exch. 2009. Vol. 27, N 4. P. 551-578.
лен)дифосфина в дихлорэтане значительно снижа-
[15] Туранов А. Н., Карандашев В. К., Баулин В. Е. // Радиохи-
ется при переходе от азотнокислых к хлорнокис-
мия. 2001. Т. 43, N 1. С. 66-71.
лым средам, что связано с высокой экстракцион-
[16] Туранов А. Н., Карандашев В. К., Федосеев А. М. и др. //
Радиохимия. 2005. Т. 47, N 2. С. 158-161.
ной способностью этого соединения по отношению
[17] Туранов А. Н., Карандашев В. К., Баулин В. Е. и др. //
к HClO4.
ЖНХ. 2015. Т. 60, N 8. С. 1117-1123.
[18] Mrochek J. E., Banks C. V. // J. Inorg. Nucl. Chem. 1965. Vol.
Работа выполнена в рамках Государственного
27. P. 589-601.
задания ИФТТ РАН, ИПТМ РАН, ИФАВ РАН и
[19] Розен А. М., Николотова З. И., Карташева Н. А., Больша-
ИФХЭ РАН при частичной финансовой поддержке
кова А. С. // Радиохимия. 1978. Т. 20, N 5. С. 725-734.
РФФИ (грант N 18-29-24069) и Министерства об-
[20] Чмутова М. К., Юссонуа М., Литвина М. Н. и др. // Ра-
разования и науки РФ по программе повышения
диохимия. 1990. Т. 32, N 4. С. 56-61.
[21] Чмутова М. К., Литвина М. Н., Нестерова Н. П. и др. //
конкурентоспособности НИТУ
«МИСиС» среди
Радиохимия. 1990. Т. 32, N 5. С. 88-95.
ведущих мировых научно-образовательных цен-
[22] Туранов А. Н., Карандашев В. К., Яркевич А. Н., Сафроно-
тров на 2013-2020 гг. (N К2-2016-070).
ва З. В. // Радиохимия. 2011. Т. 53, N 3. С. 225-228.
[23] Tachimori S., Sasaki Y., Suzuki S. // Solvent Extr. Ion Exch.
2002. Vol. 20. P. 687-699.
Список литературы
[24] Turanov A. N., Karandashev V. K., Baulin V. E. // Solvent
[1] Розен А. М., Волк В. И., Вахрушин А. Ю. и др. // Радиохи-
Extr. Ion Exch. 2008. Vol. 26, P. 77-99.
мия. 1999. Т. 41, N 3. С. 205-211.
[25] Nash K. // Sep. Sci. Technol. 1999. Vol. 34. P. 911-929.
[2] Чмутова М. К., Литвина М. Н., Прибылова Г. А. и др. //
[26] Смирнов И. В. // Радиохимия. 2007. Т. 49, N 1. С. 40-49.
Радиохимия. 1999. Т. 41, N 4. С. 331-335.
[27] Smirnov I. V., Babain V. A., Shadrin A. Yu. et al. // Solvent
[3] Мастрюкова Т. А., Артюшин О. И., Одинец И. Л., Танана-
Extr. Ion Exch. 2005. Vol. 23. P. 1-21.
ев И. Г. // Рос. хим. журн. 2005. Т. 49, N 2. С. 86-96.
[28] Туранов А. Н., Баулин В. Е., Харитонов А. В., Цвет-
[4] Мясоедова Г. В. // Рос. хим. журн. 2005. Т. 49, N 2. С. 72-
ков Е. Н. // ЖНХ. 1994. Т. 39, N 8. С. 1394-1399.
75.
[29] Цветков Е. Н., Евреинов В. И., Баулин В. Е. и др. // ЖОХ.
[5] Розен А. М., Николотова З. И., Карташева Н. А., Юди-
1995. Т. 65, N 9. С. 1421-1431.
на К. С. // ДАН СССР. 1975. Т. 222, N 5. С. 1151-1154.
[30] Туранов А. Н., Карандашев В. К., Баулин В. Е., Цвет-
[6] Розен А. М., Николотова З. И., Карташева Н. А. // Радио-
ков Е. Н. // ЖНХ. 1995. Т. 40, N 11. С. 1926-1930.
химия. 1986. Т. 28, N 3. С. 407-432.
[31] Хольцбехер З., Дивиш Л., Крал М. и др. Органические реа-
[7] Розен А. М., Крупнов Б. В. // Успехи химии. 1996. Т. 65,
генты в неорганическом анализе. М.: Мир, 1979. 752 с.
N 11. С. 1052-1079.
[32] Туранов А. Н., Карандашев В. К., Баулин В. Е. // Радиохи-
[8] Кабачник М. И., Мясоедов Б. Ф., Мастрюкова Т. А.
мия. 1998. Т. 40, N 1. С. 36-43.
и др. // Изв. АН. Сер. хим. 1996. N 11. С. 2624-2529.
[33] Литвина М. Н., Чмутова М. К., Нестерова Н. П., Мясо-
[9] Цветков Е. Н., Евреинов В. И., Бондаренко Н. А., Сафро-
едов Б. Ф. // Радиохимия. 1993. Т. 35, N 6. С. 79-84.
нова З. В. // ЖОХ. 1996. Т. 66, N 7. С. 1081-1092.
[34] Туранов А. Н., Карандашев В. К., Баулин В. Е., Цивад-
[10] Сударушкин С. К., Моргалюк В. П., Тананаев И. Г. и др. //
зе А. Ю. // ЖНХ. 2014. Т. 59, N 8. С. 1116-1121.
Изв. АН. Сер. хим. 2006. N 4. С. 609-615.
[35] Стоянов Е. С., Воробьева Т. П., Смирнов И. В. // ЖСХ.
[11] Turanov A. N., Karandashev V. K., Baulin V. E. et al. //
2003. Т. 44, N 3. С. 414-424.