108
Радиохимия, 2019, т. 61, N 2, c. 108-116
Газофазное объемное окисление мононитрида урана
© С. А. Кулюхин*а, Ю. М. Неволинб, А. В. Гордеева, А. А. Бессонова
а Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4; * e-mail: kulyukhin@ipc.rssi.ru
б Кафедра радиохимии химического факультета Московского государственного университета
им. М. В. Ломоносова, 119991, Москва, Ленинские горы, 1, стр. 10
Получена 12.03.2018, после доработки 17.04.2018, принята к публикации 24.04.2018
УДК 546.799+546.65+ 621.039.72
Исследовано газофазное объемное окисление (волоксидация) UN в различных атмосферах. Показа-
но, что окисление компактных образцов UN в условиях, характерных для волоксидации оксидного топ-
лива, приводит к образованию оксидов урана. Использование кислородсодержащей атмосферы приво-
дит к преимущественному образованию U3O8, а паров воды - к образованию UO2. Основным газообраз-
ным продуктом конверсии, содержащим азот, по-видимому, является N2. Использование альтернатив-
ной окислительной атмосферы на основе NOx-газов позволяет проводить конверсию при более низкой
температуре. При этом образуются как UO3, так и гидраты UO2(NO3)2. Максимальная степень конвер-
сии UN в водорастворимые соединения, равная ~80%, достигается при температуре процесса ~565 К.
Ключевые слова: мононитрид урана, газофазное объемное окисление, рентгенофазовый анализ,
термогравиметрический анализ, ИК спектроскопия.
DOI: 10.1134/S0033831119020035
Одной из перспективных модификаций голов-
стик нитрида и состава используемых атмосфер.
ной операции переработки ОЯТ является объемное
Гидролиз UN также приводит к получению окси-
окисление (волоксидация). В основе волоксидации
дов урана, однако при этом возможно образование
лежит процесс окисления в газовой среде компо-
NH3 и N2 [10, 14]. Состав газовой атмосферы, ис-
нентов топлива и/или оболочек твэлов. При этом из
пользуемой при волоксидации, и исходное состоя-
объема топлива происходит практически полное
ние UN существенным образом влияют на процесс
удаление 3H и радиоактивных благородных газов, а
гидролиза. В работах [16, 18, 22] показано, что
также в зависимости от условий процесса - частич-
присутствие оксидных фаз, высших нитридов и
ное удаление I, Cs и Ru [1-3]. Для конверсии топ-
силицидов в исходном материале существенно
лива предложено использовать воздух, кислород,
влияет на процесс окисления. Кроме того, наличие
пары воды, углекислый газ, NOx-газы и их смеси
тонких оксидных пленок на поверхности UN зна-
[1-4]. Следует отметить, что к настоящему време-
чительно замедляет его окисление и гидролиз [19-
ни процесс волоксидации в основном исследовался
21]. Помимо UN исследовано поведение PuN в ат-
в отношении оксидного топлива [1-4]. С другой
мосфере воздуха. В работах [11, 17] показана высо-
стороны, объемное окисление также может рас-
кая реакционная способность PuN и имитаторов
сматриваться в качестве одного из перспективных
смешанного нитрида урана и плутония (СНУП) в
путей модифицирования головных операций Пу-
кислородсодержащих атмосферах.
рекс-процесса при переработке нитридного топли-
Следует отметить, что все процессы волоксида-
ва. Объемное окисление нитридного ОЯТ позволит
ции оксидного ОЯТ проводили в газовой атмосфе-
не только полностью удалить 3H, но и в дальней-
ре, содержащей значительные количества кислоро-
шем при растворении продуктов волоксидации
да. В данных условиях была велика вероятность
нитридного ОЯТ в HNO3 избежать образования
неконтролируемого горения UN из-за его высокой
труднолокализуемого гемиоксида азота N2O.
пирофорности. Поэтому представляло интерес ис-
В работах [6-22] приведены данные о взаимо-
следовать объемное окисление как в атмосфере
действии UN c кислородом воздуха и парами воды.
водяного пара при практически полном отсутствии
Показано, что окисление UN в кислородсодержа-
кислорода, так и в разреженной воздушной атмо-
щих атмосферах приводит к образованию оксидов
сфере. Кроме того, с учетом данных работы [4]
урана и молекулярного азота. При этом скорость
представляло интерес исследовать возможность
окисления, а также состав образовавшихся продук-
объемного окисления UN в атмосфере NOx-воздух.
тов сильно зависят от поверхностных характери-
Это и составило цель данной работы.
Газофазное объемное окисление мононитрида урана
109
Экспериментальная часть
100
В работе использовали коммерческий таблети-
80
UO2
рованный мононитрид урана, поставленный ВНИ-
UN
ИХТ. В связи с отсутствием спецификации качест-
60
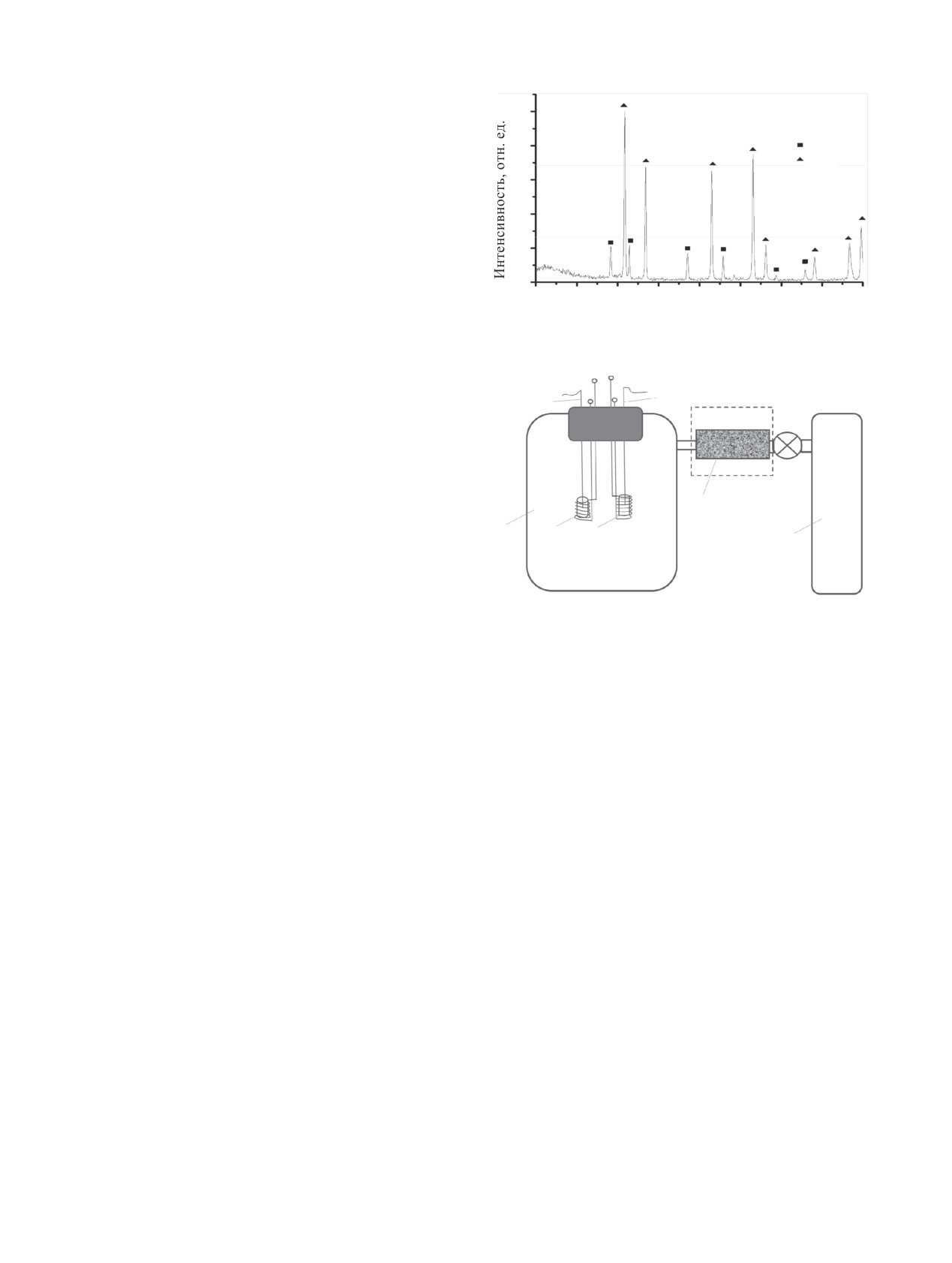
ва продукт проанализировали рентгенофазовым
методом. Дифрактограмма измельченного образца
40
UN представлена на рис. 1. Анализ порошковой
20
дифрактограммы показал наличие в продукте по-
мимо основной фазы UN дифракционно различи-
0
мых количеств примеси UO2.
10
20
30
40
50
60
70
80
90
2θ, град
Азотная кислота, использованная в работе, была
Рис. 1. Порошковая дифрактограмма исходного мононитрида
марки ч. Газообразные NOx получали взаимодейст-
урана UN. Наблюдаемые рефлексы UN [23], UO2 [24].
вием 2 г латуни марки Л68, содержащей 67-70%
Cu и 30-33% Zn, с 10 мл 12 моль/л HNO3.
5
5
Газофазную конверсию UN в атмосфере водяно-
го пара при практически полном отсутствии кисло-
A
рода и в разреженной воздушной атмосфере прово-
дили на установке, схема которой представлена на
рис. 2. Установка состояла из стеклянного реакто-
ра 1 объемом 800 см3 и накопителя 2 объемом
6
1500 см3 для сбора газовой фазы. Реактор плотно
1
3
4
2
закрывался тефлоновой пробкой, в которую были
вмонтированы тоководы для нагревателя контейне-
ра из кварца с образцом UN 3 и для нагревателя
емкости для воды 4, а также термопара 5. Нагрева-
тели для контейнера с образцом UN и емкости для
Рис. 2. Установка для изучения газофазного объемного окис-
воды изготавливали в виде спирали из нихромовой
ления UN в статических условиях. 1 - реактор; 2 - накопитель
проволоки. Помимо ввода для тефлоновой пробки
для сбора газовой фазы; 3 - тоководы для нагревателя контей-
нера из кварца с образцом UN; 4 - тоководы для нагревателя
реактор также имел выход для эвакуации газовой
емкости для воды; 5 - термопара; 6 - колонка с SiO2, прока-
смеси. К этому выходу в ходе опыта подсоединяли
ленным при ~450 К.
накопитель 2. В экспериментах с водяным паром
между реактором 1 и накопителем 2 устанавливали
колонку 6 с SiO2, прокаленным при ~450 К. Это
ровали. Отсоединяли накопитель и доводили дав-
необходимо для того, чтобы препятствовать попа-
ление внутри реактора до атмосферного. Извлека-
данию влаги в газовые кюветы со стеклами из KBr
ли продукты волоксидации UN и проводили их
для ИК спектрометрии.
рентгенофазовый анализ.
Эксперимент проводили следующим образом. В
Помимо проведения экспериментов в атмосфере
контейнер из кварца 3 помещали образец UN. При
водяного пара в статических условиях были прове-
необходимости в емкость 4 наливали рассчитанное
дены эксперименты по волоксидации UN в паро-
количество H2O. Контейнер с образцом UN и ем-
воздушном потоке. Для этой цели использовали
кость с H2O устанавливали в спиральные нагрева-
установку, схема которой представлена на рис. 3.
тели. Реактор плотно закрывали тефлоновой проб-
Установка содержала ротаметр 1, гидрозатвор 2,
кой с установленными емкостями с образцом UN и
реактор 3, шахтную печь 4, барботер с водой 5,
H2O. Воздух из реактора откачивали с помощью
термопару 6, колонку 7 с SiO2, прокаленным при
форвакуумного насоса до р = 0.1 атм, закрывали
~450 К, и накопитель для сбора газовой фазы 8. В
кран А и подсоединяли накопитель 2. Включали
реактор устанавливали контейнер с исследуемым
нагреватели и проводили нагрев емкостей с образ-
образцом UN и подсоединяли к нему с одной сто-
цом UN и H2O до ~675-725 и ~385 К соответствен-
роны барботер 5, а с другой - колонку 7. К колонке
но. Температуру внутри реактора контролировали
подсоединяли накопитель 8 объемом 1500 см3. На-
термопарой 5. Нагревание образца UN проводили в
копитель предварительно вакуумировали. Экспери-
течение 10 мин. После этого нагрев выключали.
мент проводили следующим образом. Устанавли-
Открывали кран А и проводили отбор газовой фазы
вали реактор в шахтную печь и собирали установ-
в накопитель 2, который предварительно вакууми-
ку. Затем включали нагрев и доводили температуру
110
С. А. Кулюхин и др.
водного NOx. Данную атмосферу получали следую-
6
7
2
A
щим образом. Создавали систему из двух эксикато-
ров, соединенных между собой через трубку, за-
полненную SiO2, прокаленным при ~450 К. В пер-
вом эксикаторе создавали атмосферу NOx-H2O
4
(пар)-воздух. Второй эксикатор, содержащий UN,
вакуумировали. Затем оба эксикатора соединяли и
перекачивали NOx из первого эксикатора во второй
1
8
за счет разницы давления. В результате эксикатор с
Воздух
UN заполнялся безводными NOx. Далее эксикатор с
5
3
UN помещали в эксикатор большего размера и про-
водили дальнейший эксперимент по методике,
Рис. 3. Установка для изучения газофазного объемного окис-
представленной в работе [26]. Окисление образцов
ления UN в динамических условиях. 1 - ротаметр; 2 - гидроза-
UN проводили в интервале температур ~403-673 К
твор; 3 - реактор; 4 - шахтная печь; 5 - барботер с водой; 6 -
и времени выдержки 5-10 ч. Конечные продукты
термопара; 7 - колонка с SiO2, прокаленным при ~450 К; 8 -
взвешивали и отбирали навески для рентгенофазо-
накопитель для сбора газовой фазы.
вого анализа. Оставшуюся часть конечного про-
дукта обрабатывали дистиллированной водой. При
в печи до ~675-725 К. После этого открывали кран
неполной конверсии в системе оставался нераство-
А и за счет вакуума в накопителе начинали пропус-
римый в воде осадок, который отделяли от маточ-
кание паровоздушной смеси над образцом UN со
ного раствора центрифугированием. Осадок суши-
скоростью 0.1-0.15 л/мин. Эксперимент проводили
ли до воздушно-сухого состояния и взвешивали. В
в течение 10-15 мин. После этого кран А закрыва-
маточном растворе определяли содержание U(VI).
ли и отсоединяли накопитель. Выключали нагрев.
Зная исходное количество UN и содержание U(VI)
После полного охлаждения вынимали продукты
в растворе, рассчитывали степень конверсии UN в
волоксидации UN и проводили их рентгенофазо-
водорастворимые соединения.
вый анализ.
Количество U(VI) в воде определяли методом
Поскольку вышеописанные установки не позво-
спектрофотометрии. Спектры поглощения растворов
ляли точно ответить на вопрос, образуется ли NН3
UO2+ в воде снимали на спектрофотометре Specord
в процессе волоксидации UN в присутствии водя-
M40 (Carl Zeiss) в кварцевых кюветах с толщиной
ного пара или нет, то для выяснения данного во-
поглощающего слоя 1-5 см. Концентрацию UO2+ рас-
проса были проведены эксперименты по конверсии
считывали по полосе 414 нм [ε = 7.8 л/(моль·см)].
UN в атмосфере H2O (пар)-N2 в сосуде высокого
Порошковые рентгенограммы исходного UN и
давления. В стальной автоклав объемом 130 см3
продуктов его окисления в различных атмосферах
помещали 2 мл воды в пробирке-вкладыше и ком-
получали на дифрактометре ADP-10 (Philips) с из-
пактный образец UN в танталовом тигле. Образец
лучением CuKα.
UN не контактировал с водой. Все операции по
сборке автоклава проводили в боксе, заполненном
ИК спектры газовой фазы измеряли на спектро-
N2 марки х.ч. Автоклав помещали в нагреватель-
метре Specord M 80 (Carl Zeiss). Газовые кюветы
ную печь марки PortLab NF-81 (Япония) с прину-
для ИК спектроскопии с окнами из KBr имели объ-
дительной эвакуацией газовой фазы и проводили
ем 125 см3 и длину поглощающего слоя 100 мм.
нагрев до температуры ~565 К со скоростью 5°С/
Полосы в ИК спектрах идентифицировали по дан-
мин в течение 2 ч. Расчетное давление в автоклаве
ным, приведенным в работах [27, 28].
составляло 41.3 атм. После окончания эксперимен-
Термогравиметрический анализ UN проводили
та автоклав охлаждали, вскрывали и извлекали
на воздухе в платиновых тиглях с использованием
продукты волоксидации UN, которые анализирова-
дериватографа марки Q-1500 (МОМ) при скорости
ли методом РФА. Одновременно в водном конден-
нагрева 10°С/мин.
сате из автоклава определяли содержание аммиака
по методике [25].
Результаты и обсуждение
Для изучения поведения UN в атмосфере NOx-
Окисление UN в воздушной атмосфере
воздух применяли систему эксикаторов, используе-
мую в экспериментах по газофазной конверсии
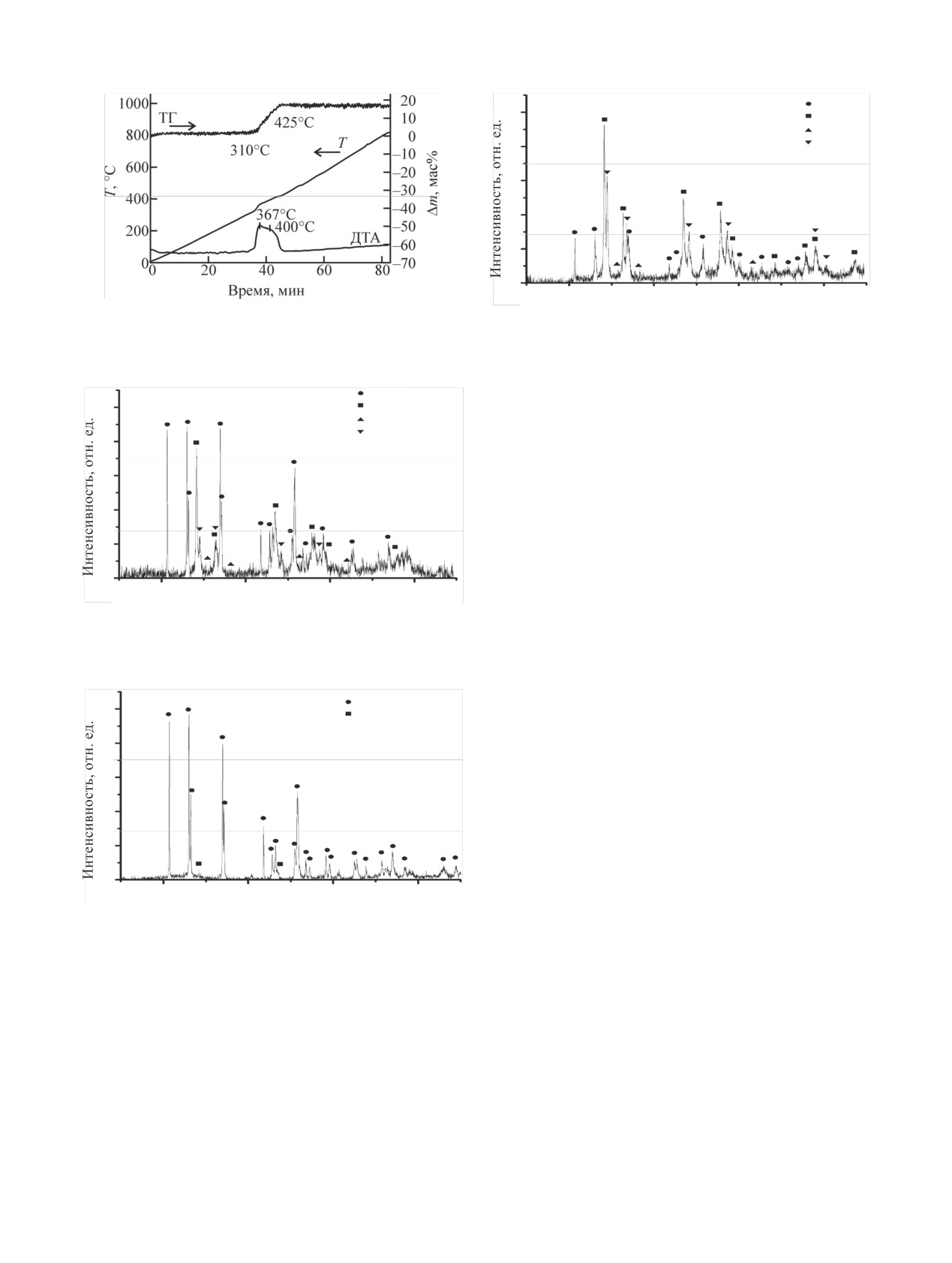
На рис. 4 приведены данные термогравиметри-
U3O8 в водорастворимые соединения в атмосфере
ческого анализа исходного UN. Как видно из
NOx-H2O (пар)-воздух [26]. Однако в отличие от
рис. 4, процесс окисления UN является экзотерми-
экспериментов работы [26] во внутреннем эксика-
ческим и сопровождается заметным выделением
торе, содержащем UN, создавалась атмосфера без-
тепла. Окисление UN протекает в широком интер-
Газофазное объемное окисление мононитрида урана
111
U3O8
100
UO2
UN
80
U2N3
60
40
20
0
20
40
60
80
2θ, град
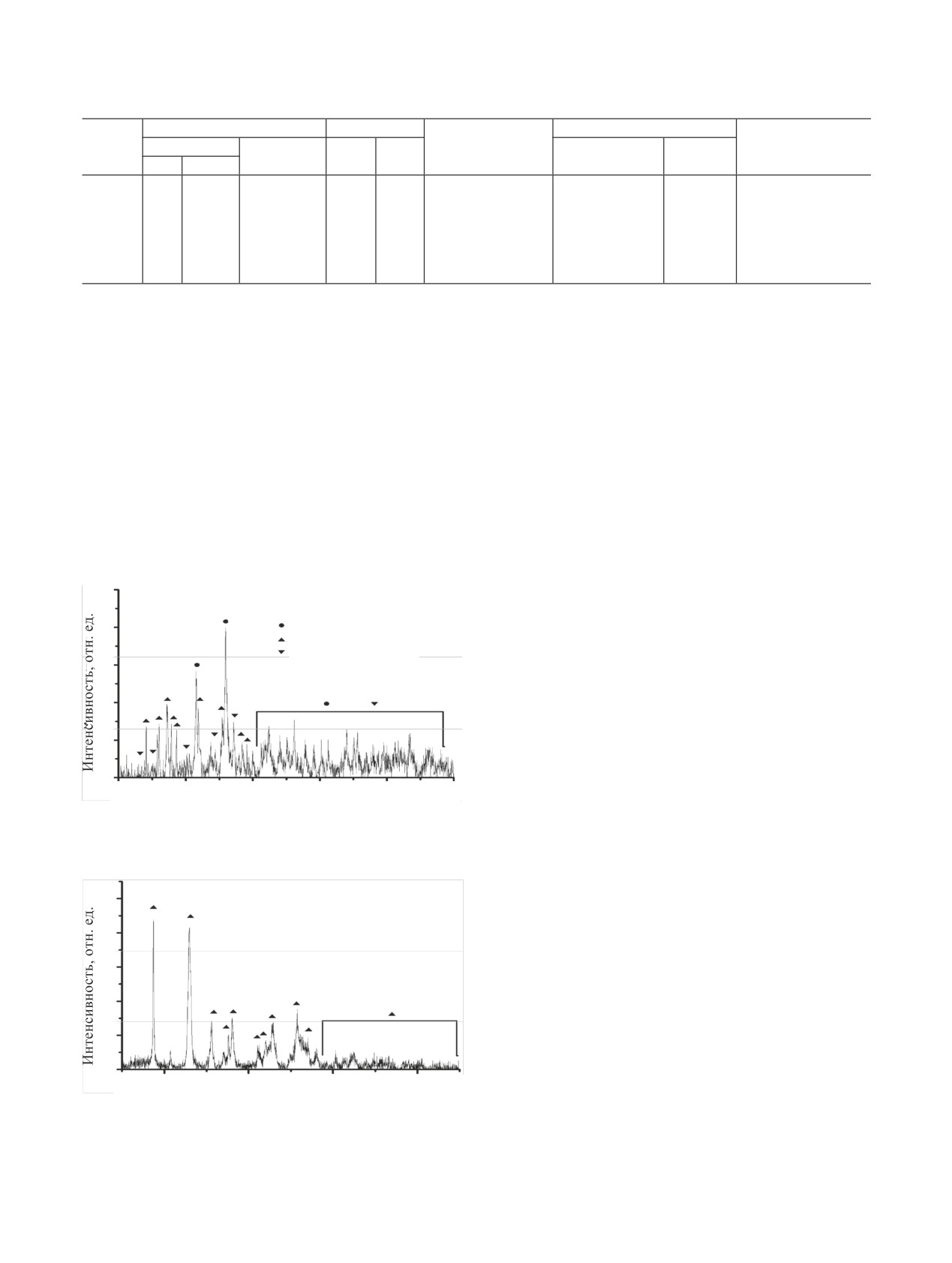
Рис. 4. Данные термогравиметрического анализа UN в воздуш-
Рис. 7. Порошковая дифрактограмма продуктов конверсии
ной атмосфере (масса навески
56.7 мг, скорость нагрева
1800 мг UN на воздухе в течение 40 мин при ~725 К. Наблю-
10°C/мин).
даемые рефлексы UO2 [24], α-U3O8 [29], UN [23], α-U2N3 [30].
U3O8
поэтому для снижения тепловыделения в ходе
100
UO2
окисления процесс проводили при разрежении p =
UN
U2N3
0.1 атм при температуре ~675-725 К. В таких усло-
80
виях окисление протекало спокойно, горения UN
не наблюдалось, что согласуется с данными работ
60
[8, 9] по реакционной способности компактных
40
образцов в атмосфере разреженного воздуха.
Для определения скорости волоксидации UN в
20
воздушной атмосфере был проанализирован фазо-
вый состав конечного продукта, образующегося
0
20
40
60
80
при разных временах выдержки. Окисление в тече-
2θ, град
ние 10 мин протекало не полностью (рис. 5), оста-
Рис. 5. Порошковая дифрактограмма продуктов конверсии UN
вался непрореагировавший UN (менее 5 мас%). На
на воздухе в течение 10 мин при ~725 К. Наблюдаемые реф-
рентгенограммах наблюдались рефлексы UO2 и
лексы UO2 [24], α-U3O8 [29], UN [23], α-U2N3 [30].
U3O8 с интенсивностями, соответствующими мас-
совому отношению UO2 : U3O8 ≈ 1 : 2. Кроме того,
U3O8
100
наблюдался сигнал фазы U2N3, соответствующий
UO2
ее содержанию менее 10 мас%. Увеличение време-
80
ни выдержки до 30 мин (рис. 6) приводило к пол-
ному окислению UN, при этом единственным про-
60
дуктом конверсии являлся U3O8.
40
Увеличение размеров UN приводило к его не-
полному окислению. В этом случае на рентгено-
20
грамме (рис. 7) наблюдались рефлексы UO2, U3O8 и
U2N3 с интенсивностью, соответствующей массо-
0
20
40
60
80
вому отношению UO2 : U3O8 : U2N3 ≈ 1.5 : 1 : 1. Ос-
2θ, град
таточное содержание исходного UN было менее
Рис. 6. Порошковая дифрактограмма продуктов конверсии
5 мас%. В то же время использование порошкооб-
300 мг UN на воздухе в течение 30 мин при ~725 К. Наблюдае-
разного UN вместо компактного в тех же условиях
мые рефлексы α-U3O8 [29], UO2 [24].
не приводило к ускорению процесса и изменению
фазового состава продуктов.
вале температур (580-700 К) и сопровождается
Изменение состава продуктов окисления UN с
увеличением массы образца (на ~17%). Следует
увеличением массы образца в целом согласуется с
отметить, что ниже температуры 580 К не наблю-
механизмом окисления, предложенным авторами
дается изменения массы образца, как и выше тем-
работы [9]. Показано, что окисление UN начинает-
пературы 700 К, т.е. весь процесс окисления UN до
ся с поверхности, при этом образуется UO2 по ре-
UOx в атмосфере воздуха протекает в интервале
акции
температур от 580 до 700 К.
UN + O2 = UO2 + N.
(1)
Как отмечалось выше, одной из проблем при
обращении с UN является его пирофорность [8],
Образующийся атомарный азот реагирует с ни-
112
С. А. Кулюхин и др.
фазой становится U3O8. Таким образом, локальный
0.06
нагрев окисляемого UN за счет собственного энер-
0.05
NO2
говыделения может привести к разложению UO3
0.04
(N) с образованием U3O8, что, возможно, и наблю-
CO
2
далось в нашем эксперименте. Известно, что в про-
0.03
цессе окисления UN наблюдается неполное выде-
0.02
ление азота в виде N2 из твердых продуктов реак-
ции [9, 15]. Авторами работы [9] показано, что эф-
0.01
фективное удаление азота происходит при конвер-
0
сии UO3(N) в U3O8. Это делает факт образования
4000
3500
3000
2500
2000
1500
1000
500
U3O8 весьма важным, особенно при переработке
ν, см-1
U15N с регенерацией 15N.
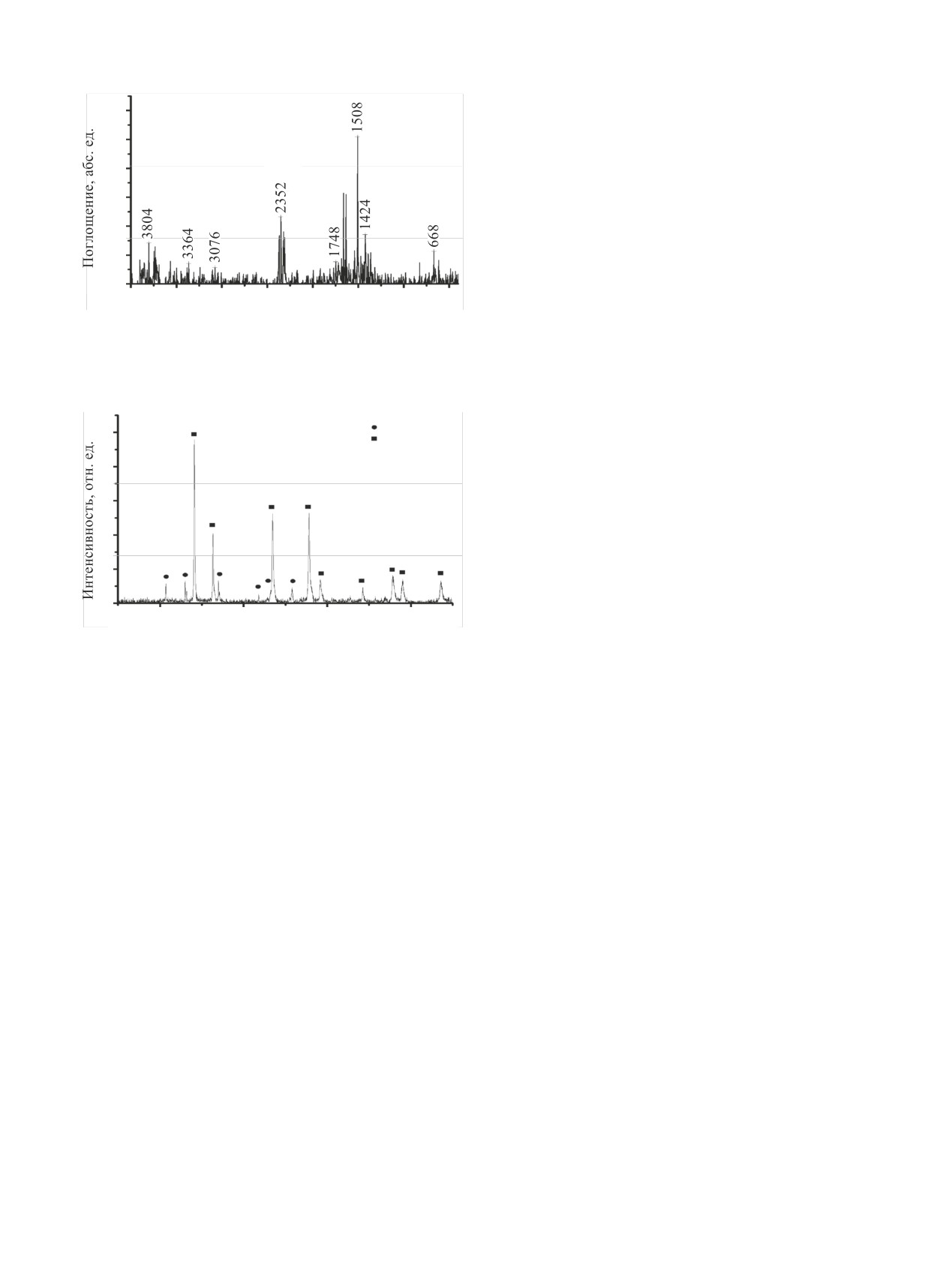
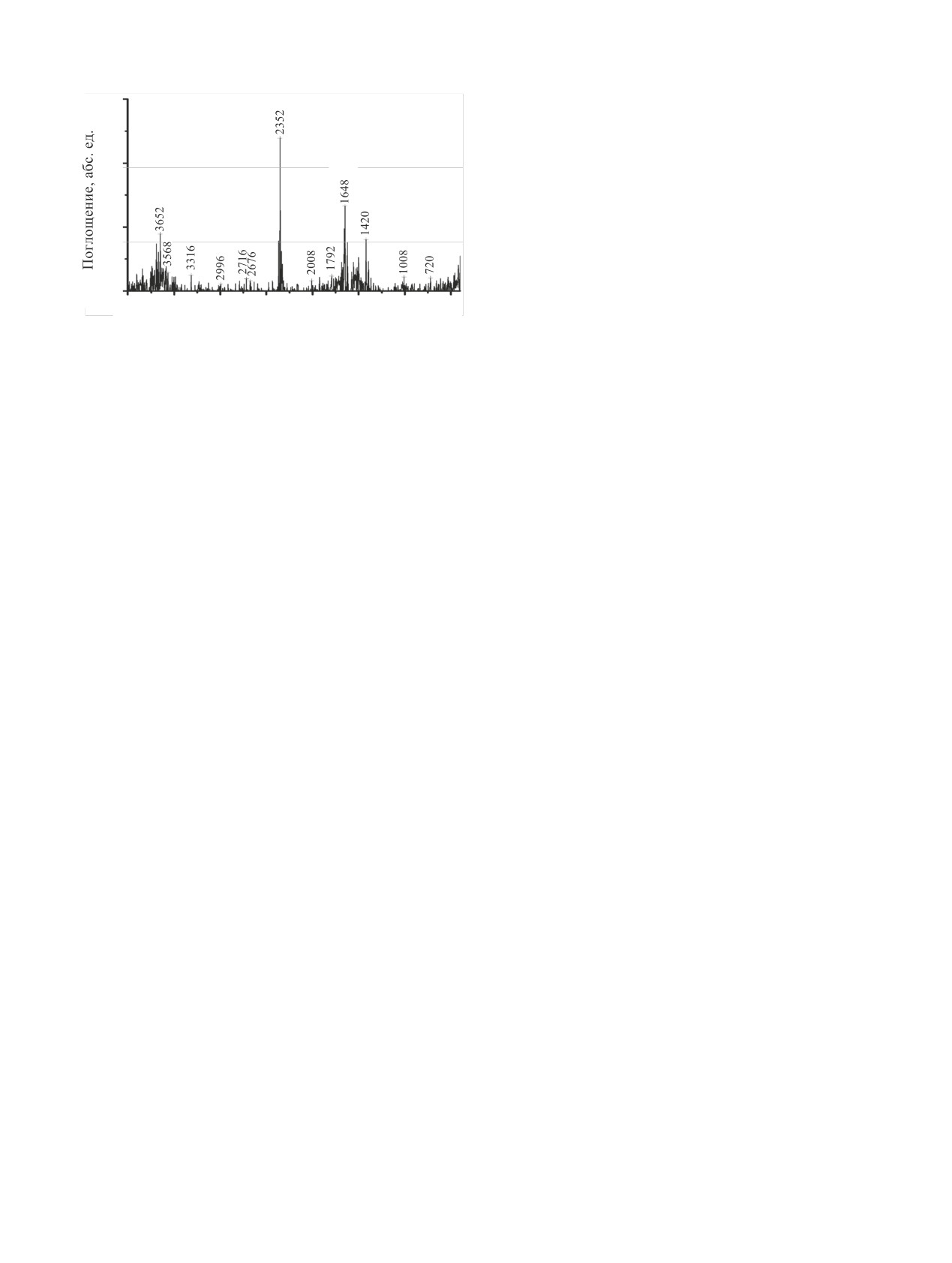
Рис. 8. ИК спектр поглощения газовой фазы в диапазоне 4000-
400 см-1, кювета KBr. Конверсия UN на воздухе в течение
Известно, что окисление UN в основном сопро-
30 мин при ~725 К. Наблюдаемые полосы поглощения CO2
вождается выделением N2 [9]. Однако не исключе-
(ν = 2370-2330 см-1) и NO2 (ν = 1628, 1598 см-1) [27].
на возможность образования различных оксидов
азота, в том числе труднолокализуемого гемиокси-
U3O8
да азота N2O. Анализ ИК спектра газовой фазы,
100
UO2
образующейся в процессе окисления UN в воздуш-
80
ной атмосфере, показал отсутствие N2O (ν = 2238,
2207 см-1 [27, 28]) (рис. 8). Наиболее интенсивны-
60
ми являются полосы поглощения, соответствую-
щие CO2 и NO2, при этом абсолютная интенсив-
40
ность полос, а значит, и содержание этих компо-
нентов в газовой фазе низки.
20
Появление CO2 в газовой фазе объясняется
0
окислением остаточного углерода, содержащегося
20
40
60
80
в исходном UN после карботермического синтеза.
2θ, град
указывает на то,
Малая интенсивность полосы NO2
Рис. 9. Порошковая дифрактограмма продуктов конверсии 300
что NO2 не является основным газообразным про-
мг UN в атмосфере H2O (пар)-воздух, содержащей 13 об%
дуктом волоксидации. Скорее всего, основным
паров воды, в течение 30 мин при ~675 К в статических усло-
виях. Наблюдаемые рефлексы UO2 [24], α-U3O8 [29].
продуктом является молекулярный N2, который не
имеет полос в ИК спектрах газовой фазы.
жележащим слоем UN с получением U2N3 по реак-
Окисление UN в атмосфере H2O (пар)-воздух
ции
Использование установок, приведенных на
2UN + N = U2N3,
(2)
рис. 2 и 3, позволило проводить окисление UN в
паровоздушной атмосфере при атмосферном дав-
который далее окисляется до UO3(N), представ-
лении, температуре ~675-725 К и содержании па-
ляющим собой раствор азота в α-UO3
ров воды от 13 до 40 об% в статическом и динами-
ческом режимах.
2U2N3 + 4O2 = 4UO3(N) + 3N2.
(3)
В работе [10] было показано, что гидролиз UN
Таким образом, важную роль в процессе окисле-
парами воды является более быстрым процессом
ния UN играют диффузия кислорода в глубь мате-
по сравнению с его окислением. В перспективе это
риала и диффузия азота наружу. Окисление образ-
может оказаться главным преимуществом при вы-
ца UN с большей массой приводит к тому, что ко-
боре состава атмосферы для волоксидации UN.
нечная скорость диффузии газов сквозь образец не
На рис. 9 приведена порошковая рентгенограм-
позволяет окислить его за время эксперимента и,
ма продуктов окисления UN в течение 30 мин в
как следствие, образуется смесь продуктов окисле-
паровоздушной атмосфере, содержащей 13 об%
ния. Следует отметить, что в отличие от данных
паров воды. Данная рентгенограмма содержит реф-
работ [9, 15] в наших экспериментах отсутствовала
лексы смеси оксидов U3O8 и UO2 в соотношении
фаза UO3(N) в продуктах окисления UN. Аналогич-
UO2 : U3O8 ≈ 2 : 1. Рефлексы, соответствующие UN
ное поведение UN в процессе окисления описано в
и U2N3, в рентгенограмме отсутствовали.
работах [12, 16]. В работе [14] показано, что при
температуре выше 825 К единственной оксидной
При увеличении массы исследуемого образца
Газофазное объемное окисление мононитрида урана
113
UN возрастает вероятность неполного окисления
100
U3O8
UN. Действительно, несмотря на увеличение содер-
UO2
UN
жания водяного пара до 40 об%, порошковая рент-
80
U2N3
генограмма содержала рефлексы не только UO2 и
U3O8, но также UN и U2N3 (рис. 10). При этом отно-
60
шение UO2 : U3O8 в продуктах окисления UN стало
40
равным 7 : 1. Наблюдаемые рефлексы UN и U2N3
имели интенсивность, соответствующую их содер-
20
жанию менее 5 мас%.
0
Считается, что гидролиз UN протекает по меха-
20
40
60
80
низму, который может быть представлен уравне-
2θ, град
ниями (4)-(7) [7, 10]
Рис. 10. Порошковая дифрактограмма продуктов конверсии
O (пар)-воздух, содержащей 40 об%
770 мг UN в атмосфере H2
2UN + 4H2O = 2UO2 + 2NH3 + H2,
(4)
паров воды, в течение 30 мин при ~675 К в статических усло-
виях. Наблюдаемые рефлексы UO2 [24], α-U3O8 [29], UN [23],
2UN + 4H2O = UO2 + N2 + 4H2
(5)
α-U2N3 [30].
Аммиак, образующийся по реакции (4), реаги-
100
U3O8
рует с UN, давая U2N3
80
4UN + 2NH3 = 2U2N3 + 3H2.
(6)
60
Заметный гидролиз U2N3 начинается лишь при
температуре выше ~675 К
40
U2N3 + 4H2O = 2UO2 + 4NH3 + 1/6H2
(7)
20
Скорость гидролиза UN, аналогично его окисле-
0
20
40
60
80
нию, определяется диффузией газообразных реа-
2θ, град
гентов и продуктов окисления. Возможно, именно
Рис. 11. Порошковая дифрактограмма продуктов конверсии
это и является причиной появления фаз UN и U2N3
UN в потоке H2O (пар)-воздух, содержащей 30 об% паров
при окислении более массивных образцов UN. Об-
воды, в течение 60 мин при ~725 К в динамических условиях.
разование U3O8 в продуктах гидролиза, очевидно,
Наблюдаемые рефлексы α-U3O8 [29].
связано с наличием остаточного количества возду-
ха в системе. При этом увеличение содержания па-
стью UN в динамическом эксперименте было зна-
ров воды в системе закономерно приводит к увели-
чительно меньше. Тем не менее, за время экспери-
чению доли UO2 в продуктах реакции.
мента наблюдалось полное окисление UN. Присут-
ствие паров воды в паровоздушном потоке позво-
Помимо исследований окисления UN в паровоз-
лит не только увеличить скорость окисления UN,
душной среде в статических условиях были также
но и даст возможность локализовать 3Н в виде
проведены эксперименты по окислению UN в ди-
3Н2О или 3ННО в процессах волоксидации нитрид-
намических условиях, а именно, в паровоздушном
ного ОЯТ.
потоке. Воздушный поток насыщали парами воды
путем барботирования воздуха через воду, нагре-
Следует отметить, что ИК спектры газовой фа-
тую до 353 К. Согласно расчетам, объемная доля
зы, образующейся после окисления UN как в ста-
насыщенных паров воды в паровоздушном потоке
тическом, так и в динамическом режимах, содер-
составляла 30 об% [31]. Рентгенофазовым анали-
жали только полосы поглощения паров Н2О и СО2
зом продуктов окисления UN было установлено,
(рис. 12). Как отмечалось ранее, появление CO2 в
что единственным продуктом конверсии является
газовой фазе объясняется окислением остаточного
U3O8 (рис. 11). Отсутствие UO2 в продуктах окис-
углерода, содержащегося в исходном UN после
ления связано, по-видимому, с тем, что в динами-
карботермического синтеза. При этом в отличие от
ческом эксперименте в отличие от статического на
экспериментов в воздушной атмосфере в данных
процесс окисления влияло несколько факторов. Во-
экспериментах в ИК спектрах отсутствовала поло-
первых, в динамическом эксперименте содержание
са поглощения NO2. Также в ИК спектрах отсутст-
паров влаги в паровоздушном потоке было ниже,
вовали полосы поглощения других оксидов азота, в
чем в условиях статического эксперимента. Во-
том числе N2O. Следует отметить, что в ИК спек-
вторых, время контакта паров воды с поверхно-
трах газовой фазы также отсутствовали интенсив-
114
С. А. Кулюхин и др.
ется молекулярный N2. Кроме того, на ход гидро-
0.15
лиза UN, возможно, влияет наличие примеси UO2 в
исходном UN. В работе [16] отмечено, что присут-
2
CO
0.10
ствие оксидной фазы способствует протеканию
H2O
гидролиза UN в соответствии с реакцией (5). При
H2O
этом необходимо заметить, что существует слож-
ность в определении выхода N2 в процессе гидро-
0.05
лиза UN из-за присутствия в исходной газовой ат-
мосфере N2. Это может составить задачу отдельно-
го исследования.
0
4000
3500
3000
2500
2000
1500
1000
500
Конверсия UN в атмосфере NOx-воздух
ν, см-1
В работе [4] двухстадийный процесс волоксида-
Рис. 12. ИК спектр газовой фазы, образующейся при окисле-
нии UN в атмосфере H2O (пар)-воздух, содержащей 40 об%
ции оксидного топлива проводили с использовани-
паров воды, в течение 30 мин при ~675 К. Наблюдаемые поло-
ем NO2. На первой стадии осуществляли окисление
сы поглощения CO2 (ν = 2370-2330 см-1) и H2O (ν = 3960-3450,
UO2 до UO3 при температуре ~473-725 К, а на вто-
2000-1330 см-1) [27].
рой - конверсию UO3 в UO2(NO3)2 при температуре
~393-403 К. Данный подход имеет ряд преиму-
ные полосы поглощения аммиака [27] или его гид-
ществ перед окислением UO2 в газовой атмосфере,
рата [32], которые должны быть основными про-
содержащей кислород воздуха. Во-первых, его
дуктами гидролиза UN в паровоздушной атмосфе-
проводят при более низких температурах по срав-
ре [7, 10, 14].
нению с
«классической» волоксидацией (~725-
775 К). Во-вторых, образующийся UO3 является
Известно [14], что доля азота, выделяющегося в
более реакционноспособным и не требует жестких
виде N2 при гидролизе UN, растет с повышением
условий для дальнейшего передела. В-третьих,
температуры процесса, причем значительные коли-
данный процесс, по мнению авторов работы [4],
чества N2 фиксируются при температуре процесса
позволяет в дальнейшем провести отделение U и
~675 К. Можно предположить, что локальный ра-
Pu от Tc. В настоящее время в литературе отсутст-
зогрев образца UN в процессе окисления до темпе-
вует информация о поведении UN в процессе во-
ратуры выше температуры проведения процесса
локсидации с использованием NO2. В наших рабо-
приводит к образованию N2 в ходе гидролиза в со-
тах [26, 33] NOx-газы в присутствии паров воды
ответствии с реакцией (5). Присутствие O2 в паро-
были использованы для конверсии UN и имитато-
воздушной атмосфере могло быть дополнительным
ров продуктов его волоксидации в водораствори-
фактором, влияющим на образование N2 в соответ-
мые соединения при температурах менее ~423 К.
ствии с реакциями (1)-(3). Кроме того, как было
Представляло интерес исследовать волоксидацию
описано выше, используемые установки с колонка-
в атмосфере NO2 при более высоких температурах,
ми с SiO2 не позволяли точно ответить на вопрос,
но в отсутствие паров воды.
образуется ли NН3 в процессе волоксидации UN в
Для проведения волоксидации UN в атмосфере
присутствии водяного пара или нет. С целью выяс-
NO2 в отсутствие паров воды был выбран темпера-
нения данного вопроса были проведены экспери-
турный режим от ~423 до ~725 К. Данный диапазон
менты по гидролизу UN в бескислородной атмо-
включал температуры, используемые в процессах
сфере H2O (пар)-N2 при повышенной температуре
волоксидации в работах [4, 26, 33]. В данных экспе-
и давлении. В результате были получены продукты
риментах помимо рентгенофазового состава продук-
гидролиза UN, представляющие собой смесь UN и
тов окисления UN также была исследована степень
UO2 в массовом отношении UN : UO2 = 3 : 1. До-
его конверсии в водорастворимые соединения.
полнительных фаз U3O8 и U2N3 в составе продук-
При температуре процесса менее ~473 К про-
тов гидролиза не обнаружено. Анализ конденсата,
дукт конверсии представлял собой компактный
извлеченного из автоклава, показал, что он пред-
образец темного цвета, покрытый желтой пленкой.
ставляет собой водный 0.06%-ный раствор NH3. На
При контакте с водой продукт желтого цвета быст-
основании степени окисления и содержания NH3 в
ро растворялся с образованием раствора бледно-
конденсате можно заключить, что в конденсате
желтого цвета. При этом оставался порошкообраз-
сконцентрировано не более 1% азота, содержавше-
ный темный осадок. Фазовый состав отмытого тем-
гося в исходном UN. Таким образом, отсутствие O2
ного осадка соответствовал исходному UN, а
в системе не вызывает рост количества NH3 в ко-
спектр оптического поглощения водного раствора
нечных продуктах гидролиза UN. Вероятнее всего,
имел полосу поглощения, характерную для UO2+.
основным продуктом реакции гидролиза UN явля-
Анализ результатов эксперимента показал, при
Газофазное объемное окисление мононитрида урана
115
Конверсия UN в водорастворимые соединения в атмосфере NOx-воздух
Навеска
Δm
Растворимость в воде
Номер
Время выдержки/
Конверсия UN, %
исходная
после вы-
U в растворе,
опыта
г
%
T, К
остаток, г
от исходногоa
г
ммоль
держки, г
ммоль
1
0.23
0.91
0.23
-
-
5 ч/403
-
0.23
~0
2
0.23
0.91
0.23
-
-
5 ч/423
-
0.23
~0
3
0.38
1.51
0.42
~0.04
~10.5
5 ч/473
0.17
0.35
~11.3
4
0.39
1.55
0.40
~0.01
~2.6
10 ч/473
0.19
0.38
~12.3
5
0.65
2.58
0.75
~0.10
~15.4
5 ч/565
2.13
0.14
~82.6
6
0.13
0.52
0.15
~0.02
~15.4
5 ч/673
0.06
0.15
~11.5
a Конверсию рассчитывают как отношение содержания U в растворе к его исходному количеству.
температурах менее ~473 К степень конверсия UN
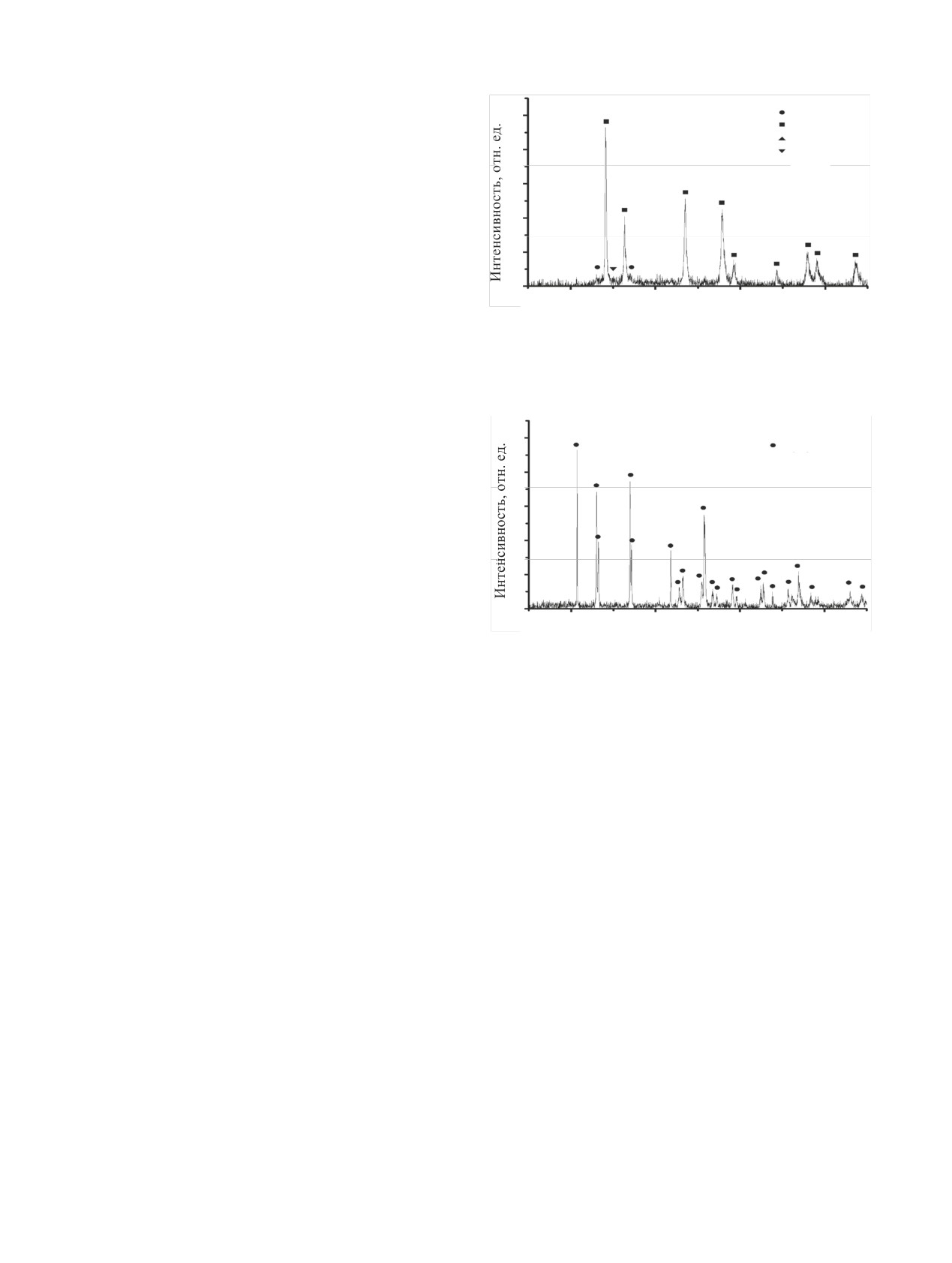
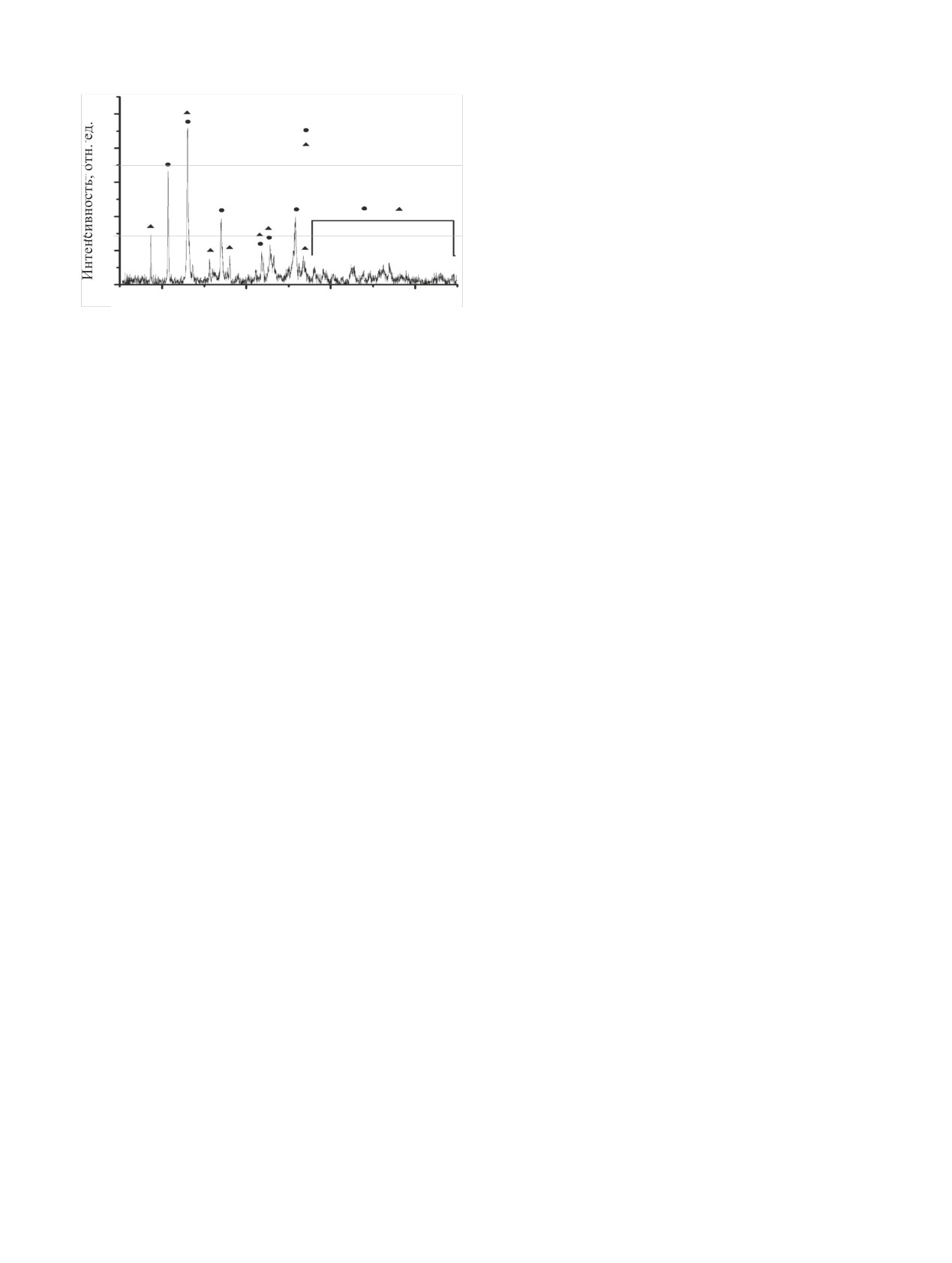
(рис. 13). Как было отмечено в работах [34, 35],
в водорастворимые соединения минимальна и не
модификация ε-UO3 образуется исключительно
превышает 12% (опыты 1-4 в таблице). Таким об-
при окислении оксидов урана в атмосфере NO2.
разом, при температуре процесса менее ~473 К в
Образование ε-UO3 также было подтверждено в
присутствии NOx происходила частичная конвер-
ходе экспериментов по волоксидации UO2 в атмо-
сия UN в водорастворимые соединения уранила.
сфере NOx [1, 34]. С другой стороны, авторами ра-
бот [1, 34] показано, что при полном отсутствии
С целью увеличения степени конверсии UN в
паров воды в NO2 образования нитратов не проис-
водорастворимые соединения были проведены экс-
ходит. Появление нитратов в продуктах конверсии
перименты при температуре ~565 и ~675 К. В опы-
в наших экспериментах может быть связано, по-
тах при ~565 К продукт конверсии UN представлял
видимому, с недостаточной степенью обезвожива-
собой кирпично-красный порошок. Его порошко-
ния NO2. При контакте продукта конверсии с во-
вая дифрактограмма содержала рефлексы, харак-
дой образовывался желтый раствор и оставался
терные для ε-UO3 и гидратов UO2(NO3)2·nH2O
нерастворимый красный осадок. Спектр оптиче-
100
ского поглощения раствора содержал полосы, ха-
рактерные для UO2+. При этом степень конверсии
UO2
80
UN в водорастворимые соединения составляла
UO2(NO3)2·3H2O
UO2(NO3)2·6H2O
~80% (опыт 5 в таблице). Порошковая дифракто-
60
грамма нерастворимого в воде красного осадка,
представленная на рис. 14, содержит рефлексы,
40
принадлежащие UO3·0.8H2O [36].
Конверсия UN в атмосфере NOx при ~675 К
20
приводила к образованию темно-красных порош-
ков с примесью порошков черного цвета. Фазовый
0
10
20
30
40
50
60
состав продукта конверсии UN представлял собой
2θ, град
смесь U3O8 и UO3·0.8H2O (рис. 15). Данные соеди-
Рис. 13. Порошковая дифрактограмма продуктов конверсии UN в
нения могут быть продуктами как окисления ис-
атмосфере NOx-воздух в течение 5 ч при ~565 К. Наблюдаемые
ходного UN, так и превращений UO3, образующе-
рефлексы ε-UO3 [38], UO2(NO3)2·3H2O [39], UO2(NO3)2·6H2O [40].
гося в процессе волоксидации UN. Образование
гидратов уранила UO2(NO3)2·nH2O при данной тем-
100
пературе маловероятно, поскольку они разлагают-
UO3·0.8H2O
ся при температурах ниже ~575 К [41-45]. При
80
взаимодействии продуктов конверсии UN с водой
60
образовывался бледно-желтый раствор и оставался
нерастворимый темный осадок. Спектр оптическо-
40
го поглощения раствора продуктов конверсии со-
держал полосу, характерную для иона UO2+. Сте-
20
пень конверсии UN в водорастворимые соединения
составила ~12% (опыт 6 в таблице). Фазовый со-
0
20
40
60
80
став нерастворимого в воде осадка практически
2θ, град
полностью соответствовал составу продукта после
Рис. 14. Порошковая дифрактограмма нерастворимого в воде
конверсии UN, за исключением слабых пиков нит-
красного осадка, образовавшегося после контакта продуктов
ратов или гидроксинитратов уранила.
конверсии UN в атмосфере NOx-воздух в течение 5 ч при
~565 К с водой. Наблюдаемые рефлексы UO3·0.8H2O [36].
При ~565 К наблюдалась максимально возмож-
116
С. А. Кулюхин и др.
[13] Ferris L. M. // J. Inorg. Nucl. Chem. 1968. Vol. 30, N 10.
100
P. 2661-2669.
U3O8
[14] Sugihara S., Imoto S. // J. Nucl. Sci. Technol. 1969. Vol. 6,
80
UO3·0.8H2O
N 5. P. 237-242.
[15] Paljevic M., Despotovic Z. // J. Nucl. Mater. 1975. Vol. 57,
60
N 3. P. 253-257.
[16] Rama Rao G. A., Mukerjee S. K., Vaidya V. N. et al. // J. Nucl.
40
Mater. 1991. Vol. 185, N 2. P. 231-241.
[17] Dehadraya J. V., Mukerjee S. K., Rama Rao G. A. et al. //
J. Alloys Compd. 1997. Vol. 257, N 1-2. P. 313-321.
20
[18] Rama Rao G. A., Jayanthi K., Mukerjee S. K. et al. //
Thermochim. Acta. 1990. Vol. 159. P. 349-356.
0
[19] Sunder S., Miller N. H. // J. Alloys Compd. 1998. Vol. 271-
20
40
60
80
273. P. 568-572.
2θ, град
[20] Liu K., Luo L., Luo L. et al. // Appl. Surf. Sci. 2013. Vol. 280.
Рис. 15. Порошковая дифрактограмма продуктов конверсии
P. 268-272.
UN в атмосфере NOx-воздух в течение 5 ч при ~675 К. Наблю-
[21] Lu L., Li F., Hu Y. et al. // J. Nucl. Mater. 2016. Vol. 480. P.
даемые рефлексы U3O8 [29], UO3·0.8H2O [36].
189-194.
[22] Johnson K., Strom V., Wallenius J., Lopes D. A. // J. Nucl.
ная степень конверсии UN в нитраты или гидро-
Sci. Technol. 2017. Vol. 54, N 3. P. 280-286.
ксинитраты уранила. Даже небольшие следы влаги
[23] JCPDS—Int. Centre for Diffraction Data. PDF 03-065-5985,
UN.
существенно повысили степень конверсии UN в
[24] JCPDS—Int. Centre for Diffraction Data. PDF 03-065-0285,
водорастворимые соединения.
UO2.
[25] Wastewater and Biosolids Analysis Manual. Digestion and
В заключение следует отметить, что проведение
Selected Methods for Determining Metals, Minerals, and
объемного окисления компактных образцов UN
Other Related Parameters: Report 49088-88. Ames: Hach,
при низком содержании кислорода воздуха позво-
1999. Method 8038.
ляет провести волоксидацию без воспламенения
[26] Кулюхин С. А., Неволин Ю. М., Мизина Л. В. и др. // Ра-
UN. В зависимости от состава газовой среды мож-
диохимия. 2016. Т. 58, N 1. C. 15-29.
[27] IR Database. IR-Spektrensammlung der ANSYCO GmbH.
но получать как U3O8, так и UO2. При этом основ-
ным газообразным азотсодержащим продуктом
[28] NIST Chemistry WebBook. NIST Standard Reference Data-
конверсии UN является N2. Использование альтер-
нативной окислительной атмосферы на основе
ния: 28.02.2018).
NOx-газов позволяет проводить конверсию при бо-
[29] JCPDS—Int. Centre for Diffraction Data. PDF 01-074-2101,
α-U3O8.
лее низкой температуре.
[30] JCPDS—Int. Centre for Diffraction Data. PDF 01-073-1712,
Работа выполнена при частичной финансовой
α-U2N3.
[31] Gallagher J. S., Kell G. S. // NBS/NRC Steam Tables. 1984.
поддержке Министерством науки и высшего обра-
[32] Sethna P. P., Downing H. D., Pinkley L. W., Williams D. //
зования РФ (тема АААА-А16-116 021 990 023-6).
J. Opt. Soc. Am. 1978. Vol. 68, N 4. P. 429-431.
[33] Кулюхин С. А., Неволин Ю. М., Гордеев А. В. // Радиохи-
Список литературы
мия. 2017. Т. 59, N 3. C. 216-225.
[34] Johnson J. A., Rawn C. J., Spencer B. B. et al. // J. Nucl.
[1] Johnson J. A. Studies of reaction process for voloxidation
Mater. 2017. Vol. 490. P. 211-215.
methods: PhD Diss. Univ. of Tennessee, 2013.
[35] Hoekstra H. R., Siegel S. // J. Inorg. Nucl. Chem.
1961.
[2] Volk V. I., Veselov S. N., Dvoeglazov K. N. et al. // At. En-
Vol. 18. P. 154-165.
ergy. 2016. Vol. 119, N 5. P. 339-343.
[36] JCPDS—Int. Centre for Diffraction Data. PDF 00-010-0309,
[3] Металиди М. М., Шаповалов С. В., Исмаилов Р. В. и др. //
UO3·0.8H2O.
Радиохимия. 2015. Т. 57, N 1. С. 86-89.
[37] JCPDS—Int. Centre for Diffraction Data. PDF 00-030-1402,
[4] Collins E. D., Delcul G. D., Hunt R. D. et al. Patent US
UO2(OH)2.
8574523. 2013.
[38] JCPDS—Int. Centre for Diffraction Data. PDF 00-018-1429,
[5] Котельников Р. Б., Башлыков С. Н., Каштанов А. И., Мень-
ε-UO3.
шикова Т. С. Высокотемпературное ядерное топливо. М.:
[39] JCPDS—Int. Centre for Diffraction Data. PDF 00-027-0937,
Атомиздат, 1978.
UO2(NO3)2·3H2O.
[6] Antill J. E., Myatt B. L. // Corros. Sci. 1966. Vol. 6, N 9.
[40] JCPDS—Int. Centre for Diffraction Data. PDF 01-077-0121,
P. 17-23.
UO2(NO3)2·6H2O.
[7] Dell M., Wheeler V. J. // J. Nucl. Mater. 1967. Vol. 21, N 3.
[41] Ondrejcin R. S., Garret T. P. // J. Phys. Chem. 1961. Vol. 65.
P. 328-336.
P. 470-473.
[8] Dell R. M., Wheeler V. J., McIver E. J. // Trans. Faraday Soc.
[42] Кац Дж., Рабинович Е. Химия урана. М.: Иностран. лите-
1966. Vol. 62. P. 3591-3606.
ратура, 1954. 490 с.
[9] Dell R. M., Wheeler V. J., Bridger N. J. // Trans. Faraday Soc.
[43] Lister A. J., Richardson R. J. The Preparation of Uranium
1967. Vol. 63. P. 1286-1294.
Trioxide by Thermal Decomposition of Uranyl Nitrate.
[10] Allbutt M., Dell R. // J. Nucl. Mater. 1967. Vol. 24, N 1. P. 1-20.
Harwell: Atomic Energy Research Establishment,
1954.
[11] Ohmichi T., Honda T. // J. Nucl. Sci. Technol. 1968. Vol. 5,
AERE C/R 1874.
N 11. P. 600-602.
[44] Галкин Н. П., Судариков Б. Н., Верятин У. Д. и др. Техно-
[12] Sole M. J., van der Walt C. M. // Acta Metall. 1968. Vol. 16,
логия урана. М.: Атомиздат, 1964. 309 с.
N 4. P. 501-510.
[45] Schaal G., Faron R. US Patent 5628048. May 6, 1997.