100
Радиохимия, 2019, т. 61, N 2, c. 100-107
Кристаллическое строение комплексов An(VI) с анионами
янтарной кислоты, [PuO2(C4H4O4)(H2O)] и Cs2[(AnO2)2(C4H4O4)3]·H2O
(An = U, Np, Pu)
© И. А. Чарушникова*, А. М. Федосеев, А. А. Бессонов
Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4; * e-mail: charushnikovai@ipc.rssi.ru
Получена 11.04.2018, после доработки 15.05.2018, принята к публикации 16.05.2018
УДК 539.26:(546.791.6+546.798.21+546.798.22)
Синтезированы и исследованы методом рентгеноструктурного анализа комплексы An(VI) с
анионами янтарной кислоты [PuO2(succ)(H2O)] и Cs2[(AnO2)2(succ)3]·H2O (An = U, Np, Pu), где succ =
[C4H4O4]2-. Соединение [PuO2(succ)(H2O)] изоструктурного с [UO2(succ)(H2O)] [1], его кристаллическая
упаковка - трехмерный электронейтральный каркас. Экваториальную плоскость пентагональной бипи-
рамиды Pu(VI) формируют атомы O четырех анионов [C4H4O4]2- и одной молекулы воды. Анионы
[C4H4O4]2- являются мостиковыми, каждый анион связывается монодентатно с четырьмя атомами Pu.
В комплексах Cs2[(AnO2)2(succ)3]·H2O основу структуры составляет анионный каркас. Экваториальную
плоскость гексагональной бипирамиды An(VI) формируют атомы O трех анионов [C4H4O4]2-, каждый
анион выполняет хелатно-мостиковую функцию и связывает два атома An(VI). Измерены электронные
спектры поглощения [PuO2(succ)(H2O)] и Cs2[(PuO2)2(succ)3]·H2O.
Ключевые слова: уран(VI), нептуний(VI), плутоний(VI), сукцинат, кристаллическая структура,
электронные спектры поглощения.
DOI: 10.1134/S0033831119020023
Комплексы уранила с анионами янтарной ки-
оксид урана UO3 получали термическим разложе-
слоты (HOOC)C2H4(COOH) изучены довольно под-
нием (NH4)4[UO2(CO3)3] при 330°С в течение 12 ч.
робно, в литературе имеются данные о строении
[PuO2(succ)(H2O)] (I) синтезировали растворени-
моноклинной [1] и ромбической [2] модификаций
ем PuO2(OH)2·xH2O, полученного по методике ра-
моногидрата [UO2(succ)(H2O)] (succ = [C4H4O4]2-).
боты [10], в водном растворе ~0.1 моль/л янтарной
Изучены также комплексы сукцината уранила с
кислоты при нагреве до температуры не более
нейтральными органическими лигандами, входя-
40°С. В течение нескольких часов в реакционной
щими в координационное окружение уранила [3-5]
смеси формируются друзы розоватых кристаллов
и хлоридный комплекс [(UO2)2Cl6(succ)]·4(C2H8N)
наряду с мелкокристаллическими продуктами. По-
[6]. Исследование комплексообразования U(VI) и
пытки получения сукцината нептунила не приво-
Pu(VI) с янтарной кислотой в водных растворах [7,
дят к получению искомых комплексов Np(VI)
8] показало, что в растворе существуют комплексы
вследствие довольно быстрого восстановления
с соотношением актинид : сукцинат 1 : 1 и 1 : 2. В
нептунила даже при пониженной температуре (6-
недавней работе [9] были синтезированы и струк-
8°С) до Np(V) при различной концентрации янтар-
турно охарактеризованы анионные сукцинатные
ной кислоты в реакционной смеси.
комплексы уранила 1 : 1.5 с калием и [Mg(H2O)6]2+
Анионные сукцинатные комплексы состава
в качестве внешнесферных катионов. Однако в ли-
Cs2[(AnO2)2(succ)3]·H2O (An
= U, Np, Pu) (II)
тературе отсутствуют данные о строении сукцина-
получали путем добавления водного раствора
тов трансурановых элементов в степени окисления
~0.2 моль/л сукцината цезия, приготовленного
+6. В настоящей работе синтезированы новые сук-
взаимодействием эквимолярных количеств янтар-
цинатные соединения U(VI), Np(VI) и Pu(VI), опре-
ной кислоты и карбоната цезия в виде водных рас-
делено их строение.
творов (0.5 моль/л), к водным растворам 0.05 моль/л
AnO2(NO3)2. В течение нескольких часов формиру-
Экспериментальная часть
ются друзы слабоокрашенных кристаллов. В слу-
Исходными реагентами служили янтарная, азот-
чае Np(VI) за это время цвет маточного раствора из
ная, щавелевая кислоты, карбонат цезия марки х.ч.,
желтовато-зеленоватого меняется на зеленый, ха-
использованные без дополнительной очистки. Три-
рактерный для гидратированного NpO+. Использо-
Кристаллическое строение комплексов An(VI)
101
Таблица 1. Кристаллографические данные и характеристики рентгеноструктурного эксперимента
Параметр
I
IIa
IIb
IIc
Эмпирическая формула
C4H6O7Pu
C12H14O17Cs2U2
C12H14O17Cs2Np2
C12H14O17Cs2Pu2
Молекулярная масса
408.09
1172.11
1170.05
1174.05
Сингония
Моноклинная
Кубическая
Кубическая
Кубическая
Пространственная группа
P21/n
I213
I213
I213
a, Å
7.5755(7)
13.4729(1)
13.4688(1)
13.4688(4)
b, Å
10.6380(8)
13.4729(1)
13.4688(1)
13.4688(4)
с, Å
9.4212(8)
13.4729(1)
13.4688(1)
13.4688(4)
β, град
90.459(5)
Объем ячейки, Å3; Z
759.21(11); 4
2445.59(3); 4
2443.36(3); 4
2443.36(13); 4
ρвыч , г/см3
3.570
3.183
3.181
3.208
μ(MoKα), мм-1
9.268
16.517
7.155
7.448
Число измеренных/независимых отражений
18381/4444
11966/1209
14268/1217
14456/1183
Число независимых отражений с I > 2σ(I)
3981
1028
1017
914
Число уточняемых/фиксированных параметров
117/3
52/2
52/2
51/2
BASF
0.221(2)
R(F); wR(F2) [I > 2σ(I)]
0.0586; 0.1582
0.0302; 0.0705
0.0330; 0.0730
0.0358; 0.0680
R(F); wR(F2) [весь массив]
0.0652; 0.1651
0.0413; 0.0757
0.0454; 0.0789
0.0569; 0.0759
GOOF
1.146
1.056
1.065
1.066
Δρmax и Δρmin, e·Å-3
14.204; -8.030
1.356; -0.880
1.317; -0.958
1.055; -1.543
вание сукцинатов щелочных металлов, отличных
турных параметров проводили с кратностями 2/3
от цезия, как правило, приводило к формированию
для атомов Cs и 1/3 для атомов О молекул воды.
либо стеклообразных, либо мелкокристаллических
Атомы Н у атомов С анионов [C4H4O4]2- в
продуктов в изученных условиях при различных
структурах I и II размещали в геометрически вы-
отношения An : C4H4O4.
численных позициях и уточняли с UН = 1.2Uэкв(C).
Атомы Н у молекулы координационно связанной
Электронные спектры поглощения кристалличе-
ских PuO2(succ)(H2O) и Cs2[(PuO2)2(succ)3]·H2O ре-
воды в структуре I и кристаллизационной воды в
структурах II локализовали на разностных синте-
гистрировали по методике работы [11].
зах Фурье и уточняли с UН = 1.5Uэкв(О) и ограни-
Рентгеноструктурный эксперимент проводили
ченными значениями межатомных расстояний O-H
на автоматическом четырехкружном дифрактомет-
и валентного угла H-О-Н.
ре с двумерным детектором Bruker Kappa Apex II
Длины связей и валентные углы в структурах I
(излучение MoKα, графитовый монохроматор) при
и II приведены в табл. 2 и 3. Координаты атомов
100 К. Параметры элементарных ячеек уточняли по
депонированы в Кембриджский центр кристалло-
всему массиву данных. В экспериментальные ин-
графических данных, депоненты CCDC 1539108,
тенсивности вводили поправки на поглощение с
1539124, 1539125, 1539127.
помощью программы SADABS [12]. Структуры
расшифровывали прямым методом (SHELXS97
Таблица 2. Длины связей (d, Å) и валентные углы (ω,
[13]) и уточняли полноматричным методом наи-
град) в структуре Iа
меньших квадратов (SHELXS-2014 [14]) по F2 по
Связь
d
Угол
ω
всем данным в анизотропном приближении для
Pu(1)=O(11)
1.743(8)
O(11)=Pu(1)=O(12)
179.0(4)
всех неводородных атомов. Результаты уточнения
Pu(1)=O(12)
1.725(8)
O(1)-Pu(1)-O(3b)
74.0(3)
и основные кристаллографические данные приве-
Pu(1)-O(1)
2.381(7)
O(1)-Pu(1)-O(4c)
71.2(3)
Pu(1)-O(2a)
2.370(8)
O(2a)-Pu(1)-O(3b)
71.1(3)
дены в табл. 1.
Pu(1)-O(3b)
2.385(7)
O(2a)-Pu(1)-Ow(1)
73.2(3)
В структуре I конечное уточнение координат
Pu(1)-O(4c)
2.364(8)
O(4c)-Pu(1)-Ow(1)
70.6(3)
атомов и температурных параметров в анизотроп-
Pu(1)-Ow(1)
2.434(7)
O(1)-C(1)-O(2)
122.6(9)
ном приближении привело к R-фактору ~12%. Вве-
С(1)-O(1)
1.269(11)
O(3)-C(4)-O(4)
123.1(9)
дение поправки на мероэдрическое двойникование
С(1)-O(2)
1.246(11)
O(1)-C(1)-C(2)
118.9(8)
позволило снизить R-фактор в два раза, значение
С(4)-O(3)
1.260(11)
O(2)-C(1)-C(2)
118.4(8)
С(4)-O(4)
1.260(11)
O(3)-C(4)-C(3)
118.6(8)
коэффициента двойникования BASF приведено в
С(1)-С(2)
1.513(13)
O(4)-C(4)-C(3)
118.3(8)
табл. 1.
С(2)-С(3)
1.513(12)
C(1)-C(2)-C(3)
114.7(8)
В кристаллах соединений состава II катионы Cs
С(3)-С(4)
1.512(13)
C(2)-C(3)-C(4)
113.1(8)
и молекулы воды размещаются в одних и тех же
а Операции симметрии: a - (1/2 + x, 1/2 - y, -1/2 + z), b - (3/2 -
позициях. Уточнение их позиционных и темпера-
x, -1/2 + y, 5/2 - z), c - (1 - x, 1 - y, 2 - z).
102
И. А. Чарушникова и др.
Результаты и обсуждение
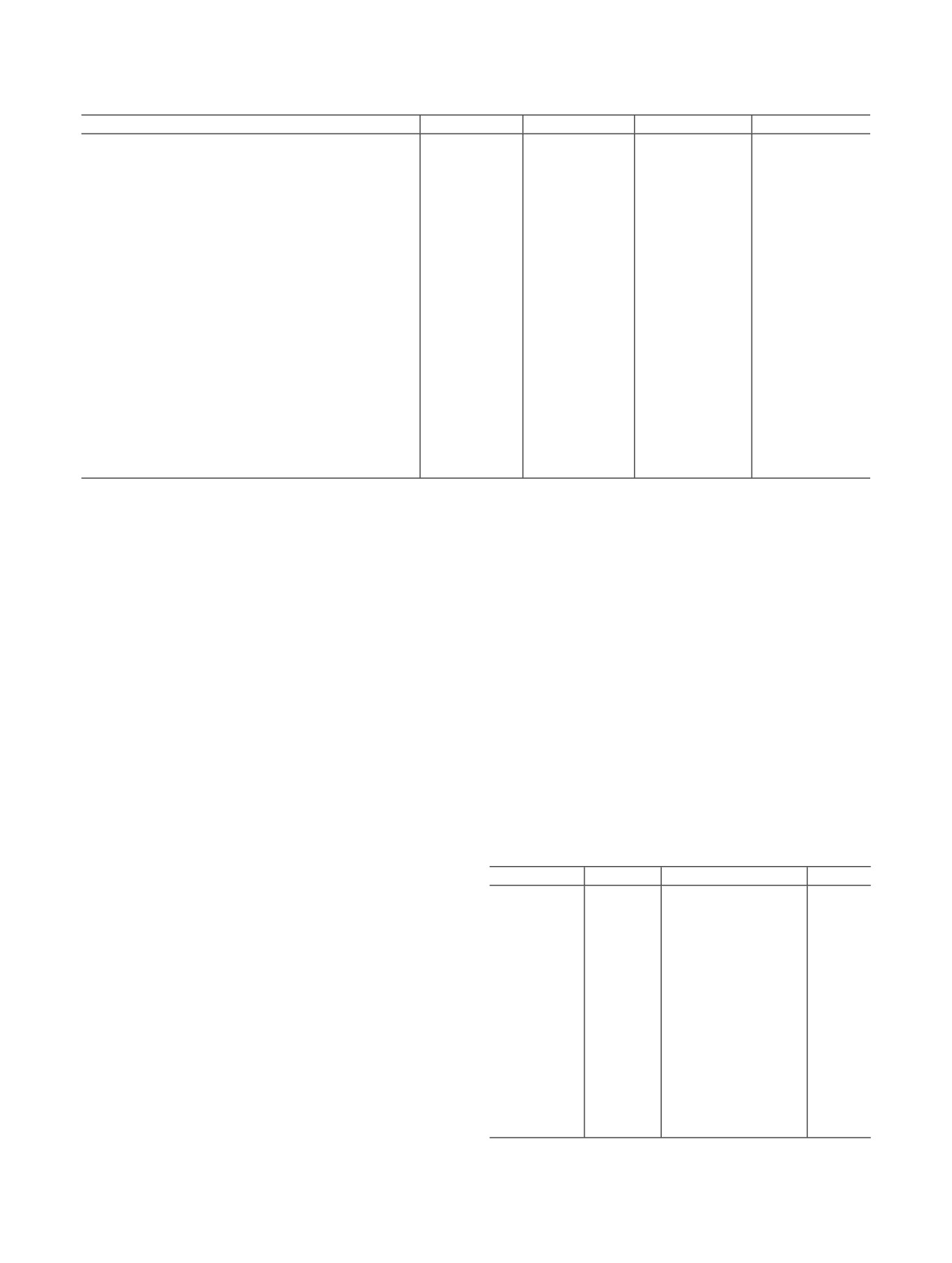
C(3a)
Кристаллы изоструктурного с [UO2(succ)(H2O)]
C(2a)
[1] плутониевого соединения I состоят из катионов
O(3a)
C(1a)
O(2b)
PuO22+, анионов [C4H4O4]2- и молекул координаци-
C(4a)
O(1b)
O(4a)
онно связанной воды. Кристаллографически неза-
O(1a)
O(2a)
O(4b)
висимый атом Pu(1) в структуре находится в об-
C(1b)
O(3b)
щем положении, его координационное окружение
C(4b)
C(2b)
в виде пентагональной бипирамиды формируют в
O(11)
H(2)
экваторе атомы O четырех анионов [C4H4O4]2- и
Pu(1)
C(3b)
одной молекулы воды (рис. 1). Атомы O группы
H(1)
Ow(1)
C(3)
O(12)
PuO2 находятся в апикальных позициях бипирами-
C(2)
ды. Средние длины связей внутри координацион-
O(1) C(1)
ного полиэдра Pu изменяются следующим обра-
O(4c)
O(2)
C(4)
зом: Pu=O 1.734(8) Å, Pu-Osucc 2.375(8) Å, длина
O(3c)
связи Pu-Ow равна 2.434 Å (табл. 2). Для сравнения
C(4c)
O(2c)
O(3)
отметим, что в уранильном комплексе [1], который
C(1c)
O(1c)
O(4)
также кристаллизуется в моноклинной ячейке,
C(3c)
средние длины связей равны: U=O 1.741(11) Å, U-
C(2c)
Osucc 2.39(1) Å, длина связи U-Ow равна 2.451(9) Å.
Налицо тенденция к уменьшению длин связей
внутри координационного полиэдра при переходе
Рис. 1. Фрагмент структуры I, пунктирными линиями показа-
от U к Pu.
ны водородные связи. Эллипсоиды тепловых колебаний даны
с 30%-ной вероятностью, операции симметрии соответствуют
Кристаллографически независимый анион
приведенным в табл. 2.
[C4H4O4]2- в структуре I является мостиковым ли-
гандом. Он связывает монодентатным способом
через каждый атом O по четыре атома Pu, в резуль-
тате чего в кристалле образуется трехмерный элек-
0
c
тронейтральный каркас (рис. 2).
O(12)
O(1a)
Кристаллы соединений общего состава Cs2
Ow(1)
Pu(1)
[(AnO2)2(succ)3]·H2O (II) состоят из катионов Cs+ и
O(1) O(2)
O(3c)
C(1)
C(2)
Таблица 3. Длины связей (d, Å) и валентные углы (ω,
O(11)
C(3)
град) в структурах IIа
O(4) C(4)
O(3)
An = U
An = Np
An = Pu
Связь, угол
(IIa)
(IIb)
(IIc)
Длины связей
An(1)=O(11)
1.758(9)
1.754(9)
1.759(11)
An(1)=O(12)
1.759(9)
1.752(9)
1.739(11)
b
An(1)-O(1)
2.463(5)
2.458(5)
2.461(6)
An(1)-O(2)
2.445(5)
2.444(6)
2.445(7)
С(1)-O(1)
1.258(9)
1.256(9)
1.257(11)
Рис. 2. Упаковка молекул в структуре I (проекция в направле-
С(1)-O(2)
1.262(8)
1.255(9)
1.270(10)
нии [100]). Пунктирными линиями показаны водородные связи
С(1)-C(2)
1.511(10)
1.502(11)
1.479(14)
с молекулами воды. Операции симметрии соответствуют при-
С(2)-C(2a)
1.484(17)
1.481(18)
1.582(19)
веденным в табл. 2.
Углы
O(11)=An(1)=O(12)
180.0(2)
180.00(19)
180.0(2)
O(1)-An(1)-O(2)
52.86(17)
52.74(18)
52.8(2)
AnO22+, анионов [C4H4O4]2- и молекул кристаллиза-
O(1)-An(1)-O(2b)
67.71(17)
67.89(18)
68.0(2)
ционной воды.
O(1)-C(1)-O(2)
120.3(6)
120.3(7)
119.3(8)
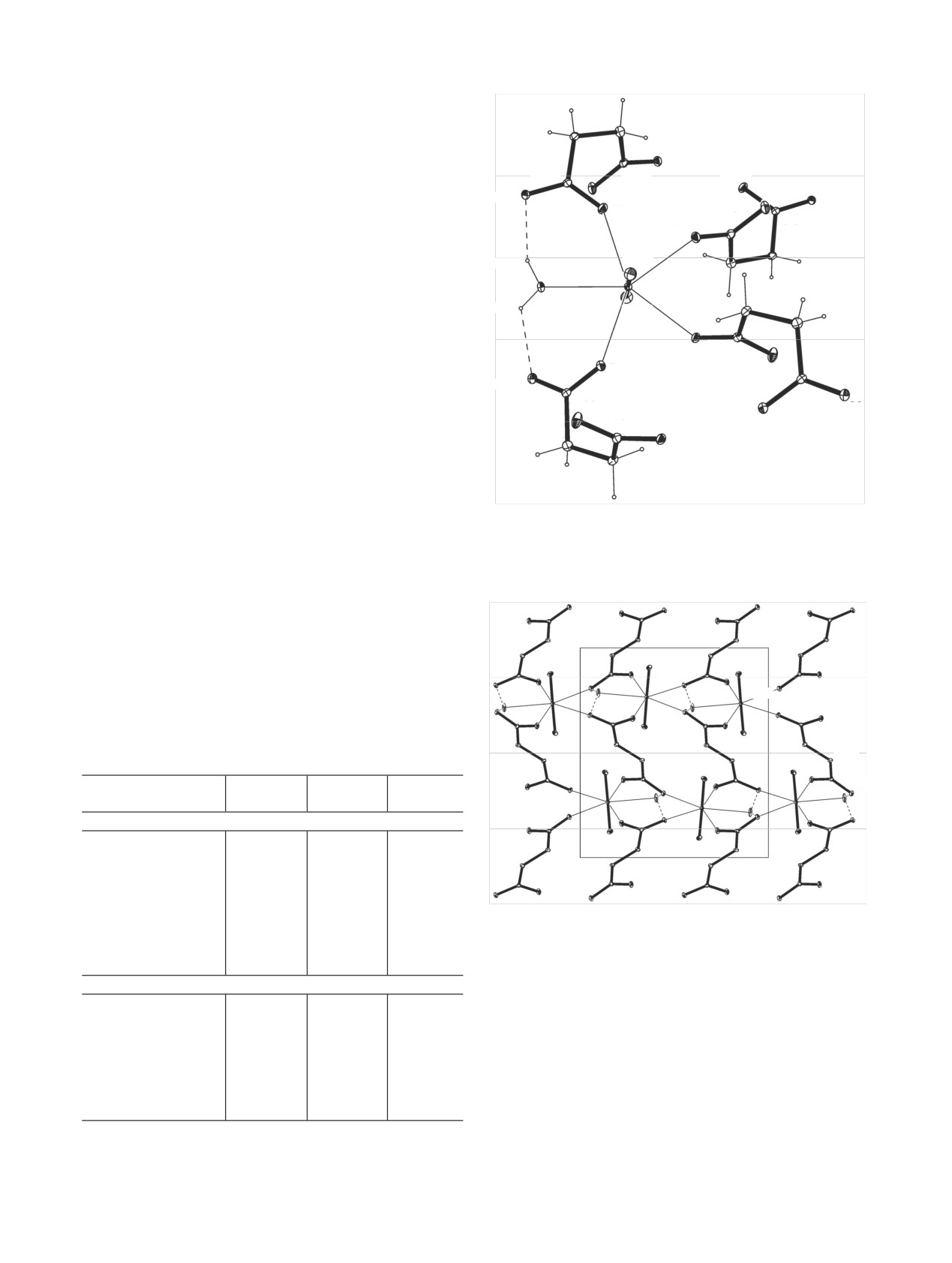
Кристаллографически независимый атом An(VI)
O(1)-C(1)-C(2)
119.8(6)
119.8(7)
117.6(8)
находится в частном положении на оси третьего
O(2)-C(1)-C(2)
120.0(7)
119.9(7)
123.1(8)
порядка, координационное окружение атома
C(1)-C(2)-C(2a)
114.5(5)
114.6(6)
111.8(6)
An(VI) показано на примере нептуниевого соеди-
а Операции симметрии: a - IIa: (1/2 - x, y, 1 - z); IIb: (2 - x,
3/2 - y, z); IIc: (1/2 - x, y, 2 - z); b - IIa: (z, x, y); IIb: (3/2 - y, 1 -
нения IIb (рис. 3). Экваториальную плоскость гек-
z, -1/2 + x); IIc: (y - 1/2, 3/2 - z, 1 - x).
сагональной бипирамиды An(VI) формируют ато-
Кристаллическое строение комплексов An(VI)
103
Cs(1)
0
b
C(2c)
O(1c) C(1c)
O(2)
O(1a)
C(2)
Np(1)
O(11)
O(2c)
Ow(1d)
C(1)
C(2a)
C(1a)
O(1b)
O(1) O(12)
O(12)
O(2a)
O(2b)
C(1b)
Np(1)
C(2b)
O(11)
O(2) C(1)O(1)
C(2)
Рис. 3. Фрагмент структуры IIb. Эллипсоиды тепловых коле-
a
C(2a)
O(1a)
C(1a)
баний даны с 30%-ной вероятностью, операции симметрии: a -
O(2a)
(2 - x; 3/2 - y, z), b - (3/2 - y, 1 - z, -1/2 + x), c - (1/2 + z, 3/2 - x,
1 - y), d - (1 - y, 1/2 + z, 1 - x).
Рис.
5. Упаковка молекул в структуре IIb (проекция в
направлении [001]). Операция симметрии: a - (2 - x, 3/2 - y, z).
O(12a)
O(12)
U(1a)
U(1)
O(2d)
атомы O двух катионов AnO22+ и четырех анионов
O(2b)
O(11a)
O(11)
[C4H4O4]2-. На рис. 4 на примере соединения IIa
C(1d)
C(1b)
представлено окружение атома Cs(1). Длины свя-
C(2d)
O(1d)
O(1b)
зей внутри координационной сферы катионов Cs+
C(2b)
(Å) изменяются следующим образом:
3.022(5)-
Cs(1)
C(2e)
3.491(7) (среднее 3.302) для IIa, 3.017(6)-3.452(6)
O(1c)
(среднее 3.299) для IIb, 2.995(6)-3.483(10) (среднее
C(2c)
O(1e)
O(2g)
C(1c)
3.289) для IIc.
C(1e)
O(2f )
O(2c)
C(1g)
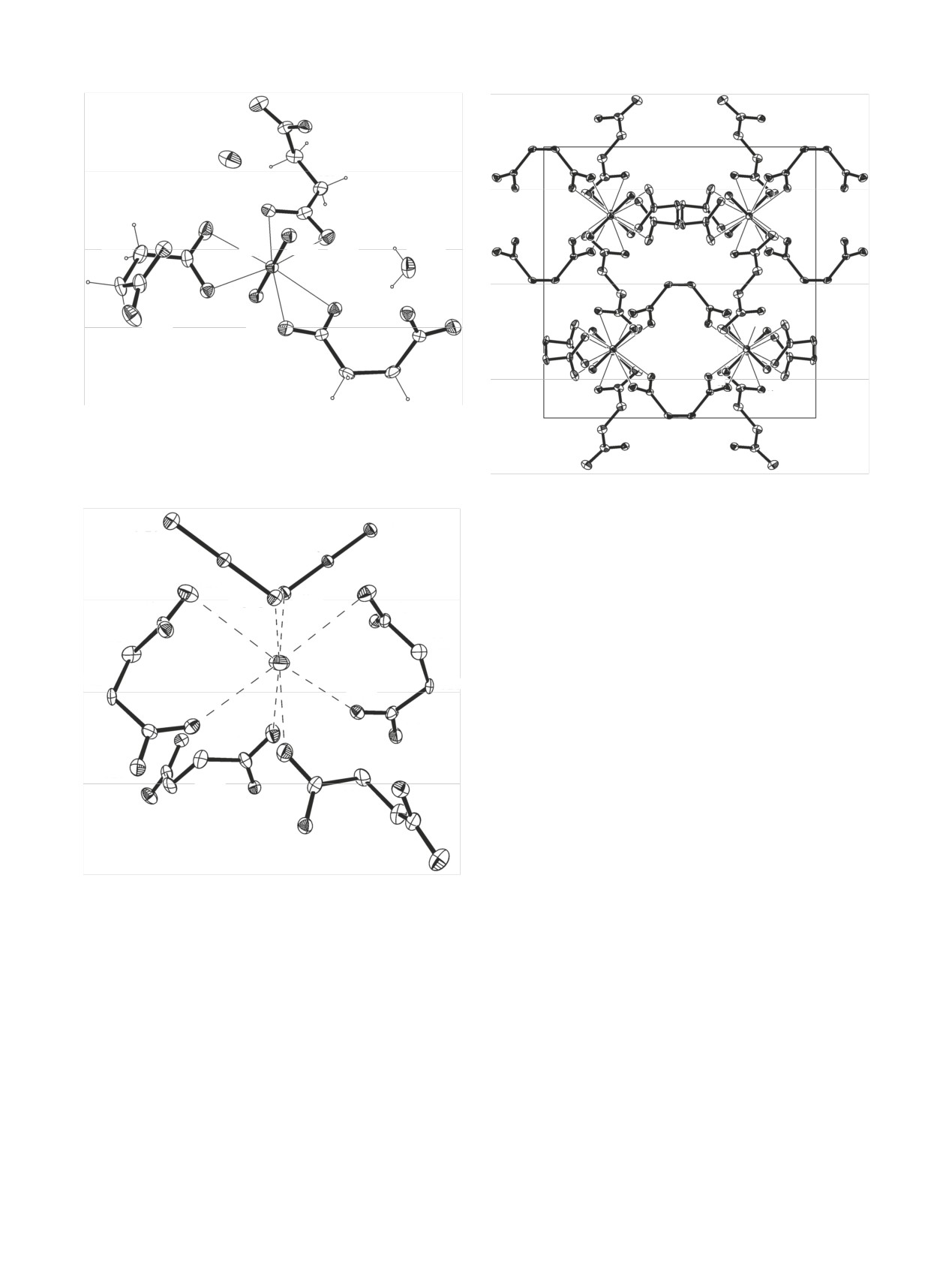
Кристаллографически независимый анион
C(1f )
[C4H4O4]2- в структуре II находится на оси второго
O(2e)
C(2g)
порядка и является хелатно-мостиковым лигандом
C(2f )
O(1g)
для катионов AnO22+. Он связывается с двумя ка-
тионами обеими карбоксилатными группами COO
O(1f )
c образованием 4-членного металлоцикла, как вид-
но на рис. 3. Катионы AnO22+ и анионы [C4H4O4]2-
связываются в анионный каркас, как показано на
Рис. 4. Координационное окружение атома Cs(1) в структу-
рис. 5 на примере нептуниевого соединения IIb. В
ре IIa (без атомов H). Эллипсоиды температурных колебаний
больших полостях анионного каркаса располага-
даны с 30%-ной вероятностью. Операции симметрии: a -
(3/2 - x, +y, 1 - z), b - (z, x, y), c - (1/2 - z, x, 1 - y), d - (-1/2 + y,
ются катионы Cs+ и молекулы воды. Каждый анион
1/2 - z, 1 - x), e - (1 - y, 1/2 - z, x), f - (-1/2 + z, 1/2 - x, 1 - y),
[C4H4O4]2- связывается также с четырьмя катиона-
g - (1 - z, 1/2 - x, y).
ми Cs+: с двумя катионами хелатным способом с
образованием 7-членного металлоцикла (рис. 4), с
мы O трех анионов [C4H4O4]2-. Средние длины свя-
двумя другими катионами Cs+ - монодентатным
зей (Å) в полиэдрах An(VI) меняются следующим
способом.
образом: An=O 1.758 (IIa), 1.753 (IIb) и 1.749 (IIc);
В обеих структурах I и II присутствуют молеку-
An-Osucc 2.454 (IIa), 2.451 (IIb) и 2.453 (IIc).
лы воды. В структуре I вода включена в координа-
Кристаллографически независимый катион Cs+
ционное окружение Pu и участвует в сравнительно
в структуре II находится в частном положении на
прочном водородном связывании (рис. 1, табл. 4).
оси второго порядка и имеет координационное ок-
В структуре II молекула воды расположена на оси
ружение в виде 8-вершинника, которое формируют
второго порядка в больших полостях анионного
104
И. А. Чарушникова и др.
Таблица 4. Водородные связи в структурах
D-H···A
D-H, Å
H···A, Å
D···A, Å
D-H···A, град
Операция симметрии
[PuO2(succ)(H2O)] (I)
Ow(1)-H(1)···O(3)
0.85(2)
2.08(15)
2.706(12)
129(16)
1 - x, 1 - y, 2 - z
Ow(1)-H(2)···O(1)
0.85(2)
1.87(8)
2.657(12)
154(18)
1/2 + x, 1/2 - y, -1/2 + z
C(2)-H(4)···O(12)
0.99
2.55
3.371(13)
140.7
1/2 + x, 1/2 - y, 1/2 + z
Cs2[(UO2)2(succ)3]·H2O (IIa)
Ow(1)-H(1)···O(2)
0.86
2.35
3.022(5)
135.8
-1/2 + y, 1/2 - z, 1 - x
C(2)-H(2)···O(12)
0.99
2.49
3.425(10)
156.7
1 - x, 3/2 - y, -1 + z
Cs2[(NpO2)2(succ)3]·H2O (IIb)
Ow(1)-H(1)···O(2)
0.86
2.54
3.017(6)
116.2
1/2 + y, 1/2 + z, -1/2 + x
C(2)-H(3)···O(12)
0.99
2.51
3.443(10)
156.5
3/2 - x, y, -z
Cs2[(PuO2)2(succ)3]·H2O (IIc)
Ow(1)-H(1)···O(2)
0.85
2.53
2.995(6)
115.3
-x, 1/2 + y, 3/2 - z
C(2)-H(3)···O(12)
0.99
2.51
3.445(11)
156.7
-x, 1/2 - y, z
Таблица 5. Геометрические характеристики анионов [C4H4O4]2- в плутониевых соединениях I и IIc: отклонения ато-
мов С от среднеквадратичной плоскости (Δ, Å), углы поворота карбоксилатных групп (φ1, φ2, град), угол между кар-
боксилатными группами (φ1,2, град)a
[PuO2(succ)(H2O)] (I)
Cs2[(PuO2)2(succ)3]·H2O (IIc)
Δ[C(1)]
+0.139(4)
Δ[C(1)]
+0.142(6)
Δ[C(2)]
-0.311(6)
Δ[C(2)]
-0.290(12)
Δ[C(3)]
+0.306(6)
Δ[C(2a)]
+0.290(12)
Δ[C(4)]
-0.134(4)
Δ[C(1a)]
-0.142(6)
φ1[O(1)C(1)O(2)]
56.4(7)
φ1[O(1)C(1)O(2)]
49.0(7)
φ2[O(3)C(4)O(4)]
39.4(8)
φ2[O(1a)C(1a)O(2a)]
49.0(7)
φ1,2
76(1)
φ1,2
70(1)
a Операция симметрии: a - (1/2 - x, y, 2 - z).
каркаса, статистически чередуясь с катионами Cs+.
На примере плутониевых соединений I и IIc
Контакты Ow···O, соответствующие наиболее веро-
сравним особенности строения исследованных
ятным водородным связям, возникают с атомами O
комплексов. На рис. 6 схематично изображены
(2g) и O(2f) (рис. 4), так как именно эти атомы об-
анионы [C4H4O4]2- связанные с диоксокатионами
разуют самые короткие межатомные расстояния с
PuO22+ в структурах. Диоксокатионы PuO2+ образу-
молекулами воды (табл. 4). Другие контакты за-
ют друг с другом углы ~7° (I) и ~80° (IIc). В табл. 5
метно слабее, например, с атомами O(11) и O(11a)
представлены геометрические характеристики сук-
они равны 3.232(5), 3.242(5) и 3.250(6) Å для U, Np
цинат-ионов: отклонения атомов C от среднеквад-
и Pu соответственно. Остальные контакты превы-
ратичной плоскости (Δ), углы поворота карбокси-
шают 3.4 Å. Отметим также, что в структурах I и II
латных групп относительно этой плоскости (φ1 и
имеют место слабые водородные связи типа C-
φ2) и двугранный угол между обеими группами
H···O, акцепторами водорода в которых являются
(φ1,2). Как видно из данных табл. 5, заметные раз-
атомы O катионов AnO2+ (табл. 4). Эти связи воз-
личия наблюдаются только в угловых характери-
никают внутри каркасных структур, дополнитель-
стиках, что обусловлено разной функцией анионов
но стабилизируя упаковку.
[C4H4O4]2-. В табл. 6 представлены торсионные уг-
лы в сукцинат-ионах, показывающие, что лиганды
O(11)
O(12a)
в соединениях имеют заслоненную гош-
C(2a)
C(3)
C(2)
Pu(1) C(2)
Pu(1a)
конформацию - торсионные углы в углеродных
C(1)
C(4)
C(1)
C(1a)
цепочках I и II близки к 60°. Внутри координаци-
O(11a)
O(12)
O(1)
O(3)
O(2)
онных полиэдров Pu наблюдается различие в дли-
O(2)
O(1a)
O(1)
O(4)
O(12)
O(12a)
нах связей Pu-Osucc: в соединении I средняя длина
Pu(1)
связей равна 2.375 Å (табл. 2), в соединении IIc -
Pu(1a)
2.453 Å (табл. 3). Такое различие всегда наблюда-
O(11)
ется в комплексах с анионами монокарбоновых
I
II
O(11a)
кислот, если анионы связываются с центральным
Рис. 6. Разная функция анионов [C4H4O4]2- в структурах I и II.
атомом монодентатным или хелатным способом,
Операция симметрии: 3/2 - x, 1/2 + y, 5/2 - z для I и 1/2 - x, y,
2 - z для IIc.
например, в комплексах U(VI) с ацетат-ионом [15,
Кристаллическое строение комплексов An(VI)
105
Таблица 6. Торсионные углы (τ, град) в соединениях I и IIa
I
II
Угол
τ
Угол
τ(IIa)
τ(IIb)
τ(IIc)
[O(1)C(1)C(2)C(3)]
164.8
[O(1)C(1)C(2)C(2a)]
-13.5
12.8
-14.6
[O(2)C(1)C(2)C(3)]
-17.1
[O(2)C(1)C(2)C(2a)]
167.4
-166.4
166.8
[C(1)C(2)C(3)C(4)]
-66.8
[C(1a)C(2a)C(2)C(1)]
-59.7
60.8
-59.5
[C(2)C(3)C(4)O(3)]
-179.4
[C(2)C(3)C(4)O(4)]
0.2
a Операции симметрии: a - IIa: (1/2 - x, y, 1 - z); IIb: (2 - x, 3/2 - y, z); IIc: (1/2 - x, y, 2 - z).
16], в комплексах U(VI) и Np(VI) с бензоат-ионом
ногидрат сукцината уранила существует в моно-
[17]. Такая же картина наблюдается и в соединени-
клинной модификации [1] с заслоненной конфор-
ях An(VI) с анионами бензолдикарбоновых кислот,
мацией аниона и в ромбической [2] - с затормо-
например, в димерном комплексе с кислым изофта-
женной конформацией аниона.
латом [AnO2(C8H5O4)2(H2O)]2 (An = U, Np) [18], в
В соединении K2[(UO2)2(succ)3], которое кри-
изофталате состава [PuO2(C8H4O4)] [19] или тереф-
сталлизуется в тетрагональной ячейке, оба незави-
талате UO2(C8H5O4Br)2 [20].
симых катиона K+ имеют кислородное окружение в
Сравним строение уранильного комплекса IIa с
виде нерегулярных 8-вершинников с межатомными
полуторными сукцинатами K2[(UO2)2(succ)3] и
расстояниями K-O в пределах 2.620(3)-3.004(3) Å
[Mg(H2O)6][(UO2)2(succ)3]·2H2O [9].
для внутрислоевого катиона и 2.650(3)-3.378(3) Å
для межслоевого катиона. Наименьшие межатом-
В калиевом соединении геометрические харак-
ные расстояния U···K и K···K равны
4.145 и
теристики анионного комплекса [(UO2)2(succ)3]2-
5.029 Å соответственно. Отметим, что согласно
близки к найденным в структуре IIa. Средние
анализу координационного окружения обоих неза-
длины связей в полиэдре атома U(1) равны: U=O
висимых катионов K+ с использованием програм-
1.771(3), U-Osucc
2.469(3) Å. Два независимых
мы TOPOS [21] вклад атомов О во взаимодействие
аниона [C4H4O4]2- имеют гош-конформацию, они
с катионами составляет ~94%.
связывают уранил в анионные слои, параллельные
плоскости (001). В структуре присутствуют два
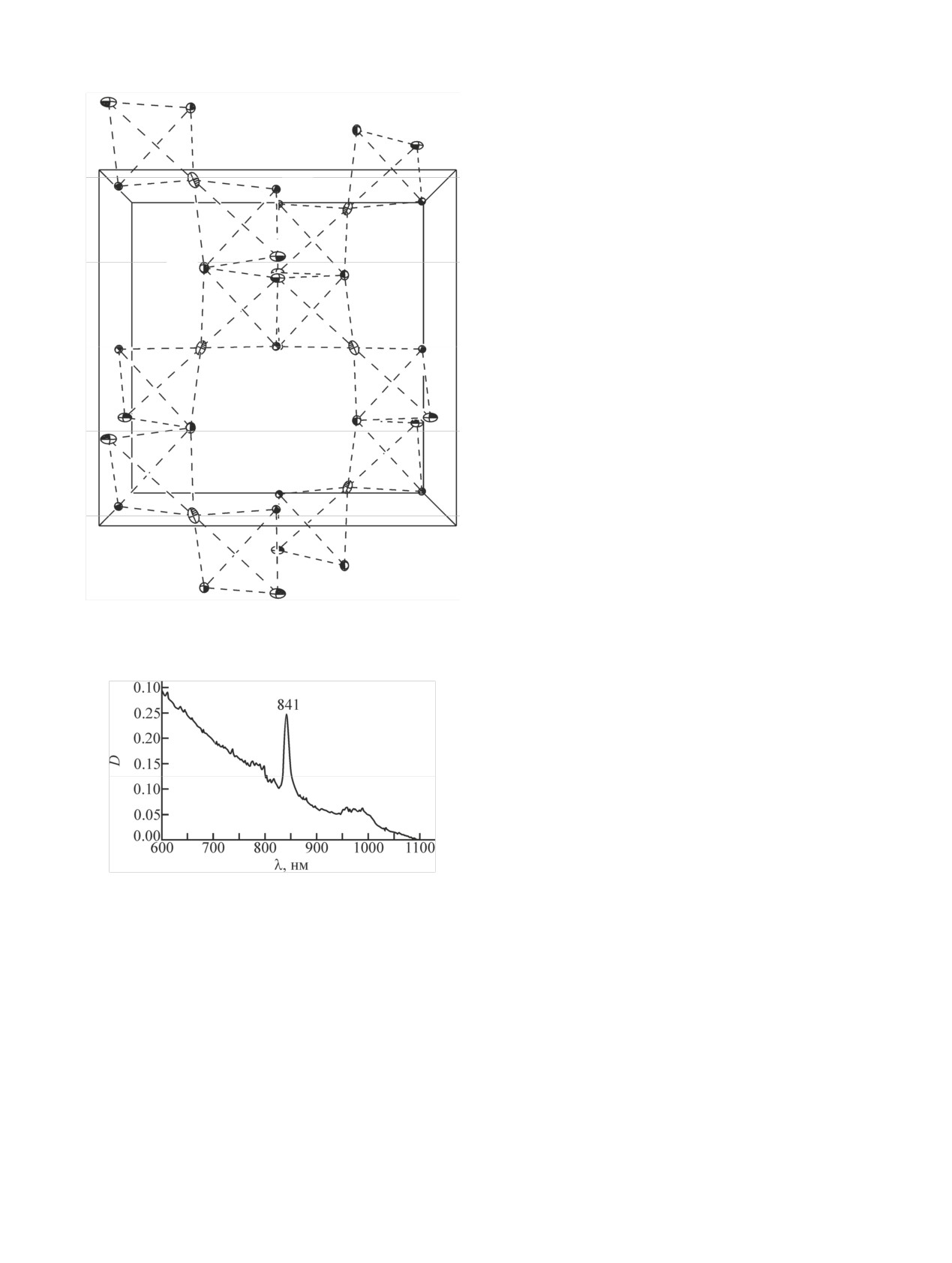
При переходе к цезиевому соединению IIa на-
независимых катиона калия. Катионы с атомом
блюдается упорядочение структуры и сингония
K(1) располагаются в полостях внутри слоя, катио-
кристаллической решетки повышается до кубиче-
ны с атомом K(2) связывают два соседних слоя. В
ской. При этом у катионов Cs+ сохраняется кисло-
соединении
[Mg(H2O)6][(UO2)2(succ)3]·2H2O гео-
родное окружение в виде 8-вершинника. В изо-
метрические характеристики координационного
структурных соединениях II каждый атом An свя-
окружения двух независимых атомов U(1) и U(2)
зан с тремя атомами Cs, образуя тетраэдр с меж-
характеризуются средними длинами связей: U=O
атомными расстояниями An···Cs 4.482 (IIa), 4.488
1.770(6), U-Osucc 2.474(6) Å. Два из трех независи-
(IIb) и 4.496 Å (IIc). Тетраэдры связываются через
мых сукцинат-анионов имеют гош-конформацию,
общие вершины - атомы Cs, следовательно, каж-
они связывают катионы UO2+ в цепочки вдоль на-
дый атом Cs связан с двумя атомами An и четырь-
правления [010] в кристалле. Третий независимый
мя атомами Cs, как показано на рис. 7 на примере
анион стягивает по две цепочки в ленты, у него
соединения IIa. Расстояния Cs···Cs равны
4.577
заторможенная конформация, обусловливающая
(IIa), 4.585 (IIb) и 4.608 Å (IIc). В результате фор-
зигзагообразное строение углеродной цепочки
мируется кубическая трехмерная катионная сетка,
С-С-С-С аниона. Гидратированные катионы Mg2+
построенная из тетраэдров, объединенных через
располагаются между лентами. В кристалле при-
три общие вершины. Сетка строится из спиралей с
сутствует трехмерная сеть водородных связей.
винтовыми осями четвертого порядка.
Очевидно, что два основных фактора влияют на
В соединении [Mg(H2O)6][(UO2)2(succ)3]·2H2O с
строение соединений с катионами K+, Cs+ и
ленточной структурой наименьшие межатомные
[Mg(H2O)6]2+ во внешней сфере. С одной стороны,
расстояния U···Mg и Mg···Mg равны 5.983 и 6.873 Å
влияют размеры и природа внешнесферного катио-
соответственно. В этой структуре важную роль иг-
на. С другой стороны, важным фактором является
рает водородное взаимодействие. У двух независи-
способность сукцинат-иона иметь различные кон-
мых анионов с гош-конформацией, связывающих
формации. Это, например, является причиной по-
катионы UO2+ в цепочки вдоль направления [010],
лиморфизма соединения [UO2(succ)(H2O)] [5]. Мо-
один атом О не участвует в водородном связыва-
106
И. А. Чарушникова и др.
счет влияния кристаллического поля. Однако тако-
го комплекса в растворе идентифицировать не уда-
лось [8], лучшая деконволюция эксперименталь-
c
ных ЭСП Pu(VI) в растворах янтарной кислоты
U(1c)
позволила предположить существование следую-
Cs(1d)
щих форм плутонила в растворе: PuO2(Hsucc)2,
0
b
PuO2Hsucc– и PuO2(succ)2- с максимумами погло-
Cs(1e)
щения при 836, 843 и 846 нм соответственно. По-
Cs(1)
этому, видимо, кристаллизация моносукцинатного
Cs(1b)
комплекса из раствора сопровождается депротони-
рованием нейтрального бисукцинатного комплекса
с частичным его разрушением для сохранения ба-
Cs(1a)
ланса электронейтальности. В ЭСП кристалличе-
U(1)
ского соединения IIc интенсивность полосы погло-
щения f-f-электронного перехода 3H4-3H6 очень
низкая, что объясняется правилом Лапорта, и экс-
периментально не определяется.
Таким образом, выделены в кристаллическом
виде и исследованы комплексы An(VI) с анионами
янтарной кислоты с соотношением металл : лиганд
a
1 : 1 (I) и 1 : 1.5 (II). Комплекс [PuO2(succ)(H2O)]
(I) изоструктурен [UO2(succ)(H2O)] [1], основу его
кристаллической упаковки составляет трехмерный
электронейтральный каркас. В комплексах общего
состава Cs2[(AnO2)2(succ)3]·H2O (II, An = U, Np, Pu)
основу структуры составляет анионный каркас. В
Рис. 7. Катионная сетка в структуре IIa. Операции симметрии:
структуре I анионы [C4H4O4]2- являются мостико-
a - (z, x, y), b - (y, z, x), c - (1/2 - x, y, 1 - z), d - (-1/2 + z, 1/2 -
x, 1 - y), e - (1/2 - y, z, 1 - x).
выми и каждый анион связывается монодентатно с
четырьмя атомами Pu, в II каждый анион выполня-
ет хелатно-мостиковую функцию и связывает два
атома An(VI). Координационное окружение атомов
Pu(VI) в структуре I - пентагональная бипирамида,
атомов An(VI) в структуре II - гексагональная би-
пирамида.
Рентгеноструктурный эксперимент выполнен в
ЦКП ФМИ ИФХЭ РАН.
Список литературы
[1] Kim J.-Y., Norquist A. J., O’Hare D. // Dalton Trans. 2003.
Рис. 8. ЭСП кристаллического [PuO2(succ)(H2O)] (I) [~2 мас%,
P. 2813-2814.
NaCl (плавл.) 87 мг].
[2] Bombieri G., Benetollo F., Del Pra A., Rojas R. // J. Inorg.
Nucl. Chem. 1979. Vol. 41. P. 201-203.
[3] Щёлоков Р. Н., Михайлов Ю. Н., Орлова И. М. и др. //
нии. У аниона, стягивающего цепочки в ленты, все
Координац. химия. 1985. Т. 11, N 7. С. 1010-1014.
четыре атома О задействованы в водородном свя-
[4] Wang J.-L., Deng Z.-Y., Duan S.-B., Xing Y.-H. // J. Coord.
зывании как акцепторы протонов.
Chem. 2012. Vol. 65, N 20. P. 3546-3555.
[5] Серёжкин В. Н., Пересыпкина Е. В., Серёжкина Л. Б.
В электронном спектре поглощения (ЭСП) кри-
и др. // ЖНХ. 2014. Т. 59, N 12. С. 1684-1691.
сталлического соединения I максимум поглощения
[6] Mihalcea I., Falaise C., Volkringer C. et al. // Inorg. Chem.
найден при 841 нм (рис. 8). Можно предположить,
Commun. 2014. Vol. 44, N 1. P. 63-66.
что образованию моносукцинатного комплекса
[7] Lucks C., Rossberg A., Tsushima S. et al. // Inorg. Chem.
2012. Vol. 51. P. 12288-12300.
плутонила в растворе, PuO2(succ), соответствует
[8] Sladkov V., Bessonov A., Roques J. et al. // New J. Chem.
положение максимума полосы поглощения 836 нм,
2018. Vol. 42, N 10. P. 7780-7788.
при переходе в кристаллическое состояние сдвиг в
[9] Novikov S. A., Grigoriev M. S., Serezhkina L. B., Serezh-
длинноволновую область увеличивается на 5 нм за
kin V. N. // J. Solid State Chem. 2017. Vol. 248. P. 178-182.
Кристаллическое строение комплексов An(VI)
107
[10] Федосеев А. М., Гоголев А. В., Шилов В. П. и др. //
[16] Чарушникова И. А., Крот Н. Н., Старикова З. А. //
Радиохимия. 2017. Т. 59, N 6. С. 502-509.
Радиохимия. 2008. Т. 50, N 2. С. 102-104.
[11] Бессонов А. А., Крот Н. Н. // Радиохимия. 2007. Т. 49, N 6.
[17] Чарушникова И. А., Григорьев М. С., Крот Н. Н. //
С. 500-502.
Радиохимия. 2010. Т. 52, N 2. С. 120-125.
[12] Sheldrick G. M. SADABS. Madison, Wisconsin (USA):
[18] Григорьев М. С., Чарушникова И. А., Федосеев А. М. //
Bruker AXS, 2008.
Радиохимия. 2015. Т. 57, N 5. С. 413-416.
[13] Sheldrick G. M. // Acta Crystallogr., Sect. A. 2008. Vol. 64, N
[19] Григорьев М. С., Чарушникова И. А., Федосеев А. М. //
1. P. 112-122.
Радиохимия. 2016. Т. 58, N 4. С. 302-310.
[14] Sheldrick G. M. // Acta Crystallogr., Sect. C. 2015. Vol. 71,
[20] Go Y. B., Wang X., Jacobson A. J. // Inorg. Chem. 2007. Vol.
N 1. P. 3-8.
46, N 16. P. 6594-6600.
[15] Григорьев М. С., Антипин М. Ю., Крот Н. Н.
//
[21] Blatov V. A. // IUCr CompComm Newslett. 2006. N 7. P. 4-
Радиохимия. 2004. Т. 46, N 3. С. 206-211.
38.