Радиохимия, 2019, т. 61, N 2, c. 93-99
93
Синтез и строение фенилацетатов U(VI), Np(VI) и Pu(VI)
© В. Н. Сережкин*а, М. С. Григорьевб, А. М. Федосеевб, Н. А. Буданцеваб, Л. Б. Сережкинаа
а Самарский национальный исследовательский университет им. акад. С. П. Королева,
443011, Самара, ул. Акад. Павлова, д. 1; * e-mail: Serezhkin@samsu.ru
б Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4
Получена 02.04.2018, после доработки 02.05.2018, принята к публикации 02.05.2018
УДК 548.736
Осуществлены синтез и рентгеноструктурное исследование кристаллов фенилацетатов [AnO2·
(C6H5CH2COO)2], где An = U (I), Np (II) или Pu (III). Соединения I-III изоструктурны, кристаллизуются
в моноклинной сингонии, пространственная группа C2/c, Z = 4. Основными структурными единицами
кристаллов I-III являются 1D цепочки [AnO2(C6H5CH2COO)2], относящиеся к кристаллохимической
группе AB11 (A = AnO2+, B11 = C6H5CH2COO-). С помощью метода молекулярных полиэдров Вороного-
Дирихле проанализированы межмолекулярные взаимодействия в структурах кристаллов [AnO2L2], где
L - бензоат- или фенилацетат-ион. Кристаллоструктурные данные подтверждены результатами иссле-
дования ИК и электронных спектров поглощения.
Ключевые слова: уранил, нептунил, плутонил, фенилацетаты, актинидное сжатие, молекулярные
полиэдры Вороного-Дирихле.
DOI: 10.1134/S0033831119020011
К настоящему времени сравнительно подробно
атомом О молекулы воды, которая играет роль мо-
изучены дикарбоксилаты UO2L2·nH2O, в составе
нодентатного концевого лиганда M1. Согласно ра-
которых содержатся анионы одноосновных насы-
ботам [4, 5], для комплексов с КХФ AB2В01М1 тео-
щенных или ненасыщенных алифатических кислот
ретически возможны два геометрических изомера,
HL [1]. Сведения же о дикарбоксилатах уранила,
отличающихся взаимным положением (цис- или
содержащих анионы одноосновных ароматических
транс-) донорных атомов мостикового лиганда B2
кислот, весьма ограничены. Наиболее широко оха-
в экваториальной плоскости иона уранила. Для
рактеризованы соединения U(VI) с бензойной ки-
транс-изомеров реализуется цепочечная 1D струк-
слотой (далее Hbox) и некоторыми ее галоген-, гид-
тура, примером которой могут служить комплексы
роксил- или алкилпроизводными. В частности, ус-
в указанных выше кристаллах [UO2(box)2(H2O)]·
тановлено, что взаимодействие гидроксида урани-
EtOH [6]. В то же время цис-изомеры имеют двухъ-
ла c Hbox при 400 К [2] или ацетата уранила c Hbox
ядерную
0D структуру, известным примером
в смеси воды и этилового спирта [3] приводит к
которой является [UO2(box)2(Dmfa)], где Dmfa -
образованию [UO2(box)2]. Согласно работам [2, 3],
N,N-диметилформамид [7, 8]. Среди охарактеризо-
в 1D цепочечной структуре кристаллов бензоата
ванных бензоатсодержащих комплексов уранила
уранила атомы U имеют КЧ 6, а все бензоат-ионы
известны также соединения, в которых атомы U
играют роль бидентатных мостиковых лигандов B2,
реализуют и КЧ 8. Примером являются, в частно-
поэтому уранилсодержащим комплексам отвечает
сти, одноядерные комплексы с КХФ AВ01 в струк-
кристаллохимическая формула AB2, где A = UO2+,
туре Na[UO2(box)3]·2H2O
[9] и центросиммет-
а B2 = box-. Здесь и далее обозначения типов коор-
ричные комплексы с КХФ AВ01M2 в кристаллах
динации лигандов и кристаллохимические форму-
[UO2(box)2(Dmso)2], где Dmso - диметилсульфок-
лы (КХФ) комплексов указаны в соответствии с
сид [10].
методом [4, 5]. При взаимодействии раствора бен-
В настоящей работе исследовано строение впер-
зоата серебра в этаноле с водным раствором хлори-
вые полученных солей фенилуксусной кислоты
да уранила были получены кристаллы [UO2(box)2·
(Hphac) AnO2(C6H5CH2COO)2 [An = U (I), Np (II),
(H2O)]·EtOH [6]. В их структуре уранилсодержа-
Pu (III)], которая является вторым членом гомоло-
щим комплексам, которые имеют 1D цепочечную
гического ряда одноосновных ароматических ки-
структуру, отвечает КХФ AB2В01М1. Согласно этой
слот С6H5-(CH2)n-COOH. В настоящее время из-
формуле, каждый атом U имеет КЧ 7, поскольку
вестна структура только одного фенилацетата
связан с двумя атомами О иона уранила, двумя ато-
U(VI) - Na[UO2(phac)3] [11]. Сведения о строении
мами О мостиковых анионов B2, двумя атомами О
каких-либо соединений Np или Pu, содержащих
бидентатного хелатного бензоат-иона В01, а также
phac-ионы, в базе данных [12] отсутствуют.
94
В. Н. Сережкин и др.
Таблица 1. Кристаллографические данные, параметры эксперимента и уточнения структур I-III
Параметр
I
II
III
Химическая формула
UO2(C6H5CH2COO)2
NpO2(C6H5CH2COO)2
PuO2(C6H5CH2COO)2
Сингония, пространственная группа, Z
Моноклинная, C2/c, 4
Моноклинная, C2/c, 4
Моноклинная, C2/c, 4
а, Å
19.6381(4)
19.706(3)
19.7025(7)
b, Å
10.6024(2)
10.3232(18)
10.4028(4)
c, Å
8.4733(1)
8.4158(14)
8.3929(2)
β, град
102.266(1)
102.127(5)
102.012(2)
V, Å3
1723.96(5)
1673.8(5)
1682.55(10)
Dx, г/см3
2.082
2.140
2.149
Излучение, λ, Å
MoKα, 0.71073
MoKα, 0.71073
MoKα, 0.71073
μ, мм-1
9.441
4.036
4.188
T, К
296(2)
100(2)
100(2)
Размеры кристалла, мм
0.24 ´ 0.14 ´ 0.06
0.22 ´ 0.04 ´ 0.03
0.36 ´ 0.04 ´ 0.03
Учет поглощения
Полуэмпирический, по эквивалентам
Tmin, Tmax
0.344, 0.601
0.635, 0.835
0.775, 0.891
θmax, град
34.70
29.98
30.00
Область h, k, l
-28 ≤ h ≤ 31, -17 ≤
-27 ≤ h ≤ 27, -14 ≤
-27 ≤ h ≤ 27, -14 ≤
k ≤16, -13 ≤ l ≤ 13
k ≤ 14, -11 ≤ l ≤ 11
k ≤ 14, -11 ≤ l ≤ 11
Число отражений: измеренных/независимых
9358/3759, 0.0286/2353
10675/2446, 0.0817/1445
8669/2456, 0.0418/1569
(N1), Rint/c I > 1.96σ(I) (N2)
Метод уточнения
Полноматричный МНК по F2
Число уточняемых параметров
106
106
106
Весовая схема
w = 1/[σ2(Fo2) +
w = 1/[σ2(Fo2) +
w = 1/[σ2(Fo2) +
(0.0107P)2 + 1.8029P],
(0.0218P)2,
(0.0112P)2,
P = (Fo2 + 2Fc2)/3
P = (Fo2 + 2Fc2)/3
P = (Fo2 + 2Fc2)/3
wR2 по N1
0.0360
0.0711
0.0434
R1 по N2
0.0148
0.0300
0.0182
S
0.997
0.984
0.953
Δρmax/Δρmin, e/Å3
0.610/-0.741
1.968/-1.668
0.780/-1.056
Экспериментальная часть
Рентгеноструктурный анализ. Строение со-
единений I-III установлено методом рентгеност-
Для синтеза использовали Hphac, перекристал- руктурного анализа монокристаллов. Измерения
лизованную из водного раствора. При получении I проводили на автоматическом четырехкружном
, прокаленный при 300°С непосредст- дифрактометре с двумерным детектором Bruker
твердый UO3
венно перед использованием, растворяли в насы- Kappa Apex II. Параметры элементарной ячейки
щенном при 40-50°С водном растворе Hphac при уточняли по всему массиву данных [14]. В экспе-
периодическом перемешивании. Мольное соотно- риментальные интенсивности рефлексов вносили
составляло (1.2-1.4) : 1. В тече- поправки на поглощение с использованием про-
шение Hphac : UO3
ние 1-2 ч в реакционной смеси формировались граммы SADABS [15]. Структуры расшифровыва-
крупные призматические кристаллы ярко-желтого ли прямым методом (SHELXS97 [16]) и уточняли
цвета. В случае синтеза II и III исходными вещест- полноматричным методом наименьших квадратов
O, (SHELXL-2014 [17]) по F2 по всем данным в анизо-
вами служили 237NpO2(OH)2 и 239PuO2(OH)2·xH2
приготовленные озонированием водной суспензии тропном приближении для всех неводородных ато-
оксалатов четырехвалентных 237Np и 239Pu [13]. Ре- мов. Атомы H фенилацетат-ионов размещали в гео-
акцию проводили так же, как и в случае комплекса метрически вычисленных позициях с изотропными
уранила, но температура реакционной смеси не температурными факторами, равными 1.2 эквива-
превышала
40°С во избежание восстановления лентного изотропного фактора атома C, с которым
шестивалентных Np и Pu. В выбранных условиях они связаны. Кристаллографические данные, пара-
побочная реакция восстановления не сказывается метры эксперимента и уточнения структур I-III
на росте кристаллов искомых соединений. Соли II приведены в табл. 1. Основные длины связей и ве-
и III выделяются в форме очень тонких игольчатых личины валентных углов, а также параметры водо-
кристаллов, бледно-зеленых для Np и коричневато- родных связей в структурах I-III представлены в
желтых для Pu. В твердом виде все соединения ус- табл. 2. КЧ всех атомов определяли с помощью
тойчивы, по крайней мере, в течение нескольких метода пересекающихся сфер [18]. Координаты
дней.
атомов и тепловые параметры депонированы в
Синтез и строение фенилацетатов U(VI), Np(VI) и Pu(VI)
95
Таблица 2. Основные длины связей и валентные углы в I-III
Параметр
I
II
III
Гексагональная бипирамида AnO2O6
Связь
d, Å
An(1)-O(1)
1.7476(18) (×2)
1.737(5) (×2)
1.735(3) (×2)
An(1)-O(2)
2.4940(14) (×2)
2.493(4) (×2)
2.495(3) (×2)
An(1)-O(3)
2.4343(14) (×2)
2.423(4) (×2)
2.419(2) (×2)
An(1)-O(3')
2.5318(13) (×2)
2.505(4) (×2)
2.504(2) (×2)
Угол
ω, град
O(1)An(1)O(1)
180.0
180.0
180.0
O(2)An(1)O(3)
70.28(5) (×2)
70.21(13) (×2)
69.91(8) (×2)
O(2)An(1)O(3')
50.78(4) (×2)
51.19(12) (×2)
51.29(8) (×2)
O(3)An(1)O(3')
60.97(6) (×2)
60.85(14) (×2)
61.11(10) (×2)
Фенилацетат-анионы (тип координации В11)
Связь
d, Å
C(1)-O(2)
1.244(2)
1.238(7)
1.249(4)
C(1)-O(3)
1.282(2)
1.294(7)
1.281(4)
C(1)-C(2)
1.493(3)
1.492(8)
1.508(5)
C(2)-C(3)
1.498(3)
1.499(8)
1.505(5)
C(3)-C(4)
1.365(4)
1.383(9)
1.373(5)
C(4)-C(5)
1.379(6)
1.383(11)
1.371(7)
C(5)-C(6)
1.343(7)
1.361(13)
1.371(7)
C(6)-C(7)
1.356(6)
1.370(12)
1.393(7)
C(7)-C(8)
1.385(4)
1.392(9)
1.384(6)
C(3)-C(8)
1.376(3)
1.370(9)
1.394(5)
Угол
ω, град
O(2)C(1)O(3)
117.18(17)
117.0(5)
117.5(3)
O(2)C(1)C(2)
123.27(19)
124.2(6)
122.6(3)
O(3)C(1)C(2)
119.47(18)
118.7(5)
119.6(3)
C(1)C(2)C(3)
115.57(19)
114.5(5)
115.2(3)
C(2)C(3)C(4)
120.1(3)
119.6(6)
120.6(4)
C(2)C(3)C(8)
121.6(3)
122.3(6)
120.2(4)
C(3)C(4)C(5)
120.4(4)
121.5(8)
121.0(4)
C(4)C(5)C(6)
121.3(4)
118.7(8)
120.3(5)
C(5)C(6)C(7)
119.2(4)
121.8(7)
119.9(4)
C(6)C(7)C(8)
120.6(4)
118.4(7)
119.6(4)
C(3)C(8)C(7)
120.2(3)
121.5(6)
120.0(4)
Параметры водородных связей
a
Связь С(2)-H(2)···O(2) [контакту H(2)···O(2) отвечает грань ПВД с РГ = 5)
d[С(2)···О(2)], Å
3.146(3)
3.129(9)
3.151(5)
d[С(2)···H(2)], Å
0.97
0.99
0.99
d[H(2)···О(2)], Å
2.32
2.28
2.32
Ω[H(2)···О(2)], %б
17.8
17.9
17.5
Угол С(2)-H(2)···О(2), град
143
143
141
Связь С(6)-H(5)···O(1) [контакту H(5)···O(1) отвечает грань ПВД с РГ = 0)а
d[С(6)···О(1)], Å
3.152(4)
3.127(8)
3.125(5)
d[С(6)···H(5)], Å
0.93
0.95
0.95
d[H(5)···О(1)], Å
2.83
2.78
2.79
Ω[H(5)···О(1)], %б
12.2
12.8
12.6
Угол С(6)-H(5)···О(1), град
102
102
102
Связь С(7)-H(6)···O(2) [контакту H(6)···O(2) отвечает грань ПВД с РГ = 0)а
d[С(7)···О(2)], Å
3.656(4)
3.558(9)
3.552 (5)
d[С(7)···H(6)], Å
0.93
0.95
0.95
d[H(6)···О(2)], Å
2.73
2.61
2.61
Ω[H(6)···О(2)], %б
12.3
13.3
13.5
Угол С(7)-H(6)···О(2), град
174
174
174
а РГ - ранг грани, указывает минимальное число химических связей, соединяющих атомы, ПВД которых имеют общую грань. Для
межмолекулярных взаимодействий РГ = 0, а для внутримолекулярных РГ > 1.
б Ω - телесный угол (выражен в процентах от 4π стерадиан), под которым общая грань полиэдров Вороного-Дирихле соседних
атомов видна из ядра любого из них.
96
В. Н. Сережкин и др.
Кембриджском банке структурных данных, CCDC
O(1d)
C(7d) C(6d)
O(2d)
1831774, 1831772 и 1831773 для I, II и III соответ-
U(1d)
C(8d)
C(1d)
C(5d)
ственно.
C(3d)
C(2b)
C(2d)
C(4b)
O(3b)
Спектры поглощения кристаллических ком-
O(3d)
C(4d)
плексов измеряли при комнатной температуре на
C(5b) C(3b) C(1b)
U(1)
спектрометрах IR Prestige21 и Shimadzu 3100 в диа-
C(8b)
O(2)
C(7) C(6)
C(7b)
O(2b)
C(3)
C(6b)
O(1)
O(1b)
пазонах 4000-400 см-1 (разрешение 2 см-1, число
C(8)
C(1)
сканирований 60) и 400-1300 нм (разрешение 1 нм,
C(2a)
C(4a)
C(5)
O(3a)
C(4)
ширина щели 1 нм) соответственно. Образцы для
O(3)
C(2)
C(7c)
C(5a) C(3a)
C(1a)
измерений готовили по обычной методике прессо-
O(1c)
C(8a)
C(8c)
ванием тонкодисперсной смеси соединения с плав-
O(2a) U(1a) O(1a)
O(2c)
C(6a)
C(3c) C(6c)
C(7a)
C(1c)
леным NaCl. Содержание исследуемого вещества в
C(5c)
матрице составляло около 1% для ИК спектров и
O(3c) C(2c) C(4c)
2-10% для электронных спектров в зависимости от
коэффициента экстинкции соответствующего акти-
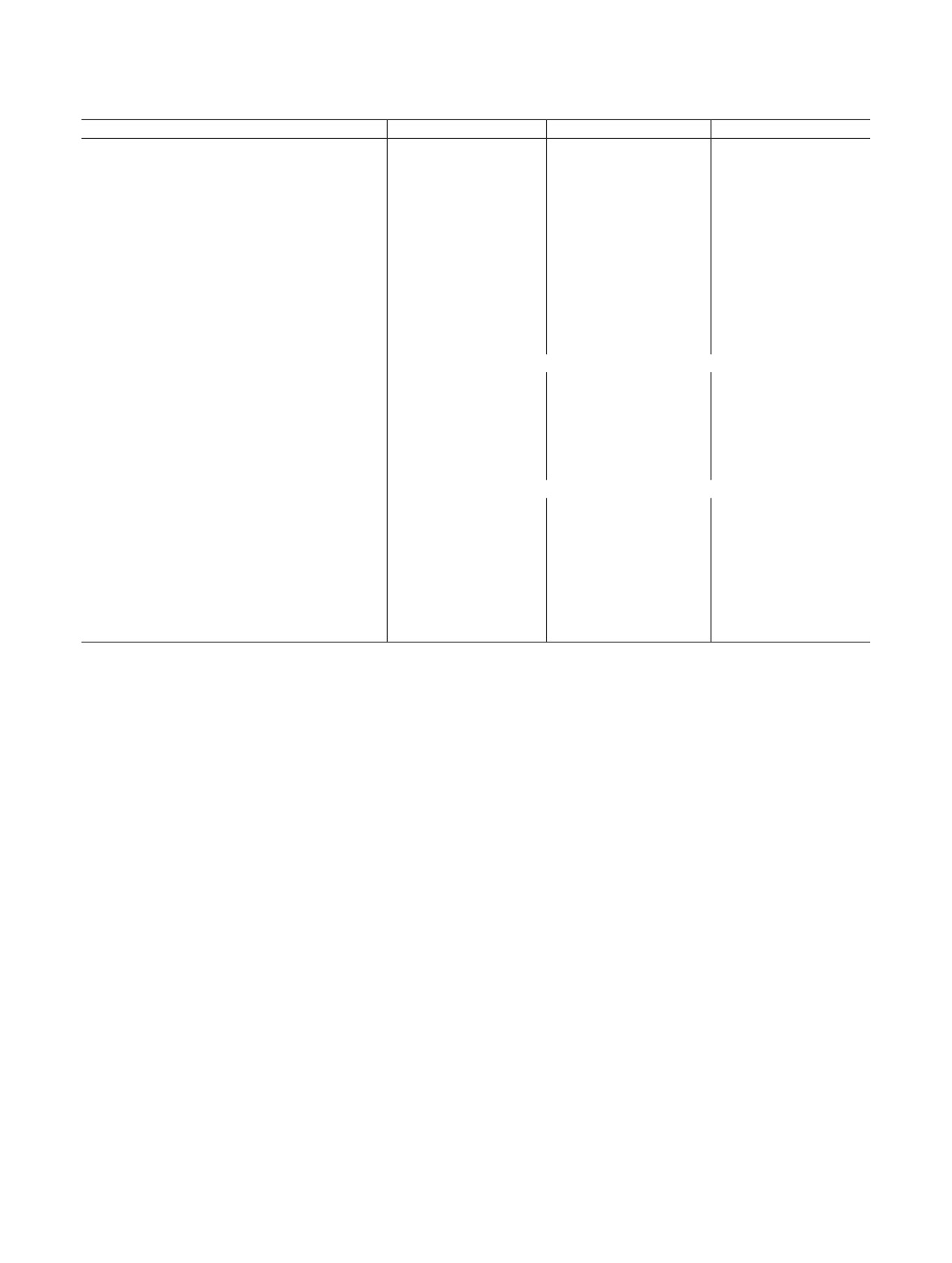
Рис. 1. Строение группы [UO2(C6H5CH2COO)2] в структуре I
нил-иона.
(эллипсоиды 50%-ной вероятности).
Результаты и обсуждение
Полученные рентгенографические данные сви-
U
детельствуют об изоструктурности соединений I-
C
III, кристаллизующихся в пространственной груп-
O
пе C2/c. Атомы актинида (An = U, Np или Pu) зани-
мают частные позиции с симметрией Сi и проявля-
ют КЧ 8. Координационными полиэдрами An явля-
а
ются гексагональные бипирамиды, на главной оси
которых находятся атомы кислорода актинильных
групп AnO2+. В экваториальной плоскости бипира-
мид AnO8 находятся шесть атомов О четырех фе-
нилацетат-ионов. Каждый анион реализует тип ко-
ординации B11, поскольку одновременно связан с
б
двумя атомами U, причем с одним монодентатно, а
с другим - бидентатно с образованием четырех-
членного цикла (рис. 1). Расстояния An=O находят-
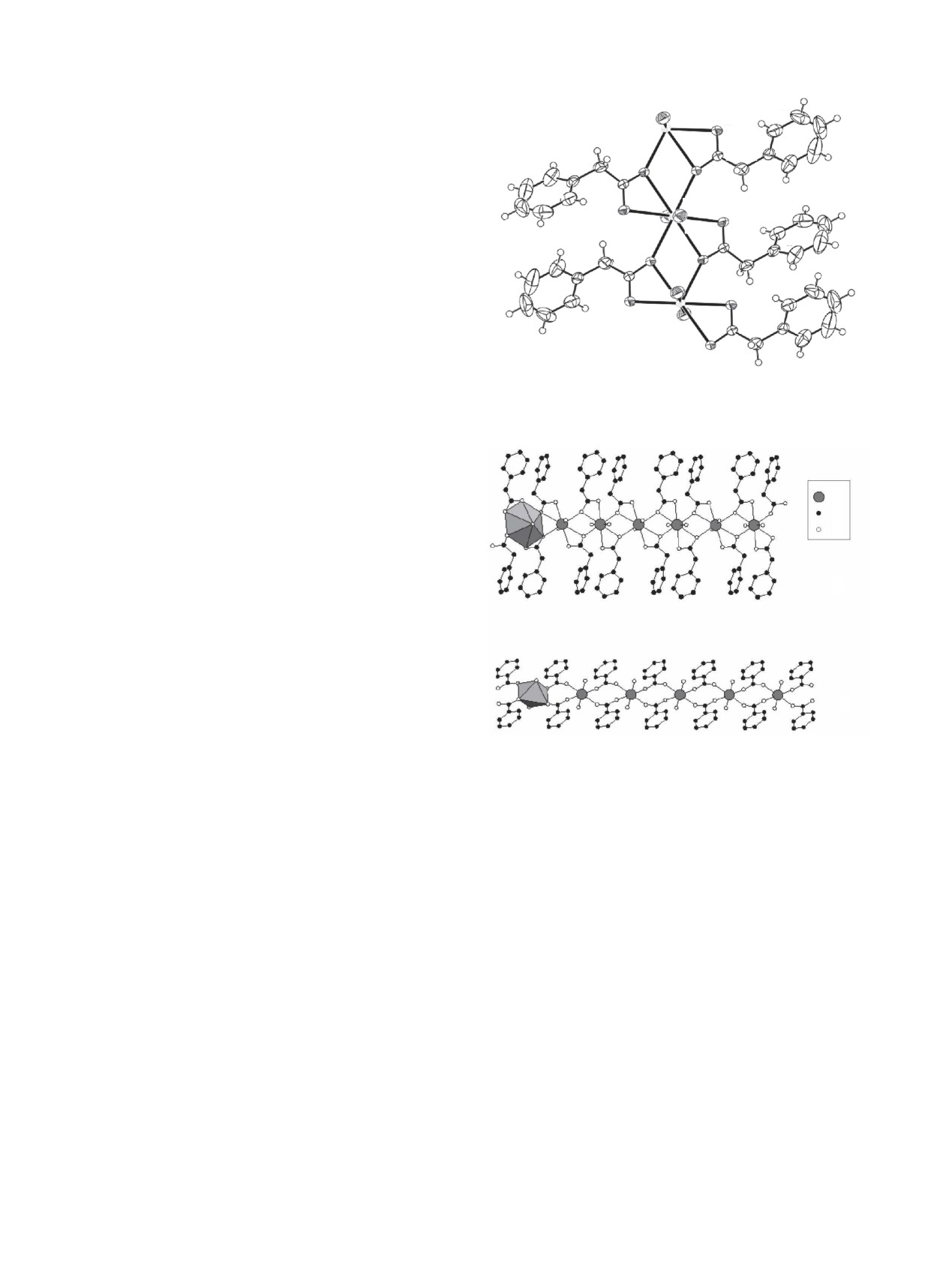
Рис. 2. Фрагмент уранилкарбоксилатной цепочки в структуре
ся в диапазоне 1.73-1.75 Å, а длины связей An-O в
кристаллов. а
-
[UO2(C6H5CH2COO)2] (I), б
-
[UO2(C6H5COO)2]
(IV). Слева показан координационный
экваториальной плоскости лежат в области 2.42-
полиэдр атома U. Для упрощения атомы H опущены.
2.53 Å (табл. 2). Основной структурной единицей
кристаллов I-III являются электронейтральные 1D
цепочки
[AnO2(phac)2], которым отвечает КХФ
что, несмотря на разные КЧ атомов U, объем поли-
AB211 (A = AnO2+, B11 = phac-).
эдров Вороного-Дирихле (Vvdp) в кристаллах I
(9.43 Å3) и IV (9.10 Å3 [2] или 9.31 Å3 [3]) в преде-
В цепочках [AnO2(phac)2] (рис. 2, а), которые
лах погрешности совпадает со средней величиной
распространяются вдоль направления [001], крат-
Vvdp атомов U(VI) в полиэдрах UOn [9.3(4) Å3] при
чайшие расстояния An-Аn равны с/2 и составляют
n от 5 до 9 [19].
≈4.24 (I), 4.21 (II) и 4.20 Å (III). Отметим, что в
цепочках упомянутой выше структуры
[UO2·
Наличие метиленового мостика -СН2- в фенил-
(box)2] (IV) [2, 3] с КХФ AB2 (рис. 2, б) кратчайшее
ацетате позволяет бензольному циклу легко изме-
расстояние U-U в цепочке значительно больше и
нять пространственную ориентацию за счет враще-
равно 5.30 Å (совпадает с трансляцией c). Различие
ния вокруг одинарной связи С-С. Если в бензоат-
более чем на 1 Å минимального d(An-An) в сте-
ионах диэдрический угол между плоскостью, про-
хиометрически однотипных линейных цепочках
ходящей через атомы С и О карбоксильной груп-
[AnO2(L)2] является следствием изменения типа
пы, и плоскостью бензольного цикла из-за сопря-
координации бидентатного карбоксилатного лиган-
жения π-связей обычно близок к 0 (в структуре IV
да L от B2 (бензоат-ион) к В11 (фенилацетат-ион),
он составляет ≈13° [3], а в [UO2(box)2(Dmso)2] [10]
что приводит к росту КЧ урана от 6 до 8. Заметим,
- ≈5°), то в структуре I такой угол равен ≈66°. Кро-
Синтез и строение фенилацетатов U(VI), Np(VI) и Pu(VI)
97
Таблица 3. Основные параметры межмолекулярных взаимодействий в структурах I-IVa
I
II
III
IV [2]
Контакт
SAZ,
ΔAZ,
SAZ,
ΔAZ,
SAZ,
ΔAZ,
SAZ,
ΔAZ,
A/Z
kAZ
d, Å
kAZ
d, Å
kAZ
d, Å
kAZ
d, Å
Å2
%
Å2
%
Å2
%
Å2
%
O/O
-
-
-
-
-
-
-
-
-
-
-
-
2
4.37
3.3
1.3
C/O
16
3.15-3.92
7.6
2.3
16
3.13-3.88
7.1
2.1
16
3.13-3.91
7.3
2.2
16
3.77-3.82
7.7
3.0
H/O
52
2.73-5.92
95.5
28.8
52
2.61-5.86
95.1
28.9
52
2.61-5.87
94.3
28.6
72
3.02-4.20
124.6
48.4
C/C
2
3.66
<0.1
<0.1
2
3.54
0.4
0.1
2
3.56
0.3
0.1
76
3.56-4.09
41.6
16.1
H/C
90
2.95-4.26
69.9
21.1
94
2.83-4.67
73.5
22.3
90
2.84-4.16
73.8
22.4
56
3.25-4.02
19.2
7.5
H/H
80
2.64-5.51
158.2
47.8
78
2.53-5.69
153.2
46.5
78
2.56-5.69
154.2
46.7
22
2.45-3.81
61.1
23.7
Сумма
240
2.64-5.92
331.3
100.0
242
2.53-5.86
329.2
100.0
238
2.56-5.87
329.9
100.0
244
2.45-4.37
257.5
100.0
a kAZ
- общее число всех граней A/Z с рангом, равным 0 у молекулярного ПВД, в расчете на одну формульную единицу
[AnO2(L)2], d - диапазон соответствующих межатомных расстояний A-Z, SAZ - общая площадь всех граней указанного типа у
ПВД атомов, содержащихся в одной формульной единице вещества, ΔAZ - парциальный вклад (в процентах) соответствующих
невалентных контактов A/Z в величину интегрального параметра 0S = ∑SAZ (указан в последней строке) молекулярного ПВД.
ме того, если в цепочках [UO2(box)2] бензольные
π-стекинг (контакты С/C с ΔСС ≈ 16%), в то время
циклы всех бензоат-ионов взаимно параллельны,
как вклад С-Н···π-взаимодействий понижен до ≈8%
то в цепочках [AnO2(phac)2] в результате поворота
(табл. 3). Межмолекулярные взаимодействия С/O с
вокруг связи С-С бензольные циклы соседних фе-
ΔСО ≈ 3% в структурах как IV, как и I-III являются
нилацетат-ионов практически взаимно перпендику-
малозначимыми.
лярны (в стукрурах I-III такие углы равны соот-
Отметим, что в структурах I-III кратчайшее
ветственно ≈81, 83 и 82°, рис. 2). Разная взаимная
расстояние между центрами бензольных циклов
ориентация соседних бензольных циклов в струк-
(dCg) составляет ≈5.1 Å, тогда как в IV оно равно
турах I-III и IV отражается на особенностях нева-
4.06 Å. Поэтому заключение о наличии π-стекинга
лентных взаимодействий, реализующихся в струк-
в структуре IV и его отсутствие в I-III, опираю-
турах их кристаллов, для анализа которых был ис-
щееся на результаты анализа по методу молекуляр-
пользован метод молекулярных полиэдров Вороно-
ных ПВД, полностью согласуется с критерием Δππ
го-Дирихле (ПВД) [20, 21].
[22], согласно которому π-стекинг играет значи-
Согласно полученным данным, в структурах
мую роль в организации супрамолекулярной архи-
кристаллов I-III реализуется только 5 из 10 теоре-
тектуры кристаллов лишь при условии, что Δππ =
тически возможных типов межмолекулярных кон-
ΔСС + ΔСN составляет не менее 2% величины 0S, а
тактов (табл. 3). Основной вклад в связывание це-
dCg не превышает 4.1 Å.
почек [AnO2(phac)2] вносят дисперсионные взаимо-
С ростом порядкового номера An в I-III наблю-
действия H/H, на которые приходится ≈46-48%
дается актинидное сжатие, сопровождающееся тре-
общей площади граней молекулярного ПВД (0S),
мя эффектами, которые, как правило, наблюдаются
отвечающих межмолекулярным взаимодействиям.
в изоструктурных соединениях An(VI) [23]. Так, в
Второй по значимости вклад вносят водородные
ряду U-Np-Pu закономерно уменьшается длина
связи C-H···O (контакты H/О в табл. 3, детальные
связей An=O в диоксокатионе AnO2+ (соответст-
характеристики некоторых из них указаны в табл. 2),
венно 1.748, 1.737 и 1.735 Å), уменьшается объем
которым отвечает парциальный вклад ΔHO ≈ 29%.
полиэдра Вороного-Дирихле атома An (9.43, 9.28 и
Одновременно значительную роль (≈21-22%) игра-
9.25 Å3) и увеличивается безразмерный второй мо-
ют и С-Н···π-взаимодействия, которым в табл. 3
мент инерции этого полиэдра (G3), который равен
отвечают контакты Н/C. Вклад в связывание урани-
0.083936, 0.083977 и 0.083984 соответственно. Рост
ланионных цепочек двух оставшихся типов межмо-
G3 показывает, что увеличение числа 5f-электронов
лекулярных контактов - С/O и С/C соответственно
в ряду U-Np-Pu сопровождается закономерным
с Δ ≈ 2 и 0.1% - близок к нулю.
уменьшением степени сферичности ПВД атома
актинида.
По сравнению с I-III в кристаллах IV реализу-
ется один дополнительный тип дисперсионных
ИК спектры соединений I-III близки, что отве-
взаимодействий (контакты O/O c Δ ≈ 1%, табл. 3).
чает сходству их кристаллического строения. Боль-
Основной же вклад в связывание цепочек [UO2
шое число узких хорошо разрешенных полос по-
(box)2] вносят водородные связи C-H···O, для кото-
глощения различной интенсивности в спектрах
рых ΔHO ≈ 48%, тогда как вклад дисперсионных
соответствует колебаниям различных функцио-
взаимодействий H/H снижен до ≈24%. В отличие
нальных групп в составе соединений. Различия в
от I-III в структуре IV значительную роль играет
положениях максимумов полос при переходе от
98
В. Н. Сережкин и др.
Рис. 4. Фрагмент оптического спектра [PuO2(C6H5CH2COO)2]
Рис. 3. ИК спектр [UO2(C6H5CH2COO)2] (I).
(III).
одного соединения к другому не превышают не-
Влияние координации лиганда на состояние ак-
скольких обратных сантиметров. На рис. 3 пред-
тинильной группы отмечено и изменениями в элек-
ставлен ИК спектр [UO2(C6H5CH2COO)2]. В табл. 4
тронных спектрах (ближний ИК и видимый диапа-
приведены волновые числа максимумов основных
зоны) изученных соединений, наиболее ярко про-
полос поглощения и их предполагаемое отнесение,
являющимися в спектре комплекса Pu(VI) (элек-
сделанное с учетом известного спектра свободного
тронная конфигурация 5f2). На рис. 4 дан фрагмент
лиганда и литературных данных [24-27]. Слабая
оптического спектра [PuO2(C6H5CH2COO)2], в ко-
широкая полоса в высокочастотном диапазоне обу-
тором наблюдается узкая интенсивная полоса f-f-
словлена колебаниями молекулярной воды, окклю-
электронного перехода 3H4-3H6 с максимумом при
дированной в ходе приготовления образца. Отме-
841.7 нм и несколько длинноволновых сателлитов.
чено, что значения колебательных частот аромати-
Максимум основной полосы смещен в длинновол-
ческого кольца мало изменяются относительно не-
новую часть спектра по сравнению со спектром
гидратированного плутонил-иона [28]. В коротко-
координированной Hphac. Это, видимо, объясняет-
ся наличием метиленовой группы, экранирующей
волновой части спектра присутствуют малоинтен-
сивные слабо разрешенные полосы “уранилоподоб-
ароматический фрагмент от влияния карбоксиль-
ных” переходов. Рассчитанный коэффициент экс-
ной группы и атома U. Как следствие координации
тинкции в максимуме основной полосы поглоще-
аниона фенилуксусной кислоты уранил-ионом, в
ния равен 230 л·моль-1·см-1. Спектр [NpO2(C6H5·
спектре исчезает полоса, отвечающая неионизиро-
CH2COO)2] менее выразителен, в нем присутству-
ванной Hphac (1765 см-1 для свободного лиганда),
ют диффузные полосы f-f-электронных переходов
и проявляются полосы валентных колебаний кар-
из основного состояния 2F5, характерные для рас-
боксилат-иона. К валентным колебаниям νas(UO2+)
творов и твердых комплексов NpO2+-иона (элек-
отнесена сильная полоса при 966 см-1. Это значе-
тронная конфигурация 5f1). Основная полоса имеет
ние не выходит за диапазон частот, характерных
малую интенсивность (ε = 40 л·моль-1·см-1), ее мак-
для комплексов уранила, в которых экваториаль-
симум при 1228 нм, как и в случае комплекса
ное окружение состоит из атомов O. Можно отме-
Pu(VI), несколько смещен в длинноволновую часть
тить, что νas(AnO2+) мало меняется для соединений
спектра по сравнению со спектром гидратирован-
Np(VI) и Pu(VI). Это коррелирует со структурными
ного NpO2+-иона [29].
данными, в соответствии с которыми межатомные
расстояния An-O в кристаллической решетке ком-
Работа выполнена в рамках государственного
плексов I-III различаются мало.
задания Минобрнауки России по проекту
Таблица 4. Положение максимумов основных полос поглощения в ИК спектре [UO2(C6H5CH2COO)2] и их возмож-
ное отнесение
Волновое число, см-1
Отнесение
Волновое число, см-1
Отнесение
3070 сл, 3036 сл
ν(CH)arom
966 ср
νas(UO2)
2896 сл
ν(CH)aliph
944 сл
ν(C-COO)
1548 с, 1540 с
ν (COO) + ν(CC)arom
914 ср, 842 сл
γ(CH)ip
1460 с, 1422 ср
ν (COO) + δ(CH)
720 с
γ(CH)oop
1396 с
ν(COO)
698 ср, 668 ср
δ(COO)
1336 с
ω(CH2)
564 ср
δ(CCC)arom
1286 с, 1254 ср
ν(CC)arom + γ(CH)ip
480 сл
ρ(COO)
1160 сл, 1080 сл, 1036 сл
δ(CCC)
Синтез и строение фенилацетатов U(VI), Np(VI) и Pu(VI)
99
4.5037.2017/8.9. Рентгенодифракционные экспери-
химия. 2017. T. 59, N 6. С. 502-509.
[14] SAINT-Plus (Version 7.68). Madison, Wisconsin (USA):
менты проведены в ЦКП ФМИ ИФХЭ РАН при
Bruker AXS, 2007.
частичном финансировании Министерством науки
[15] Sheldrick G. M. SADABS. Madison, Wisconsin (USA):
и высшего образования РФ (тема N AAAA-A18-
Bruker AXS, 2008.
118040590105-4).
[16] Sheldrick G. M. // Acta Crystallogr., Sect. A. 2008. Vol. 64,
N 1. P. 112-122.
[17] Sheldrick G. M. // Acta Crystallogr., Sect. C. 2015. Vol. 71,
Список литературы
N 1. P. 3-8.
[1] Loiseau T., Mihalcea I., Henry N., Volkringer C. // Coord.
[18] Cережкин В. Н., Михайлов Ю. Н., Буслаев Ю. А. // ЖНХ.
Chem. Rev. 2014. Vol. 266-267. P. 69-109.
1997. Т. 42, N 12. С. 2036-2077.
[2] Cousson A., Proust J., Pages M. et al. // Acta Crystallogr.,
[19] Serezhkin V. N. // Structural Chemistry of Inorganic Actinide
Sect. C. 1990. Vol. 46, N 6. P. 2316-2318.
Compounds. Eds S. V. Krivovichev, P. C. Burns, I. G. Tana-
[3] Gao X., Wang C., Shi Z.-F. et al. // Dalton Trans. 2015. Vol.
naev. Amsterdam: Elsevier, 2007. P. 31-65.
44, N 25. P. 11562-11571.
[20] Сережкин В. Н., Сережкина Л. Б. // Кристаллография.
[4] Сережкин В. Н., Медведков Я. А., Сережкина Л. Б., Пуш-
2012. Т. 57, N 1. С. 39-49.
кин Д. В. // ЖФХ. 2015. Т. 89, N 6. С. 978-988.
[21] Serezhkin V. N., Savchenkov A. V. // Cryst. Growth Des. 2015.
[5] Serezhkin V. N., Vologzhanina A. V., Serezhkina L. B. et al. //
Vol. 15, N 6. P. 2878-2882.
Acta Crystallogr., Sect. B. 2009. Vol. 65, N 1. P. 45-53.
[22] Новиков С. А., Пересыпкина Е. В., Сережкина Л. Б. и
[6] Nierlich M., Iroulart G., Vigner D. et al. // Acta Crystallogr.,
др. // ЖНХ. 2014. Т. 59, N 2. С. 190-199.
Sect. C. 1990. Vol. 46, N 6. P. 2459-2460.
[23] Serezhkin V. N., Grigoriev M. S., Abdulmyanov A. R. et al. //
[7] Navaza A., Iroulart M. G., Nierlich M. et al. // Acta
Inorg. Chem. 2017. Vol. 56. P. 7151-7160.
Crystallogr., Sect. C. 1993. Vol. 49, N 10. P. 1767-1770.
[24] Nyquist R. A., Settioneri S. E. // Appl. Spectrosc.
1990.
[8] Wang J.-L., Deng Z.-Y., Duan S.-B., Xing Y.-H. // J. Coord.
Vol. 44, N 10. P. 1629-1632.
Chem. 2012. Vol. 65, N 20. P. 3546-3555.
[25] Castro J. L., Lopez Ramırez M. R., Lopez Tocon I., Otero J. C. //
[9] Bismondo A., Casellato U., Graziani R. // Inorg. Chim. Acta.
J. Mol. Struct. 2003. Vol. 651-653. P. 602-606.
1994. Vol. 223, N 1-2. P. 151-153.
[26] Krishnamurthy M. V., Nagar M. S., Hon N. S. // J. Radioanal.
[10] Щелоков Р. Н., Михайлов Ю. Н., Орлова И. М. и др. // Ко-
Nucl. Chem. 1987. Vol. 117, N 2. P. 91-98.
ординац. химия. 1985. Т. 11, N 6. С. 706-709.
[27] Lee H., Wilmshurst J. K. // Aust. J. Chem. 1969. Vol. 22, N 4.
[11] Bismondo A., Casellato U., Rizzo L., Graziani R. // Inorg.
P. 691-670.
Chim. Acta. 1992. Vol. 191, N 1. P. 69-73.
[28] Gruen D. M. // J. Chem. Phys. 1952. Vol. 20, N 11. P. 1818-
[12] Cambridge Structural Database System. Cambridge: Cam-
1821.
bridge Crystallographic Data Centre, 2017.
[29] McGlynn S. P., Smith J. K. // J. Mol. Spectrosc. 1961. Vol. 6,
[13] Федосеев А. М., Гоголев А. В., Шилов В. П. и др. // Радио-
N 2. P. 164-187.