ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2020, том 90, № 1, с. 57-62
УДК 547.835.5
СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ
НОВЫХ ПРОИЗВОДНЫХ АКРИДОНА СОДЕРЖАЩИХ
ИЗОКСАЗОЛИНОВЫЙ ФРАГМЕНТ
© 2020 г. Т. Н. Кудрявцеваa,*, А. Ю. Ламановa, П. И. Сысоевa, Л. Г. Климоваb
a Курский государственный университет, ул. Радищева 33, Курск, 305000 Россия
b Курский государственный медицинский университет, 305000 Россия
*e-mail: labos.kgu@mail.ru
Поступило в Редакцию 1 июля 2019 г.
После доработки 1 июля 2019 г.
Принято к печати 4 июля 2019 г.
Разработан способ получения 4-замещенных N-(4,5-дигидроизоксазол-5-ил)метилакридонов реакцией
оксимов ароматических альдегидов с аллилакридонами. Для полученных соединений выявлена высокая
ингибирующая активность по отношению к тест-штаммам патогенных микроорганизмов, превосходящая
фурацилин.
Ключевые слова: изоксазолины, акридоны, 4-замещенные N-(4,5-дигидроизоксазол-5-ил)метилакри-
доны, фурацилин, антибактериальная активность
DOI: 10.31857/S0044460X20010072
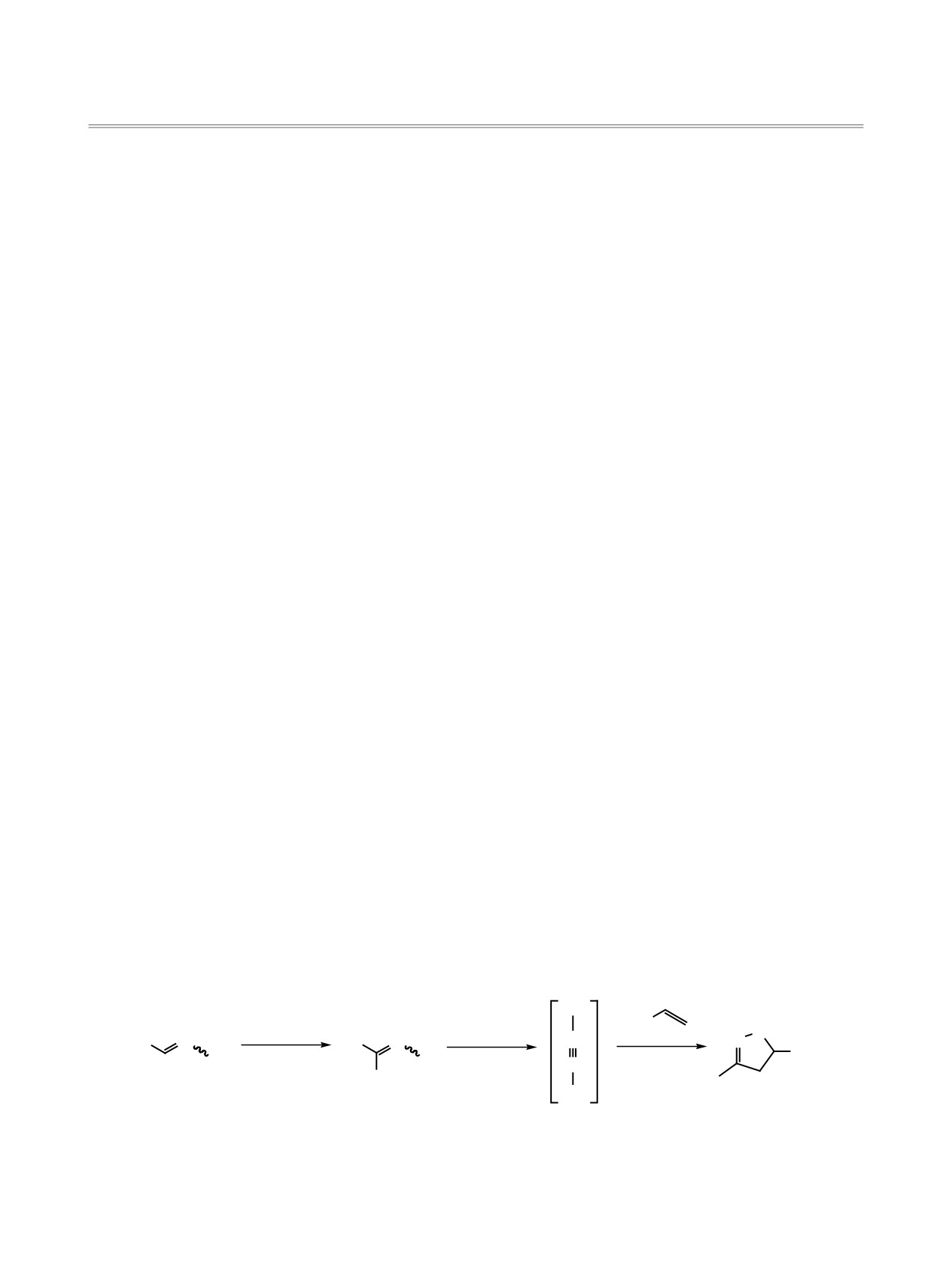
В продолжение работы по поиску новых био-
изоксазолиновый (дигидроизоксазольный) фраг-
логически активных веществ в ряду акридина и
мент. Этот цикл легко синтезируется, а многие
акридона, обладающих антибактериальной актив-
производные этого ряда обладают антибактери-
ностью [1-4], нами были синтезированы и иссле-
альной активностью [5].
дованы на антибактериальную активность новые
На практике применяют несколько способов
соединения этого ряда, содержащие фармакофор-
синтеза изоксазолинового цикла, например взаи-
ный фрагмент изоксазолина (дигидроизоксазола).
модействием нитроалканов с алкенами в присут-
Известно большое количество фармакофорных
ствии основания [6], однако ограниченное число
групп, обладающих биологической активностью,
нитропроизводных и низкие выходы мешают рас-
однако стоит учитывать сложность их синтеза и
пространению этого метода. По другому способу
совместимость с молекулой акридона для получе-
оксимы 1 хлорируют, затем при помощи основа-
ния нужного биологического эффекта. В качестве
ния in situ получают реакционноспособный ни-
циклической фармакофорной группы, подходящей
трилоксид 2 [7], который легко вступает в реакцию
для синтеза соединений, обладающих антибакте-
1,3-диполярного циклоприсоединения с алкенами
риальными свойствами, мы решили использовать
3 (схема 1). При этом выходы изоксазолинов 4 до-
Схема 1.
O
R2
ɯɥɨɪɢɪɨɜɚɧɢɟ
ɨɫɧɨɜɚɧɢɟ
3
R1
N
R1
N
N+
N O
R2
OH
OH
C
Cl
R1
R1
1
2
4
57
58
КУДРЯВЦЕВА и др.
Схема 2.
O
O
O
8
1
R1
R1
8a
1a
2
R1
NaH, ȾɆɎȺ
7
ɯɥɨɪɚɦɢɧ T
9
C2H5OH
6
3
N
Br
N
5a
N
4a
5
4
H
R3
N
R2
R2
11
OH
10
R2
12
R3
10a
5 7
O
N
8 10
11 17
(11);
R1 = R2 = H (5, 8); R1 = F, R2 = H (6, 9); R1 = H, R2 = F (7, 10); R1 = R2 = H, R3 =
O
N
O
O
R1 = H, R2 = F, R3 =
(12),
(13),
(14),
(15),
N
Br
N
O
S
O
O
O
O
(16); R1 = F, R2 = H, R3 =
(17).
O
N
N
O
O
O
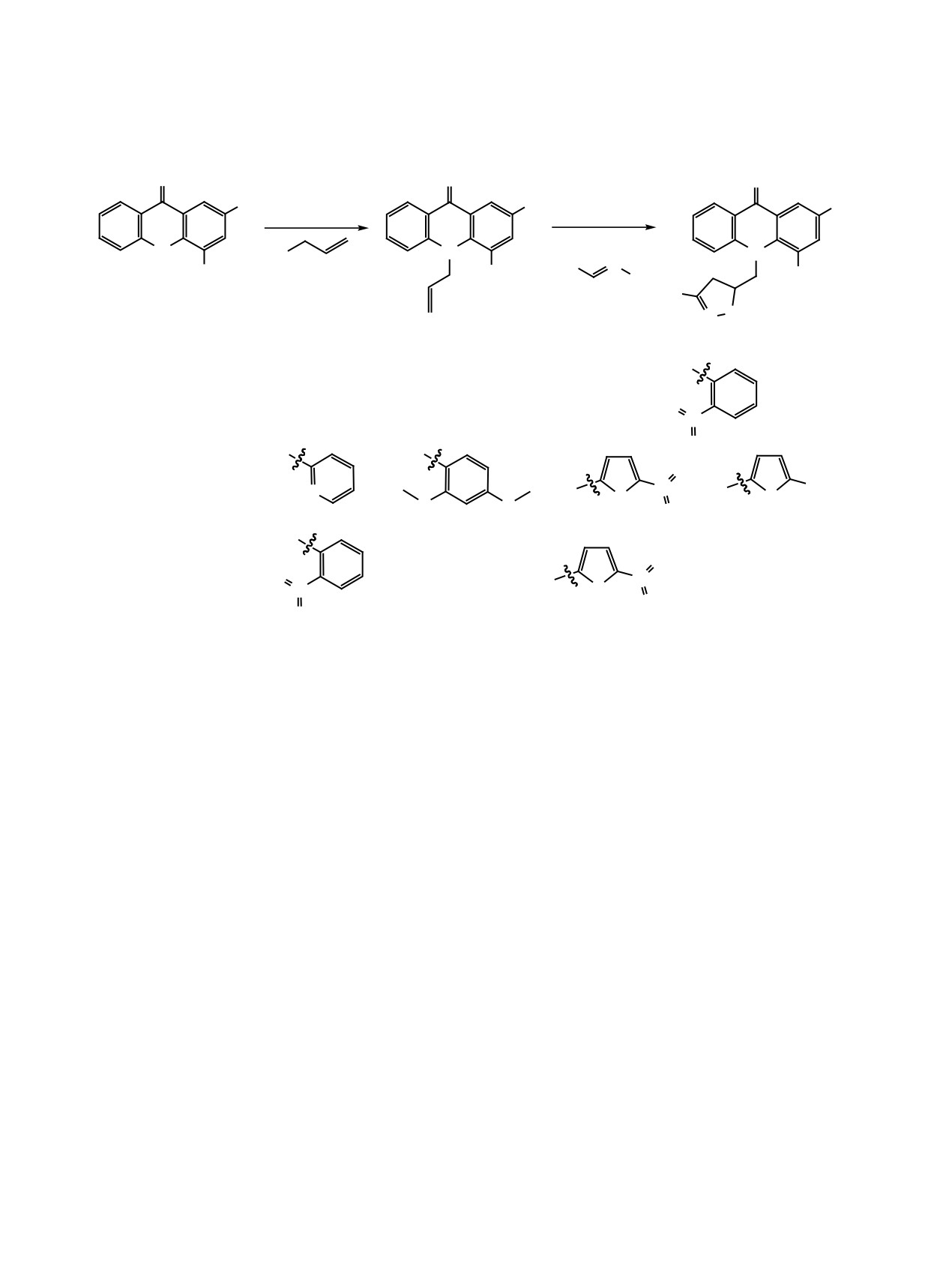
статочно высокие и имеется широкий выбор аль-
В спектрах ЯМР 1H полученных аллилакри-
дегидов, из которых могут быть синтезированы
донов следует выделить сигналы алифатических
оксимы.
протонов. Например, для соединения 6 сигналы
протонов при C10Н2 наблюдаются в виде муль-
В качестве строительного блока, несущего ал-
типлета при 4.96-5.04 м. д., в более слабое поле
кеновую группу, широко используется аллилбро-
смещен сигнал протонов С11H2 (5.25-5.40 м. д).,
мид, который применяется в качестве алкилиру-
а сигнал протона С10аH находится в области 6.21-
ющего агента. Алкилированием аллилбромидом
6.31 м. д. Сигналы ароматических протонов на-
акридонов 5-7 нами были получены соответству-
ходятся в области 7.18-8.49 м. д. В спектре ЯМР
ющие N-аллилакридоны 9-11 (схема 2). Стоит от-
1H соединения 10 наблюдается другая картина.
метить, что полученные аллилакридоны хорошо
Сигналы протонов С11H2 регистрируются при
растворимы в этаноле и дихлорметане в отличие
3.36-3.72 м. д., сигналы протонов С10H2 проявля-
от исходного акридона.
ются в области 4.78-5.01 м. д. Протон С10аH резо-
Для проведения реакции
1,3-диполярного
нирует в области 5.24-5.21 м. д., при этом в арома-
циклоприсоединения в качестве хлорирующих
тической области появляются сигналы протонов
агентов были исследованы гипохлорит натрия,
нитрофуранового цикла в виде дублетов при 7.31
N-хлорсукцинимид, хлорамин Т. Использование
и 7.84 м. д. с J = 3.8 Гц.
первых двух агентов дало низкую конверсию ис-
Синтезированные производные были иссле-
ходного аллилакридона. Использование хлорами-
дованы in vitro в отношении тест-штаммов ми-
на Т в среде кипящего этанола позволило полно-
кроорганизмов E. coli, Ps. aeruginosa, Pr. vulgaris,
стью перевести исходные аллилакридоны в целе-
S. aureus, B. subtilis, Candida albicans по методике
вые продукты 11-17 (схема 2). При этом не было
[8] при использовании в качестве эталонов таких
необходимости добавлять основание, что упрости-
препаратов, как этакридиналактат (риванол), ме-
ло технологию процесса.
тронидазол, офлоксацин и фурацилин, применя-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ НОВЫХ ПРОИЗВОДНЫХ АКРИДОНА
59
Антимикробная активность соединений 11, 12, 14 и 17
Зона задержки роста, мм
Соединение
с, %
Е. coli
Ps. aeruginosa
Pr.vulgaris
S. aureus
B.subtilis
C. albicans
(АТСС 25922)
(АТСС 27853)
(АТСС 4636)
(АТСС 25923)
(АТСС 6633)
(NCTC2625)
11
1
14.1±0.50
14.1±0.50
14.0±0.50
10.2±0.50
8.0±0.50
12.1±0.5
2
12.1±0.50
17.1±0.50
14.2±0.50
14.1±0.50
9.1±0.50
15.2±0.5
12
1
13.0±0.50
13.0±0.70
13.1±0.60
10.2±0.50
8.1±0.50
12.5±0.5
2
10.5±0.50
17.1±0.60
13.1±0.50
13.5±0.50
9.2±0.50
13.5±1.5
14
1
31.0±0.50
21.2±0.50
33.2±0.50
34.1±1.00
25.5±0.50
43.1±1.0
2
34.2±1.00
29.5±0.50
39.1±1.00
39.2±1.00
37.0±0.50
49.1±1.0
17
1
31.1±0.60
21.0±0.50
25.0±0.50
38.0±0.80
42.1±0.70
46.0±0.5
2
36.5±0.70
27.2±0.60
31.1±0.60
42.1±0.50
47.1±0.50
55.5±0.5
Метронидазол
1
11.5±0.40
20.1±0.70
14.0±0.40
22.0±0.70
14.5±0.40
20.3±0.6
2
12.1±0.30
21.0±0.60
22.0±0.70
25.0±0.30
15.0±0.40
25.3±0.7
Риванол
1
12.7±0.40
12.0±1.10
12.5±0.80
17.0±1.00
14.3±0.90
13.5±0.5
2
14.5±0.50
15.0±0.90
15.0±0.60
20.1±0.90
15.2±1.10
15.1±0.9
ДМСО
8.5±0.66
9.5±0.82
9.0±0.71
7.0±0.37
7.0±0.50
-
Фурацилин
1
26.0±1.10
9.0±0.50
28.0±1.00
30.0±1.00
31.0±1.00
14.5±0.5
2
28.0±1.00
10.0±0.40
30.5±1.50
31.0±1.00
35.0±1.00
17.0±1.0
Офлоксацин
2
40.5±0.50
37.2±1.10
36.1±1.20
36.5±0.50
31.1±1.00
34.5±1.0
емых в медицине в качестве антибактериальных
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
средств (см. таблицу). Полученные данные пока-
Масс-спектры регистрировали на прибо-
зывают, что соединения 14 и 17 обладают высокой
ре Thermo Scientific Dionex Ultimate
3000 с
ингибирующей способностью по отношению ко
масс-спектрометрическим детектором LCQ Fleet
всем исследуемым тест-штаммам микроорганиз-
(ESI, 70 эВ). Спектры ЯМР 1Н и 13С растворов в
мов, значительно превосходя по данным показа-
ДМСО-d6 регистрировали на спектрометре Bruker
телям препараты сравнения - риванол и метрони-
АМ-600 при рабочей частоте 600.13 МГц, вну-
дазол (почти в 3 раза). По зонам задержки роста
тренний стандарт - Me4Si. Элементный анализ
некоторых других микроорганизмов соединения
выполняли на приборе Thermo Element 2.
14 и 17 также превосходят либо сопоставимы с
Общая методика синтеза соединений 8-10.
фурацилином и офлоксацином. Особо следует от-
К суспензии 0.01 моль акридона в 10 мл ДМФА
метить высокую активность соединений 14 и 17 по
прибавляли 0.012 моль гидрида натрия. Смесь пе-
отношению к дрожжеподобному грибку Candida
ремешивали 30 мин, затем прибавляли 0.011моль
albicans. Можно отметить, что для фурацилина та-
аллилбромида. Через 5 ч реакционную смесь вы-
кая активность незначительна.
ливали в воду, осадок отфильтровывали и сушили.
Таким образом, нами разработан простой метод
Полученные соединения использовали далее без
синтеза арилзамещенных оксазолилакридонов,
дополнительной очистки.
включающий стадии алкилирования акридона и
10-Аллилакридин-9(10H)-он (8). Выход 90%,
1,3-диполярного циклоприсоединения. Также сто-
белый порошок, т. пл. 132-134°С. Спектр ЯМР 1Н,
ит отметить хорошие выходы целевых продуктов и
δ, м. д. (J, Гц): 4.92-5.02 м (2Н, С10H2), 5.23-5.38
доступность используемых реагентов.
м (2Н, С11H2), 6.18-6.28 м (1Н, С10аH), 7.35 т (2H,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
60
КУДРЯВЦЕВА и др.
С2,7H, J = 7.4), 7.54 д (2H, С4,5H, J=8.7), 7.76-7.80
С10аH), 7.37 т (2Н, С2,7H, J = 7.4), 7.75-7.93 м (7Н,
м (2H, С3,6H), 8.37 д. д (2 H, С1,8H, J = 8.0, 1.7).
С3-6H + CHAr), 8.09 д (1Н, CHAr, J = 8.0), 8.39 д. д
Спектр ЯМР 13C, δС, м. д.: 54.08 (С10), 115.79 (С11),
(2Н, С1,8H, J = 8.0, 1.6). Масс-спектр, m/z (Iотн, %):
116.54 (C4,5), 121.78 (C2,7), 122.02 (C1а,8а), 126.92
399.3987 (100) [М + H]+. Найдено, %: C 69.37; H
(С1,8), 133.67 (С10a), 134.42 (С3,6), 142.94 (С4а,5а),
4.25; N 10.56. C23H17N3O4. Вычислено, %: C 69.17;
165.20 (С4с), 177.20 (С9). Масс-спектр, m/z (Iотн,
H 4.29; N 10.52.
%): 235.2766 (100) [М + H]+. Найдено, %: C 81.65;
4-Фтор-10-{[3-(пиридин-2-ил)-4,5-дигидро-
H 5.56; N 5.97. C16H13NO. Вычислено, %: C 81.68;
изоксазол-5-ил]метил}акридин-9(10H)-он
(12).
H 5.57; N 5.95.
Выход 53%, желтые кристаллы, т. пл. 224-226°С.
10-Аллил-2-фторакридин-9(10H)-он
(9).
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.37-3.71 м (2Н,
Выход 92%, белый порошок, т. пл. 140-142°С.
С11H2), 4.80-4.99 м (2Н, С10H2), 5.15-5.23 м (1Н,
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 4.88-4.95м (1Н,
С10аH), 7.33-7.43 м (2Н, С5H + С7H), 7.45-7.50 м
С11Hа), 5.01 уш. с (2Н, С10H2), 5.19-5.22 м (1Н,
(1Н, СHPy), 7.69-7.77 м (1Н, С2H), 7.83-7.92 м (3Н,
С6H + 2СHPy), 8.06 д (1Н, С3H, J = 8.7), 8.21 д (1Н,
С11Hb), 6.12-6.18 м (1Н, С10аH), 7.35 т (1H, С7H,
С8H, J = 7.8), 8.32 д (1Н, С1H, J = 7.8), 7.45-7.50 м
J = 7.4), 7.68 д (1H, С5H, J = 8.6), 7.70-7.84 м (2Н,
(1Н, СHPy). Спектр ЯМР 13C, δС, м. д.: 38.55 (С11),
С3,4H), 7.80-7.84 м (1Н, С1H), 7.97-8.00 м (1Н,
53.2 (С10), 80.75 (С10a), 117.86 (С5), 121.63 (С7),
С6H), 8.39 д. д (1H, С8H, J = 8.0, 1.6). Масс-спектр,
122.43 (С1), 122.58 (С16), 122.83 (С3), 123.38 (С2),
m/z (Iотн, %): 253.2703 (100) [М + H]+. Найдено, %:
125.27 (С8a), 125.57 (С1a), 127.00 (С4a), 132.62 (С8),
C 75.74; H 4.75; N 5.51. C16H12FNO. Вычислено,
134.88 (С6), 137.41 (С15), 143.96 (С5a), 148.93 (С12),
%: C 75.88; H 4.78; N 5.53.
149.99 (СPy), 151.14 (СPy), 152.82 (С4), 159.19 (СPy),
10-Аллил-4-фторакридин-9(10H)-он
(10).
176.58 (С9). Масс-спектр, m/z (Iотн, %): 373.3798
Выход 88 %, белый порошок, т. пл. 135-137°С.
(100) [М + H]+. Найдено, %: C 70.83; H 4.35; N
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 4.99 уш. с (2Н,
11.28. C22H16FN3O2. Вычислено, %: C 70.77; H
С10H2), 5.25-5.40 м (2Н, С11H2), 6.21-6.31 м (1Н,
4.32; N 11.25.
С10аH), 7.18-7.23 м (1Н, С7H), 7.30 т (1H, С2H, J =
10-{[3-(2,4-Диметоксифенил)-4,5-дигидро-
7.4), 7.39-7.46 м (1Н, С3H), 7.54 д (1H, С5H, J =
изоксазол-5-ил]метил}-4-фторакридин-9(10H)-
8.6), 7.67-7.72 м (1Н, С6H), 8.35 д (1H, С8H, J =
он (13). Выход 53%, желтые кристаллы, т. пл. 237-
7.9), 8.49 д (1H, С1H, J = 8.0). Спектр ЯМР 13C, δС,
239°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.25-3.40
м. д.: 54.08 (С10), 115.79 (С11), 120.60 (С5), 120.76
м (2Н, С11H2), 3.53-3.63 м (3Н, ОСH3), 3.85-3.94
(С7), 121.43 (С3), 122.00 (С8a), 122.48 (С1), 123.43
м (3Н, ОСH3), 4.70-4.91 м (2Н, С10H2), 4.98-5.09
(С2), 125.65 (С1a), 127.43 (С4a), 132.69 (С8), 133.67
м (1Н, С10aH), 6.56-7.61 м (2Н, СHAr), 7.31-7.43
(С10a), 134.16 (С6), 144.02 (С5a), 152.46 (С4), 177.39
м (2Н, С5,7H), 7.50-7.56 м (1Н, СHAr), 7.67-7.75 м
(С9). Масс-спектр, m/z (Iотн, %): 253.2707 (100)
(1Н, С2H), 7.82-7.89 м (1Н, С6H), 8.00-8.06 м (1Н,
[М + H]+. Найдено, %: C 75.77; H 4.76; N 5.50.
С3H), 8.18-8.24 м (1Н, С8H), 8.29-8.35 м (1Н, С1H).
C16H12FNO. Вычислено, %: C 75.88; H 4.78; N 5.53.
Спектр ЯМР 13C, δС, м. д.: 41.44 (С11), 53.38 (С10),
Общая методика синтеза соединений 11-17.
55.91 (СAr), 56.28 (СAr), 79.46 (С10a), 117.87 (СAr),
К раствору 0.01 моль соответствующего аллила-
121.60 (СAr), 121.75 (СAr), 122.47 (С3), 126.76 (С5),
кридона в 50 мл этанола прибавляли 0.015 моль
123.33 (С7), 125.55 (С8a), 126.06 (С1), 126.95 (С2),
оксима и 0.02 моль хлорамина-Т. Полученную
129.76 (С1a), 130.33 (С8), 132.68 (С14), 134.75 (С4a),
смесь кипятили 3 ч, затем охлаждали. Осадок от-
144.05 (С6), 151.20 (С5a), 152.82 (С4), 156.08 (С12),
фильтровывали, промывали водой и этанолом, за-
159.16 (С18), 162.76 (С16), 176.54 (С9). Масс-спектр,
тем сушили.
m/z (Iотн, %): 432.4437 (100) [М + H]+. Найдено, %:
10-{[3-(2-Нитрофенил)-4,5-дигидро-
C 69.57; H 4.93; N 6.54. C25H21FN2O4. Вычислено,
изоксазол-5-ил]метил}акридин-9(10H)-он
(11).
%: C 69.44; H 4.89; N 6.48.
Выход 64%, желтые кристаллы, т. пл. 243-245°С.
4-Фтор-10-{[3-(5-нитрофуран-2-ил)-4,5-ди-
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.40-3.79 м (2Н,
гидроизоксазол-5-ил]метил}акридин-9(10H)-он
С11H2), 4.69-5.04 м (2Н, С10H2), 5.32-5.40 м (1Н,
(14). Выход 45%, желтые кристаллы, т. пл. 251-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ НОВЫХ ПРОИЗВОДНЫХ АКРИДОНА
61
253°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.36-3.72
м (1Н, С10аH), 6.12-6.18 м (1Н, С10аH), 7.31 д
м (2Н, С11H2), 4.78-5.01 м (2Н, С10H2), 5.24-5.21 м
(1H, СHфуран, J = 3.8), 7.34 т (1H, С7H, J = 7.4),
(1Н, С10аH), 7.31 д (1H, СHфуран, J = 3.8), 7.34-7.38
7.68 д (1H, С5H, J = 8.6), 7.71-7.85 м (3Н, С3,4H +
м (1Н, С5H), 7.39-7.43 м (1Н, С7H), 7.71-7.77 м
СHфуран), 7.83-7.87 м (1Н, С1H), 7.95-7.98 м (1Н,
(1Н, С2H), 7.84 д (1H, СHфуран, J = 3.8), 7.85-7.89
С6H), 8.39 д. д (1H, С8H, J = 8.0, 1.6). Масс-спектр,
м (1Н, С6H), 8.02 д (1H, С3H, J = 8.8), 8.20-8.23 м
m/z (Iотн, %): 407.3518 (100) [М + H]+. Найдено, %:
(1Н, С8H), 8.33 д. д (1Н, С1H, J = 8.0, 1.8). Спектр
C 61.84; H 3.49; N 10.28. C21H14FN3O5. Вычислено,
ЯМР 13C, δС, м. д.: 37.91 (С10a), 52.96 (С10), 81.42
%: C 61.92; H 6.46; N 10.32.
(С11), 114.69 (СНфуран), 116.00 (СНфуран), 121.91
Испытания на антибактериальную активность
(С5), 122.36 (С7), 122.65 (С3), 122.89 (С8a), 123.42
растворов соединений с концентрацией 1.0 и 2.0%
(С1), 125.49 (С2), 127.04 (С1a), 132.55 (С8), 134.94
в ДМСО проводили в чашках Петри с агаровой
(С4a), 143.85 (С6), 146.79 (С5a), 149.21 (С12), 151.11
средой, предварительно засеянной тест-штамма-
(Сфуран), 152.47 (С4), 152.73 (Сфуран), 176.54 (С9).
ми микроорганизмов с микробной нагрузкой 106
Масс-спектр, m/z (Iотн, %): 407.3515 (100) [М + H]+.
микробных клеток в 1 мл, измеряя диаметр зон
Найдено, %: C 61.81; H 3.49; N 10.26. C21H14FN3O5.
ингибирования через 24 ч. Диаметр зон угнете-
Вычислено, %: C 61.92; H 3.46; N 10.32.
ния роста тест-микробов измеряли с точностью до
10-{[3-(5-Бромтиофен-2-ил)-4,5-дигидро-
1 мм [8].
изоксазол-5-ил]метил}-4-фторакридин-9(10H)-
ФОНДОВАЯ ПОДДЕРЖКА
он (15). Выход 65%, желтые кристаллы, т. пл. 236-
238°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.32-3.69
Работа выполнена при финансовой поддержке
м (2Н, С11H2), 4.76-4.97 м (2Н, С10H2), 5.15-5.25
Министерства образования и науки РФ (проект
м (1Н, С10аH), 7.26 д (1Н, СHтиофен, J = 3.9), 7.32 д
№ 4.9516.2017/БЧ).
(1Н, СHтиофен, J = 3.9), 7.36 т. д (1Н, С7H, J = 7.9),
7.39-7.42 м (1Н, С5H), 7.73 д. д. д (1Н, С2Н, J =
КОНФЛИКТ ИНТЕРЕСОВ
16.1, 7.8, 1.5), 7.86 д. д. д (1Н, С6Н, J = 8.8, 6.9, 1.7),
8.03 д (1Н, С3H, J = 8.8), 8.21 д. д (1Н, С8H, J = 7.9,
Авторы заявляют об отсутствии конфликта
1.4), 8.32 д. д (1Н, С1Н, J = 8.0, 1.7). Масс-спектр,
интересов.
m/z (Iотн, %): 457.3156 (100) [М + H]+. Найдено,
СПИСОК ЛИТЕРАТУРЫ
%: C 55.29; H 3.15; N 6.19. C21H14BrFN2O2S.
Вычислено, %: C 55.15; H 3.09; N 6.13.
1. Кудрявцева Т.Н., Сысоев П.И., Попков С.В., Климо-
ва Л.Г. // ЖОХ. 2017. Т. 87. № 7. C. 1289; Kud-
4-Фтор-10-{[3-(2-нитрофенил)-4,5-дигидро-
ryavtseva T.N., Sysoev P.I., Popkov S.V., Klimova L.G. //
изоксазол-5-ил]метил}акридин-9(10H)-он
(16).
Russ. J. Gen. Chem. 2017. Vol. 87. N 8. P. 1702. doi
Выход 67%, желтые кристаллы, т. пл. 249-251°С.
10.1134/ S1070363217080102
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.32-3.69 м (2Н,
2. Кудрявцева Т.Н., Богатырев К.В., Сысоев П.И.,
С11H2), 4.78-5.01 м (2Н, С10H2), 5.18-5.24 м (1Н,
Климова Л.Г. // ЖОХ. 2019. Т. 89. № 1. С. 146;
С10аH), 7.33-7.39 м (1Н, С7H), 7.41 т (1Н, С5H, J =
Kudryavtseva T.N., Bogatyrev K.V., Sysoev P.I., Klimo-
7.4), 7.70-7.78 м (2Н, СHAr), 7.81-7.89 м (2Н, С6H +
va L.G. // Russ. J. Gen. Chem. 2019. Vol. 89. N 1.
CHAr), 8.01 д (1Н, С3H, J = 8.9), 8.05 д (1Н, СHAr,
P. 157. doi 10.1134/S1070363219010298
J = 8.5), 8.21 д (1Н, С8H, J = 7.9), 8.33 д (1Н, С1H,
3. Кудрявцева Т.Н., Ламанов А.Ю., Климова Л.Г.,
J = 8.0). Масс-спектр, m/z (Iотн, %): 417.3893 (100)
Назаров Г.В. // ЖОХ. 2018. Т. 88. № 4. C. 593;
[М + H]+. Найдено, %: C 66.32; H 3.89; N 10.05.
Kudryavtseva T.N., Lamanov A.Yu., Klimova L.G.,
C23H16FN3O4. Вычислено, %: C 66.18; H 3.86; N
Nazarov G.V. // Russ. J. Gen. Chem. 2018. Vol. 88. N 4.
10.07.
P. 676. doi 10.1134/ S1070363218040102
2-Фтор-10-{[3-(5-нитрофуран-2-ил)-4,5-ди-
4. Кудрявцева Т.Н., Ламанов А.Ю., Климова Л.Г., На-
гидроизоксазол-5-ил]метил}акридин-9(10H)-он
заров Г.В. // Изв. АН. Сер. хим. 2017. № 1. С. 123;
(17). Выход 41%, желтые кристаллы, т. пл. 241-
Kudryavtseva T.N., Lamanov A.Yu., Klimova L.G.,
243°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 3.37-3.71
Nazarov G.V. // Russ. Chem. Bull. 2017. Vol. 66. N 1.
м (2Н, С11H2), 4.78-5.01 м (2Н, С10H2), 5.24-5.21
P. 123. doi 10.1007/s11172-017-1709-8
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020
62
КУДРЯВЦЕВА и др.
5. Zghab I., Trimeche B., Mansour M.B., Hassine M.,
7. Minakata S., Okumura S., Nagamachi T., Takeda Y. //
Touboul D., Jannet H.B. // Arab. J. Chem. 2017. Vol. 10.
Org. Lett. 2011. Vol. 13. N 11. P. 2966. doi 10.1021/
N 2. P. 2651. doi 10.1016/j.arabjc.2013.10.008
ol2010616
6. Cecchi L., Sarlo F.D., Machetti F. // Eur. J. Org.
8. Государственная фармакопея Российской Федера-
Chem. 2006. Vol. 2006. N 21. P. 4852. doi 10.1002/
ции. М.: Министерство здравоохранения РФ, 2015.
ejoc.200600475
Т. 1. С. 993.
Synthesis and Antibacterial Activity of New Acridone
Derivatives Containing an Isoxazoline Fragment
T. N. Kudryavtsevaa,*, A. Yu. Lamanova, P. I. Sysoeva, and L. G. Klimovab
a Kursk State University, ul. Radishcheva 33, Kursk, 305000 Russia
b Kursk State Medical University, 305000 Russia
*e-mail: labos.kgu@mail.ru
Received July 1, 2019; revised July 1, 2019; accepted July 4, 2019
A method was developed for the preparation of N-(4-R-4,5-dihydroisoxazol-5-yl)methylacridones by the reaction
of aromatic aldehyde oximes with allyl acridones. For the obtained compounds, a high inhibitory activity in
relation to test strains of pathogenic microorganisms was revealed, exceeding furacilin.
Keywords: isoxazolines, acridones, 4-substituted N-(4,5-dihydroisoxazol-5-yl)methylacridones, furacilin,
antibacterial activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 90 № 1 2020