ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2019, том 89, № 3, с. 372-376
УДК 542.943.7:541.128.34:541.49:547.854.4
ГИДРОКСИЛИРОВАНИЕ 2,3-ДИМЕТИЛ-5-ГИДРОКСИ-
6-АМИНОПИРИМИДИН-4(3Н)-ОНА МОЛЕКУЛЯРНЫМ
КИСЛОРОДОМ В ПРИСУТСТВИИ ХЛОРИДА МЕДИ(II)
В ВОДНЫХ И НЕВОДНЫХ РАСТВОРАХ
© 2019 г. В. Ю. Мишинкин, С. А. Грабовский, Н. Н. Кабальнова, Ю. И. Муринов*
Уфимский институт химии Уфимского федерального исследовательского центра
Российской академии наук, пр. Октября 71, Уфа, 450054 Россия
*e-mail: murinov@anrb.ru
Поступило в Редакцию 27 сентября 2018 г.
После доработки 27 сентября 2018 г.
Принято к печати 2 октября 2018 г.
Каталитическое гидроксилирование
2,3-диметил-5-гидрокси-6-аминопиримидин-4(3Н)-она в водном
растворе в присутствии ионов меди(II) и кислорода протекает с образованием 2,3-диметил-5,5,6-
тригидрокси-6-аминопиримидин-4-(3Н)-она.
Ключевые слова: молекулярный кислород, 2,3-диметил-5-гидрокси-6-аминопиримидин-4(3Н)-он, ионы
меди(II), гидроксилирование
DOI: 10.1134/S0044460X19030065
Реакции окислительного гидроксилирования в
она 1 молекулярным кислородом в присутствии
живой природе протекают с участием ферментов
хлорида меди(II) в водных и неводных растворах
монооксигеназ, имеющих в своем составе ионы
проводили спектрофотометрическим методом по
металлов переменной валентности [1-5]. Важным
уменьшению оптической плотности полосы
вопросом теоретической, бионеорганической и
поглощения соединения
1 при λ
=
276 нм в
биоорганической химии является активация
интервале температур 10-50°С. Начальные кон-
молекулярного кислорода с участием комплексов
центрации 2,3-диметил-5-гидрокси-6-аминопирими-
металлов переменной валентности с биомоле-
дин-4(3Н)-она и хлорида меди(II) составляли 1×10-4
кулами в реакциях окислительного гидроксили-
и 1.25×10-5-8×10-4 моль/л соответственно.
рования [6-9]. Синтез низкомолекулярных коорди-
национных соединений ионов меди с различными
При смешении растворов
2,3-диметил-5-гид-
лигандами, позволяющих проводить процессы в
рокси-6-аминопиримидин-4(3Н)-она и хлорида
органической химии с эффективностью и селектив-
меди(II) на воздухе происходит уменьшение
ностью, близкими к реакциям в живых системах,
интенсивности полосы поглощения при 276 нм,
актуален.
вероятно, обусловленное окислением по двойной
связи. Кинетические кривые расходования
Ранее нами было показано, что производные
соединения 1 в воде (ε = 1.0×104 л·моль-1·см-1) в
урацила с заместителями различной природы, явля-
интервале температур
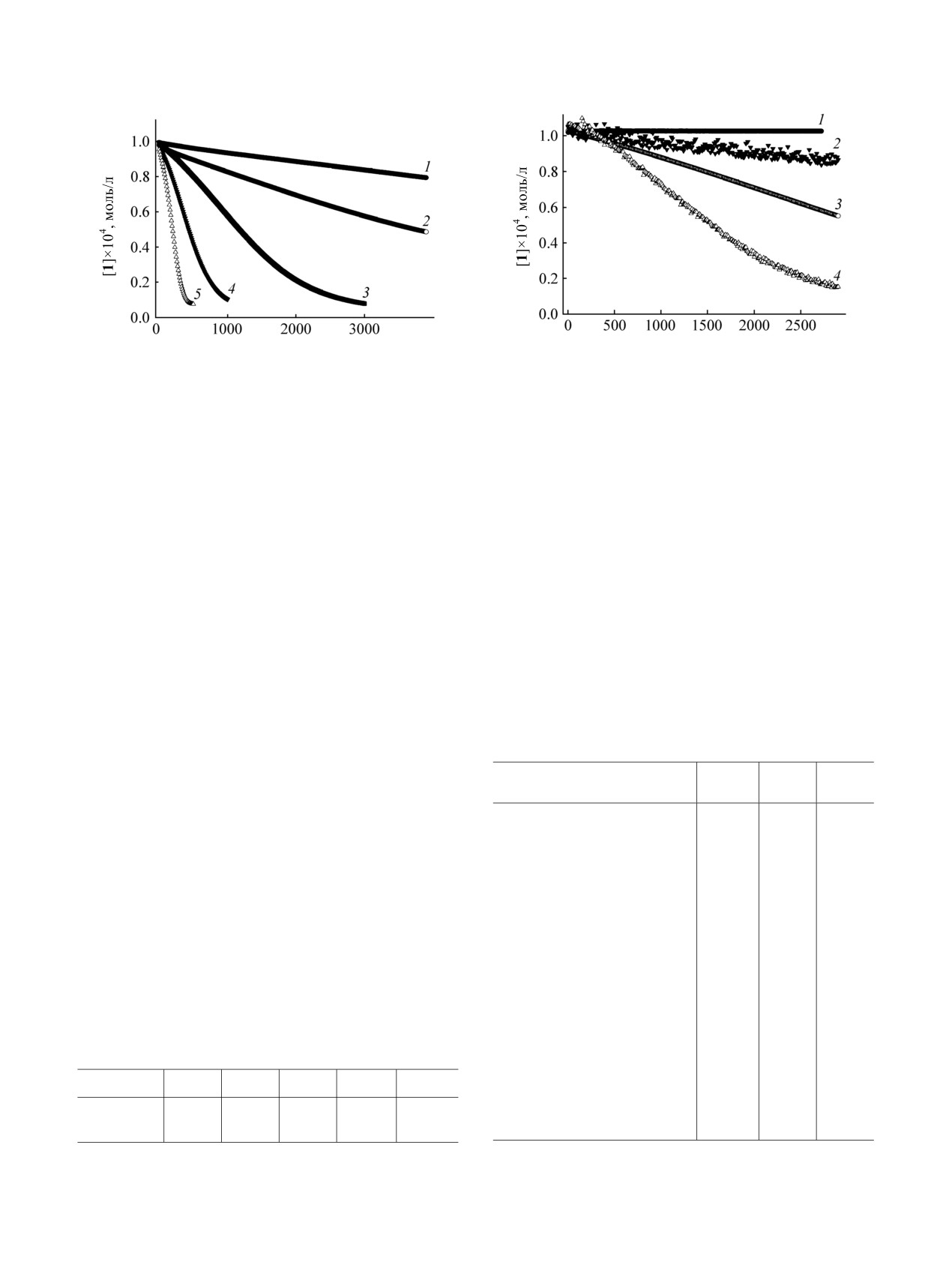
10-50°С приведены на
ются перспективными лигандами для моделиро-
рис.
1. Повышение температуры увеличивает
вания ферментных систем
[10,
11]. В данной
скорость расходования 2,3-диметил-5-гидрокси-6-
работе изучено гидроксилирование 2,3-диметил-5-
аминопиримидин-4(3Н)-она (табл.
1). Продувка
гидрокси-6-аминопиримидин-4(3Н)-она молекуляр-
реакционной смеси аргоном уменьшает, а
ным кислородом в присутствии хлорида меди(II) в
кислородом - увеличивает скорость расходования
водных и неводных растворах.
2,3-диметил-5-гидрокси-6-аминопиримидин-4(3Н)-
Изучение закономерностей гидроксилирования
она 1 (рис. 2). Расходование пиримидинона
1
2,3-диметил-5-гидрокси-6-аминопиримидин-4(3Н)-
наблюдается только в присутствии кислорода. В
372
ГИДРОКСИЛИРОВАНИЕ 2,3-ДИМЕТИЛ-5-ГИДРОКСИ-6-АМИНОПИРИМИДИН-4(3Н)-ОНА
373
t, c
t, c
Рис. 2. Расходование 2,3-диметил-5-гидрокси-6-амино-
Рис 1. Кинетические кривые расходования 2,3-диметил-
пиримидин-4(3Н)-она 1 в присутствии трилона Б (1),
5-гидрокси-6-аминопиримидин-4(3Н)-она 1 при различ-
при продувке реакционной смеси аргоном
(2),
ных температурах ([1]0 = [CuCl2]0 = 1×10-4 моль/л,
воздухом (3) и кислородом (4) ([1]0 = [CuCl2]0 = 1×
вода). 1 - 10, 2 - 20, 3 - 30, 4 - 40, 5 - 50ºС.
10-4 моль/л, [трилон Б]0 = 1.2×10-4 моль/л, вода, 20°С).
условиях проведения эксперимента концентрация
2,3-диметил-5-гидрокси-6-аминопиримидин-4(3Н)-
растворенного кислорода в воде близка к
она 1 и равна 2.42, 1.94, 0.33×10-3 моль/л при 25°С
концентрации соединения
1 и уменьшается с
в ацетонитриле, этаноле, диметилсульфоксиде
3.53×10-4 до 1.77×10-4 моль/л в интервале 10-50°С
соответственно [13].
[12].
Продукт реакции гидроксилирования
2,3-
В отсутствие ионов меди(II), а также при
диметил-5-гидрокси-6-аминопиримидин-4(3Н)-она
проведении реакции в присутствии трилона Б,
получали в растворе этанола, содержащем
5%
который образует с ионами Cu(II) прочный
воды. Соотношение начальных концентраций 2,3-
комплекс, 2,3-диметил-5-гидрокси-6-аминопирими-
диметил-5-гидрокси-6-аминопиримидин-4(3Н)-она
дин-4(3Н)-он не расходуется. C повышением
и хлорида меди(II) - 10:1, при этом конверсия
концентрации ионов меди(II) скорость окисления
исходного пиримидинона практически количест-
увеличивается, что, возможно, связано с образо-
ванием комплекса между ионами меди(II) и 2,3-ди-
метил-5-гидрокси-6-аминопиримидин-4(3Н)-оном 1.
Таблица 2. Данные ЯМР 1Н, 13С и 15N (δ, м. д.) для
соединений 1-3
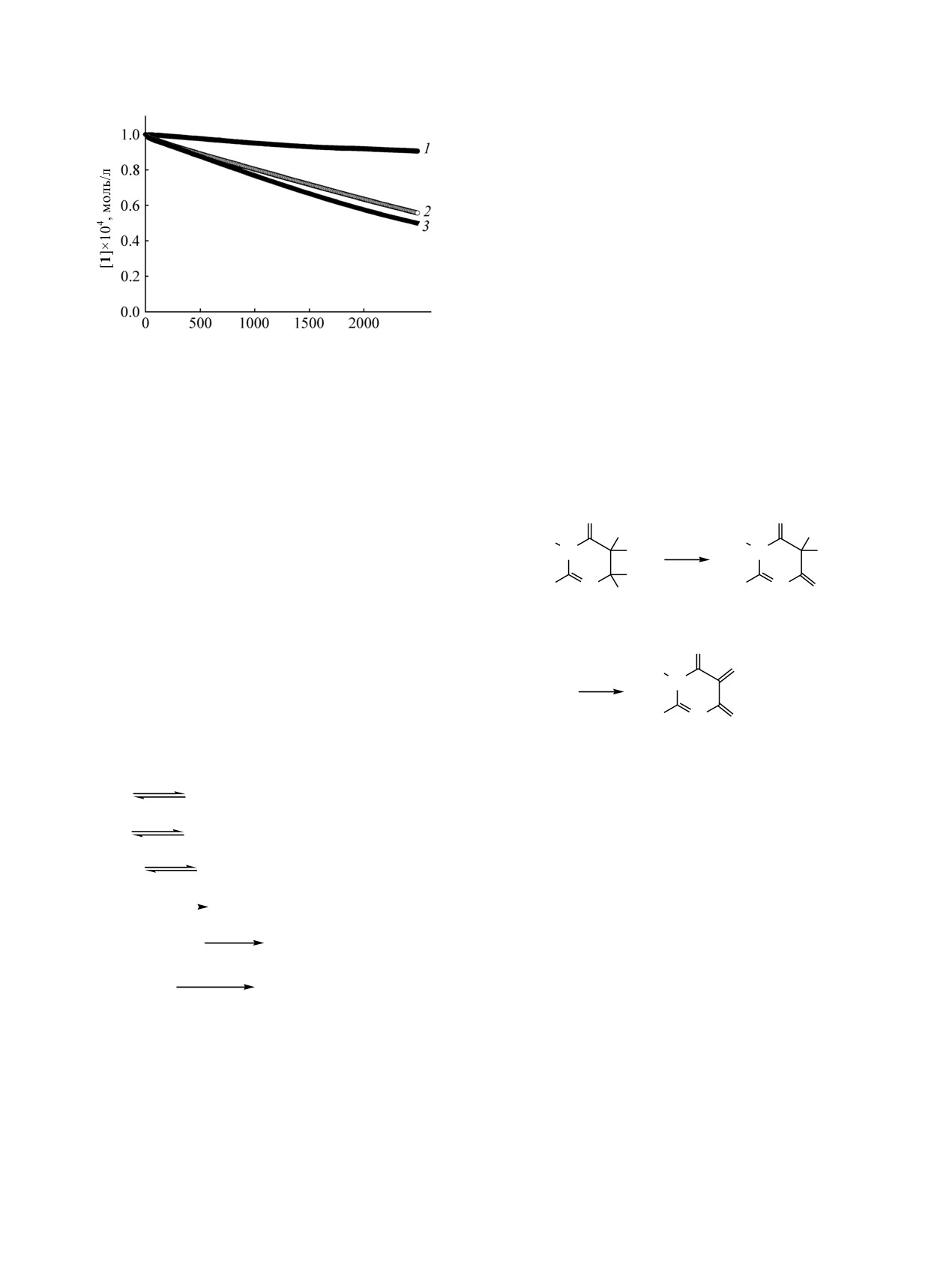
Растворитель оказывает значительное влияние
на протекание этой реакции. В абсолютированном
Отнесение
1
2
3
этаноле
2,3-диметил-5-гидрокси-6-аминопирими-
дин-4(3Н)-он
1 расходуется с незначительной
С2
150.13
165.97
164.87
скоростью, добавление воды
(~5%) ускоряет
С4
156.82
169.10
178.76
процесс (рис.
3). Расходование
2,3-диметил-5-
С5
147.92
97.11
81.90
гидрокси-6-аминопиримидин-4(3Н)-она
1
в
ацетонитриле и диметилсульфоксиде наблюдается
С6
118.54
107.80
168.27
только в присутствии молекулярного кислорода и
СН3С2
22.06
22.87
15.39
воды.
Концентрация кислорода в этих
растворителях выше, чем начальная концентрация
СН3N3
30.22
25.50
26.55
СН3С2
2.30
1.74
2.18
СН3N3
3.35
2.90
2.98
Таблица 1. Начальные скорости расходования 2,3-ди-
метил-5-гидрокси-6-аминопиримидин-4(3Н)-она ([1]0 =
NH2
5.62
6.92
-
[CuCl2]0 = 1×10-4 моль/л, вода)
N1
226.00
256.00
t, °C
10
20
30
40
50
N3
162.00
125.00
146.00
w0,
5.4×10-9
1.8×10-8
4.3×10-8
1.1×10-7
2.6×10-7
моль·л-1·с-1
NH2
68.00
22.00
-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
374
МИШИНКИН и др.
фиксация молекулярного кислорода (2). На стадии
(3) в результате переноса электрона от Cu+ на
молекулярный кислород образуется супероксид-
анион-радикал. Дальнейшее присоединение моле-
кулы воды приводит к образованию гидроксили-
рованного радикала
2,3-диметил-5-гидрокси-6-
аминопиримидин-4(3Н)-она 1 и HO2 радикала (4).
Образование триола 2, вероятно, происходит через
стадии
присоединения
гидропероксильного
радикала к гидроксилированному радикалу 2,3-
t, c
диметил-5-гидрокси-6-аминопиримидин-4(3Н)-она
1 и дальнейшей трансформации образовавшегося
Рис. 3. Кинетические кривые расходования 2,3-ди-
метил-5-гидрокси-6-аминопиримидин-4(3Н)-она
1 в
интермедиата. Триол 2 был нами идентифицирован
абсолютированном этаноле (1), воде (2) и 95%-ном
по данным ЯМР реакционной массы. При отгонке
= 1×10-4 моль/л, 20°С).
этаноле (3) ([1]0 = [CuCl2]0
растворителя последовательно происходит деами-
нирование с образованием 2,3-диметил-5,5-дигид-
роксипиримидин-4,6-диона
3 и дегидратация с
венная, т. е. наблюдается катализируемое ионами
образованием трикетона 4, идентифицированного
меди(II) гидроксилирование соединния 1. Продукт
методом ИК спектроскопии.
реакции окисления
2,3-диметил-5-гидрокси-6-
аминопиримидин-4(3Н)-она
-
2,3-диметил-5,5,6-
O
O
тригидрокси-6-аминопиримидин-4-он
2
- был
OH
OH
H3C
H3C
идентифицирован по данным спектроскопии ЯМР
N
OH
N
OH
1H и 13С (табл. 2).
NH3
OH
H3C
N
H3C
N
Продукт гидроксилирования 2,3-диметил-5-гид-
O
NH2
рокси-6-аминопиримидин-4(3Н)-она 1 в растворе
2
3
диметилсульфоксида, содержащем
25% воды,
O
также был идентифицирован методами спектро-
H3C
O
скопии ЯМР
1H и 13С как 2,3-диметил-5,5-ди-
N
гидроксипиримидин-4,6-дион 3.
H2O
Процесс гидроксилирования
2,3-диметил-5-
H3C
N
O
гидрокси-6-аминопиримидин-4(3Н)-она
1 может
4
протекать по следующим стадиям:
Таким образом, установлено, что катализи-
Cu2+1
руемое ионами меди(II) гидроксилирование 2,3-
Cu+1
(1)
диметил-5-гидрокси-6-аминопиримидин-4(3Н)-она
+O2
Cu+1
O2Cu+1
(2)
протекает только в присутствии молекулярного
кислорода и воды с образованием 2,3-диметил-
O2Cu+1
O2Cu2+1+
(3)
5,5,6-тригидрокси-6-аминопиримидин-4-(3Н)-она.
+
O2Cu2+1
+H2O HOO.Cu2+1. (OH)
(4)
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
HOO.Cu2+1. (OH)
Cu2+ + 1(OH)(OOH)
(5)
В работе использовали CuCl2∙2H2O марки ХЧ,
гидрид кальция и молекулярные сита 3 Å для
+Cu+, +H+
1(OH)(OOH)
2
(6)
осушки растворителей. Растворы готовили по
Cu2+, HO.
навеске. В качестве растворителей использовали
На первой стадии в результате окислительно-
ацетонитрил, этанол и ДМСО, а также дистиллиро-
восстановительного процесса осуществляется
ванную деионизированную воду. Этанол осушали
перенос электрона от 2,3-диметил-5-гидрокси-6-
гидридом кальция, ацетонитрил и ДМСО сушили
аминопиримидин-4(3Н)-она 1 на ион меди(II) с
молекулярными ситами 3 Å. Трилон Б готовили из
образованием катион-радикала и Cu+. На
фиксанала. Для продувки реакционной смеси
образовавшемся катионе меди(I) происходит
использовали кислород и аргон.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
ГИДРОКСИЛИРОВАНИЕ 2,3-ДИМЕТИЛ-5-ГИДРОКСИ-6-АМИНОПИРИМИДИН-4(3Н)-ОНА
375
Электронные спектры поглощения регистри-
ФОНДОВАЯ ПОДДЕРЖКА
ровали на UV-Vis спектрофотометре ShimadzuUV-
2600, снабженном термостатируемым кювето-
Работа выполнена в рамках научно-исследо-
держателем, в области
200-900 нм с исполь-
вательских работ Уфимского института химии
зованием кварцевых кювет (l = 1 см). Температуру
РАН (№ госрегистрации АААА-А17-117011910033-
поддерживали постоянной с помощью термостата
1, АААА-А17-117011910035-5) с использованием
LOIPLT-205a. ИК спектры регистрировали на
оборудования Центра коллективного пользования
спектрометре IRPrestige-21 (Shimadzu Corp.) в виде
«Химия» Уфимского института химии Российской
суспензии в вазелиновом масле в диапазоне 4000-
академии наук.
400 см-1. Спектры ЯМР 1Н записывали на приборе
Bruker Avance-500 (500.30 МГц) с использованием
КОНФЛИКТ ИНТЕРЕСОВ
сигналов остаточных протонов дейтерированного
растворителя (ДМСО-d6) в качестве стандарта.
Авторы заявляют об отсутствии конфликта
Спектры ЯМР 13С записывали на приборе Bruker
интересов.
Avance-500 (125.75 МГц) с использованием тетра-
СПИСОК ЛИТЕРАТУРЫ
метилсилана в качестве внутреннего стандарта.
Спектры ЯМР
15N регистрировали на приборе
1. Allen S.E., Walvoord R. R., Padilla-Salinas R.,
Bruker Avance-500 (50.58 МГц) с использованием
Kozlowski M. C. // Chem. Rev. 2013. Vol. 113. P. 6234.
жидкого аммиака в качестве внешнего стандарта
doi 10.1021/cr300527g
2,3-Диметил-5-гидрокси-6-аминопиримидин-
2. Liu J.J., Diaz D.E., Quist D.A., Karlin K.D. // Isr. J.
4(3Н)-он
(1) был получен окислением
1.00 г
Chem. 2017. Vol. 56. N 9-10. P. 1. doi 10.1002/
(7.2 ммоль) 2,3-диметил-6-аминопиримидин-4(3H)-
ijch.201600025
она [14] по методике, описанной в работе [15].
3. Bissaro B., Røhr Е. K., Müller G., Chylenski P.,
Выход 0.75 г (67%), белые кристаллы, т. пл. 265°C
Skaugen M., Forsberg Z., Horn S.J., Vaaje-Kolstad G.,
(разл.). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 2.31 с
Eijsink V.G. // Nature Chem. Biol. 2017. Vol.
13.
(3H, CCH3), 3.36 с (3H, NCH3), 6.63 с (2H, NH2),
P. 1123. doi 10.1038/nchembio.2470
7.79 с (1H, OH). Спектр ЯМР 13C (ДМСО-d6), δС,
4. Chowdhury B., Maji M., Biswas B. // J. Chem. Sci.2017.
м. д.: 21.88 (CCH3), 30.04 (NCH3), 118.40 (COH),
Vol. 129. N 10. P. 1627. doi 10.1007/s12039-017-1379-y
147.74 (CNH2), 149.94 (N=C), 156.65 (C=O). Спектр
5. Holm R.H., Kennepohl P., Solomon E.I. // Chem. Rev.
ЯМР 15N (ДМСО-d6), δN, м. д.: 68.8 (NH2), 162.3
1996. Vol. 96. N 7. P. 2239. doi 10.1021/cr9500390
(NMe), 226.4 (N=C). Найдено, %: C 46.2; H 6.0; N
6. Schönecker B., Zheldakova T., Liu Y., Kötteritzsch M.,
26.8. C6H9N3O2. Вычислено, %: C 46.5; H 5.9; N 27.1.
Günther W., Görls H. // Angew. Chem. Int. Ed. 2003.
Гидроксилирование 2,3-диметил-5-гидрокси-
Vol. 42. P. 3240. doi 10.1002/anie.200250815
6-аминопиримидин-4(3Н)-она кислородом воздуха
7. Активация кислорода ферментативными систе-
в присутствии CuCl2. Навеску
2,3-диметил-5-
мами / Под ред. Д.И. Метелицы. М.: Наука, 1982.
гидрокси-6-аминопиримидин-4(3Н)-она
1 массой
256 с.
50 мг растворяли в 300 мл этилового спирта,
8. Активация и каталитические реакции алканов / Под
содержащего
5% воды. К раствору добавляли
ред. А.Е. Шилова. М.: Мир, 1992. 421 с.
5.5 мг хлорида меди(II). Через определенные про-
9. Al-Arab M. M., Hamilton G. A. // J. Am. Chem. Soc.
межутки времени отбирали пробы из реакционной
1986. Vol. 108. N 19. P. 5972. doi 10.1021/ja00279a051
массы и определяли концентрацию 2,3-диметил-5-
10. Муринов Ю.И., Мишинкин В.Ю., Акчурина О.В.,
гидрокси-6-аминопиримидин-4(3Н)-она 1 спектро-
Грабовский С.А., Кабальнова Н.Н. // ЖОХ. 2017.
фотометрически на максимуме полосы погло-
Т. 87. Вып. 8. С. 1252; Murinov Yu.I., Mishinkin V.Yu.,
щения. Реакцию проводили в течение 10 ч при
Akchurina O.V., Grabovskii S.A., Kabal’nova N.N. //
комнатной температуре при постоянном пере-
Russ. J. Gen. Chem. 2017. Vol. 87. N 8. P. 1667. doi
мешивании. Соединения 2 и 3 зафиксированы при
10.1134/S1070363217080047
анализе реакционной смеси методами ЯМР 13С и
11. Мишинкин В.Ю., Грабовский С.А., Кабальнова Н.Н.,
1Н. После окончания реакции растворитель отгоняли.
Муринов Ю.И. // ЖОХ. 2017. Т.87. Вып. 7. С. 1149;
Идентификацию соединения 4 проводили методом
Mishinkin V.Yu., Grabovskii S.А., Kabal’nova N.N.,
ИК спектроскопии. ИК спектр, ν, см-1: 1668 ср (С=N),
Murinov Yu.I. // Russ. J. Gen. Chem. 2017. Vol. 87.
1639 сл (C=O), 1630 сл (C=O), 1620 сл (C=O).
N 7. P. 1542. doi 10.1134/S1070363217070167
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019
376
МИШИНКИН и др.
12. Справочник по растворимости
/ Под. ред. В.Б.
14. Coburn R.A., Taylor M.D. // J. Heterocycl. Chem. 1982.
Когана, В.М. Фридмана, В.В. Кафарова. М.; Л.: Изд.
Vol. 19. N 3. P. 567. doi 10.1002/jhet.5570190323
АН СССР, 1961. Т. 1. Кн. 1. 970 с.
15. Mátyus P., Makk N., Tegdes A., Kosáry J., Kasztreiner E.,
Podányi B., Rabloczky G., Kiirthy M. // J. Heterocycl.
13. Franco C., Olmsted III J. // Talanta. 1990. Vol. 37. N 9.
Chem. 1990. Vol. 27. N 2. P. 151. doi 10.1002/
jhet.5570270207
CuCl2-Mediated Hydroxylation
of 2,3-Dimethyl-5-hydroxy-6-aminopyrimidine-4(3H)-one
with Molecular Oxygen in Aqueous
and Non-Aqueous Solutions
V. Yu. Mishinkin, S. A. Grabovsky, N. N. Kabalnova, and Yu. I. Murinov*
Ufa Institute of Chemistry, Ufa Federal Research Center of the Russian Academy of Sciences,
pr. Oktyabrya 71, Ufa, 450054 Russia
*e-mail: murinov@anrb.ru
Received September 27, 2018; revised September 27, 2018; accepted October 2, 2018
The catalytic hydroxylation of 2,3-dimethyl-5-hydroxy-6-aminopyrimidine-4(3H)-one in an aqueous solution in
the presence of copper(II) ions and oxygen proceeds with the formation of 2,3-dimethyl-5,5,6-trihydroxy-6-
aminopyrimidine-4-(3H) -one.
Keywords: molecular oxygen, 2,3-dimethyl-5-hydroxy-6-aminopyrimidine-4(3H)-one, copper(II) ions, hydroxylation
reaction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 89 № 3 2019