БИОФИЗИКА, 2023, том 68, № 5, с. 1014-1021
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 576.7:591.1: 591.13
РОЛЬ ОКСИДА АЗОТА И ИОНОВ КАЛЬЦИЯ В ЭФФЕКТАХ
СЕРОВОДОРОДА НА СОКРАТИТЕЛЬНУЮ АКТИВНОСТЬ
ТОЩЕЙ КИШКИ КРЫСЫ
© 2023 г. Д.М. Сорокина*, И.Ф. Шайдуллов*, А.Р. Гиззатуллин*,
Ф.Г. Ситдиков*, Г.Ф. Ситдикова*, #
*Казанский (Приволжский) федеральный университет, ул. Кремлевская,
18, Казань, Республика Татарстан, 420008, Россия
#E-mail: guzel.sitdikova@kpfu.ru
Поступила в редакцию 15.02.2023 г.
После доработки 02.03.2023 г.
Принята к публикации 15.03.2023 г.
Исследована роль оксида азота, внутри- и внеклеточного кальция в эффектах сероводорода на
спонтанные и вызванные карбахолином сокращения препарата тощей кишки крысы в условиях
изометрического сокращения. Донор H2S - гидросульфид натрия - приводил к снижению тонуса
препарата, амплитуды и частоты спонтанных сокращений, а также параметров сокращений,
вызванных неспецифическим агонистом рецепторов ацетилхолина карбахолином. В условиях
ингибирования эндогенного синтеза NO с помощью L-NAME эффект донора H2S сохранялся,
тогда как на фоне действия SNAP, донора NO, эффекты NaHS на амплитуду спонтанных и
вызванных карбахолином сокращений были выражены в меньшей степени. Снижение тонуса
препарата при действии NaHS предотвращалось дантроленом, блокатором рианодиновых
рецепторов. Бескальциевый раствор снижал ингибиторное влияние NaHS на сокращения,
вызванные аппликацией карбахолина. Сделано предположение о том, что угнетающее влияние H2S
связано с динамикой внутриклеточной концентрации ионов кальция, а взаимодействие NO и H2S
реализуется на уровне общих мишеней действия двух газов.
Ключевые слова: сероводород, оксид азота, сократительная активность, тощая кишка крысы,
вызванные карбахолином сокращения, кальций.
DOI: 10.31857/S0006302923050228, EDN: NAPRMD
включая гладкомышечные, нейрональные, эпи-
Сероводород (H2S) и оксид азота (NO) отно-
телиальные и интерстициальные клетки Кахаля
сятся к классу газомедиаторов наряду с моноок-
[8-10].
сидом углерода (CO) [1]. H2S обнаружен во мно-
гих системах, включая желудочно-кишечный
NO продуцируется ферментативно с помощью
тракт (ЖКТ), где он синтезируется ферментами
синтазы оксида азота, а также бактериальной
цистатионин-β-синтазой и цистатионин-γ-лиа-
микрофлорой и участвует в регуляции перисталь-
зой [2]. Третий ферментативный путь синтеза
тики кишечника, секреции слизистых желез, пе-
H2S осуществляется 2-оксоглутарат-аминотранс-
реваривания пищи, абсорбции и опорожнении
кишечника [11]. Значительное число эфферентов
феразой совместно с 3-меркаптопируват-сульф-
энтеральной нервной системы млекопитающих
трансферазой [3, 4]. Кроме того, H2S продуциру-
содержат нейрональную синтазу оксида азота, а
ется
сульфатредуцирующими бактериями,
выделяющийся NO является неадренергическим
являющимися частью нормальной энтеробакте-
и нехолинергическим тормозным нейромедиато-
риальной флоры [2, 5-7]. Ферменты цистатио-
ром [11]. Известно, что H2S также вызывает ре-
нин-β-синтаза, цистатионин-γ-лиаза и 3-мер-
лаксацию гладких мышц ЖКТ и ингибирует пе-
каптопируват-сульфтрансфераза экспрессируют-
ристальтику, путем активации калиевых каналов
ся повсеместно ЖКТ в различных типах клеток,
и гиперполяризации гладкомышечных клеток [8,
Сокращения: ЖКТ
- желудочно-кишечный тракт,
12-17].
L-NAME - NG-нитро-L-аргинин-метил-эфир, SNAP -
S-нитрозо-N-ацетилпеницилламин, ППК - площадь под
Несмотря на наличие собственных механиз-
кривой.
мов влияния, эти два газомедиатора могут взаи-
1014
РОЛЬ ОКСИДА АЗОТА И ИОНОВ КАЛЬЦИЯ
1015
модействовать друг с другом как на уровне регу-
кишки в контроле и при добавлении исследуемых
ляции активности ферментов синтеза, так и ми-
веществ. Также оценивали амплитуду (в граммах)
шеней действия
[18,
19]. Так, эндогенная
и площадь под кривой (ППК, в г·с) в течение
продукция H2S в ткани аорты усиливалась при
1 мин аппликации карбахолина в контроле и на
действии доноров NO [19], а взаимодействие H2S
фоне веществ. Реакцию препарата на введение
исследуемых веществ рассчитывали в процентах
и NO необходимы для ангиогенеза и вазодилята-
от исходного значения. Параметры сократитель-
ции [18], регуляции секреции и двигательной ак-
ной активности в контроле принимали за 100%,
тивности желудка [12, 20]. NO может активиро-
n указывает на количество препаратов. В каждой
вать цистатионин-γ-лиазу/цистатионин-β-син-
серии экспериментов использовали не менее трех
тазу с последующим усилением продукции H2S, а
животных. Достоверность различий определяли с
H2S при этом ингибировал синтазу оксида азота и
помощью парного t-критерия Стьюдента или
продукцию NO [19, 21, 22]. С другой стороны, H2S
дисперсионного анализа ANOVA с применением
обладает способностью ускорять высвобождение
теста Бонферрони. Все данные представлены как
NO из S-нитрозоглутатиона [21, 22]. При этом до-
среднее значение ± ошибка среднего. Различия
нор NO ингибировал экспрессию цистатионин-
считали достоверными при р < 0.05. Статистиче-
β-синтазы [23], а H2S снижал экспрессию эндоте-
ский анализ был выполнен с помощью програм-
лиальной синтазы оксида азота [24].
мы OriginPro 2015 (Origin Lab, США).
Целью нашего исследования было выявление
роли NO, а также механизмов, связанных с регу-
ляцией внутриклеточного кальция, в эффектах
РЕЗУЛЬТАТЫ
H2S на сократимость тощей кишки крысы.
Влияние донора H2S гидросульфида натрия на
спонтанную и вызванную карбахолином сократи-
МАТЕРИАЛЫ И МЕТОДЫ
тельную активность препарата тощей кишки кры-
сы. Препарат тощей кишки крысы в контроле ха-
Исследования по анализу спонтанной и вы-
рактеризовался спонтанными сокращениями ам-
званной сократительной активности проводили
плитудой 0.9±0.08 г, возникающих с частотой
на изолированных сегментах тощей кишки кры-
сы длиной 5-7 мм в изометрических условиях на
29.3 ± 0.6 сокращений·мин-1. Донор H2S - NaHS -
установке фирмы Biopac Systems (США). Реги-
вызывал угнетение как спонтанных, так и вы-
страцию и последующий анализ параметров со-
званных карбахолином сокращений препаратов
кращения препарата проводили с помощью про-
тощей кишки крысы, как было показано ранее
граммы AcqKnowledge 4.1. На протяжении всего
[25]. NaHS в концентрации 200 мкМ приводил к
эксперимента препарат омывался раствором
снижению тонуса препарата до 76% (с 1.2 ± 0.09 г
Кребса, который содержал (в мМ·л-1): NaCl -
до 0.99 ± 0.05 г, n = 19, p < 0.05), амплитуды и ча-
121.0, KCl - 5.9, CaCl2 - 2.5, MgCl2 - 1.2,
стоты спонтанных сокращений
- до
43%
(с 0.9 ± 0.08 г до 0.4 ± 0.06 г, n=19, p < 0.05) и 80%
NaHCO3 - 25.0, NaH2PO4 - 1.2, С6Н12О6 -
8.0 (Sigma, США) с постоянной подачей карбоге-
(с 29.3 ± 0.6 мин-1 до 23.4 ± 1.1 мин-1, n = 19,
на (95% O2 и 5% CO2), при температуре 37°С и
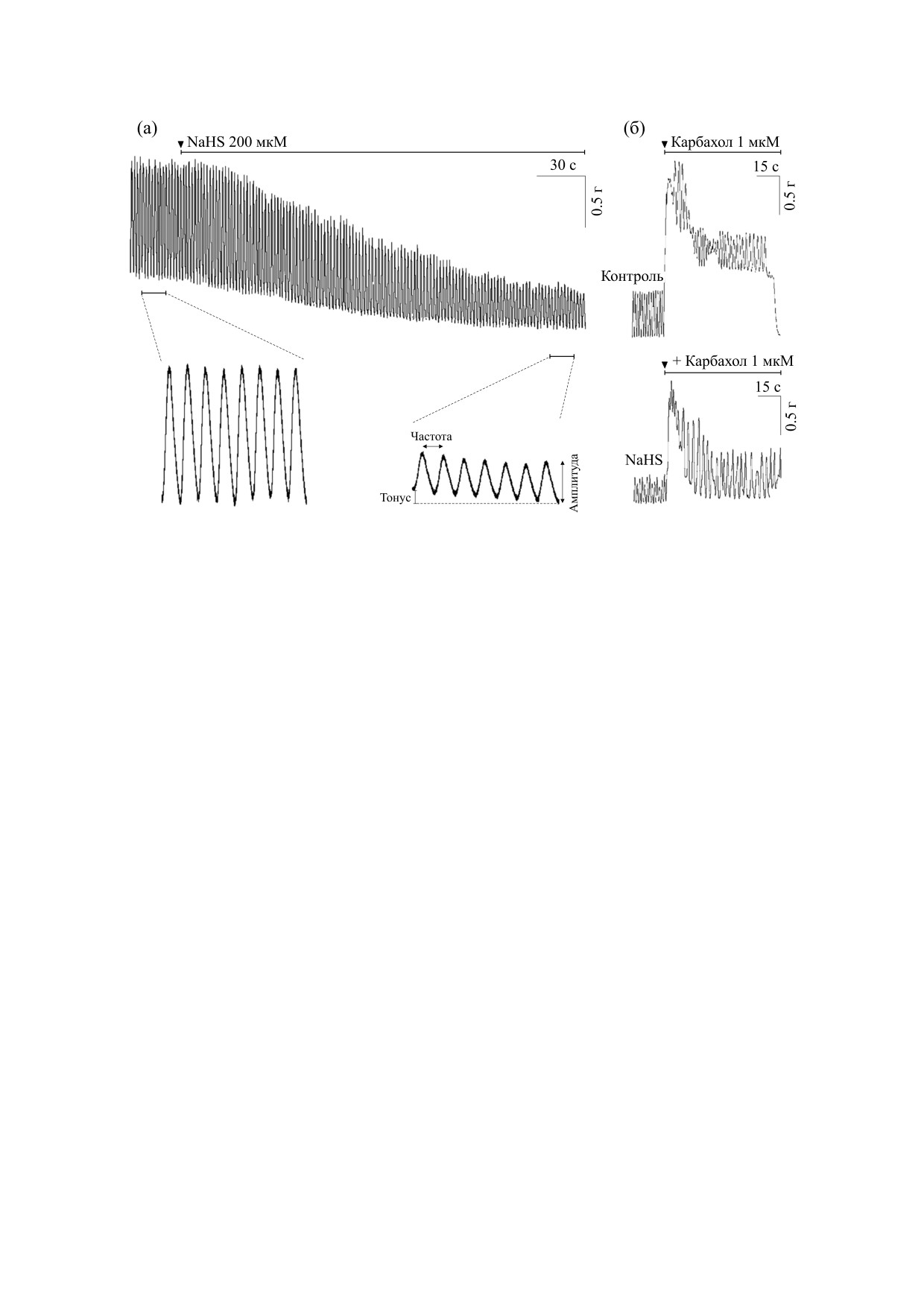
p < 0.05) соответственно, по отношению к
контрольным значениям (рис. 1а). Эти эффекты
рН 7.2-7.4. После подвешивания препарат разра-
полностью проявлялись и в присутствии блока-
батывали в течение 40-60 мин при напряжении
1 г до получения стабильных сокращений.
тора потенциалзависимых Na+ каналов тетродо-
токсина: тонус препарата снижался до 60% (с
В качестве донора H2S использовали гидро-
1.16 ± 0.09 г до 0.69 ± 0.04 г, n = 19, p < 0.05), ам-
сульфид натрия (NaHS, Sigma, США) в концен-
плитуда - до 30% (с 0.62 ± 0.06 г до 0.17 ± 0.01,
трации 200 мкМ. В экспериментах также исполь-
n = 19, p < 0.05) и частота - до 59% (с 26 ±
зовали агонист рецепторов ацетилхолина - кар-
± 0.26 мин-1 до 15.5 ± 0.8 мин-1, n = 19, p < 0.05).
бахолин в концентрации
1 мкМ, блокатор
потенциал-зависимых Na+ каналов - тетродо-
Аппликация карбахолина (1 мкМ) вызывала
токсин в концентрации 0.5 мкМ, неспецифиче-
резкое увеличение тонического напряжения, ко-
ский блокатор NО-синтазы - NG-нитро-L-арги-
торое достигнув максимального значения, сни-
нин-метил-эфир (L-NAME) в концентрации
жалось и держалось на уровне плато. NaHS угне-
100 мкМ, донор NO - S-нитрозо-N-ацетилпени-
тал сокращение, вызванное карбахолином: ППК
цилламин (SNAP) в концентрации 50 мкМ, бло-
и амплитуда сокращения составили
59% (с
катор рианодиновых рецепторов - дантролен в
120.7 ± 6.4 г·с до 67.01 ± 3.04 г·с, n = 37, p < 0.05) и
концентрации 25 мкМ.
64% (с 2.1 ± 0.1 г до 1.3 ± 0.08 г, n = 37; p < 0.05) со-
Анализировали амплитуду и частоту спонтан-
ответственно по сравнению с эффектами карба-
ных сокращений, а также тонус сегмента тощей
холина в контроле (рис. 1б).
БИОФИЗИКА том 68
№ 5
2023
1016
СОРОКИНА и др.
Рис. 1. Механограммы спонтанной и вызванной сократительной активности тощей кишки крысы при действии NaHS в
концентрации 200 мкМ. (а) - Изменение спонтанной сократительной активности в условиях аппликации NaHS. На
врезках показаны сокращения на расширенной временной шкале в контроле и к 7 мин аппликации NaHS. На графике
обозначены тоническое напряжение препарата и параметры спонтанных сокращений. (б) - Изменение вызванной
карбахолином (1 мкМ, 1 мин) сократительной активности на фоне действия NaHS. Горизонтальная линия указывает на
продолжительность действия вещества.
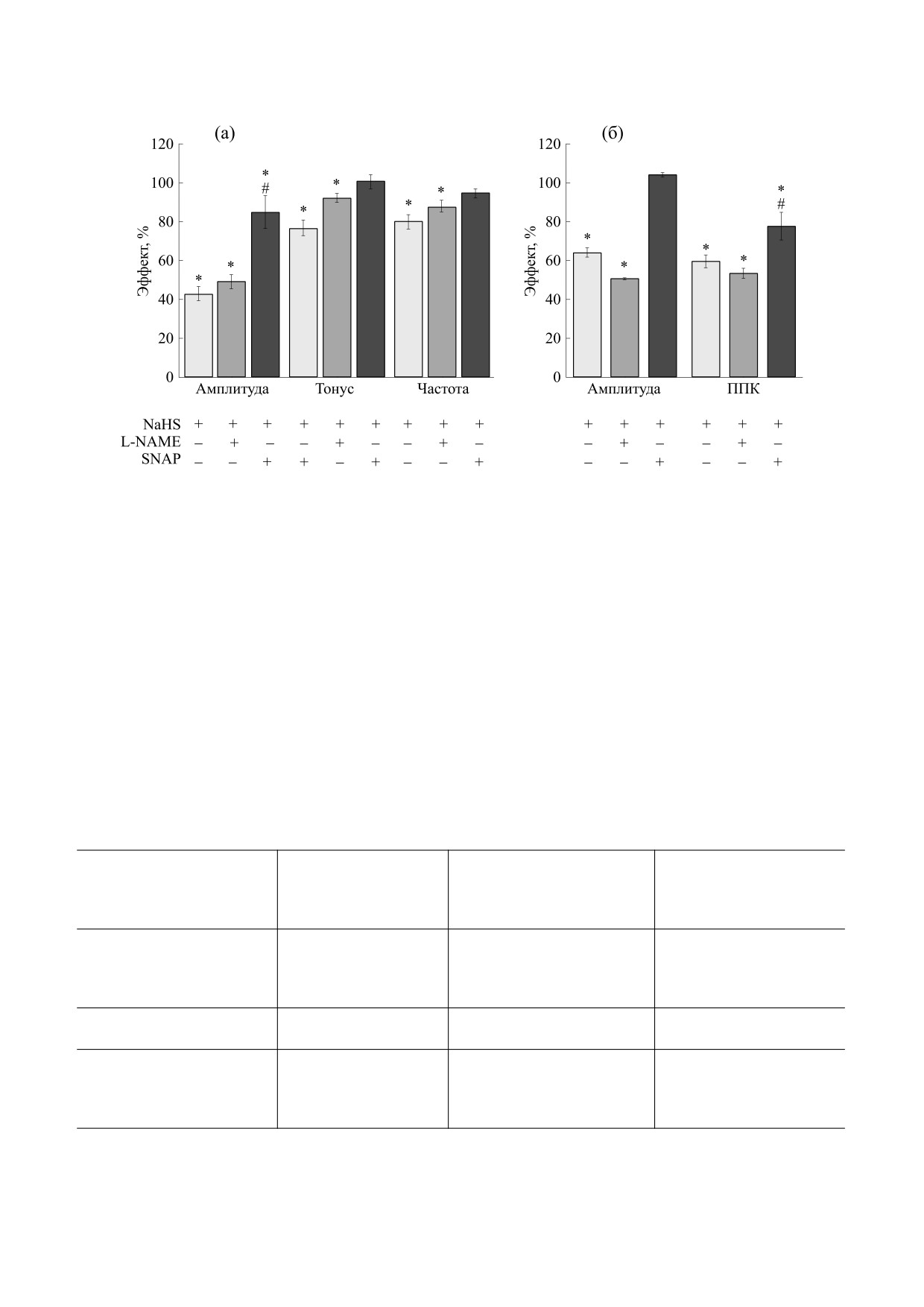
Роль NO в эффектах NaHS. Для ингибирова-
p < 0.05, рис. 2б, табл. 2), на фоне действия SNAP
ния эндогенного синтеза NO использовали
был выражен в меньшей степени на ППК (n = 12,
L-NAME в концентрации 100 мкМ, аппликация
р < 0.05), а на амплитуду вызванных карбахоли-
которого приводила к повышению амплитуды
ном сокращений не проявлялся (n = 12, р > 0.05,
спонтанных сокращений до 119% (n = 32, p < 0.05)
рис. 2б, табл. 2).
от начального уровня, при этом тоническое на-
Роль ионов кальция в эффектах сероводорода на
пряжение препарата и частота спонтанных сокра-
параметры спонтанных и вызванных карбахолином
щений не изменялись (n = 34, p > 0.05) (табл. 1).
сокращений тощей кишки крысы. Для анализа ро-
На фоне L-NAME ингибирующие эффекты
NaHS на тонус спонтанных сокращений сохраня-
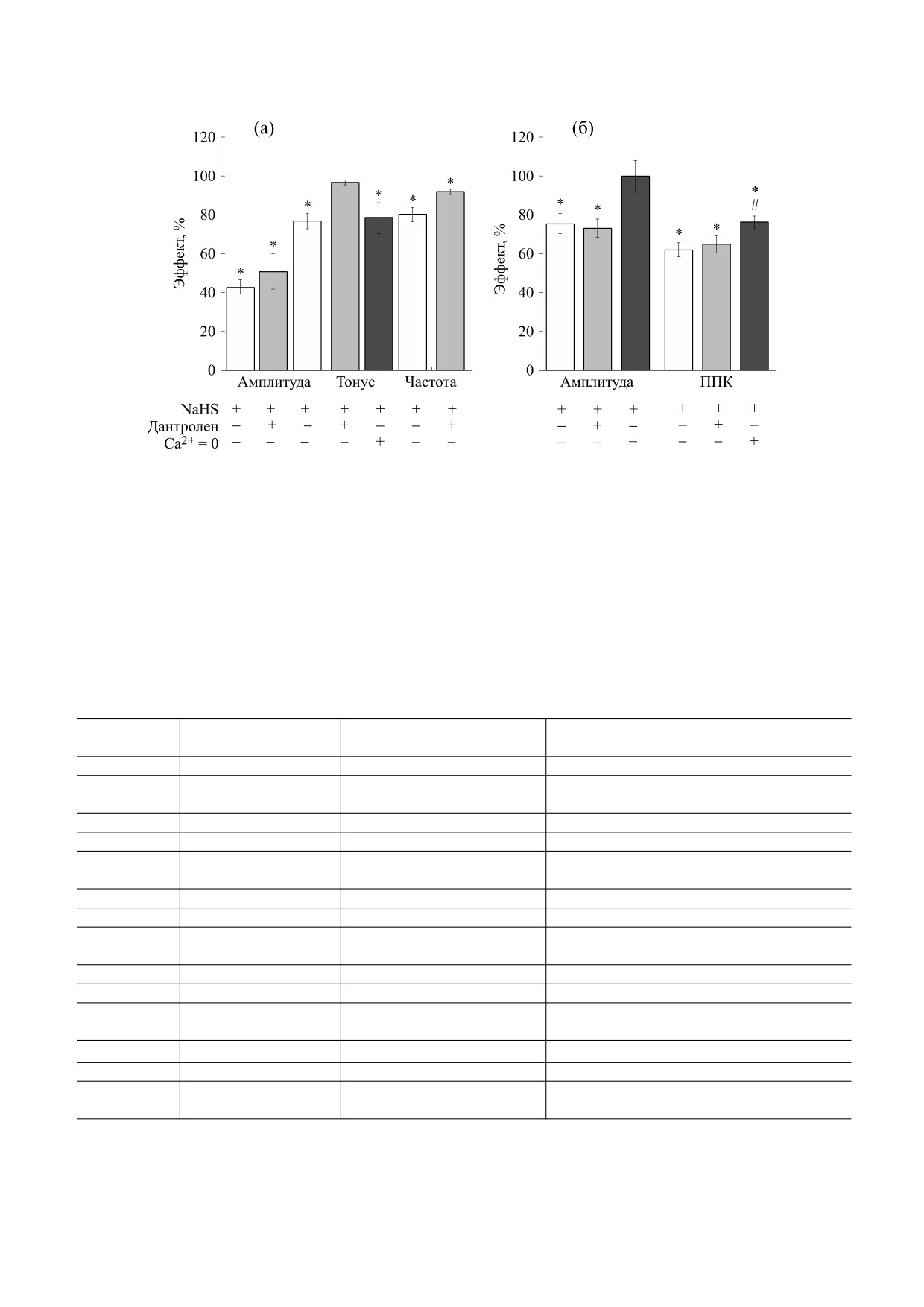
ли внутриклеточных Ca2+-депо в эффектах NaHS
лись (n = 18, p > 0.05) (рис. 2а, табл. 1). Экзоген-
использовали дантролен в концентрации 25 мкМ,
ный донор NO - SNAP - в концентрации 50 мкМ
который снижает высвобождение кальция из сар-
приводил к снижению амплитуды к 30-й секунде
коплазматического ретикулума за счет ингибиро-
до 55% (n = 22, p < 0.05), после чего происходило
вания рианодиновых рецепторов [26]. Добавле-
восстановление амплитуды до исходных значе-
ние дантролена не приводило к изменению тони-
ний (n = 22, p > 0.05), при этом тонус препарата и
ческого напряжения (93%, n = 17, p > 0.05),
частота спонтанных сокращений не изменялись
амплитуды (103%, n = 13, p > 0.05) и частоты спон-
(n = 22, р > 0.05, табл. 1). На фоне SNAP эффект
танных сокращений (94%, n = 15, p > 0.05, табл. 1).
NaHS на амплитуду спонтанных сокращений был
На фоне дантролена эффекты донора H2S на ам-
выражен в меньшей степени
(84%, n
= 11,
плитуду (50%, n = 8, p < 0.05) и частоту спонтан-
p < 0.05), а на тонус препарата (100%, n = 11,
ных сокращений сохранялись
(91%, n
= 7,
p > 0.05) и частоту сокращений - не проявлялся
p < 0.05), а на тоническое напряжение (96%, n = 8,
(94%, n = 9, p > 0.05, рис. 2а, табл. 1).
p > 0.05, рис. 3а, табл. 1) не проявлялся. Для ана-
Аппликация L-NAME или SNAP не влияла на
лиза роли внеклеточного Ca2+ в эффектах NaHS
использовали бескальциевый раствор. Замеще-
амплитуду и ППК вызванного карбахолином со-
ние нормального раствора на раствор, не содер-
кращений (n = 15, p > 0.05, табл. 2). Угнетающий
эффект NaHS на ответ, вызванный карбахоли-
жащий Ca2+, характеризовалось снижением то-
ном, на фоне L-NAME сохранялся (n = 27,
нического напряжения препарата от 1.38 ± 0.13 г
БИОФИЗИКА том 68
№ 5
2023
РОЛЬ ОКСИДА АЗОТА И ИОНОВ КАЛЬЦИЯ
1017
Рис. 2. Роль NO в эффектах донора H2S на спонтанные и вызванные карбахолином сокращения тощей кишки крысы. (а)
- Изменение тонуса препарата, амплитуды и частоты спонтанных сокращений при действии NaHS (200 мкМ) в
контроле (белые столбики), NaHS на фоне блокатора NO-синтазы L-NAME (100 мкМ, серые столбики) и донора NO S-
нитрозо-N-ацетилпеницилламина (SNAP) (50 мкМ, черные столбики). * - p < 0.05 относительно начальных значений
(100%), # - p < 0.05 по отношению к эффектам NaHS в контроле. (б) - Амплитуда и ППК вызванных карбахолином
сокращений при действии NaHS (200 мкМ) в контроле (белые столбики), NaHS на фоне L-NAME (100 мкМ, серые
столбики) и донора NO SNAP (50 мкМ, черные столбики). * - p < 0.05 по отношению к значениям, полученным при
действии карбахолина в контроле (100%), # - p < 0.05 по отношению к карбахолин вызванному сокращению на фоне
NaHS.
до 1.13 ± 0.10 г (n = 12, p < 0.05) и практически пол-
На фоне предварительной аппликации дан-
ным угнетением спонтанных сокращений, поэто-
тролена параметры вызванного карбахолином со-
му анализировали влияние NaHS только на то-
кращения не отличались от контроля (n = 12,
нус. В бескальциевом растворе ингибирующий
p > 0.05) (табл. 2). На фоне действия дантролена
эффект NaHS на тонус сохранялся (78%; n = 8,
ингибирующие эффекты NaHS на карбахолин
p < 0.05, рис. 3а).
вызванные сокращения сохранялись (n = 12,
Таблица 1. Роль NO и ионов Са2+ в эффектах NaHS на спонтанную сократительную активность тощей кишки
крысы
Контроль
L-NAME
L-NAME + NaHS
Амплитуда, г
0.86 ± 0.04
1 ± 0.06*
0.46 ± 0.05*
Тоническое напряжение, г
0.90 ± 0.02
0.87 ± 0.05
0.81 ± 0.04*
Частота, мин-1
30.25 ± 0.67
28.25 ± 0.73
24.8 ± 1.17*
Контроль
SNAP
SNAP + NaHS
Амплитуда, г
0.74 ± 0.06
0.80 ± 0.06
0.64 ± 0.06*#
Тоническое напряжение, г
1.28 ± 0.08
1.20 ± 0.08
1.19 ± 0.08
Частота, мин-1
28.73 ± 0.47
26 ± 0.46
24.66 ± 0.60
Контроль
[Са2+] = 0
[Са2+] = 0, NaHS
Тоническое напряжение, г
1.38 ± 0.13
1.13 ± 0.10
1.01 ± 0.11
Контроль
Дантролен
Дантролен + NaHS
Амплитуда, г
0.68 ± 0.10
0.67 ± 0.09
0.31 ± 0.08*
Тоническое напряжение, г
1.08 ± 0.09
1.01 ± 0.09
0.83 ± 0.09
Частота, мин-1
31.2 ± 0.57
29.40 ± 0.70
28 ± 0.97
Примечание. * - p < 0.05 по отношению к исходным значениям, # - p < 0.05 по отношению к эффекту NaHS в контроле.
БИОФИЗИКА том 68
№ 5
2023
1018
СОРОКИНА и др.
Рис. 3. Роль ионов кальция в эффектах NaHS на сократительную активность тощей кишки крысы. (а) - Изменение
параметров спонтанных сокращений при действии NaHS (200 мкМ) в бескальциевом растворе (черный столбик) и на
фоне дантролена (25 мкМ, серые столбики). * - p < 0.05 относительно исходных значений (100%), # - p < 0.05 по
отношению к эффектам NaHS в контроле (белые столбики). (б) - Амплитуда и ППК вызванных карбахолином
сокращений при действии NaHS (200 мкМ) в контроле (белые столбики), на фоне действия дантролена (100 мкМ, серые
столбики) и в бескальциевом растворе (черные столбики). * - p < 0.05 по отношению к значениям, полученным при
действии карбахолина в контроле (100%), # - p < 0.05 - по отношению к вызванному карбахолином сокращению на
фоне NaHS.
p < 0.05, рис. 3б, табл. 2). В бескальциевым рас-
и 73% (n = 16, p < 0.05) соответственно (табл. 2).
творе амплитуда и ППК сокращения, вызванного
Последующая аппликация NaHS не приводила к
карбахолином, снижались до 74% (n = 16, p < 0.05) изменению амплитуды карбахолин вызванных
Таблица 2. Роль NO и ионов Са2+ в эффектах NaHS на вызванные карбахолином сокращения тощей кишки крысы
Параметры
Контроль
NaHS + Карбахолин
(Карбахолин)
Амплитуда, г
2.15 ± 0.12
1.36 ± 0.08*
Площадь под
120.75 ± 6.46
67.01 ± 3.04*
кривой, г·с
L-NAME + карбахолин
L-NAME + NaHS + карбахолин
Амплитуда, г
2.23 ± 0.11
2.10 ± 0.17
1.06 ± 0.13*
Площадь под
125.10 ± 6.50
103.96 ± 8.20*
55.64 ± 2.63*
кривой, г·с
SNAP + карбахолин
SNAP + NaHS + карбахолин
Амплитуда, г
1.81 ± 0.16
1.80 ± 0.16
1.87 ± 0.16
Площадь под
118.76 ± 8.90
116.00 ± 8.55
90.15 ± 7.00*#
кривой, г·с
Дантролен + карбахолин
Дантролен + NaHS + карбахолин
Амплитуда, г
1.52 ± 0.27
1.36 ± 0.30
0.99 ± 0.14*
Площадь под
93.17 ± 13.88
88.50 ± 13.68
57.21 ± 5.46*
кривой, г·с
[Cа2+] = 0, + карбахолин
[Cа2+] = 0, NaHS + Карбахолин
Амплитуда, г
2.01 ± 0.15
1.41 ± 0.10*
1.25 ± 0.13
Площадь под
110.68 ± 8,97
77.66 ± 4.40*
58.70 ± 3.99*#
кривой, г·с
Примечание. * - p < 0.05 по отношению к значениям, полученным при действии карбахолина в контроле, # - p < 0.05 - по
отношению к вызванному карбахолином сокращению на фоне NaHS.
БИОФИЗИКА том 68
№ 5
2023
РОЛЬ ОКСИДА АЗОТА И ИОНОВ КАЛЬЦИЯ
1019
сокращений (99%; n = 16; p > 0.05), его эффект на
ки крысы вызывал кратковременное угнетение
ППК был выражен в меньшей степени, чем в
амплитуды спонтанных сокращений, после чего
контроле (75%, n = 16, p < 0.05; рис. 3б, табл. 2).
она возвращалась к исходным значениям. Сход-
ные эффекты были продемонстрированы и в то-
щей кишке мыши и человека, и этот эффект бло-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
кировался ODQ [43, 44], тогда как в циркулярных
Взаимодействие газовых сигнальных молекул
мышцах тощей кишки крысы донор NO не ока-
NO и H2S показано во многих системах нашего
зывал существенного влияния на спонтанную ак-
тивность [45]. В присутствии донора NO эффекты
организма [1, 22, 27-30]. В нашей работе мы ис-
NaHS на амплитуду спонтанных и вызванных
следовали роль NO и внутриклеточного кальция в
карбахолином сокращений были выражены в
эффектах H2S на спонтанные и вызванные карба-
меньшей степени. Можно предположить, что
холином сокращения тощей кишки крысы. H2S
предварительная аппликация донора NO вызыва-
на сегодняшний день является общепризнанной
ет активацию внутриклеточных сигнальных пу-
сигнальной молекулой, которая синтезируется в
тей, общих для NO и H2S, что снижает эффектив-
ЖКТ и регулирует двигательную активность,
ность действия NaHS. Большинство эффектов
процессы секреции, абсорбции [31, 32], а также
NO в ЖКТ опосредуется NO-чувствительной гуа-
играет роль в развитии различных патологиче-
нилатциклазой, которая экспрессируется в глад-
ских процессов, таких как синдром раздраженно-
комышечных клетках [11, 46-48]. Активация рас-
го кишечника, воспалительные заболевания, язва
творимой гуанилатциклазы приводит к синтезу
желудка и двенадцатиперстной кишки, язвенный
цГМФ, мишенью которого являются три группы
колит, болезнь Крона, ожирение и рак [33, 34].
белков
- цГМФ-зависимая протеинкиназа,
Было показано, что инъекции NaHS, донора H2S,
цГМФ-регулируемая фосфодиэстераза и цГМФ-
заметно облегчают воспаление и окислительный
зависимые ионные каналы [48, 49]. цГМФ-регу-
стресс при постинфекционном синдроме раздра-
лируемая фосфодиэстераза 3 (цГМФ ингибируе-
женного кишечника [35], а снижение продукции
мая расщепляющая цАМФ) была показана в
H2S приводит к усилению перистальтики.
гладкомышечных клетках ЖКТ и интерстициаль-
H2S повсеместно продуцируется в ЖКТ [36] и
ных клетках Кахаля [48, 50] и может опосредовать
взаимодействие между NO/цГМФ- и цАМФ-сиг-
оказывает преимущественно расслабляющие эф-
нализацией, и таким образом действовать на ми-
фекты на двигательную активность [37, 38], а его
шени цАМФ (например, HCN-каналы)
[48].
клеточные мишени зависят от участка ЖКТ, про-
цГМФ-зависимая протеинкиназа 1 повсеместно
дольных или кольцевых мышечных волокон и ви-
экспрессируется в гладкомышечных клетках и
да, используемого в эксперименте животного
вызывает расслабление преимущественно путем
[15-17, 25, 38]. В нашем исследовании донор H2S
снижения уровня Са2+, угнетая выброс Са2+ из
вызывал расслабление препарата тощей кишки
крысы, снижая спонтанную активность и вы-
внутриклеточных депо или вход Са2+ из внекле-
званные карбахолином сокращения, что согласу-
точного пространства [48]. Так, механизмы рас-
ется с ранее полученными данными [8, 12, 15, 25].
слабления продольных гладкомышечных клеток
желудка крысы при действии нитропруссида на-
В ряде работ предположено участие NO в ме-
ханизмах действия H2S в различных тканях [25,
трия связаны с освобождением Са2+ из сарко-
27, 39, 40]. В желудочно-кишечном тракте NO яв-
плазматического ретикулума через рианодино-
ляется основным тормозным медиатором неадре-
вые рецепторы и входом Са2+ через потенциалза-
нергической, нехолинергической передачи наря-
висимые Са2+-каналы L-типа [51, 52]. Поэтому
ду с вазоинтестинальным пептидом и пуринами
далее анализировали роль внутри- и внеклеточ-
[11, 41]. Синтаза оксида азота экспрессируется в
ного Са2+ в эффектах NaHS.
соме и варикозных расширениях нейронов энте-
ральной нервной системы и синтезирует NO в от-
Тоническое напряжение и амплитуда спон-
вет на повышение уровня кальция [41, 42]. Для
танных сокращений гладкомышечных клеток
анализа роли NO в эффектах H2S использовали
определяется мембранным потенциалом покоя и
ингибитор синтазы оксида азота - L-NAME, ап-
уровнем внутриклеточного Са2+ [53, 54]. Дей-
пликация которого вызывала повышение ампли-
ствительно, снижение тонуса препарата тощей
туды спонтанных сокращений, что указывает на
кишки при действии NaHS предотвращалось в
тоническое выделение NO из нервных окончаний
присутствии блокатора рианодиновых рецепто-
[43]. Ингибиторные эффекты H2S полностью со-
ров - дантролена, тогда как в бескальциевом рас-
хранялись на фоне действия L-NAME и также на
творе эффект NaHS сохранялся. Однако бескаль-
фоне тетродотоксина, что свидетельствует о пря-
циевый раствор снижал ингибиторный эффект
мом действии NaHS на гладкомышечные клетки.
NaHS на сокращения, вызванные аппликацией
Аппликация донора NO на препарат тощей киш-
карбахолина. По-видимому, H2S может влиять
БИОФИЗИКА том 68
№ 5
2023
1020
СОРОКИНА и др.
КОНФЛИКТ ИНТЕРЕСОВ
как на вход Са2+ в гладкомышечные клетки, так и
на его высвобождение из сакроплазматического
Авторы заявляют об отсутствии конфликта
ретикулума [55]. Известно, что H2S является ак-
интересов.
тиватором K+-каналов различных типов [15-17].
Это может приводить в гиперполяризации мем-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
браны или ускорению реполяризации, что будет
Все эксперименты проведены в соответствие c
вызывать снижение входящего Са2+-тока через
Директивой Совета Европейских сообществ
потенциал зависимые Са2+-каналы. Кроме того,
(86/609/ЕЕС) и одобрены локальным этическим
не исключено и непосредственное ингибирую-
комитетом КФУ (протокол № 8 от 05.05.2015;
щее влияние H2S на Са2+-каналы L-типа [10].
протокол №33 от 25.11.2021).
Снижение уровня Са2+ будет приводить к изме-
нению активности киназы/фосфатазы легких це-
СПИСОК ЛИТЕРАТУРЫ
пей миозина и, как следствие, к снижению эф-
1.
A. Hermann, G. F. Sitdikova, and T. M. Weiger, Gas-
фективности работы сократительных белков [56].
otransmitters Physiol. Pathophysiol., 1-204 (2013).
Спонтанная активность гладкомышечных
2.
M. Jimenez, V. Gil, M. Martinez-Cutillas, et al., Br. J.
клеток в ЖКТ определяется ритмическими изме-
Pharmacol., 174, 2805 (2017).
нениями потенциала мембраны, так называемы-
3.
M. H. Stipanuk and P. W. Beck, Biochem. J., 206, 267
ми медленными волнами, в генерации которых
(1982).
ключевую роль играют интерстициальные клетки
4.
N. Shibuya, M. Tanaka, M. Yoshida, et al., Antioxid.
Кахаля, образующие щелевые контакты с низким
Redox Signal., 11, 703 (2009).
сопротивлением с гладкомышечными клетками
5.
K. Sudha, S. Anitta, P. M. Devi, and G. Thejomayah,
[11]. NaHS вызывал угнетение частоты спонтан-
Int. J. Soc. Sci. Interdiscip. Res., 4, 165 (2015).
6.
D. R. Yarullina, R. O. Mikheeva, G. I. Sabirullina,
ной активности препарата тощей кишки, и этот
et al., Bull. Exp. Biol. Med., 160, 343 (2016).
эффект не изменялся значительно ни при воздей-
7.
G. Sitdikova, A. Hermann, A. Yakovlev, Uchenye Zap.
ствии на синтез NO, ни при изменении уровня
Kazan. Univ. Seriya Estestv. Nauk, 160, 686 (2018).
Ca2+ в гладкомышечных клетках, однако предот-
8.
M. S. Kasparek, D. R. Linden, G. Farrugia, and
вращался в присутствие донора NO. По-видимо-
M. G. Sarr, J. Surg. Res., 175, 234 (2012).
му, действие NaHS связано с прямыми эффекта-
9.
L. Sha, D. R. Linden, G. Farrugia, and J. H. Szursze-
ми газа на интерстициальные клетки Кахаля, ко-
wski, J. Physiol., 592, 1077 (2014).
торый в больших концентрациях угнетал
10.
X. Quan, H. Luo, Y. Liu, et al., PLoS One, 10,
пейсмекерную активность в интерстициальных
e0121331 (2015).
клетках Кахаля тонкого кишечника мыши [57].
11.
K. M. Sanders and S. M. Ward, Br. J. Pharmacol., 176,
212 (2019).
Таким образом, донор H2S - NaHS - вызывает
12.
D. Gallego, P. Clavé, J. Donovan, et al., Neurogastro-
снижение тонуса, частоты и амплитуды спонтан-
enterol. Motil., 20, 1306 (2008).
ных сокращений препарата тощей кишки крысы,
13.
M. Nagao, J. A. Duenes, and M. G. Sarr, J. Gastroin-
а также сокращения, вызванные активацией му-
test. Surg., 16, 334 (2012).
скариновых рецепторов карбахолином. Ингиби-
14.
G. F. Sitdikova, N. N. Khaertdinov, and A. L. Zefirov,
торные эффекты H2S реализуются непосред-
Bull. Exp. Biol. Med., 151, 163 (2011).
ственно на гладкомышечные клетки, так как со-
15.
М. У. Шафигуллин, Р. А. Зефиров, Г. И.
храняются в присутствие тетродотоксина и
Сабируллина и др., Бюл. эксперим. биологии и
блокатора NO-синтазы, однако снижаются в
медицины, 157, 275 (2014).
присутствие донора NO, что может быть связано
16.
Г. И. Сабируллина, М. У. Шафигуллин, Н. Н.
с его влиянием на NO-зависимые механизмы ре-
Хаертдинов и др., Вестник науки Сибири, № 15,
339 (2015).
гуляции сократительной активности. Механизмы
17.
И. Ф. Шайдуллов, М. У. Шафигуллин, Д. М.
действия H2S связаны с изменением уровня внут-
Габитова, и др., Журн. эволюц. биохимии и
риклеточного Са2+ вследствие его высвобожде-
физиологии, 54, 355 (2018).
ния из саркоплазматического ретикулума или
18.
C. Coletta, A. Papapetropoulos, K. Erdelyi, et al.,
Proc. Natl. Acad. Sci. USA, 109, 9161 (2012).
входа через потенциалзависимые Са2+-каналы.
19.
W. Zhao, R. Wang, Am. J. Physiol. Heart Circ. Physi-
ol., 283 (2), H474 (2002).
ФИНАНСИРОВАНИЕ РАБОТЫ
20. K. Takeuchi, E. Aihara, M. Kimura, et al., Curr. Med.
Chem., 19, 43 (2012).
Работа выполнена в рамках Программы стра-
21. M. Y. Ali, C. Y. Ping, Y. Y. P. Mok, et al., Br. J. Phar-
тегического академического лидерства Казанско-
macol., 149, 625 (2006).
го (Приволжского) федерального университета
22. Z. Wang, Y. Yan, Y. Wang, and F. Tong, Biomed. Phar-
(«ПРИОРИТЕТ-2030»).
macother., 112, 108736 (2019).
БИОФИЗИКА том 68
№ 5
2023
РОЛЬ ОКСИДА АЗОТА И ИОНОВ КАЛЬЦИЯ
1021
23. G. A. Prathapasinghe, Y. L. Siow, Z. Xu, and
40. Y. Q. Huang, H. F. Jin, H. Zhang, et al., Adv. Exp.
O. Karmin, Am. J. Physiol. Renal Physiol., 295 (4),
Med. Biol., 1315, 205 (2021).
F912 (2008), DOI: 10.1152/AJPRENAL.00040.2008
41. E. Idrizaj, C. Traini, M. G. Vannucchi, and M. C. Bac-
24. G. K. Kolluru, X. Shen, and C. G. Kevil, Redox Biol.,
cari, Int. J. Mol. Sci., 22 (2021).
1, 313 (2013).
42. T. Okamoto, M. J. Barton, G. W. Hennig, et al., Neu-
25. Д. М. Габитова, И. Ф. Шайдуллов, Г. И. Саби-
rogastroenterol. Motil., 26, 556 (2014).
руллина и др., Бюл. эксперим. биологии и
43. N. J. Zyromski, M. L. Kendrick, D. M. Nagorney,
медицины, 160, 18 (2017).
et al., J. Gastrointest. Surg., 5, 588 (2001).
26. F. Zhao, P. Li, S. R. W. Chen, et al., J. Biol. Chem.,
44. T. Ueno, J. A. Duenes, A. E. Zarroug, and M. G. Sarr,
276, 13810 (2001).
J. Gastrointest. Surg., 8, 831 (2004).
27. M. L. Lo Faro, B. Fox, J. L. Whatmore, et al., Nitric
45. B. M. Balsiger, J. A. Duenes, N. Obtani, et al., J. Gas-
Oxide Biol. Chem., 41, 38 (2014).
trointest. Surg., 4, 86 (2000).
28. B. V. Nagpure and J. S. Bian, Handb. Exp. Pharmacol.
46. S. Moncada, R. M. Palmer, and E. A. Higgs, Pharma-
230, 193 (2015).
col. Rev., 43 (1991).
29. A. Walewska, A. Szewczyk, and P. Koprowski, Int. J.
47. T. Ördög, S. M. Ward, and K. M. Sanders, J. Physiol.,
Mol. Sci., 19 (10), 3227 (2018).
518, 257 (1999).
30. D. Wu, Q. Hu, and D. Zhu, Oxid. Med. Cell. Longev.,
48. D. Groneberg, B. Voussen, and A. Friebe, Curr. Med.
2018, ID 4579140 (2018).
Chem., 23, 2715 (2016).
31. D. R. Linden, M. D. Levitt, G. Farrugia, and
49. S. H. Francis, J. L. Busch, and J. D. Corbin, Pharma-
J. H. Szurszewski, Antioxid. Redox Signal., 12, 1135
col. Rev., 62, 525 (2010).
(2010).
50. K. Y. So, S. H. Kim, H. M. Sohn, et al., Mol. Cells, 27,
32. R. Wang, Physiol. Rev., 92, 791 (2012).
525 (2009).
33. S. B. Singh and H. C. Lin, Microorganisms, 3, 866
51. J. Geeson, K. Larsson, S. M. O. Hourani, and
(2015).
N. J. Toms, Auton. Autacoid Pharmacol., 22,
297
34. J. E. Belizário and J. Faintuch, Exp. Suppl., 109, 459
(2002).
(2018).
52. J. G. De Man, B. Y. De Winter, A. G. Herman, and
35. S. Yang, D. Deng, Y. Luo, et al., RSC Adv., 6, 64208
P. A. Pelckmans, Br. J. Pharmacol., 150, 88 (2007).
(2016).
53. C. E. Van Hove, C. Van Der Donckt, A. G. Herman,
36. G. R. Martin, G. W. McKnight, M. S. Dicay, et al.,
et al., Br. J. Pharmacol., 158, 920 (2009).
Dig. Liver Dis., 42, 103 (2010).
54. A. L. Gonzales and S. Earley, Microcirculation, 20, 337
37. R. Hosoki, N. Matsuki, and H. Kimura, Biochem. Bio-
(2013).
phys. Res. Commun., 237, 527 (1997).
55. I. Castro-Piedras and J. F. Perez-Zoghbi, J. Physiol.,
38. I. Dhaese, I. Van Colen, and R. A. Lefebvre, Eur. J.
591, 5999 (2013).
Pharmacol., 628, 179 (2010).
56. K. S. Murthy, Annu. Rev. Physiol., 68, 345 (2006).
39. L. T. Lucetti, R. O. Silva, A. P. M. Santana, et al., Dig.
57. P. J. Yoon, S. P. Parajuli, D. C. Zuo, et al., Chonnam
Dis. Sci., 62, 93 (2017).
Med. J., 47, 72 (2011).
Role of Nitric Oxide and Calcium Ions in the Effects of Hydrogen Sulfide on Contractile
Activity of Rat Jejunum
D.M. Sorokina*, I.F. Shaidullov*, A.R. Gizzatullin*, F.G. Sitdikov*, and G.F. Sitdikova*
Kazan Federal University, Kremlevskaya ul. 18, Kazan, Republic of Tatarstan, 420008 Russia
This study was performed to explore the role of nitric oxide, intracellular and extracellular calcium in the ef-
fects of hydrogen sulfide on spontaneous and carbachol-induced contractions of a rat jejunum preparation
during a isometric contraction. Application of H2S donor, sodium hydrosulfide, led to a decrease in tonic
tension, the amplitude and frequency of spontaneous contractions, as well as in the amplitude induced by
carbachol, a nonspecific acetylcholine receptor agonist. Inhibiting the production of endogenous NO syn-
thesis by with L-NAME, the effect of H2S donor remained unchanged, while in the presence of SNAP, a NO
donor, the effects of NaHS on the amplitude of spontaneous and carbachol-induced contractions were less
pronounced. Dantrolene, a ryanodine receptor inhibitor was used to stop a decrease in tonic tension in the
presence of NaHS. The calcium-free solution reduced the inhibitory effect of NaHS on carbachol-induced
contractions. This suggests that the inhibitory effect of H2S is associated with the dynamics of the intracellular
concentration of calcium ions, and the interaction between NO and H2S occurs at the level of common tar-
gets of two gases.
Keywords: hydrogen sulfide, nitric oxide, contractile activity, rat jejunum, carbachol-induced contractions, calci-
um
БИОФИЗИКА том 68
№ 5
2023