БИОФИЗИКА, 2023, том 68, № 5, с. 982-998
БИОФИЗИКА КЛЕТКИ
УДК 577.3
СРАВНИТЕЛЬНАЯ ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ ЛЮТЕИНА
И ЦИСПЛАТИНА В СОЧЕТАНИИ С ЛИПОСОМАМИ ПО ОТНОШЕНИЮ
К КЛЕТКАМ ОПУХОЛИ МОЛОЧНОЙ ЖЕЛЕЗЫ, ПРОШЕДШИМ
ВОЗДЕЙСТВИЕ РАДИОТЕРАПИИ
© 2023 г. Р.А. Лафта*, М.В. Шафаа*, #, В.М. Дарвиш**, М.С. Эль-Нагди*
*Факультет естественных наук, Хелуанский университет, Каир, 11765, Египет
**Отдел полимеров и пигментов Национального исследовательского центра,
ул. Эльбухут, округ Докки, Гиза, 12622, Египет
#E-mail: Shafaa@science.helwan.edu.eg
Поступила в редакцию 10.11.2021 г.
После доработки 10.11.2021 г.
Принята к публикации 26.11.2021 г.
Охарактеризованы взаимодействия противоопухолевого вещества цисплатина и антиоксидантного
вещества лютеина с липосомами, выбранными в качестве модельных мембран. Морфология всех
липосом была практически сферической, при этом в отсутствие этих веществ липосомы были более
равномерно распределены и менее склонны к агрегации. Средний размер ненагруженных
липосомных образцов составлял 617.90 ± 75.64 нм, в то время как после включения цисплатина,
лютеина и их комбинации он составлял 425.60 ± 64.74 нм, 877.85 ± 93.90 нм и 189.91 ± 136.84 нм,
соответственно. Включение цисплатина или лютеина в липосомные мембраны приводило к
увеличению значений дзета-потенциала. В присутствии цисплатина в комбинации с лютеином
дзета-потенциал достигал наименьших значений. Включение цисплатина в липосомы приводило к
сдвигу в сторону более высокой температуры плавления по сравнению с основным пиком
ненагруженных липосом, что указывает на конформационное нарушение структуры
фосфолипидов. Добавление лютеина приводило к исчезновению основного характерного для
чистых липосом эндотермического пика. Исследование методом ИК-Фурье-спектроскопии
подтвердило взаимодействие лютеина и цисплатина с функциональными группами липосом. В
отсутствии внешнего гамма-облучения значение IC50 для свободного лютеина в тесте
цитотоксичности с клетками MCF-7 составило 10.62 мкг/мл, в то время как для свободного
цисплатина оно составило 41,02 мкг/мл. Для нанолипосомного лютеина и цисплатина значение
IC50 составило 65.84 мкг/мл и 34.29 мкг/мл соответственно. При использовании комбинированной
терапии с дозой гамма-излучения 5 Гр и затем 10 Гр, IC50 свободного лютеина снизилась с 17.0 до
9.5 мкг/мл. Для свободного цисплатина IC50 изменилась с 51.00 до 43.09 мкг/мл. Эта работа
показала, что цитотоксический эффект стандартной формы лютеина сильнее, чем
нанолипосомального лютеина. Согласно обнаруженным фактам можно предложить новый
протокол терапии, в котором цисплатин следует заменить свободным лютеином для увеличения
эффективности терапии против опухолевых клеток линии MCF-7.
Ключевые слова: лютеин; цисплатин; липосомы; FTIR-спектроскопия; цитотоксичность; гамма-
облучение.
DOI: 10.31857/S0006302923050198, EDN: MZUSUE
клетки делятся и распространяются бесконтроль-
Рак - это термин, используемый для описания
группы заболеваний, при которых аномальные но. В отсутствие сдерживания опухолевого роста
это ведет к смерти. Рак является второй наиболее
Сокращения: DPPA - дипальмитоилфосфатидная кислота, распространенной причиной смерти после забо-
Фурье-преобразованием, LipoCis - липосомы с цисплати- леваний сердечно-сосудистой системы, вызыва-
ющих один случай смерти из четырех. Среди ме-
ном, LipoLut - липосомы с лютеином, LipoCisLut -липо-
сомы с цисплатином в сочетании с лютеином, ДСК - диф- тодов лечения рака применяются хирургия, ра-
ференциальная сканирующая калориметрия, МТТ
-
диотерапия, химиотерапия, иммунотерапия и
3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бро-
мид, ИПД - индекс полидисперсности.
направленная терапия [1].
982
СРАВНИТЕЛЬНАЯ ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ ЛЮТЕИНА
983
Наряду с раком легкого рак груди (рак молоч-
к высвобождению высоколетального низкоэнер-
ной железы) - вторая по распространенности
гетического вторичного электрона. Цисплатин
причина смертности. Согласно данным Всемир-
также способен генерировать свободные радика-
ной организации здравоохранения ожидается,
лы, что вызывает существенные повреждения
что в 2050 г. будет зарегистрировано 27 миллио-
ДНК [7]. Цисплатин может выступать как радио-
нов случаев рака молочной железы и 17.5 миллио-
сенсибилизатор, увеличивая дозу радиации, по-
нов случаев смерти от него [2].
глощенную опухолевым очагом. Радиосенсиби-
лизаторы используются в лучевой терапии для
Применение наноразмерных носителей, в том
числе на основе липидов, позволило добиться су-
увеличения поглощенной дозы радиации через
щественных успехов в лечении рака. В настоящее
увеличение собственной радиочувствительности
раковых клеток. Благодаря этому может прово-
время доступны разные формы липидных носи-
телей - липидные наночастицы и другие нано-
диться терапия меньшими дозами радиации, что
структурированные липидные носители. Вслед-
снижает побочное воздействие на нормальные
клетки [8].
ствие их биосовместимости и биодеградабельно-
сти эти липидные модели менее токсичны, чем
Лучевая терапия - это метод, который обычно
другие системы доставки лекарств, такие, как по-
используется тогда, когда опухоль ограничена
лимерные наночастицы. Липосомы - это сфери-
конкретной зоной организма, на которую можно
ческие искусственные носители, состоящие из
физически воздействует. Поскольку она разру-
липидного бислоя и полости внутри, которая мо-
шает ДНК, в том числе гены, контролирующие
жет быть заполнена химиотерапевтическим сред-
репликацию и развитие, она является эффектив-
ством для его доставки в очаг опухоли [3]. Вслед-
ным методом лечения рака. Вследствие прямого
ствие их эффективности, биосовместимости, не-
поглощения радиация может вызывать поврежде-
иммуногенности, повышенной растворимости в
ния ДНК и клеточную гибель, а кроме того, она
них химических агентов и способности к инкап-
может запускать образование свободных радика-
суляции широкого диапазона веществ, эти нано-
лов, ионизируя молекулы воды внутри клеток, в
размерные пузырьки липидного бислоя стали
особенности вблизи молекул ДНК [9].
широко распространены в системах доставки ле-
Комбинация цисплатина и лучевой терапии -
карств. В результате липосомальное применение
распространенная схема лечения различных
противораковых веществ увеличит их эффектив-
форм рака. Во время терапии эти два агента обла-
ность, снижая воздействие веществ на здоровые
дают значительной синергией, но механизм этой
ткани или снижая дозу, необходимую для прояв-
синергии в целом не до конца ясен. Механизм ра-
ления цитотоксичности по отношению к опухо-
диосенсибилизации цисплатином был исследо-
левым клеткам.
ван на in vitro моделях рака груди, который все
Дипальмитоилфосфатидная кислота (DPPA) -
еще остается значительной проблемой для миро-
важный промежуточный метаболит, производи-
вого здравоохранения. Поскольку большинство
мый в основном вследствие гидролиза глицеро-
опухолей такого типа диагностируются очагово,
фосфолипидов фосфолипазой D. DPPA важна
лучевая терапия является самым эффективным
для контроля входа веществ внутрь клетки через
способом лечения.
плазматическую мембрану [4]. DPPA обладает ря-
Каротиноиды - это липофильные пигменты
дом преимуществ, включая способность предот-
полиизопреноидной сруктуры, получаемые в ос-
вращать агрегацию липосом вследствие электро-
новном из растений. Согласно эпидемиологиче-
статического отталкивания, способность образо-
ским исследованиям, женщины с повышенным
вывать латеральные нанокластеры по заряд-
уровнем каротиноидов в пище - таких, как a-ка-
зависимому механизму, способность накапли-
ротин, β-каротин, ликопин и лютеин/зеаксан-
ваться в опухолях и поглощаться по механизму
тин, обладают меньшим риском развития рака
эндоцитоза, и способность увеличивать стабиль-
молочной железы [10]. Каротиноид лютеин явля-
ность липосом. Таким образом, в последние годы
ется нетоксичным, по крайней мере для людей,
возрастает интерес к использованию DPPA как
потребляющих его в терапевтических дозах [11].
основного компонента липидного бислоя при
Предыдущие исследования показали, что лютеин
приготовлении липосом [5, 6].
оказывает многоплановое воздействие - проти-
Цисплатин - это вещество на основе платины,
вовоспалительное, антиоксидантное, противора-
широко используемое для лечения различных со-
ковое, в частности, замедление роста и цитоток-
лидных опухолей (плоскоклеточный рак головы и
сическое действие на ряде раковых клеточных ли-
шеи, карциномы семенников и яичников, про-
ний и опухолей на животных моделях [12].
двинутые стадии рака мочевого пузыря, злокаче-
Насколько нам известно, до сих пор не прово-
ственные глиомы, метастазированный рак про-
дилось исследований взаимодействия цисплати-
статы, молочной железы, меланома, мезотелио-
на с фосфолипидами в отсутствие или в присут-
ма). Благодаря высокому атомному номеру
ствии лютеина с точки зрения термотропного фа-
платины (78) увеличивается вероятность взаимо-
зового поведения фосфолипидов, изменения
действия излучения с цисплатином, что приводит
конформации ацильных цепей или характерных
БИОФИЗИКА том 68
№ 5
2023
984
ЛАФТА и др.
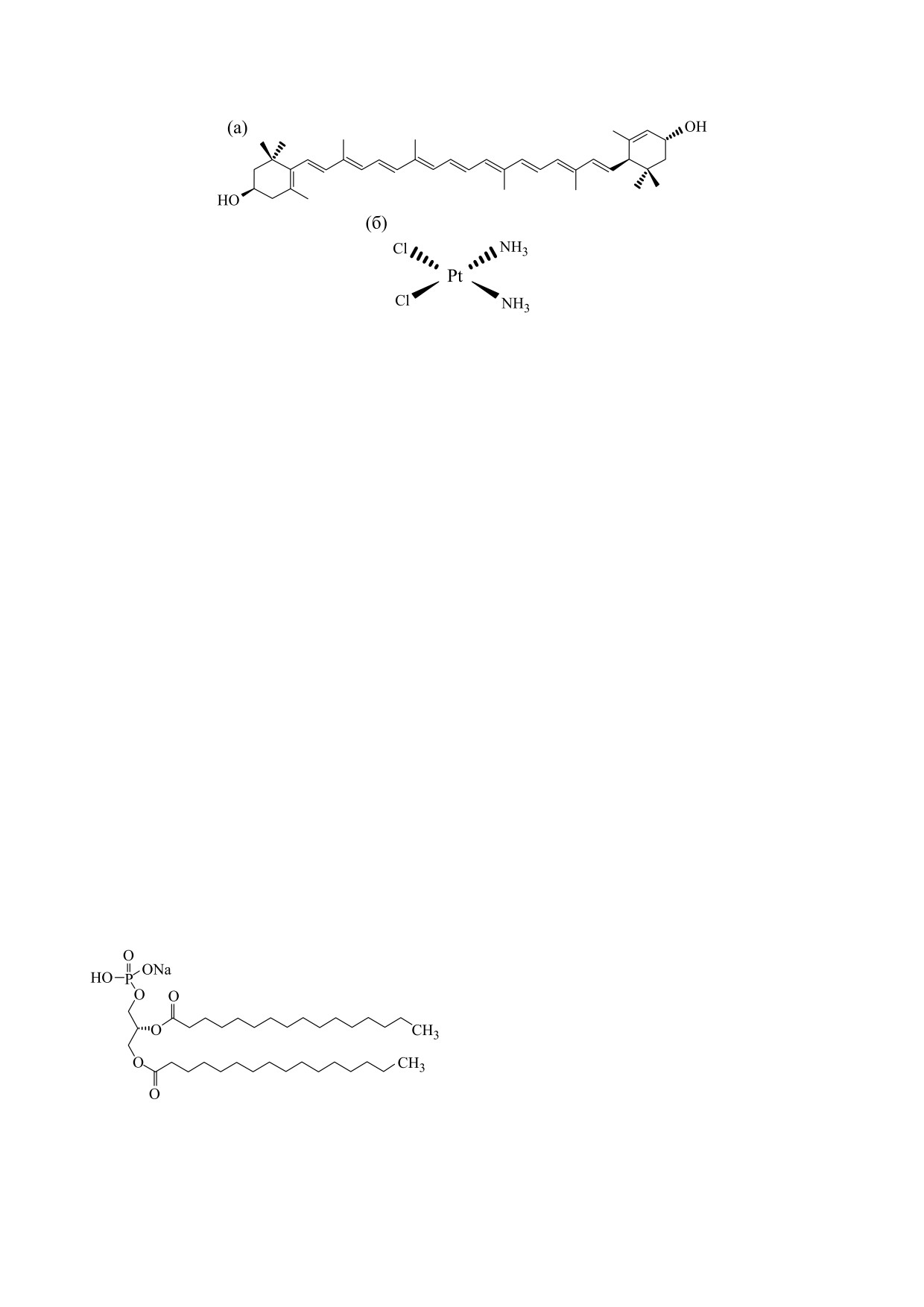
Рис. 1. Химическая структура лютеина (а) и цисплатина (б).
МАТЕРИАЛЫ И МЕТОДЫ
для PO2--групп полярных головок полос в спек-
трах. К настоящему времени также не проводи-
Реактивы. Лютеин получали из природных ис-
точников и оценивали их чистоту с помощью
лись исследования цисплатина, лютеина и их
методов тонкослойной хроматографии и высоко-
комбинации в свободной или нанолипосомной
эффективной жидкостной хроматографии.
формах в плане их воздействия на клеточную ли-
Структуру лютеина подтверждали спектроскопи-
нию MCF-7 (культура клеток рака молочной же-
ческими методами. Молекулярная масса лютеина
лезы).
составляет 568.87 Да. Цисплатин был приобретен
в компании Sigma (Сент-Луис, США). Его моле-
Данное исследование проводилось с целью
кулярная масса составила 300.05 Да. Молекуляр-
оценки изменений, вносимых цисплатином в
ная структура лютеина и цисплатина показана на
физическую структуру и свойства дипальмитоил-
рис. 1.
фосфатидной кислоты как модельной липидной
Этиловый спирт (абсолютный, чистотой
мембраны в отсутствии и в присутствии лютеина
99.9%) приобретали в компании DaeJung Chemi-
cals (Сихын, Кёнгидо, Республика Корея). Ди-
через оценку возмущений в тонкой структуре
пальмитоилфосфатидную кислоту приобретали в
бислоя с помощью инфракрасной спектроскопии
компании Sigma (Сент-Луис, США). Ее молеку-
с Фурье-преобразованием (FTIR-спектроско-
лярная масса составляла
648.9, чистота
99%
пии), просвечивающей электронной микроско-
(рис. 2). Трис покупали в основной форме (моле-
пии, динамического светорассеяния, измерений
кулярная масса 121.1 Да) в компании CDH (Нью-
полидисперсности, дзета-потенциала и диффе-
Дели, Индия). Клетки линии MCF7 (клеточная
линия рака молочной железы) хранили при -
ренциальной сканирующей калориметрии. Кро-
180°C в жидком азоте согласно рекомендациям
ме того, в статье исследуется эффективность ци-
ATCC. Затем культуры размножали посредством
тотоксического действия свободного цисплатина
серийных пересевов в Центре вакцинации Ваксе-
в отсутствие или в присутствии свободного люте-
ра (Каир, Египет). Диметилсульфоксид, среда
ина, а также липосомальных форм этих веществ,
DMEM, бикарбонат натрия, трипановый синий
на клетки линии MCF-7 (линия рака молочной
(0.05%-й изотонический раствор в физиологиче-
ском растворе), пенициллин/стрептомицин,
железы) в комбинированной терапии после гам-
трипсин, уксусная кислота, плодная сыворотка
ма-облучения различными дозами.
теленка, сульфородамин B (0.4%-й раствор в
1%-й уксусной кислоте), трихлоруксусная кисло-
та, изопропанол были приобретены в компании
Sigma Chemical Co. (США). Все растворы готови-
ли на особо чистой дистиллированной воде. Все
растворители и другие реактивы были хромато-
графической чистоты.
Приготовление липосом. Смесь DPPA : циспла-
тин в молярном соотношении 7 : 2 использовали
для приготовления нейтральных мультиламел-
лярных везикул методом гидратации тонкой
пленки по Бангхэму [13]. 20 мг DPPA и 2.64 мг ци-
сплатина в отсутствие или в присутствии 5 мг лю-
Рис. 2. Схематичная структурная формула дипальми-
тоилфосфатидной кислоты.
теина (молярное отношение к DPPA 2 : 7) пере-
БИОФИЗИКА том 68
№ 5
2023
СРАВНИТЕЛЬНАЯ ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ ЛЮТЕИНА
985
носили в колбу объемом 100 мл с круглым дном.
кривой, построенной для разных концентраций
Затем добавляли 20 мл этанола и встряхивали
цисплатина.
колбу до растворения всех компонентов. С помо-
Для определения эффективности включения в
щью ротационного вакуумного испарителя в теп-
липосомы лютеина экстракцию проводили в со-
лой водяной бане (50°C) последовательно удаля-
ответствии с методикой, опубликованной в рабо-
ли органический растворитель для образования
те [14]. Для получения свободного лютеина в сус-
однородной тонкой пленки липида на внутрен-
пензии, 2 мл этанола и 100 мкл аликвоты липо-
ней стенке колбы. Затем липид гидратировали бу-
сом, нагруженных лютеином, тщательно
ферным раствором с трисом (0.2 M, pH 7.2 при
перемешивали в течение 3 мин на встряхивателе.
37°C) для последующего образования мульти-
Затем образцы центрифугировали 20 мин при
ламеллярных везикул на водяной бане при 50°C в
6000 об/мин для отделения супернатанта. Каж-
течение 15 мин. После этого колбу ставили на ме-
дый эксперимент проводили в трех повторностях.
ханический встряхиватель при 50°C на 1 час и ис-
Поглощение лютеина измеряли спектрофотомет-
пользовали ток азота для продувки колбы, после
рически при 446 нм. Определяли содержание лю-
чего колбу закрывали. Ненагруженных липосо-
теина в экстрактах, используя следующую фор-
мы, служившие в качестве контроля, готовили
мулу для расчета:
по такой же схеме, используя только аликвоты
DPPA, равные тем, что использовались в опыт-
3
A·V10
ных образцах.
W
(мг)=
·DF,
1%
A
1
100
cm
Измерение эффективности инкапсуляции. Эф-
где W - масса каротиноида, A - оптическая плот-
фективность инкапсуляции цисплатина в липо-
ность (значение должно быть от 0.2 до 0.8), V -
сомы DPPA измеряли после экстракции невклю-
1%
ченного в липосомы цисплатина и центрифуги-
объем лютеинсодержащей жидкости,
A
1 cm
- ко-
рования при 14000 об/мин в течение 20 мин.
эффициент экстинкции каротиноида (2550 для
Цисплатин, оставшийся в супернатанте, опреде-
лютеина в этаноле), DF - фактор разбавления
ляли спектрофотометрически по поглощению
[15].
при 301 нм на спектрофотометре Jasco V-630.
Определение эффективности включения ве-
Длина волны соответствовала максимуму погло-
щества в липосомы. Эффективность включения
щения цисплатина. Поглощение супернатанта
вещества (EE, %) рассчитывали через следующее
каждого образца сравнивали с калибровочной
соотношение:
Totaldrugimput(мг)−Druginsupernatant(
мг)
EE
=
100,
(1)
Totaldruginput(мг)
где Total drug input - общая масса вещества, Drug in
Динамическое светорассеяние и дзета-потенци-
supernatant - масса вещества в супернатанте.
ал. Дзета-потенциал, средний размер частиц и
Исследование морфологии липосом на просве-
распределение по размеру липосом, нагруженных
чивающем электронном микроскопе. Размер и мор-
цисплатином и лютеином, только цисплатином,
фологию ненагруженных липосом и липосом с
только лютеином, а также ненагруженных липо-
цисплатином (LipoCis), лютеином (LipoLut) или
сом, были рассчитаны с помощью метода PSS
цисплатином в сочетании с лютеином (LipoCis-
(particle sizing method), примененного для данных
Lut) анализировали с применением просвечива-
динамического светорассеяния при pH 7.4 в бу-
ющего электронного микроскопа JEM-2100
ферном растворе триса при 25°C. Эксперимент
(JEOL, Japan), работающего при напряжении
проводили в трех повторностях, все данные выра-
200 кВ, с применением негативного контрастиро-
жали как среднее ± стандартное отклонение.
вания. Водный раствор фосфовольфрамовой кис-
Измерения методом дифференциальной скани-
лоты (1% w/v) использовалb как агент для нега-
рующей калориметрии. Для определения поведе-
тивного контрастирования. Образцы липосом
сперва разбавляли 1 : 10 буферным раствором
ния ненагруженных липосом и липосом, нагру-
(трис-HCl, pH 7.4 при 37°C), для микроскопиче-
женных цисплатином, лютеином или комбина-
ского исследования отбирали по 20 мкл образца,
цией цисплатина и лютеина при нагревании
наносимого на покрытую углеродом медную сет-
использовали метод дифференциальной скани-
ку микроскопа. Затем раствор оставляли на
рующей калориметрии (ДСК) с помощью прибо-
1 мин, после чего удаляли излишки образца с сет-
ра Setaram (Labsys, Франция), откалиброванного
ки. Полученные на электронном микроскопе
по индиевому образцу. Анализы проводили на
микрофотографии образца объединяли и обраба-
образцах массой 5 мг, запечатанных в стандарт-
тывали.
ные алюминиевые ячейки. Каждую термограмму
БИОФИЗИКА том 68
№ 5
2023
986
ЛАФТА и др.
строили в диапазоне температур 25-200°C при
ющую рост клеток на 50% (полуингибирующая
скорости нагрева 3°C/ мин.
концентрация, IC50).
Инфракрасная спектроскопия с Фурье-преобра-
In vitro облучение линии клеток карциномы мо-
зованием. FTIR-спектры лиофилизированных
лочной железы MCF-7. Клеточную линию рака
образцов липосом, нагруженных лютеином, цис-
молочной железы MCF-7 выращивали в течение
платином, их комбинацией и ненагруженных ли-
24 ч в культуральных колбах с площадью поверх-
посом, нанесенных на диски из бромида калия,
ности 25 см2 до значений плотности клеток 1·104,
регистрировали с помощью спектрометра
после этого обрабатывали исследуемым веще-
Alpha 11 (Bruker, Швейцария). Сканирование
ством в концентрации, рассчитанной из MTT-те-
осуществляли со скоростью 2 мм/с в диапазоне
ста и равной IC50. Затем проводили облучение
400-4000 см-1 при комнатной температуре.
гамма-лучами в дозах 5 и 10 Гр с помощью уста-
Оценка цитотоксичности in vitro с помощью
новки на изотопе 137Cs Gamma-cell 40 (Канада) с
MTT-теста. Клетки карциномы молочной желе-
дозой излучаемой радиации 0.653 рад/с.
зы линии MCF-7 промывали фосфатно-солевым
буфером, обрабатывали трипсином и ресуспен-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
дировали в полной кульутральной среде RPMI-
1640, затем считали жизнеспособные клетки в ка-
Эффективность включения вещества в липо-
мере гемоцитометра с помощью методики с три-
сомы составляла более 90% для всех приготовлен-
пановым синим [16]. Для анализа хемочувстви-
ных суспензий липосом, когда вещество сме-
тельности клетки культивировали в 96-луночном
шивали с порошком липида до растворения в эта-
ноле.
планшете при плотности 104 клеток на лунку в те-
чение 24 ч перед обработкой химиотерапевтиче-
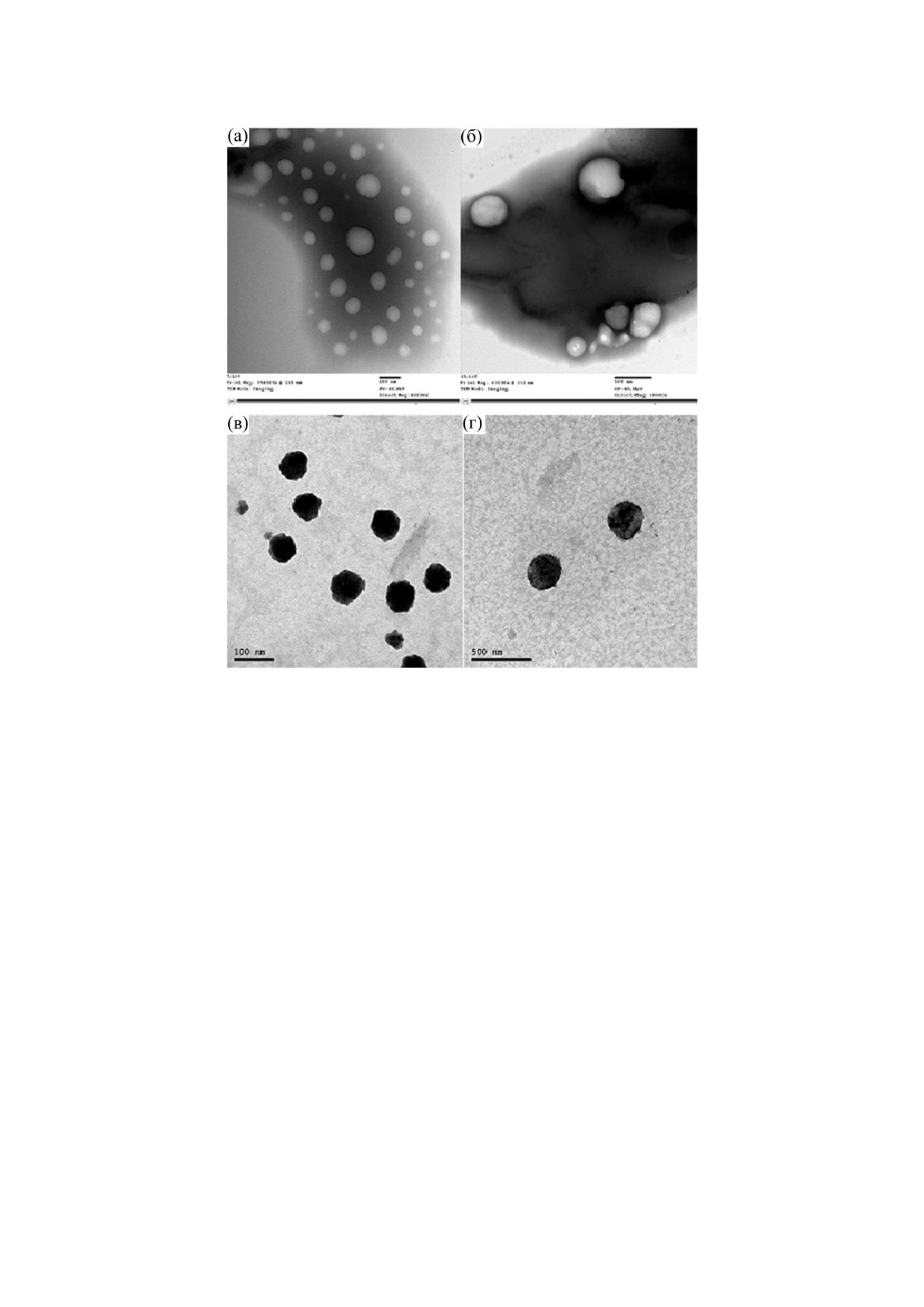
Изображения, полученные с помощью транс-
ским агентом, чтобы клетки могли прикрепиться
миссионной электронной микроскопии, показа-
к стенкам планшета. Через 24 ч из каждой лунки
ны на рис. 3. Морфология всех липосом, приго-
удаляли среду и заменяли свежей, содержащей
товленных в работе, была почти сферической,
исследуемые вещества при разных концентраци-
равномерной, с малой долей агрегатов для нена-
ях, методом двукратных разведений. Потенци-
груженных (рис. 3а) и нагруженных везикул.
альную цитотоксичность чистых липосом и ли-
Микроскопия показала, что добавление циспла-
посом, нагруженных цисплатином, лютеином
тина коррелирует со способностью липосом к
или комбинацией цисплатина и лютеина оцени-
плотной упаковке на поверхности (рис. 3б). При-
вали в отдельных экспериментах. Для каждого ве-
сутствие лютеина в липосомах (LipoLut, рис. 3в)
щества и каждой дозы эксперимент проводили в
увеличивало промежуток между соседними бис-
трех повторностях.
лоями, что приводило к большему размеру липо-
сом в сравнении с контрольными. Увеличение
Затем монослои клеток инкубировали в тече-
размера частиц может быть связано с более силь-
ние 48 ч при 37°C в инкубаторе в атмосфере 5%
ным взаимодействием лютеина с липидными
CO2 с разными концентрациями химиотерапев-
бислоями липосом через образование водород-
тических агентов. Среду, содержащую необходи-
ных связей. Предполагается, что лютеин может
мые вещества, затем удаляли, а клетки дважды
встраиваться в гидрофобный участок бислоя, эти
промывали фосфатно-солевым буфером. В каж-
наблюдения согласуются с данными ДСК и
дую лунку немедленно добавляли 50 мкл раствора
FTIR-спектроскопии.
(0.5 мг/мл) желтой соли метилтиазолилтетразо-
Гомогенность частиц коллоидной суспензии
лия (MTT - 3-(4,5-диметилтиазол-2-ил)-2,5-ди-
эффективно описывается индексом полидис-
фенилтетразолия бромид) и инкубировали в тече-
персности (ИПД). Значения этого индекса более
ние 4 ч при 37°C. Затем удаляли среду и добавляли
0.7 означают, что в образце очень большой диапа-
50 мкл диметилсульфоксида для растворения
зон размера частиц и в данном случае метод дина-
кристаллов формазана.
мического светорассеяния неспособен дать ста-
Для оценки доли жизнеспособных клеток по-
бильные результаты [17].
глощение образующегося хромофорного субстра-
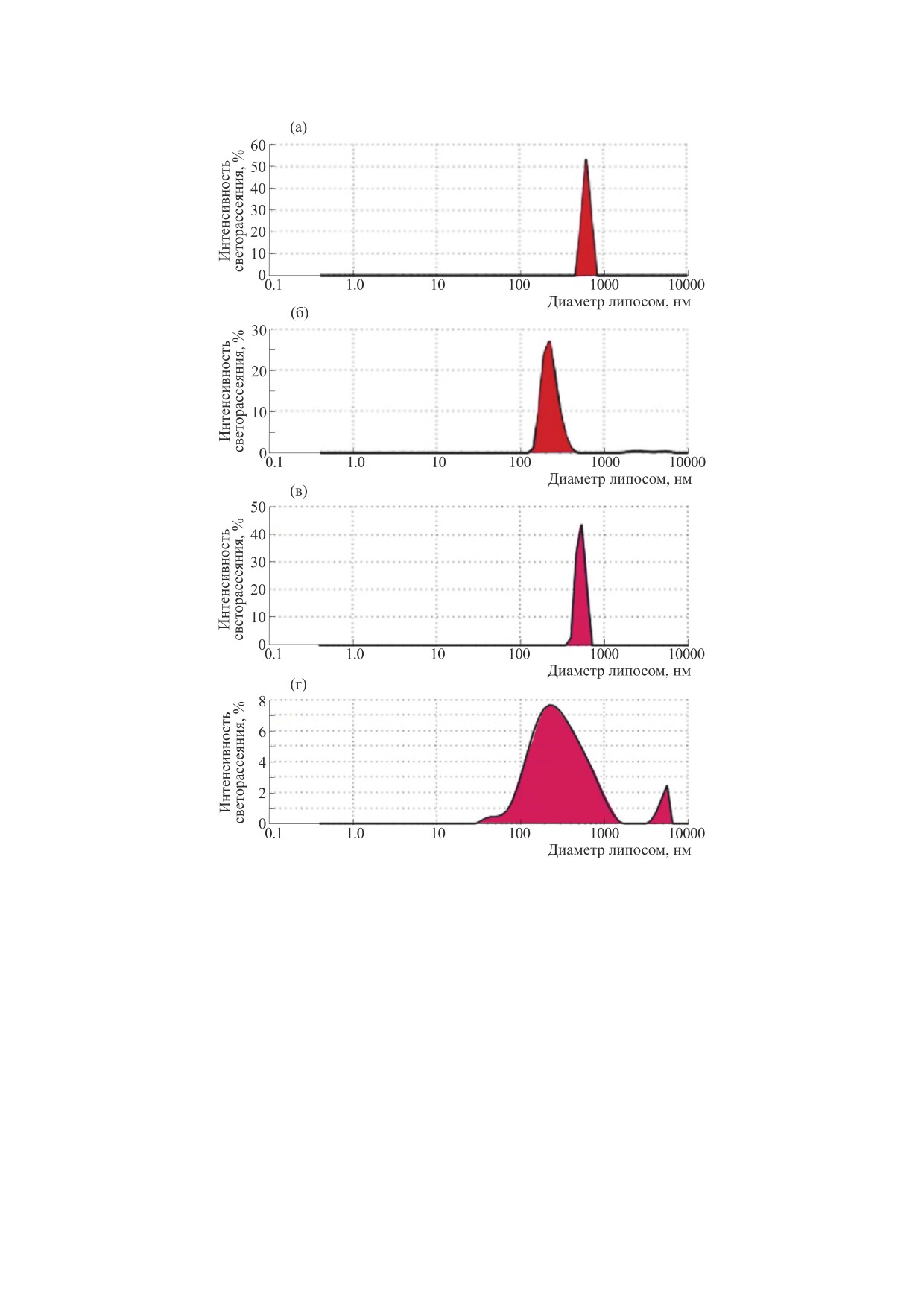
Рис. 4а показывает распределение по размеру
та анализировали при 490 нм с помощью прибора
образца чистых липосом из DPPA, мода которого
для иммуноферментного ELISA-анализа (Boster
была около 617.9 ± 75.64 нм с индексом полидис-
Immunoleader, США). Выживаемость клеток
персности (ИПД). Рис. 4б показывает снижение
определяли как истинное поглощение лунок, по-
среднего размера до 425.6 ± 64.74 нм с ИПД 0.337
деленное на поглощение контроля и выраженное
после включения цисплатина в липосомы,
в процентах. Зависимости между выживаемостью
это может быть связано с электростатическим
клеток и концентрацией вещества представляли в
притяжением между отрицательно заряженными
виде графиков кривой выживаемости клеток рака
груди линии MCF-7 по отношению к каждому
PO2--группами DPPA и NH3+-группой циспла-
конкретному препарату, по полученным кривым
тина, при этом, поскольку цисплатин считается
рассчитывали концентрацию веществ, ингибиру-
гидрофильным веществом, он должен быть со-
БИОФИЗИКА том 68
№ 5
2023
СРАВНИТЕЛЬНАЯ ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ ЛЮТЕИНА
987
Рис. 3. Микрофотографии, полученные методом трансмиссионной микроскопии, ненагруженных липосом (а), липосом
с цисплатином (б), липосом с лютеином (в) и липосом с комбинацией лютеина и цисплатина (г).
средоточен в гидрофильном ядре бислоя. Когда
136.84 нм с ИПД 0.426 после включения циспла-
цисплатин добавляли в липосомы, расстояние
тина в ассоциате с лютеином внутрь липосом. Ре-
между соседними бислоями уменьшалось, что
зультаты показывают, что липосомы могут быть
приводило к уменьшению размеров липосом.
физически ассоциированы с цисплатином или
Включение лютеина в DPPA приводило к увели-
лютеином в центре и их молекулы в большой сте-
чению расчетной моды диаметра липосом до
пени взаимодействуют с липидным бислоем и на-
877.85 ± 93.90 с ИПД 0.527. После добавления лю-
рушают их структуры. Эти данные хорошо согла-
теина к липосомам расстояние между соседними
суются с исследованиями методами динамиче-
бислоями увеличивалось, в результате липосомы
ского светорассеяния и FTIR-спектроскопии.
становились больше, чем контрольные. Более
Амплитуда дзета-потенциала отражает ста-
сильные взаимодействия вещества с полярной
бильность коллоидной системы. По мере роста
головкой фосфолипидов возле PO2--группы с
дзета-потенциала растет отталкивание между ча-
стицами, что приводит к большей стабильности
образованием водородных связей могут объяс-
коллоидной дисперсии. Если все взвешенные ча-
нить изменение размера липосом на рис. 4в. Лю-
стицы обладают значительным отрицательным
теин может входить в ламеллярную структуру
или положительным дзета-потенциалом, то они
фосфолипида и должен располагаться параллель-
отталкиваются друг от друга и не склонны сли-
но углеводородной цепи фосфолипидного бис-
паться друг с другом [19].
лоя. Два его полярных конца находятся в контак-
те с противоположными полярными участками
Согласно данным других исследователей, не-
бислоя, что приводит к высокой смешиваемости
нагруженные липосомы обладают отрицатель-
с фосфолипидным бислоем и объясняет увеличе-
ным дзета-потенциалом (-13.1 ± 6.49 мВ) [20-
ние размера [18]. Рис. 4г показывает снижение
23]. У липосом, нагруженных цисплатином или
расчетного значения размера липосом до 189.91 ±
лютеином, значения дзета-потенциала были
БИОФИЗИКА том 68
№ 5
2023
988
ЛАФТА и др.
Рис. 4. Измеренные методом динамического светорассеяния размеры образца ненагруженных липосом (а), липосом с
включением цисплатина (б), липосом с включением лютеина (в) и липосом с комбинацией цисплатина и лютеина (г).
еще более отрицательными (-14.52 ± 4.11 мВ и
Липосомная система с цисплатином и лютеи-
-15.55 ± 5.35 мВ, соответственно), чем у нена-
ном (LipoCisLut) продемонстрировала наименее
низкие значения среди всех исследованных ве-
груженных липосом, вследствие включения
ществ (-2.11 ± 5.66 мВ) по причине того, что от-
обоих веществ в липосомные мембраны. Наноча-
талкивание между частицами становится мень-
стицы с дзета-потенциалом более +30 мВ или ме-
ше, поэтому и коллоидная дисперсия становится
нее -30 мВ в общем случае обладают большей
менее стабильной (рис. 5). Результаты измерения
стабильностью. Наличие цисплатина (LipoCis)
размера частиц и дзета-потенциала липосомных
или лютеина (LipoLut) в липосомных мембранах,
дисперсий с различным составом приведены в
по-видимому, увеличивает поверхностную плот-
табл. 1.
ность отрицательного заряда, что приводит к бо-
Вследствие изменения взаимодействий между
лее отрицательным значениям дзета-потенциала. включенными веществами и липосомами метод
БИОФИЗИКА том 68
№ 5
2023
СРАВНИТЕЛЬНАЯ ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ ЛЮТЕИНА
989
Рис. 5. Дзета-потенциал для образца ненагруженных липосом DPPA (а), липосом с включением цисплатина (б), липосом
с включением лютеина (в) и липосом с комбинацией цисплатина и лютеина (г).
Таблица 1. Данные, полученные для размера частиц, измеренного методом динамического светорассеяния, и
дзета-потенциала липосом до и после включения цисплатина, лютеина и цисплатина в комбинации с лютеином
Дзета-потенциал,
Диаметр, среднее ± станд.
Среднее
Название образца
среднее ± станд.
отклонение, нм
значение ИПД
отклонение, мВ
Ненагруженные липосомы
617.9 ± 75.64
0.7
-13.1 ± 6.49
LipoCis
425.6 ± 64.74
0.337
-14.52 ± 4.11
LipoLut
877.85 ± 93.90
0.527
-15.55 ± 5.35
LipoCisLut
189.91 ± 136.84
0.426
-2.11 ± 5.66
БИОФИЗИКА том 68
№ 5
2023
990
ЛАФТА и др.
бислоями, сильно взаимодействуя с ними и нару-
шая их структуру, что приводит к исчезновению
главного эндотермического пика, который для
чистых DPPA имеет место при 130.7°C.
Температура второго пред-перехода снизилась
с 87.0°C до 63.1°C для липосом DPPA, нагружен-
ных лютеином, что продемонстрировало эффект
увеличения жесткости мембран. Пик первого
пред-перехода, который у чистых DPPA прихо-
дится на 95.4°C, у лютеинизированных липосом
исчезает. Встраивание биомолекул в липидные
бислои может быть важной причиной исчезнове-
ния пика пред-перехода [31]. Встраивание фарма-
кофора между полярных головок DPPA обеспе-
чит более предпочтительное значение тепловых
параметров для образования менее упорядочен-
ной жидкокристаллической фазы, чем для обра-
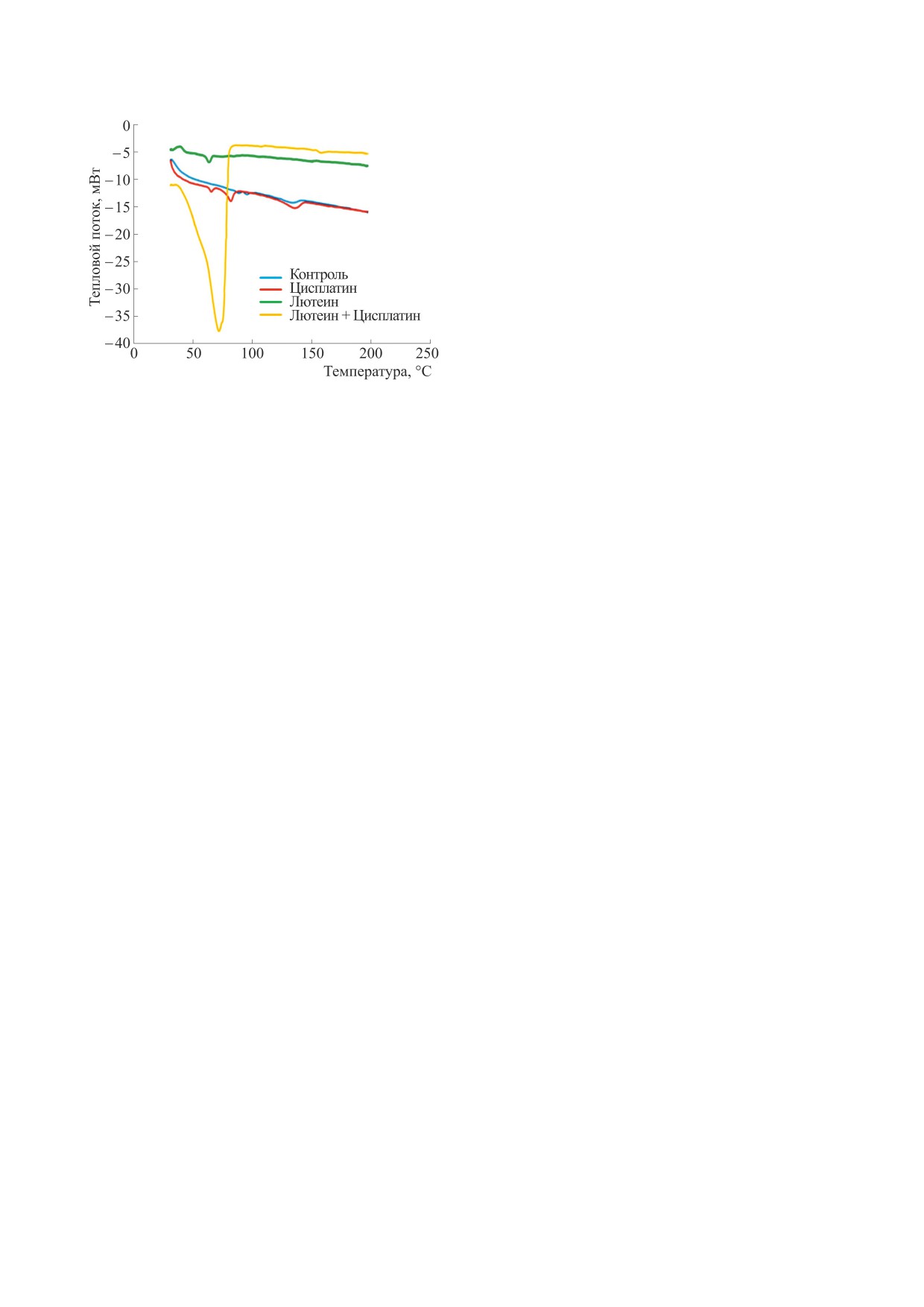
Рис. 6. Термограммы, полученные методом ДСК для
зования фазы геля, и, как показывает ДСК, не-
липосом из чистой DPPA, а также липосом, нагружен-
ных цисплатином, лютеином или комбинацией обоих
много снижает температуру перехода геля в жид-
веществ. По оси абсцисс - температура, по оси орди-
кий кристалл [32].
нат - скорость теплового потока, мВт.
Главный эндотермический пик чистых DPPA,
который имеет место при 130.7°C, уширяется и
сдвигается в зону более высоких температур
ДСК использовали для исследования изменений
(157.4°C), когда цисплатин встраивается в липо-
в фазовом переходе липидного бислоя [24, 25].
сомы из DPPA в сочетании с лютеином. К удивле-
Везикулы DPPA используются как модельные
нию, пик пред-перехода(Tp) для комбинации
мембраны, потому что этот фосфолипид имити-
DPPA/(цисплатин + лютеин) увеличивается и
рует многие свойства биологических мембран.
составляет почти 71°C (рис. 6). Включение ин-
Чистые везикулы DPPA после дегидратации де-
капсулированного цисплатина в ассоциации с
монстрировали значительный главный эндотер-
лютеином в липофильную часть мембранного
мический пик (Tm) при 130.7°C (рис. 6) в процессе
бислоя и их взаимодействие с полярной головкой
ДСК. Это согласуется с другими исследованиями
может быть отражено в сдвиге этого пика (Tp). С
[26-28]. Чистые липосомы DPPA также обладают
помощью ДСК было показано, что смеси DPPA и
двумя максимумами, соответствующими темпе-
лютеина или цисплатина обладают одним пиком,
ратурам пред-переходов (Tp) в районе 95.4 и
что указывает на их смешиваемость [33].
87.0°C соответственно.
FTIR-спектроскопию использовали для опре-
Присутствие дополнительных соединений в
деления изменений в структуре липосомных
мембранах DPPA может влиять на термотропные
мембран по анализу волнового числа разных ко-
параметры фазового перехода везикул. Включе-
лебательных мод, чтобы подтвердить изменения,
ние цисплатина в липосомы DPPA показало
обнаруженные методом ДСК.
сдвиг в сторону более высоких температур, до
Для исследования потенциальных изменений
135.2°C, в сравнении с главным эндотермическим
структуры DPPA FTIR-спектроскопию исполь-
пиком чистых липосом при 130.7°C, что показы-
зовали для оценки волнового числа разных функ-
вает существенный эффект цисплатина на бис-
циональных групп в присутствии или в отсут-
лой DPPA, выражающийся в конформационных
ствие чужеродных молекул, принимая во внима-
изменениях внутри бислоя и снижении коопера-
ние вклад ацильных цепей и полярных головок
тивности фазового перехода липидных ацильных
липидных групп.
цепей [29, 30]. Увеличенная температура главного
На рис. 7 показаны FTIR-спектры чистых лио-
эндотермического пика (Tm) свидетельствует о
филизованных липосом DPPA в сравнении с ли-
том, что цисплатин приводит к более нарушенно-
посомами, нагруженными цисплатином, лютеи-
му и рыхлому расположению ацильных цепей.
ном или их комбинацией, в диапазоне волновых
Два пика температуры пред-перехода в цисплати-
чисел 3000-1000 см-1.
новых липосомах снижаются (78.5 и 65.0°C соот-
Наиболее высокий характерный пик FTIR-
ветственно), что указывает на взаимодействие
спектров имел место у липосомных везикул [34].
цисплатина с полярными группами фосфолипи-
Включение лютеина в липосомы DPPA привело
дов (рис. 6).
к изменению волнового числа симметричных
Когда лютеин включен в липосомы DPPA, он
полос растяжения ацильных цепей (рис. 7), это
обладает более выраженным эффектом. Лютеин в
указывает на то, что лютеин наводит конформа-
основном встраивается, сопрягаясь с липидными
ционную упорядоченность внутри ацильных
БИОФИЗИКА том 68
№ 5
2023
СРАВНИТЕЛЬНАЯ ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ ЛЮТЕИНА
991
Рис. 7. Полные ИК-Фурье-спектры ненагруженных DPPA-липосом (а) и липосом, нагруженных цисплатином (б),
лютеином (в) или обоими веществами (г). По оси абсцисс - волновое число, по оси ординат - поглощение.
цепей фосфолипидов. Другими словами, его мо-
ний при добавлении лютеина или лютеина в ком-
лекулы повлияли на упорядоченность мембран-
бинации с цисплатином (2915.03 см-1) в сравне-
ной структуры. Пик при 2849.11 см-1 для чистых
нии со значением, свойственным чистым DPPA-
DPPA-липосом в случае лютеиновых липосом
липосомам (2917.09 см-1) (рис. 7).
сдвинут в область более низких значений,
Пики симметричных и антисимметричных ко-
2847.05 см-1. Это может указывать на снижение
лебаний CH2-групп на растяжение используются
количества гош-конформеров, что приводит к
как чувствительные индикаторы степени упоря-
возрастанию упорядоченности бислоя [35]. Инте-
доченности алкильных цепей. В волновом числе
ресно, что интенсивность сигнала липосом, на-
для полосы колебаний CH2 имеются занчитель-
груженных лютеином, становится выше по срав-
ные изменения, свидетельствующие о том, что
нению с ненагруженными липосомами. После
лютеин снизил количество гош-конформеров, а
включения цисплатина или цисплатина в сочета-
следовательно, увеличил конформационную упо-
нии с лютеином в липосомы DPPA пик при
рядоченность бислоя [36, 37]
2849.11 см-1 остается стабильным, что дает осно-
вания предположить стабилизацию системы в
Для определения взаимодействия цисплатина,
фазе геля и фазе жидкости.
лютеина либо обоих этих веществ с глицерино-
вым остовом вблизи головки фосфолипидов (в
Полоса антисимметричного колебания CH2-
«интерфазе») анализировали полосы колебаний
групп сдвинулась в сторону более низких значе- связи C=O [38]. Как видно из рис. 7, поглощение
БИОФИЗИКА том 68
№ 5
2023
992
ЛАФТА и др.
Таблица 2. Химические сдвиги, наблюдаемые для цисплатина, лютеина или их комбинации после встраивания
их в липосомы
Волновое число, см-1
Волновое число,
Цисплатин в
Тип колебания
см-1
Контроль
Цисплатин
Лютеин
сочетании с
лютеином
Симметричное растяжение группы
(2800-2855)
2849.11
2849.11
2847.05
2849.11
CH2 ацильной цепи
Антисимметричное растяжение
(2900-2925)
2917.09
2917.09
2915.03
2915.03
группы CH2 в ацильной цепи
Растяжение карбонильной группы
(1730-1740)
1629.53
1629.53
1627.47
-
C=O
«Ножницеобразное» колебание
(1456-1470)
1462.66
1462.66
1466.78
1466.78
CH2-группы
Антисимметричное растяжение
(1200-1300)
1295
1293.74
1293.74
1293.74
группы PO2-
изменения спектра в этой области могут быть вы-
группы C=O с волновым числом 1629.53 см-1
званы взаимодействием лютеина или цисплатина
снижается или исчезает в образцах липосом с лю-
с границей раздела полярной и неполярной обла-
теином (1627.47 см-1) или лютеином и цисплати-
стей мембраны [39].
ном соответственно, что, очевидно, указывает на
Взаимодействие цисплатина, лютеина или
образование водородных связей. В глицериновом
обоих веществ с полярной головкой в липосомах
остове молекулы DPPA сдвиги контура колеба-
DPPA исследовалось через анализ полосы анти-
ния сложноэфирной C=O-группы регулируют
симметричного колебания PO2--группы при
образование водородных связей. Значит, любые
1295 см-1. Как показано на рис. 7, волновое число
было сдвинуто в более низкие значения после до-
бавления к липосомам DPPA цисплатина
(1293.74 см-1), лютеина (1293.74 см-1) или смеси
обоих веществ (1293.74 см-1). Это указывает на
образование водородных связей между головкой
липида липосомы и лютеином или цисплатином.
Уменьшение волнового числа указывает либо на
то, что существующие водородные связи стано-
вятся сильнее, либо на то, что образуются новые
водородные связи между компонентами [35].
Ксантофиллы или полярные каротиноиды, та-
кие как лютеин, располагаются практически пер-
пендикулярно плоскости мембраны в полярном
участке липидных головок, а также пересекают
липидный бислой, заякориваясь своими гидрок-
сильными группами и оставаясь неподвижными
в толще мембраны [40].
Включение лютеина или его комбинации с ци-
сплатином в препарат липосом DPPA влияет на
«ножницеобразные» колебания CH2-группы,
Рис. 8. In vitro цитотоксичность свободных липосом
(Lip), свободного цисплатина (Cis), свободного люте-
мода которых имеет волновое число 1462.66 см-1.
ина (Lut) и их липосомных форм (LipoCis, LipoLut,
После инкапсуляции лютеина или его конъюгата
LipoCisLut) в отсутствие внешнего гамма-облучения
с цисплатином в липосомы DPPA это значение
на клеточной линии карциномы молочной железы
MCF-7; инкубацию проводили в течение 48 ч при раз-
увеличивается до 1466.78 см-1. Это позволяет
ных концентрациях веществ - от 100 до 1200 мкг/мл.
утверждать, что лютеин или его комбинация с ци-
Для измерения жизнеспособности клеток использова-
сплатином играют роль своеобразных малых
ли MTT-тест. Результаты приведены как среднее и
спейсеров для полярной группы липида, вызывая
стандартное отклонение в трех повторностях. По оси
малые нарушения в углеводородной цепи. В
абсцисс - концентрация, мкг/мл; по оси ординат -
жизнеспособность клеток, %.
табл. 2 приводятся значения химических сдвигов
БИОФИЗИКА том 68
№ 5
2023
СРАВНИТЕЛЬНАЯ ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ ЛЮТЕИНА
993
Рис. 9. Значения IC50 для свободных липосом (Lip), свободного цисплатина (Cis), свободного лютеина (Lut) и их
липосомных форм (LipoCis, LipoLut и LipoCisLut) в отсутствие внешнего гамма-излучения в тесте цитотоксичности
(MTT-тесте) на клетках карциномы молочной железы через 48 ч после обработки.
для цисплатина, лютеина или их смеси после
Интересно, что ненагруженные липосомы
включения в липосомы из DPPA.
проявляли выраженное снижение выживаемости
клеток в тестах на линии MCF-7 при той же кон-
Эффективность систем доставки фармакопре-
центрации
(1200 мкг/мл). Жизнеспособность
паратов в отсутствие и в присутствии гамма-излу-
клеток составляла 13.60%. Это указывает на то,
чения проверяли на линии клеток карциномы
что клетки повреждались высокими концентра-
молочной железы (MCF-7) с помощью MTT-те-
циями липосом DPPA. DPPA подавляла проли-
ста выживаемости клеток (тест цитотоксичности
ферацию клеток и ангиогенез в опухолевых тка-
in vitro) при разных концентрациях чистых липо-
нях трижды негативного рака молочной железы,
сом, свободного цисплатина, свободного лютеи-
согласно работам [5, 6]. В этих исследованиях
на, и их липосомных форм (LipoCis, LipoLut и
предлагались предварительные доказательства
LipoCisLut) [16]. Необработанные клетки исполь-
применимости DPPA в терапии TNBC.
зовались как контрольные (точки нулевой кон-
Интересно, что липосомная форма комбина-
центрации каждого вещества). В отдельном ис-
ции цисплатина и лютеина не приводила к силь-
следовании линия раковых клеток MCF-7 была
ному снижению выживаемости клеток MCF-7
проинкубирована при различных концентрациях
при той же концентрации (1200 мкг/мл) в сравне-
веществ в диапазоне от 100 до 1200 мкг/мл в тече-
нии с другими веществами, встроенными в липо-
ние 48 ч (рис. 8). Тест заканчивали через 48 ч и
сомы. Жизнеспособность клеток была равна при-
проводили измерение жизнеспособности клеток.
мерно 12.72%. Видимо, комбинация цисплатина с
В отсутствие внешнего гамма-облучения наи-
лютеином не обладает способностью к синергии.
большей цитотоксичностью против клеток линии
Цитотоксическое действие различных форм
MCF-7, которые обрабатывали веществами в од-
веществ при высоких концентрациях снижалось
ном и том же диапазоне концентраций, обладал
в следующем порядке: Lut > Cis LipoLut > Lipo-
свободный лютеин. Клетки MCF-7 при макси-
CisLut > Lipo > LipoCis, согласно рис. 8.
мальной концентрации лютеина (1200 мкг/мл)
При более низкой концентрации (700 мкг/мл),
обладали выживаемостью около 7% через 48 ч по-
клетки MCF-7, обработанные лютеином, показа-
сле инкубации. В то же время со свободным цис-
ли выживаемость 13.23%, в то время как для его
платином выживаемость клеток была около
липосомной формы она была около 90.70%, а для
9.32%, а с липосомами, нагруженными лютеином
цисплатина в свободной форме и его липосомной
(LipoLut) жизнеспособность клеток составляла
формы составила 22.14% и 80.88% соответственно
11.84%, в сравнении с 14.82% для цисплатиновых
(рис. 8).
липосом (LipoCis) при той же концентрации
(1200 мкг/мл). Такая сниженная эффективность
В отсутствие внешнего гамма-облучения зна-
веществ, солюбилизированных в виде липосом,
чение IC50 для свободного лютеина в цитотокси-
может быть отнесена к их включению внутрь
ческом тесте с MCF-7 составило 10.62 мкг/мл, в
множества липоидных доменов внутри везикул.
то время как для свободного цисплатина оно рав-
Цисплатин был наиболее токсичен для линии
нялось 41.02 мкг/мл. Для липосомных форм лю-
клеток рака груди MDA-MB-23, за ними следова-
теина и цисплатина оно составило 65.84 мкг/мл и
ли клетки рака молочной железы MCF-7 и затем
34.29 мкг/мл соответственно. На основании вы-
нормальные фибробласты линии NIH/3T3, что
шеприведенных результатов и в зависимости от
было сходно с результатами нашей работы [8].
типа клеток видно, что свободный лютеин про-
БИОФИЗИКА том 68
№ 5
2023
994
ЛАФТА и др.
астаксантин использовали в сочетании с низкими
концентрациями бета-каротина и лютеина
(5 мкмоль/л), IC
50 и значения комбинационного
индекса показали увеличение цитотоксичности и
уровня окислительного стресса в сравнении с ка-
ротиноидами, примененными по отдельности.
Результаты исследования избирательной гибели
клеток MCF-7 обеспечивают лучшее понимание
эффекта синергии между выделенным из креве-
ток астаксантином и бета-каротином и лютеином
[41].
Согласно работе [42], каротиноид лютеин се-
лективно ингибирует развитие клеток рака мо-
лочной железы. Это следует из повышенной про-
дукции активных форм кислорода, активации
внутриклеточной сигнализации, такой, как p53-
сигнальный путь, и увеличенной экспрессии
HSP60, которые являются составными частями
реализации этого механизма. Результаты, пред-
ставленные в работе [42], позволяют предполо-
жить роль лютеина как нетоксичного селектив-
ного вещества, которое вызывает прерывание
клеточного цикла и апоптоз в клетках линии рака
молочной железы, включая трижды негативные
клетки.
Степень сенсибилизации измеряли при раз-
ных вариантах обработки для того, чтобы иссле-
довать характер соотношений между тестируе-
мыми формами цисплатина и лютеина, дозой
радиации и сенсибилизирующим действием цис-
платина и лютеина.
Пролиферация/жизнеспособность клеток ли-
нии MCF-7 оценивали по MTT-тесту после инку-
Рис. 10. In vitro цитотоксичность ненагруженных липо-
бации с тестируемыми химиотерапевтическими
сом (Lip), свободного цисплатина (Cis), свободного
средствами в присутствии внешней радиации с
лютеина (Lut), и их липосомных форм (LipoCis, Lipo-
дозами 5 и 10 Гр соответственно (рис. 10а,б) с
Lut, LipoCisLut) в присутствии внешнего гамма-излу-
чения в дозах 5 Гр (а) и 10 Гр (б) против клеточной ли-
применением 137Cs в качестве излучающего изо-
нии карциномы молочной железы MCF-7, инкубиро-
топа. Цитотоксический эффект исследуемых ве-
ванной в течение 48 ч с различным концентрациями
ществ увеличивался при увеличении дозы от 5 до
веществ - от 100 до 1200 мкг/мл. Для измерения жиз-
неспособности клеток использовали MTT-тест.
10 Гр. Токсичность всех проверенных химиотера-
Результаты приведены как среднее и стандартное от-
певтических агентов возрастала в зависимости от
клонение по трем повторностям. По оси абсцисс -
концентрации. При максимальной концентра-
концентрация, мкг/мл; по оси ординат - жизнеспо-
ции (1200 мкг/мл) комбинированной с дозой ра-
собность клеток, %.
диации 5 Гр (рисунок 10а), токсический эффект
LipoCis и свободных липосом значительно сни-
жал жизнесбпособность клеток - с 14.82% до
явил самую выраженную терапевтическую эф-
1.67% и с 13.60% до 3.13% соответственно. В этом
фективность против клеток линии MCF-7
тесте цитотоксичности липосомная форма ком-
(рис. 9). Можно отметить, что IC50 для чистых ли-
бинации цисплатина и лютеина (LipoCisLut) вы-
посом в тесте цитотоксичности на MCF-7 была
зывала больше смертей клеток по сравению с Lut
равна 281.67 мкг/мл. Для липосомной комбина-
и Cis по отдельности в виде свободных веществ.
ции цисплатина и лютеина она составила
Жизнеспособность клеток снижалась с 12.72% до
55.56 мкг/мл. На линии клеток MCF-7 исследо-
7.88%. LipoLut выраженно снижал выживаемость
вались эффекты совместного применения бета-
клеток с 11.84% до 6.67%. Такая возросшая цито-
каротина и лютеина с очищенным астаксанти-
токсичность может быть вызвана преимуще-
ном, выделенным из креветок, на цитотоксич-
ственным захватом клетками наночастиц, а не
ность, окислительный статус, генерацию актив-
свободных веществ. Lut или Cis по отдельности
ных форм кислорода и активность опосредован-
не проявляли большей токсичности в присут-
ных апоптозом сигнальных путей. Когда
ствии дозы излучения 5 Гр, в этих случаях жизне-
БИОФИЗИКА том 68
№ 5
2023
СРАВНИТЕЛЬНАЯ ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ ЛЮТЕИНА
995
Рис. 11. значения IC50 для чистых липосом (Lip), свободного цисплатина (Cis), свободного лютеина (Lut) и их
липосомных форм (LipoCis, LipoLut, LipoCisLut) при гамма-облучении дозами 5 и 10 Гр по отношению к клеткам
карциномы молочной железы (MCF-7) по данным MTT-теста через 48 ч после обработки.
способность клеток сохранялась на уровне 8.67%
IC50 свободных липосом была равна 284.5 мкг/мл
и 9.33% соответственно.
в тесте цитотоксичности с MCF-7. IC50 для
Очевидно, что режим комбинированной тера-
MCF-7, обработанных комбинацией цисплатина
пии (LipoCis, Lip, LipoLut или LipoCisLut + ради-
и лютеина в липосомах, составила 74.46 мкг/мл.
ация) обладает более выраженным противорако-
При
максимальной
концентрации
вым эффектом по сравнению с режимом, не
(1200 мкг/мл) и высокой дозе радиации (10 Гр)
включающим облучение. Это позволяет заклю-
цитотоксичность различных форм веществ убы-
чить, что комбинация химиотерапии и радиоте-
вала в следующем порядке: LipoCisLut > Lipo >
рапии будет более успешна, чем изолированные
LipoLut > Cis > Lut > LipoCis (см. рис. 10б). При
типы терапии.
более низкой концентрации (700 мкг/мл) и высо-
Цитотоксическое действие различных комби-
кой дозе радиации (10 Гр) цитотоксичность сни-
наций веществ при максимальной концентрации
жалась в следующем порядке: LipoCis > Lut >
(1200 мкг/мл) и облучении клеток дозой 5 Гр сни-
Cis > Lipo > LipoLut > LipoLutCis (рис. 10б). Экс-
жалось, согласно рис. 10а, в следующем порядке:
позиция клеток при более высокой дозе радиации
LipoCis > Lipo > LipoLut > LipoCisLut > Lut > Cis.
увеличивает их чувствительность к химиотера-
При более низкой концентрации веществ (700
певтическим агентам. Это явно наблюдается при
мкг/мл) в комбинации с дозой радиации 5 Гр
сравнении ответов клеток на дозу 5 Гр в сравне-
жизнеспособность клеток MCF-7, обработанных
нии с дозой 10 Гр (рис. 10а и 10б).
свободным лютеином, составляла 39.33% (срав-
В присутствии гамма-радиаци в дозах 10 Гр
ним с липосомной формой, для которой она со-
значение IC50 для свободного лютеина в тесте ци-
ставила около 80.30%). В то же время для свобод-
тотоксичности на MCF-7 составило 9.5 мкг/мл, в
ной формы цисплатина и его липосомной формы
то время как свободный цисплатин обладал зна-
значения жизнеспособности составили 40.67% и
чением IC50, равным 43.09 мкг/мл. Для лютеина в
78.13% соответственно (рис. 10а).
форме липосом значение IC50 составило
Значение IC50 для свободного лютеина в тесте
24.2 мкг/мл, а для цисплатина в форме липосом -
цитотоксичности с клетками MCF-7 в сочетании
9.29 мкг/мл. На основании вышеизложенных ре-
с дозой радиации 5 Гр равнялось 17 мкг/мл, в то
зультатов свободный лютеин и липосомальный
время как для свободного цистеина оно состави-
цисплатин показали максимальную терапевтиче-
ло 51 мкг/мл. Для липосомальных форм оно было
скую акивность против клеточной линии MCF-7
равно 49.22 мкг/мл для лютеина и 44.27 мкг/мл
(рис. 11). Можно отметить, что IC50 ненагружен-
для цисплатина. На основании вышеперечислен-
ных результатов и в зависимости от типов рако-
ных липосом составила 94.84 мкг/мл в тесте цито-
вых клеток свободный лютеин показал наивыс-
токсичности с MCF-7. Значение IC50 для липо-
шую терапевтическую активность против линии
сом с комбинацией LipoCisLut составило
клеток MCF-7 (рис. 11). Можно заметить, что
68.73 мкг/мл. Рис. 12 представляет суммирован-
БИОФИЗИКА том 68
№ 5
2023
996
ЛАФТА и др.
Рис. 12. Значения IC50, полученные для чистых липосом (Lip), свободного цисплатина (Cis), свободного лютеина (Lut),
и их липосомных препаратов (LipoCis, LipoLut и LipoCisLut) в отсутствие и в присутствии гамма-радиации в различных
дозах по отношению к клеточной линии карциномы молочной железы MCF-7 с использованием MTT-теста через 48 ч
после обработки.
ные значения IC50, полученные с помощью MTT-
радиацией очень важна, потому что химиотера-
теста для ненагруженных липосом, свободного
певтические агенты контролируют образование
цисплатина, свободного лютеина и их липосом-
метастазов и предотвращают репарацию клеток.
ных форм (LipoCis, LipoLut, LipoCisLut) в отсут-
Также сниженная эффективность лютеина, со-
ствие и в присутствии гамма-излучения в различ-
любилизированного липосомами, может быть от-
ных дозах против линии карциномы молочной
несена к его включению во многие липоидные
железы (MCF-7).
домены внутри наночастиц.
Представленные данные позволяют предполо-
Цисплатин действует как радиосенсибилиза-
жить новый режим терапии, в котором свобод-
тор, увеличивая количество радиации, доставляе-
ный лютеин будет заменен цисплатином для уве-
мое в зону опухоли. Радиосенсибилизаторы ис-
личения противораковой активности против
пользуются в радиационной терапии для увели-
линии раковых клеток MCF-7. Имеются доказа-
чения поглощенной дозы радиации в очаге
тельства, что свободный лютеин обладает более
опухоли посредством увеличения собственной
выраженным токсическим эффектом на линии
радиочувствительности раковых клеток. Поэтому
клеток рака груди. Авторы работы [18] предполо-
терапия может производиться меньшими дозами
жили, что присутствие двух ортогонально ориен-
радиации, снижая побочный эффект воздействия
тированных пулов лютеина, одного перпендику-
на нормальные клетки [8].
лярного поверхности мембраны и другого - па-
Существует существенная разница в цитоток-
раллельного плоскости мембраны, в результате
сическом действии свободного лютеина и лютеи-
приведет к большей стабильности лютеина в био-
на в липосомной форме. Мы предположили, что
мембранах. Натуральные терапевтические агенты
включение лютеина в липосомы DPPA может
могут быть лучшей заменой в терапии рака, поз-
увеличивать способность наночастиц к агрега-
воляя избежать различных побочных эффектов,
ции, а это имеет место при высоких концентра-
вызываемых химиотерапией и радиотерапией.
циях и ведет к увеличению их размера (см.
Эта схема лечения может позволять эффективно
табл. 1). Авторы работы [43] обнаружили, что раз-
избегать повреждения нормальных, здоровых
мер наночастиц играет очень важную роль в ра-
клеток в районе вблизи опухолевых клеток [9].
диосенсибилизации. В результате наночастицы,
нагруженные лекарствами, имели меньший ра-
ВЫВОДЫ
диосенсибилизирующий эффект, чем ненагру-
женные, особенно при высоких концентрациях
Итак, в представленном исследовании показа-
лекарств. В результате хемотерапевтический эф-
но, что комбинация химиотерапии и высокой до-
фект компенсировался этим снижением. В до-
зы (10 Гр) ионизирующей радиации приводит к
полнение к эффективности в сочетании с локаль-
синергии в отношении ингибирования роста кле-
ной радиотерапии химиотерапия в комбианции с
ток карциномы молочной железы благодаря ин-
БИОФИЗИКА том 68
№ 5
2023
СРАВНИТЕЛЬНАЯ ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ ЛЮТЕИНА
997
дукции цитотоксичности, и данный подход мо-
14. M. W. Shafaa, H. A. Diehl, and C. Socaciu, Biophys.
жет быть перспективен в терапии молочной желе-
Chem., 129, 111 (2007).
зы, несмотря на то, что нужны дополнительные
15. D. B. Rodriguez-Amaya, A guide to carotenoid analysis
исследования. Вышеизложенные наблюдения
in foods, Vol. 71 (ILSI Press, Washington, 2001).
указывают на то, что лютеин может быть исполь-
16. P. K. Bellamakondi, A. Godavarthi, M. Ibrahim, et al.,
зован как новый противораковый агент, позволя-
Asian J. Pharm. Clin. Res., 7 (2), 17 (2014).
ющий использовать цитотоксичные препараты в
17. U. Kätzel, PhD Thesis (Technische Universitat, Dres-
более низких дозах, что приведет к более селек-
den,
2007),
тивной и менее токсичной для организма схеме
de:swb:14-1197634640783-66357.
терапии рака молочной железы у человека. Пред-
18. A. Sujak, J. Gabrielska, and W. Grudzecki, Arch. Bio-
ставленные доказательства эффективности поз-
chem. Biophys., 371, 301 (1999).
воляют выдвинуть новую схему терапии, в кото-
19. D. Paolino, M. Fresta, P. Sinha, and M. Ferrari, In En-
рой свободный лютеин может быть замещен цис-
cyclopedia of medical devices and instrumentation, 2nd
платином для увеличения противораковой
ed., Ed. by J. G. Webster (Wiley, New York, 2006),
активности против линии раковых клеток
pp. 437-495
MCF-7. Результаты показали, что натуральное ве-
щество (лютеин) может быть альтернативой стан-
20. L. Plank, C. E. Dahl, and B. R. Ware, Chem. Phys.
дартному фармакологическому вмешательству в
Lipids, 36 (4), 319 (1985).
лечении карциномы молочной железы.
21. J. W. Klein, B. R. Ware, G. Barclay, and H. R. Petty,
Chem. Phys. Lipids, 43 (1), 13 (1987).
22. S. Law, W. Lo, S. Pai, and G. The, Int. J. Pharmaceut.,
КОНФЛИКТ ИНТЕРЕСОВ
43 (3), 257 (1988).
Авторы сообщают об отсутствие какого бы то
23. K. Makino, T. Yamada, M. Kimura, et al., Biophys.
ни было конфликта интересов, относящегося к
Chem., 41 (2), 175 (1991).
данной статье
24. I. Kolman, N. Pippa, A. Meristoudi, et al., J. Therm.
Analysis Calorimetry, 123 (3), 2257 (2016).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
25. K. A. Riske, R. P. Barroso, C. C. Vequi-Suplicy, et al.,
Biochim. Biophys. Acta - Biomembranes, 1788 (5),
Настоящая работа не содержит описания ка-
954 (2009).
ких-либо исследований с использованием людей
26. R. Koynova and M. Caffrey, Biochim. Biophys. Acta -
и животных в качестве объектов.
Rev. Biomembranes, 1376 (1), 91 (1998).
27. C. H. Spink, Methods Cell Biol., 84, 115 (2008).
СПИСОК ЛИТЕРАТУРЫ
28. M. W. Shafaa, N. M. Sabra, and R. A. Fouad, Biophar-
1. T. Tarver, Cancer facts & figures (American Cancer So-
maceut. Drug Disposition, 32 (9), 507 (2011).
ciety, Atlanta, 2012).
29. T. B. Pedersen, T. Kaasgaard, M. Ø. Jensen, et al., Bio-
2. S. V. Talluri, G. Kuppusamy, V. V. S. R. Karri, et al.,
phys. J., 89 (4), 2494 (2005).
Drug Delivery, 23 (4), 1291 (2016).
30. A. V. Popova and D. K. Hincha, Biophys. J. 93 (4),
3. S. E. Leucuta, Curr. Clin. Pharmacol., 5, 257 (2010).
1204 (2007).
4. M. Khvedelidze, T. Mdzinarashvili, E. Shekiladze,
31. W. I. Gruszecki and K. Strzałka, Biochim. Biophys.
et al., J. Liposome Res., 25, 20 (2015).
Acta - Mol. Basis of Disease, 1740 (2), 108 (2005).
5. Q. Q. Zhang, J. Chen, D. L. Zhou, et al., Int. J. Biol.
32. N. Fa, S. Ronkart, A. Schanck, et al., Chem. Phys. Lip-
Sci., 13 (4), 471 (2017).
ids, 144 (1), 108 (2006).
6. J. Chen, Z. Zhou, Y. Yao, et al., J. Cell. Mol. Med. 22,
33. S. S. Bafna, T. Sun, and D. G. Baird, Polymer, 34 (4),
4760 (2018).
708 (1993).
7. L. Cui, S. Her, M. Dunne, et al., Radiat. Res., 187 (2),
34. A. Blume, Curr. Opin. Colloid Interface Sci., 1, 64
147 (2017).
(1996).
8. N. Sisin, K. Abdul Razak, S. Zainal Abidin, et al., Int.
35. F. Severcan, I. Sahin, and N. Kazancı, Biochim. Bio-
J. Nanomed., 14, 9941 (2019).
phys. Acta - Biomembranes, 1668 (2), 215 (2005).
9. R. Baskar, K. A. Lee, R. Yeo, K.-W. Yeoh, Int. J. Med.
36. M. M. Mady, M. W. Shafaa, E. R. Abbase, and
Sci., 9 (3), 193 (2012).
A. H. Fahium, Cell biochem. biophys., 62 (3), 481
10. B. Yan, M. S. Lu, L. Wang, et al., Br. J. Nutr., 115, 129
(2012).
(2016).
37. K. Kushwaha, J. Saxena, B. K. Tripathi, and
11. E. J. Johnson, Nutr. Rev., 72, 605 (2014).
M. K. Agarwal, J. BioSci. Biotechnol., 3 (3),
253
12. T. Tanaka, M. Shnimizu, and H. Moriwaki, Molecules,
(2014).
17, 3202 (2012).
38. M. J. Llansola-Portoles, A. A. Pascal, and B. Robert, J.
13. A. D. Bangham, M. W. Hill, and N. G. A. Miller, In
Roy. Soc. Interface., 14 (135), 20170504 (2017).
Methods in Membrane Biology, ed. by E. D. Karn (Ple-
39. A. Blume, W. Hubner, and G. Messner, Biochemistry.,
num Press, New York, 1974), Vol. 1, pp. 1-68.
27, 8239 (1988).
БИОФИЗИКА том 68
№ 5
2023
998
ЛАФТА и др.
40. W. Grudzinski, L. Nierzwicki, R. Welc, et al., Sci. Rep.,
42. X. Gong, J. R. Smith, H. M. Swanson, and L. P. Rubin,
7 (1), 1 (2017).
Molecules, 23 (4), 905 (2018).
41. P. R.-R. Sowmya, B. P. Arathi, K. Vijay, et al., Food
43. X. D. Zhang, D. Wu, X. Shen, et al., Biomaterials, 33
Chem. Toxicol., 106, 58 (2017).
(27), 6408 (2012).
Comparative Cytotoxic Activity of Lutein or Cisplatin Doped with Liposomes
against Breast Cancer Cell Lines after Radiotherapy
R.A. Lafta*, M.W. Shafaa*, W.M. Darwish**, and M.S. El-Nagdy*
*Faculty of Natural Sciences, Helwan University, Cairo, 11765 Egypt
**Department of Polymers and Pigments, National Research Centre, Elbohouth St., Dokki, Giza, 12622 Egypt
Interactions of the anticancer drug cisplatin or the antioxidant drug lutein with liposomes as model mem-
branes were characterized. All liposomes had the almost spherical shape, taking into account that lyposomes
without the said drugs were more evenly dispersed and tended to aggregate less. The mean size diameter of
empty liposomal samples was 617.90 ± 75.64 nm, while liposomes loaded with cisplatin, lutein and a cispla-
tin+lutein combination were 425.60 ± 64.74 nm, 877.85 ± 93.90 nm and 189.91 ± 136.84 nm, respectively,
in diameter. The incorporation of cisplatin or lutein into liposome membranes resulted in an increase in the
zeta potential values. The lowest zeta potential value was achieved in lyposomes containing cisplatin in com-
bination with lutein. The addition of cisplatin to liposomes caused a shift in the melting temperature towards
higher values than those of the main peak of empty liposomes indicating a conformational disorder within the
phospholipids. Encapsulation of lutein into liposomes resulted in the disappearance of the main characteris-
tic endothermic peak of pure liposomes. FTIR spectroscopy confirmed the interaction of lutein or cisplatin
with functional groups in liposomes. In the absence of external gamma-irradiation, the IC50 value for free lu-
tein in the cytotoxic assay with MCF-7 treated cells was 10.62 μg/ml, while free cisplatin showed the IC50 val-
ue of 41.02 μg/ml. IC50 was 65.84 μg/ml and 34.29 μg/ml for nanoliposomal lutein and cisplatin, respectively.
Using the combined therapy of gamma irradiation at dose rate 5 Gray followed by 10 Gray, the IC50 value for
free lutein changed from 17.0 to 9.5 μg/ml. IC50 for free cisplatin changed from 51.00 to 43.09 μg/ml. This
study showed that cytotoxic effect of a standard form of lutein is stronger than that of nanoliposomal lutein.
The current evidence reveals a new regimen for the treatment during which replacing cisplatin with free lutein
increases anticancer activity against the MCF-7 cancer cell line.
Keywords: lutein, cisplatin, liposomes, FTIR spectroscopy, cytotoxicity, gamma irradiation
БИОФИЗИКА том 68
№ 5
2023