БИОФИЗИКА, 2023, том 68, № 5, с. 973-981
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 577.23
СОВМЕСТНОЕ ДЕЙСТВИЕ МЕЛАТОНИНА
И ДИЭТИЛДИТИОКАРБАМАТА НА КЛЕТКИ НЕЙРОБЛАСТОМЫ
МЫШИ N1Е-115 (КЛОН С-1300)
© 2023 г. С.Н. Мякишева*, #, Ю.Л. Бабурина**, М.И. Кобякова**, Р.Р. Крестинин**,
Л.Д. Сотникова**, О.В. Крестинина**, ##
*Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», Институтская ул., 3, Пущино Московской области, 142290, Россия
#E-mail: *myakisheva@mail.ru
**Институт теоретической и экспериментальной биофизики, РАН,
Институтская ул., 3, Пущино Московской области, 142290, Россия
##E-mail: *ovkres@mail.ru
Поступила в редакцию 07.07.2023 г.
После доработки 07.07.2023 г.
Принята к публикации 02.08.2023 г.
Изучено действие диэтилдитиокарбамата натрия, мелатонина и их совместного применения на
пролиферативную активность, изменение цитозольного Са2+, мембранного потенциала и продук-
ции активных форм кислорода в культуре клеток нейробластомы мыши N1Е-115 (клон С-1300). Бы-
ло показано, что диэтилдитиокарбамат натрия и мелатонин ингибируют пролиферацию и усилива-
ют дифференцировку клеток. При этом содержание анти-апоптотического белка Bcl-2 снижается,
тогда как содержание про-апоптотического белка Bax повышается, что может предполагать запуск
апоптотического каскада. Однако применение этих двух препаратов совместно не усиливало на-
блюдаемые эффекты. Видимо, механизмы, благодаря которым диэтилдитиокарбаматы и мелато-
нин действуют на клетки, различны.
Ключевые слова: диэтилдитиокарбамат натрия, мелатонин, пролиферация, дифференцировка, субъ-
единицы комплексов дыхательной цепи митохондрий, продукция активных форм кислорода, митохон-
дриальный мембранный потенциал, цитозольный кальций.
DOI: 10.31857/S0006302923050186, EDN: NAZGQY
неспособность клеток, запускают апоптоз
Дитиокарбаматы являются хелаторами метал-
нейронов, индуцируют митохондриальную дис-
лов на основе серы, которые содержат дитио-
функцию и генерируют продукцию активных
карбоксильную функциональную группу, конъ-
форм кислорода (АФК) в дозозависимой манере.
югированную с алифатической вторичной ами-
Дитиокарбаматы индуцировали апоптоз в клет-
ногруппой
[1]. Дитиокарбаматы способны
ках нейробластомы, повышая внутриклеточный
оказывать как прооксидантные, так и антиокси-
уровень меди, запускающий высвобождение ци-
дантные эффекты в биологических системах [2].
тохрома с и активацию каспазы [1, 4]. В настоя-
Они широко применяются в качестве сельскохо-
щее время дитиокарбаматы изучаются в качестве
зяйственных инсектицидов, гербицидов и фунги-
потенциальных противоопухолевых препаратов в
цидов [3]. Обнаружены нейропротекторные, ан-
сочетании с другими лекарственными препарата-
тимикробные и иммуномодулирующие свойства
ми. Возможный синергизм или антагонизм ди-
дитиокарбаматов. Дитиокарбаматы применяются
тиокарбаматов в сочетании с другими лекар-
в качестве спиновой ловушки нитроксидного ра-
ственным препаратами может представлять инте-
дикала NO в онкологических исследованиях. Бо-
рес для исследования. Недавно мы исследовали
лее того, было показано, что в клетках нейробла-
совместное действие дитиокарбамата и В12b и за-
стомы SH-SY5Y дитиокарбаматы снижают жиз-
ключили, что применение этих препаратов ока-
зывает синергическое токсическое действие на
дитиокарбамат натрия, PBS - фосфатно-солевой буфер, опухолевые клетки (HEp-2), вызывая выражен-
GAPDH - глицеральдегид-3-фосфатдегидрогеназа, NSE -
ный стресс эндоплазматического ретикулума, об-
нейронспецифическая енолаза (neuron specific enolase).
ширную вакуолизацию и ингибирование апопто-
973
974
МЯКИШЕВА и др.
за, что в конечном итоге приводит к индукции па-
после добавления исследуемых веществ в каждую
раптозоподобной гибели клеток [5].
лунку добавляли резазурин (Sigma-Aldrich, США)
в конечной концентрации 100 мкг/мл и инкуби-
В последние несколько лет в качестве лекар-
ровали 4 ч в условиях СО2-инкубатора. Флуорес-
ственного препарата, используемого в противо-
опухолевой терапии, применяется производное
центный анализ проводили на устройстве для
считывания микропланшетов Infinite F200 (Tec-
биогенного амина серотонина - эпифизарный
гормон N-ацетил-5-метокситриптамин (мелато-
an, Швейцария) при длине волны возбуждения
нин). Амфифильные характеристики мелатонина
535 нм и длине волны испускания 595 нм.
позволяют ему достигать любого участка клетки
Измерение внутриклеточной продукции актив-
или биологической жидкости [6]. Было показано,
ных форм кислорода. Продукцию АФК измеряли с
что мелатонин участвует в регуляции клеточной
использованием флуоресцентного красителя
пролиферации и дифференцировки [7]. В наших
2',7'-дихлордигидрофлуоресцеиндиацетата (Sig-
исследованиях на культурах опухолевых клеток
ma-Aldrich, США) (длина волны возбуждения
было обнаружено, что мелатонин обладает про-
485 нм, длина волны испускания 530 нм). Для
тивоопухолевым действием [8-12].
анализа продукции АФК в клетке (5·105 кле-
Целью настоящего исследования было изу-
ток/мл) добавляли 10 мкМ красителя, после чего
чить влияние дитиокарбамата натрия (ДК) и ме-
клетки инкубировали в СО2-инкубаторе в тече-
латонина на пролиферативную активность, изме-
ние 10 мин. После этого клетки однократно про-
нение цитозольного Са2+, мембранного потенци-
мывали в фосфатно-солевом буфере (PBS). H2O2
ала и продукции АФК в клетках нейробластомы
(1 мкМ) использовали в качестве положительно-
мыши N1E-115 (клон C-1300).
го контроля. Измерение окислительной активно-
сти проводили на проточном цитометре BD Accu-
ri C6 (Biosciences, США).
МАТЕРИАЛЫ И МЕТОДЫ
Измерение митохондриального мембранного по-
Клеточные культуры и условия культивирова-
тенциала. Для анализа митохондриального потен-
ния. Исследования проводили на культуре клеток
циала использовали флуоресцентный краситель
нейробластомы мыши N1Е-115 (клон С-1300),
3,3'-дигексилоксакарбоцианин йодид DiOC6(3)
полученной из Российской коллекции клеточных
(Sigma-Aldrich, США) (длина волны возбуждения
культур (Институт цитологии РАН, Санкт-Пе-
482 нм, длина волны испускания 501 нм). К кле-
тербург). Клетки нейробластомы культивировали
точной суспензии (5·105 клеток/мл) добавляли
в среде DМЕМ (Sigma, США) с добавлением 10%
10 нМ красителя и инкубировали в СО2-инкуба-
эмбриональной сыворотки (fetal bovine serum,
торе в течение 30 мин. После этого клетки одно-
Flow Laboratories, Великобритания) при 37°С, в
кратно промывали в PBS. Валиномицин (250 нМ)
атмосфере 5% СО2. В экспериментах в качестве
использовали в качестве положительного кон-
контроля использовали среду DМЕМ без сыво-
троля. Изменение мембранного потенциала из-
ротки и экспериментальную среду DМЕМ без
меряли на проточном цитометре BD Ac-curi C6
сыворотки с добавлением диэтилдитиокарбамата
(Biosciences, США).
натрия в концентрации 10-6 М и мелатонина в
Измерение содержания цитозольного Ca2+. Из-
концентрации 10-5 М. Исследуемые препараты
менение содержания цитозольного Ca2+ прово-
добавляли в культуру в логарифмической фазе
дили с помощью флуоресцентного красителя
роста через 24 ч после посева клеток во флаконы.
Fluo-4 AM (Sigma-Aldrich, США) (длина волны
Подсчет клеток проводили в девяти произвольно
возбуждения 494 нм, длина волны испускания
выбранных областях флакона. В контрольной и
516 нм). Для оценки изменения содержания ци-
экспериментальной группах было не менее
тозольного Ca2+ (5·105 клеток/мл) клеток отмы-
трех флаконов в каждой. Плотность посева в пла-
вали в PBS. К клеточной суспензии добавляли
стиковых флаконах объемом 50 мл составляла
Fluo-4 AM (2 мкМ) и инкубировали в СО2-инку-
5.5·103 клеток на см2 при объеме среды 5 мл.
баторе в течение 30 мин. После окрашивания
Оценка цитотоксического действия исследуе-
клетки дважды промывали PBS. Содержание
мых препаратов на клетки нейробластомы мыши
Ca2+ в цитозоле измеряли с помощью проточного
N1Е-115 (клон С-1300). Жизнеспособность кле-
цитометра BD Accuri C6 (Biosciences, США).
ток оценивали с использованием метода извлече-
Электрофорез и вестерн-блоттинг. К клеточной
ния резазурина. Клетки с плотностью 5⋅103 кле-
суспензии добавляли выбранные количества ме-
ток на лунку высевали в 96-луночный планшет.
латонина (10-5 М) и ДК (10-6 М). Через 24 ч клет-
Через 24 ч клетки обрабатывали мелатонином
ки дважды промывали ледяным PBS и центрифу-
(Sigma-Aldrich, США) (10-8-10-4 М) или ДК
гировали при 1500 g в течение 3 мин при комнат-
(Sigma-Aldrich, США) (10-7-10-3 М). Через 24 ч
ной температуре.
Полученный осадок
БИОФИЗИКА том 68
№ 5
2023
СОВМЕСТНОЕ ДЕЙСТВИЕ МЕЛАТОНИНА
975
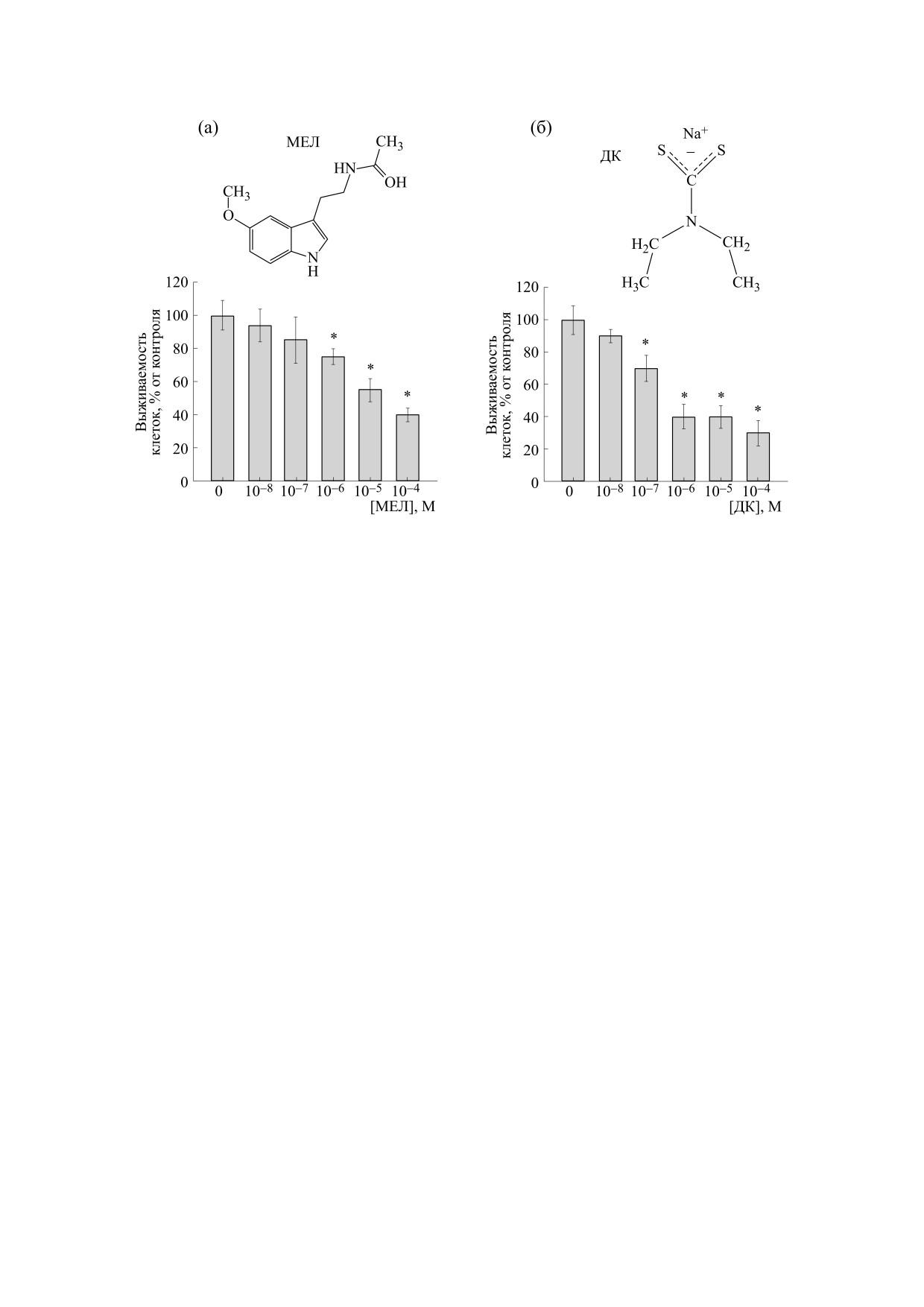
Рис. 1. Зависимость жизнеспособности клеток нейробластомы мыши N1E-115 от концентрации мелатонина (а) и
дитиокарбомата натрия (б). Долю живых клеток определяли через 24 ч после добавления препаратов и интенсивности
восстановления резазурина. Количество клеток интактной культуры (без обработки препаратами) принимали за 100%.
Данные представлены как среднее ± стандартное отклонение (n = 6), *p < 0.05 - достоверная разница по сравнению с
контролем.
солюбилизировали в лизирующем буфере (RIPA)
ны в компании Santa Cruz Biotehnology (США),
с добавлением ингибиторов протеиназ/фосфатаз,
моноклональные антитела к Bах - в компании
держали во льду в течение 30 минут и центрифу-
Abcam (Великобритания). Для нормализации
гировали при 13000 g в течение 10 мин. Концен-
белка использовали анти-глицеральдегид-3-фос-
трацию белка в супернатантах измеряли по мето-
фатдегидрогеназу (GAPDH) (Cell Signaling,
ду Брэдфорда. Полученные образцы растворяли в
США). Белковые полосы инициировали с ис-
буфере для образцов по Лэммли (Bio-Rad, США)
пользованием системы обнаружения ECL
и нагревали до 95°С в течение 5 мин. Полученные
(ChemiDoc Touch Imaging System, Bio-Rad,
лизаты разделяли на белки с помощью электро-
США).
фореза в 12.5% полиакриламидном геле. Затем
Статистический анализ. Для статистического
белки переносили из геля на нитроцеллюлозную
анализа использовали однофакторный дисперси-
мембрану (0.2 мкм) с помощью метода вестерн-
онный анализ и соответствующий апостериор-
блоттинга. Мембрану блокировали в растворе
ный анализ (Стьюдента-Ньюмена-Кеулса). Раз-
Roti-block (Carl Roth GmbH, Германия) при ком-
личия считали достоверными при p < 0.05.
натной температуре в течение одного часа. Затем
мембрану промывали водой и инкубировали с
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
первичными антителами, как описано в инструк-
ции. Изменения в уровнях основных субъединиц
Чтобы выявить цитотоксическое действие
электронно-транспортной цепи определяли с по-
препаратов, клетки нейробластомы мыши N1Е-
мощью коктейля антител Total Oxphos Rodent WB
115 культивировали в течение 24 ч с различными
Antibody Cocktail (моноклональные антитела).
концентрациями мелатонина (от 10-8 до 10-3М) и
Коктейль антител Oxphos состоит из альфа-субъ-
ДК (от 10-7 до 10-4 М) (рис. 1). На рис. 1а показа-
единицы комплекса V (CV-ATP5A - 55 кДа), ци-
на структурная формула мелатонина и диаграм-
тохрома b-c1 complex subunit 2 комплекса III
ма, отражающая жизнеспособность клеток. Ме-
(CIII-UQCRC2-48 кДа), сукцинатдегидрогеназы
комплекса II (CII-SDHB - 30 кДа), NADH:уби-
латонин при концентрации 10-8 и 10-7 М не ока-
зывал влияния на жизнеспособность клеток
хинон оксидоредуктазы Complex Assembly
нейробластомы мыши. Однако при концентра-
Factor 8 - 20 кДа комплекса I (CI-NDUFB8). Мо-
ноклональные антитела к Bcl-2 были произведе- ции мелатонина от 10-6 до 10-4 М жизнеспособ-
БИОФИЗИКА том 68
№ 5
2023
976
МЯКИШЕВА и др.
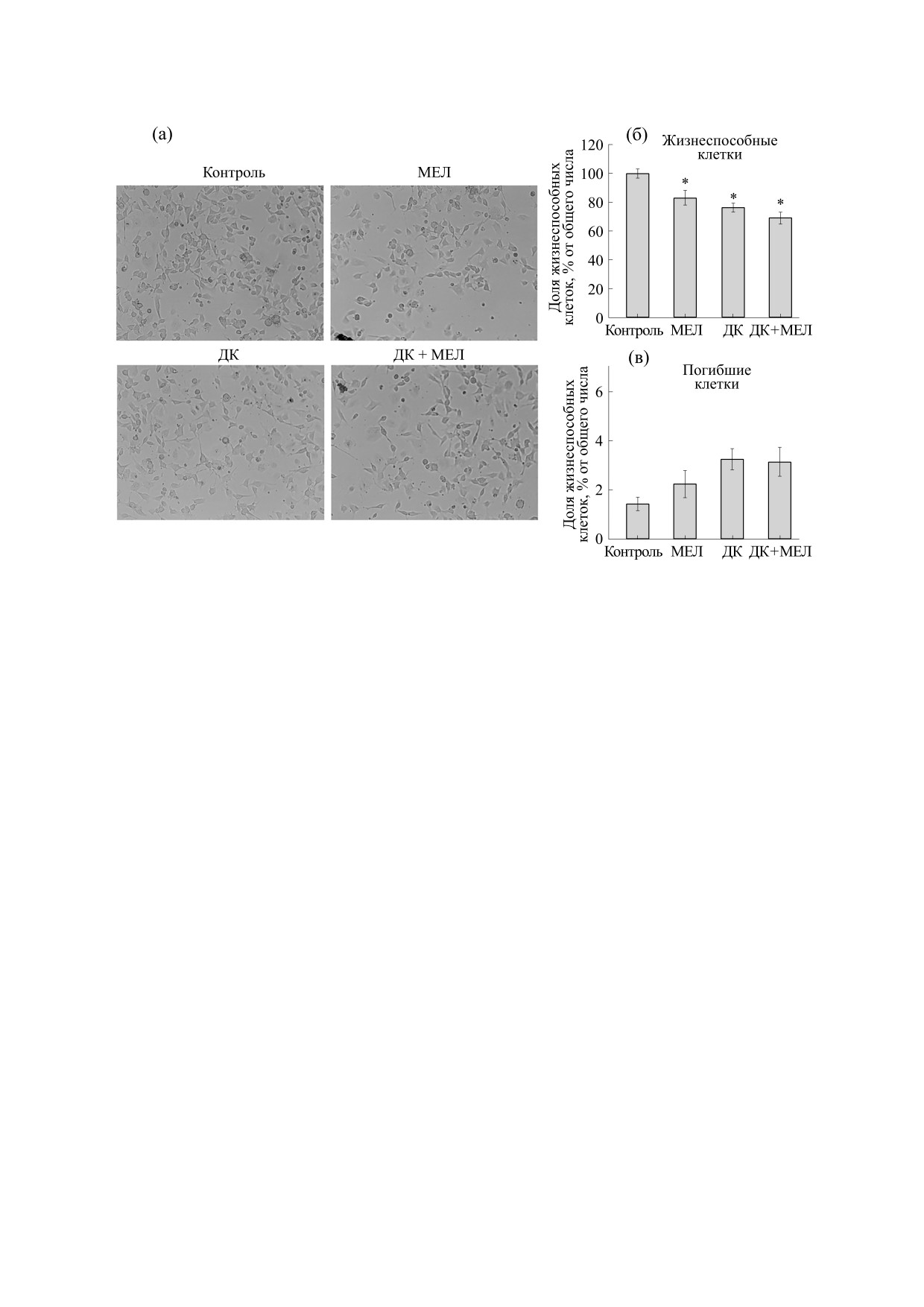
Рис. 2. Морфологический статус культуры нейробластомы мыши N1E-115 при инкубации с мелатонином (10-5 М),
дитиокарбоматом натрия (10-6 М) и их совместным действием через 24 ч культивирования: (а) - микрофотографии
клеток с исследуемыми веществами; (б) - изменение количества жизнеспособных клеток после 24 ч культивирования в
средах, содержащих мелатонин и ДК; (в) - изменение количества погибших клеток. Количественные изменения
отображены в процентах относительно общего количества клеток. Данные представлены как среднее ± стандартное
отклонение (n = 6); *p < 0.05 - достоверная разница по сравнению с контролем.
ность клеток снижалась на 25, 45 и 60% соответ-
ток во всех изучаемых условиях было незначи-
ственно относительно контроля. Аналогичным
тельным и не отличалось от контроля (рис. 2б).
образом мы подобрали нетоксичную концентра-
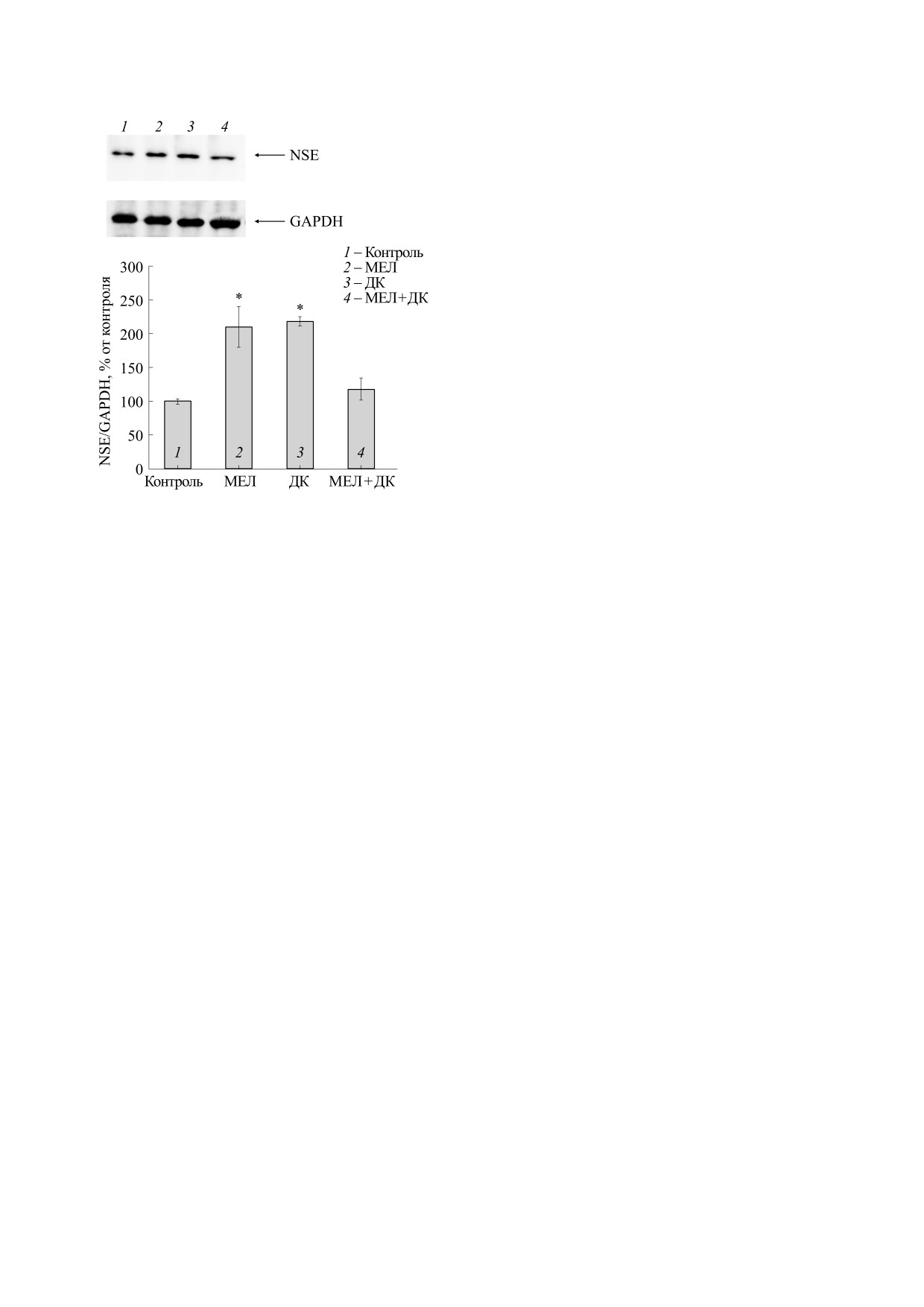
Известно, что белок нейронспецифическая
цию ДК (рис. 1б). Из рисунка видно, что ДК при
енолаза (NSE) считается одной из структурных
10-7 М не оказывал влияния на жизнеспособ-
разновидностей фермента енолазы. Клетки ней-
ность клеток нейробластомы, тогда как с увели-
робластомы характеризуются высоким потенциа-
чением концентрации от 10-6 до 10-3 М жизне-
лом дифференцировки in vivo и in vitro и поэтому
способность клеток снижалась на 25, 60 и 70% со-
представляют собой идеальную модель для изуче-
ответственно. Поскольку жизнеспособность
ния модуляции экспрессии специфических моле-
клеток снижалась почти на 50% при воздействии
кул во время дифференцировки нейронов. В ка-
мелатонина в концентрации 10-5 М и ДК в кон-
честве маркера дифференцировки используется
центрации 10-6 М, эти концентрации препаратов
NSE [13]. На рис. 3 показано изменение содержа-
мы использовали для дальнейшего исследования.
ния NSE в клетках нейробластомы мыши в при-
сутствии мелатонина и ДК и их совместное дей-
На следующем этапе исследования изучали
ствие через 24 ч культивирования. Верхняя часть
изменение пролиферации в клетках нейробласто-
рисунка - вестерн-блот, окрашенный антитела-
мы мыши N1Е-115 в наших экспериментальных
ми к NSE и GAPDH, нижняя часть отражает ко-
условиях (рис. 2). Было выявлено, что культиви-
личественную характеристику изменения фер-
рование клеток с мелатонином в течение 24 ч
приводило к снижению прироста клеток на 20%
мента как соотношение NSE к GAPDH. Из рис. 3
(рис. 2а), тогда как ДК снижал число жизнеспо-
видно, что мелатонин повышал содержание белка
собных клеток на 25%. Обработка клеток сов-
на 40%, тогда как ДК - на 50% по сравнению с
местно с мелатонином и ДК позволила снизить
контролем. Совместное действие мелатонина и
число живых клеток на 30% относительно кон-
ДК не изменяло уровня белка относительно кон-
троля. Стоит отметить, что число погибших кле-
троля.
БИОФИЗИКА том 68
№ 5
2023
СОВМЕСТНОЕ ДЕЙСТВИЕ МЕЛАТОНИНА
977
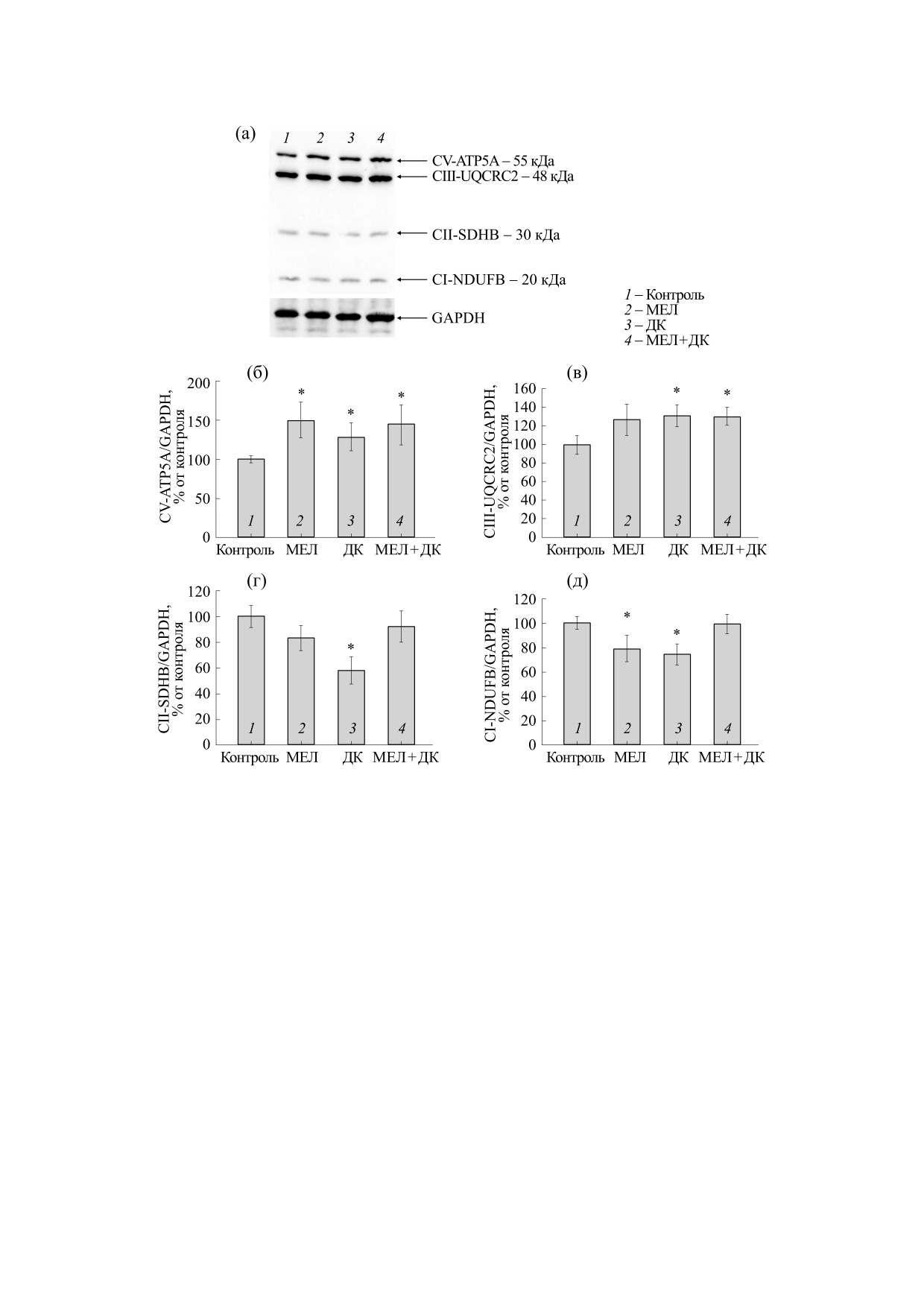
нина и ДК содержание NDUFB8 не изменялось
по сравнению с контролем (рис. 4д).
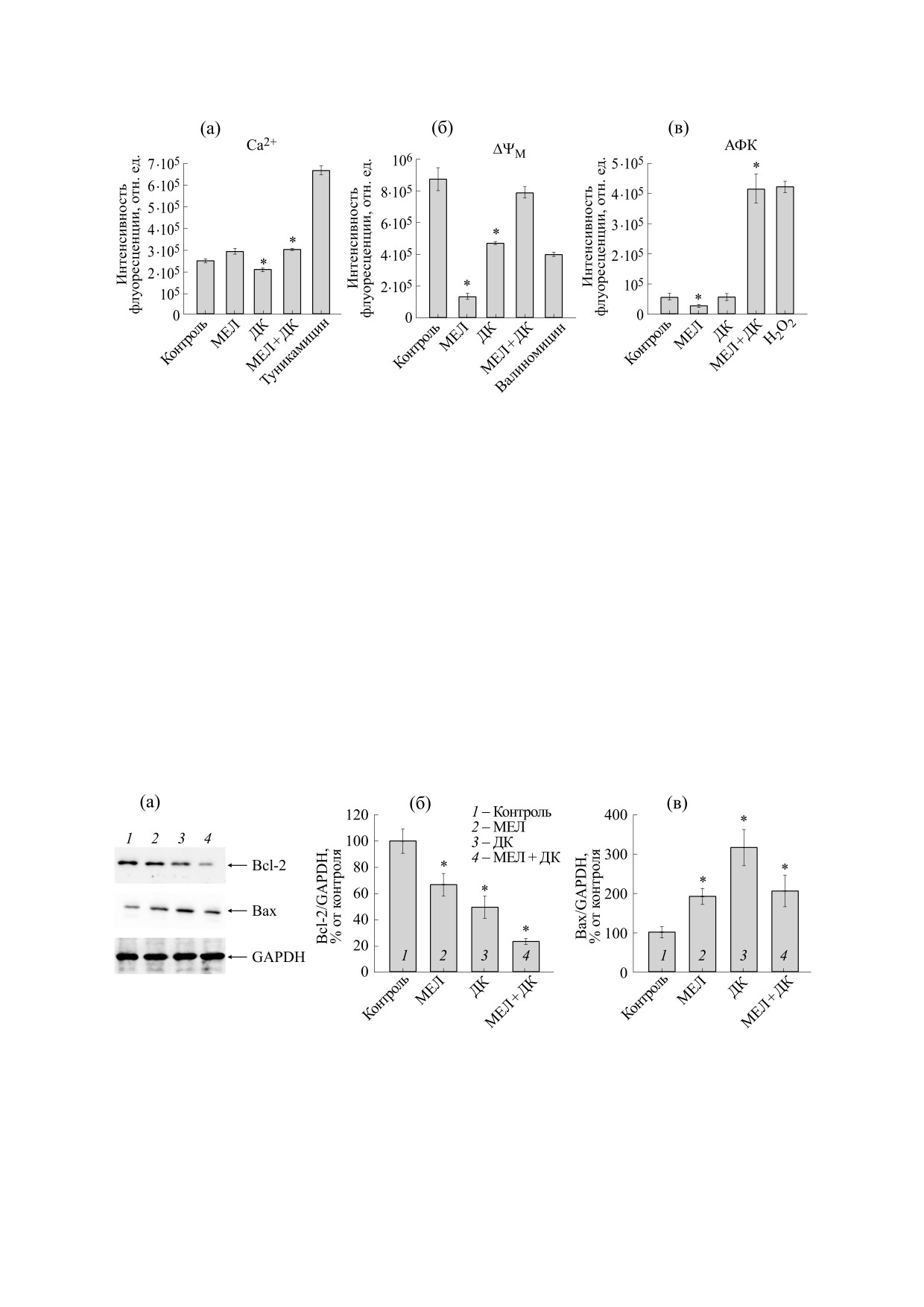
На следующем этапе мы исследовали влияние
мелатонина и ДК на изменение митохондриаль-
ного мембранного потенциала ΔΨм, продукции
АФК и цитозольного Са2+ (рис. 5) в клетках ней-
робластомы мыши. Валиномицин (250 нМ), Н2О2
и туникамицин использовали соответственно в
качестве положительного контроля. Мелатонин
снижал ΔΨм в 6 раз, ДК - на 50% по сравнению с
контролем, тогда как при совместном примене-
нии мелатонина и ДК эффект не наблюдался
(рис. 5а). При обработке клеток мелатонином
продукция АФК снижалась на 50%, в то время как
ДК не изменял этот параметр по сравнению с
контролем. При совместном действии мелатони-
на и ДК продукция АФК увеличивалась в 6 раз по
сравнению с контролем (рис. 5б). Содержание
цитозольного Са2+ снижалось на 10% в присут-
ствии мелатонина, на 15% в присутствии ДК и не
изменялось при совместном использовании этих
двух препаратов (рис. 5в).
Рис. 3. Влияние мелатонина и ДК на изменение содер-
жания нейронспецифичной енолазы в клетках ней-
Известно, что мелатонин способен модулиро-
робластомы мыши N1E-115: (а) - иммуноокрашива-
вать индукцию апоптоза в различных типах кле-
ние антителами к NSE и GAPDH в клетках нейробла-
точных линий, поэтому мы проверили изменение
стомы; (б) - диаграмма, количественно отражающая
содержание анти- и проапоптотических белков,
изменения содержания белка, нормированного на
таких как соответственно Bcl-2 и Bax, в наших
GAPDH (в % от контроля). Уровень белка в лизате
клеток без каких-либо добавок принимали за 100%.
экспериментальных условиях в клетках нейроб-
Данные по трем независимым экспериментам пред-
ластомы. На рис. 6 показаны вестерн-блоты,
ставлены в виде среднего ± стандартное отклонение,
окрашенные антителами к Bcl-2 и Bax. GAPDH
*p < 0.05 - достоверное различие по сравнению с кон-
использовали как контроль белковой нагрузки.
тролем.
Количественные характеристики представлены
как соотношение оптической плотности белков к
GAPDH. Из рисунка видно, что мелатонин сни-
Далее мы проанализировали изменение уров-
жал содержание Bcl-2 на 35% и повышал Bax в
ней основных субъединиц комплексов ЭТЦ в
2 раза по сравнению с контролем. Уровень Bcl-2
клетках нейробластомы мыши в наших экспери-
снижался на 50% в присутствии ДК, а уровень
ментальных условиях. На рис. 4 показан вестерн-
Bax - в 3 раза по сравнению с контролем. При
блот, окрашенный антителами к OXPHOS и
совместном использовании препаратов мы заме-
представлены количественные изменения как со-
тили, что мелатонин снижал содержание Bcl-2 на
отношение белков к GAPDH. Из рисунка видно,
80%, тогда как содержание Bax повышалось в
что мелатонин повышал содержание субъедини-
2 раза.
цы АТФазы АТР5А на 50%, тогда как ДК - на
25%. При совместном действии уровень субъеди-
ницы АТР5А увеличивался на 40% по сравнению
ОБСУЖДЕНИЕ
с контролем (рис. 4б). Содержание субъединицы
Совместное использование препаратов, на-
UQCRC2 комплекса III (рис. 4в) в присутствии
правленных на снижение/повышение пролифе-
мелатонина не изменялось по сравнению с кон-
ративной активности представляет собой много-
тролем, в то время как ДК повышал уровень субъ-
обещающий терапевтический подход к заболева-
единицы на 25%, а при совместном применении
ниям различной природы. Так недавно было
двух препаратов - на 23%. Содержание субъеди-
установлено, что дитиокарбамат, который счита-
ницы SDHB комплекса II под действием мелато-
ется хелатором ионов тяжелых металлов [2], в
нина не изменялось, ДК снижал ее на 40%, тогда
комплексе с другим членом тиолсодержащего
как при их совместном использовании уровень
препарата может применяться в антираковой те-
субъединицы не изменялся по сравнению с кон-
рапии [14-16]. Другим препаратом, широко ис-
тролем (рис. 4г). Мелатонин снижал уровень
пользуемым в последнее время в онкологической
субъединицы NDUFB8 комплекса I на 25%, а
практике как дополнение к общеизвестным хи-
ДК - на 30%. При совместном действии мелато-
миотерапевтическим препаратам, является мела-
БИОФИЗИКА том 68
№ 5
2023
978
МЯКИШЕВА и др.
Рис. 4. Влияние мелатонина и ДК на изменение уровней основных субъединиц комплексов дыхательной цепи в клетках
нейробластомы мыши N1E-115. GAPDH использовали в качестве контроля белковой нагрузки: (а) - иммуноокрашива-
ние коктейлем антител OXPHOS и GAPDH (контроль белковой нагрузки); (б) - количественная оценка иммунного
окрашивания с помощью компьютерной денситометрии. Данные по трем независимым экспериментам представлены
как среднее ± стандартное отклонение, *p < 0.05 -достоверное различие по сравнению с контролем.
тонин [17]. В настоящем исследовании, мы выяс-
мы мыши N1Е-115 (клон С-1300) при определен-
няли, способны ли ДК и мелатонин, применяе-
ных условиях способствует дифференцировке
мые совместно, усиливать свои действия в
нейрона, демонстрирует синтез нейромедиаторов
клетках нейробластомы мыши N1Е-115 (клон
и специфических ферментов, наличие электриче-
С-1300). Мы наблюдали, что ДК и мелатонин тор-
ской и химической возбудимости [18]. Более того,
мозили пролиферацию как по отдельности, так и
показано, что мелатонин усиливает клеточную
совместно, причем совместное использование
этих двух препаратов не усиливало торможение
пролиферацию и способствует дифференцировке
пролиферации.
[7, 19]. В наших экспериментальных условиях мы
наблюдали, что как мелатонин, так и ДК усилива-
Клеточная дифференцировка представляет
ли клеточную дифференцировку (рис. 3) по срав-
собой процесс, в результате которого клетка ста-
нению с контролем, однако при их совместном
новится специализированной, т.е. приобретает
химические, морфологические и функциональ-
использовании значения не отличались от кон-
ные особенности. Культура клеток нейробласто-
трольных.
БИОФИЗИКА том 68
№ 5
2023
СОВМЕСТНОЕ ДЕЙСТВИЕ МЕЛАТОНИНА
979
Рис. 5. Влияние мелатонина и ДК на изменение содержания цитозольного Ca2+, митохондриального мембранного
потенциала (ΔΨм) и внутриклеточной продукции АФК в клетках нейробластомы мыши N1E-115: (а) - изменение
содержания цитозольного Ca2+ туникамицин использовали в качестве положительного контроля; (б) - изменение ΔΨм,
валиномицин использовали в качестве положительного контроля; (в) - изменение внутриклеточной продукции АФК,
Н2О2 использовали в качестве положительного контроля. Данные по трем независимым экспериментам представлены в
виде среднего ± стандартное отклонение, *p < 0.05 - достоверное различие по сравнению с контролем.
Известно, что на изменение концентрации
[26-28]. Согласно полученным результатам, ме-
Са2+ в цитозоле активно реагируют различные
латонин повышал содержание цитозольного Са2+
органеллы клетки, в первую очередь митохон-
по сравнению с контролем, при этом мы наблю-
дрии [20]. Накопление сверхпорогового Са2+ в
дали драматичное снижение ΔΨм и снижение
матриксе митохондрий может привести к различ-
АФК в клетках нейробластомы. В этих условиях в
ным нарушениям, таким как снижение мембран-
присутствии ДК происходило уменьшение цито-
ного потенциала и повышение продукции АФК,
зольного Са2+ и ΔΨм, тогда как внутриклеточная
и тем самым вызвать окислительный стресс [21-
продукция АФК не отличалась от контроля. Сов-
23]. Сообщалось, что в опухолевых клетках мела-
местное применение мелатонина и ДК приводи-
тонин инициирует апоптоз и увеличивает клеточ-
ное содержание АФК [24, 25], что сопровождает-
ло к повышению цитозольного Са2+, снижению
ся снижением митохондриального потенциала
ΔΨм и драматичному повышению продукции
Рис. 6. Влияние мелатонина и ДК на изменение уровней апоптотических белков в клетках нейробластомы мыши N1E-
115: (а) - иммуноокрашиевание антителами к Bcl-2, Bax и GAPDH (контроль белковой нагрузки); (б) - количественная
оценка иммунного окрашивания с помощью компьютерной денситометрии, представленное как соотношение Bcl-2 к
GAPDH; (в) - количественная оценка иммунного окрашивания с помощью компьютерной денситометрии,
представленное как соотношение Bax к GAPDH. Уровень белка в лизате клеток без каких-либо добавок принимали за
100%. Данные по трем независимым экспериментам представлены в виде среднего ± стандартное отклонение, *p < 0.05 -
достоверная разница по сравнению с контролем.
БИОФИЗИКА том 68
№ 5
2023
980
МЯКИШЕВА и др.
АФК. По-видимому, повышение содержания
вышали содержание Bcl-2, причем их совместное
применение усиливало этот эффект. Что касается
Са2+ при комбинированном применении мелато-
изменения Вах, то и ДК, и мелатонин повышали
нина и ДК было обусловлено действием мелато-
содержание Вах, тогда как при их совместном
нина, тогда как снижение ΔΨм было менее зна-
применении усиление эффекта не наблюдалось.
чительным, чем при действии препаратов по от-
дельности. Вероятно, механизмы действия
мелатонина и ДК по отдельности и при совмест-
ЗАКЛЮЧЕНИЕ
ном их применении различны.
В настоящем исследовании мы изучили дей-
Как известно, мутации в раковых клетках, за-
ствие ДК, мелатонина и их совместное примене-
трагивающие субъединицы дыхательной цепи,
ние на культуру клеток нейробластомы мыши
указывают на центральную роль окислительного
N1Е-115 (клон С-1300). Несмотря на то, что оба
фосфорилирования в онкогенезе. Недавние ис-
препарата ингибируют пролиферацию и усилива-
следования показали, что такие мутации ком-
ют дифференцировку, а также повышают содер-
плексов дыхательной цепи влияют на индукцию
жание проапоптотического белка и снижают уро-
апоптоза [29]. Митохондриальная дыхательная
вень антиапоптотического белка, что предполага-
цепь состоит из четырех связанных с мембраной
ет запуск апоптотического каскада, мы
мультимерных комплексов и катализирует
наблюдали, что по отдельности эти препараты
окисление восстанавливающих эквивалентов, в
обладают более сильными эффектами, чем при
основном
никотинамидадениндинуклеотида
совместном применении. Мы предполагаем, что
(НАДН), используя терминальный акцептор
поскольку ДК и мелатонин не усиливают дей-
электронов кислород (O2) во внутренней мито-
ствия друг друга, по-видимому, механизмы их
хондриальной мембране [30]. Перенос электро-
действия различны, поэтому их совместное при-
нов по дыхательной цепи завершается конечным
менение в культуре клеток нейробластомы N1Е-
комплексом АТФ-синтазой (комплекс V), кото-
115 (клон С-1300) нецелесообразно.
рый генерирует АТФ. Следует отметить, что утеч-
ка электронов может возникать на всем протяже-
ФИНАНСИРОВАНИЕ РАБОТЫ
нии дыхательной цепи и приводить к образова-
нию АФК. Ингибирование митохондриального
Работа выполнена в рамках Государственного
дыхания является одной из стратегий по усиле-
задания (№№ 075-01025-23-01 и 075-00957-23-
нию индуцированного лекарственными сред-
00).
ствами апоптоза в различных типах раковых кле-
ток [31]. Полученные нами результаты показыва-
КОНФЛИКТ ИНТЕРЕСОВ
ют, что содержание субъединицы комплекса V
повышалось при действии ДК, мелатонина и при
Авторы заявляют об отсутствии конфликта
их совместном применении, тогда как уровень
интересов.
субъединицы комплекса III повышался при дей-
ствии ДК и совместно ДК с мелатонином. ДК ин-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
гибировал содержание субъединицы комплекса
II, хотя ни мелатонин, ни совместное примене-
Настоящая работа не содержит описания ка-
ние не оказывали влияние на изменение субъеди-
ких-либо исследований с использованием людей
ницы комплекса II. Содержание субъединицы
и животных в качестве объектов.
комплекса I снижалось в присутствии мелатони-
на и ДК, но их совместное добавление не отлича-
СПИСОК ЛИТЕРАТУРЫ
лось от контроля.
1. A. C. Matias, T. M. Manieri, S. S. Cipriano, et al., To-
Семейство Bcl-2 представляет собой наиболее
xicol. In Vitro, 27 (1), 349 (2013).
охарактеризованное семейство белков, участвую-
2. C. I. Nobel, M. Kimland, B. Lind, et al., J. Biol.
щих в регуляции апоптотической гибели клеток,
Chem., 270 (44), 26202 (1995).
состоящее из антиапоптотических и проапопто-
3. O. M. Viquez, H. L. Valentine, K. Amarnath, et al.,
тических членов. Это белковое семейство вклю-
Toxicol. Appl. Pharmacol., 229 (1), 77 (2008).
чает как ингибиторы, так и индукторы клеточной
гибели. Вместе они регулируют процессы, мито-
4. C. Liu, Z. Liu, Y. Fang, et al., Environ. Int., 171,
хондриального внутреннего апоптоза, приводя-
107696 (2023).
щие к гибели клеток. Этот путь необходим для
5. M. Solovieva, Y. Shatalin, R. Fadeev, et al., Biomole-
нормального эмбрионального развития и для
cules, 10 (1), 69 (2020).
предотвращения рака [32]. Мы исследовали изме-
6. A. Menendez-Pelaez, R.. Reiter, J. Pineal Res., 15 (2),
нение содержание антиапоптотического белка
59 (1993).
Bcl-2 и проапоптотического Bax. Согласно полу-
7. S. Cos, R. Verduga, C. Fernandez-Viadero, et al., Neu-
ченным результатам как ДК, так и мелатонин по-
rosci. Lett., 216 (2), 113 (1996).
БИОФИЗИКА том 68
№ 5
2023
СОВМЕСТНОЕ ДЕЙСТВИЕ МЕЛАТОНИНА
981
8. Y. Baburina,, A. Lomovsky, and O. Krestinina, J. Pers.
21. I. Kruman, Q. Guo, and M. P. Mattson, J. Neurosci.
Med., 11 (4), N274 (2021).
Res., 51 (3), 293 (1998).
9. A. Lomovsky, Y. Baburina, I. Odinokova, et al., Anti-
22. E. N. Maciel, A. E. Vercesi, and R. F. Castilho, J. Neu-
oxidants (Basel), 9 (11), (2020).
rochem., 79 (6), 1237 (2001).
10. A. I. Lomovsky, Y. L. Baburina, R. S. Fadeev, et al.,
23. P. Pinton, C. Giorgi, R. Siviero, et al., Oncogene, 27
Biochemistry (Moscow), 88 (1), 73 (2023).
(50), 6407 (2008).
11. А. И. Ломовский, Ю. Л. Бабурина, М. И. Кобякова
24. D. Lanoix, A. A. Lacasse, R. J. Reiter, and C. Vaillan-
и др., Биол. мембраны, 37 (2), 103 (2020).
court, Mol. Cell. Endocrinol., 348 (1), 1 (2012).
12. О. В. Крестинина, С. Н. Мякишева, Ю. Л. Бабури-
на и др., Нейрохимия, 34 (1), 41 (2017).
25. F. Radogna, L. Paternoster, M. De Nicola, et al., Tox-
icol. Appl. Pharmacol., 239 (1), 37 (2009).
13. V. Matranga,, D. Oliva, S. Sciarrino, et al., Cell. Mol.
Neurobiol., 13 (2), 137 (1993).
26. A. P. Batista, T. G. da Silva, A. Teixeira, et al., Life Sci.,
14. M. E. Solovieva, Y. V. Shatalin, V. V. Solovyev, et al.,
93 (23), 882 (2013).
Redox Biol., 20, 28 (2019).
27. A. P. Batista, T. G. da Silva, A. A. Teixeira, et al., Mi-
15. I. Ali, W. A. Wani, K. Saleem, and M.-F. Hseih, Poly-
cron (Oxford) 59, 17 (2014).
hedron, 56, 134 (2013).
28. I. Bejarano, J. Espino, A. M. Marchena, et al., Mol.
16. M. Altaf, M. Monim-Ul-Mehboob, A. N. Kawde,
Cell. Biochem., 353 (1-2), 167 (2011).
et al., Oncotarget, 8 (1), 490 (2017).
29. A. Lemarie, S. Grimm, Oncogene. 30 (38), 3985
17. W. H. Talib, A. R. Alsayed, A. Abuawad, et al., Mole-
(2011).
cules, 26 (9), 2506 (2021).
30. G. Lenaz and M. L. Genova, Antioxid. Redox Signal.,
18. T. Amano, E. Richelson, and M. Nirenberg, Proc.
12 (8), 961 (2010).
Natl. Acad. Sci. USA, 69 (1), 258 (1972).
19. W. J. Lee, L. C. Chen, J. H. Lin, at al., Cancer Medi-
31. H. Pelicano, L. Feng, Y. Zhou, et al., J. Biol. Chem.,
cine, 8 (10), 4821 (2019).
278 (39), 37832 (2003).
20. C. Giorgi, A. Romagnoli, P. Pinton, and R. Rizzuto,
32. J. M. Hardwick and L. Soane, Cold Spring Harb. Pers-
Curr. Mol. Med., 8 (2), 119 (2008).
pect. Biol., 5 (2), a008722 (2013).
Effect of Combined Use of Melatonin and Diethyldithiocarbamate on the N1E-115
Cell Line (a Clone of Cells from Mouse Neuroblastoma C-1300)
S.N. Myakisheva*, Y.L. Baburina**, M.I. Kobyakova**, R.R. Krestinin**,
L.D. Sotnikova**, and O.V. Krestinina**
*Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
A study has been made on the effects of sodium diethyldithiocarbamate and melatonin and their interaction
on proliferative activity, the variation in cytosolic Ca2+, membrane potential and reactive oxygen species pro-
duction in the neuroblastoma N1E-115 cell line (a clone of cells from mouse neuroblastoma C-1300). This
study showed that combined use of diethyldithiocarbamates and melatonin inhibited proliferation and en-
hanced cell differentiation. At the same time, the content of Bcl-2 decreased, while the content of Bax in-
creased, that were likely to trigger an apoptotic cascade. However, the use of these two drugs in combination
did not enhance the observed effects. Therefore, this study suggests that the mechanisms by which dieth-
yldithiocarbamates and melatonin act are apparently different.
Keywords: sodium diethyldithiocarbamate, melatonin, proliferation, differentiation, subunits of mitochondrial re-
spiratory chain complexes, production of reactive oxygen species, mitochondrial membrane potential, cytosolic cal-
cium
БИОФИЗИКА том 68
№ 5
2023