БИОФИЗИКА, 2023, том 68, № 5, с. 964-972
БИОФИЗИКА КЛЕТКИ
УДК 577.35.085
ПАРАМЕТРЫ КЛЕТОЧНОГО ЦИКЛА И АКТИВНОСТЬ
ОРНИТИНДЕКАРБОКСИЛАЗЫ В КРАСНОМ КОСТНОМ МОЗГЕ
ГИБЕРНИРУЮЩИХ СУСЛИКОВ Urocitellus undulatus
© 2023 г. Г.Е. Аксёнова*, О.С. Логвинович**, В.Н. Афанасьев*, К.И. Лизоркина*
*Институт биофизики клетки РАН - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН, ул. Институтская, 3 Пущино Московской области, 142290,
E-mail: AksyonovaGE@rambler.ru
**Гомельский государственный медицинский университет, ул. Ланге, 5, Гомель, 246000, Республика Беларусь
Поступила в редакцию 15.03.2023 г.
После доработки 18.07.2023 г.
Принята к публикации 19.07.2023 г.
В сезон гибернации у межбаутных активных сусликов Urocitellus undulatus параметры клеточного
цикла клеток красного костного мозга не отличаются от летних значений. У животных в состоянии
оцепенения по сравнению с состоянием межбаутной активности суммарная доля покоящихся (G0)
и находящихся в пресинтетической (G1) фазе клеток увеличена с 71.8 до 76.0%, доля клеток в
синтетической (S) фазе снижена с 19.3 до 15.3%. Суммарная доля клеток в постсинтетической (G2)
фазе и в митозе (М) не меняется, но растет соотношение (G2+М)/S. При входе в состояние
оцепенения изменения параметров наблюдаются при снижении температуры тела ниже 25°С, их
зависимость от температуры немонотонна. Активность ключевого фермента синтеза полиаминов
орнитиндекарбоксилазы, маркера активации и пролиферации клеток, у межбаутных активных и
летних животных достоверно не отличается, во время входа в состояние оцепенения при
температуре тела ниже 25°С резко снижается, и остается на низком уровне в течение баута спячки и
при пробуждении до достижения температуры тела 30°С. Обсуждается роль изменений параметров,
связанных с пролиферативной активностью, в адаптации кроветворной ткани при гибернации
якутского суслика.
Ключевые слова: гибернация, костный мозг, клеточный цикл, пролиферация, орнитиндекарбоксилаза.
DOI: 10.31857/S0006302923050174, EDN: PGWGKV
баутной активности обычно длится от
Зимоспящие млекопитающие являются уни-
нескольких часов до суток, реже, у крупных видов
кальным объектом для изучения адаптивных воз-
сусликов (к которым относится якутский суслик
можностей организма, в частности, адаптации
U. undulatus) - до двух суток [1-4]. Вход в состоя-
активно пролиферирующих тканей, к которым
ние оцепенения происходит медленнее, чем про-
относится гемопоэтическая ткань красного кост-
буждение, и занимает у мелких видов сусликов
ного мозга. Зимняя спячка сусликов состоит из
12-18 ч [1, 2], у крупных - до 24 ч [5].
циклов (баутов) оцепенения, или торпора, или
собственно спячки, прерываемых кратковремен-
Пролиферация клеток - энергоемкий про-
ными пробуждениями. Продолжительность баута
цесс, который сильно зависит от температуры и
спячки составляет от нескольких дней до трех не-
уровня метаболизма. В состоянии торпора пока-
дель, температура тела (Тт) достигает значений,
зано резкое снижение митотического индекса в
близких к нулю, частота сердечных сокращений
быстро обновляющихся тканях - слизистой обо-
- нескольких ударов в минуту, уровень метабо-
лочке органов желудочно-кишечного тракта [6,
лизма снижен на 96-98% [1, 2]. При пробуждении
7], костном мозге [8], селезенке [9]; при пробуж-
дении митотическая активность восстанавлива-
животные за короткий период (2-3 ч) возвраща-
ется. В периоды межбаутной активности также
ются к нормотермии, восстанавливая изменен-
возобновляется рост зубов [10], восстанавливает-
ный во время баута спячки уровень физиологиче-
ся нормальный клеточный состав крови (в состо-
ских и обменных процессов [1-3]. Период меж-
янии оцепенения у большинства видов наблюда-
Сокращения: Тт - температура тела: ОДК - орнитинде-
ется лейко- и тромбоцитопения) [11, 12]. В сезон
карбоксилаза.
гибернации у сусликов с января начинает восста-
964
ПАРАМЕТРЫ КЛЕТОЧНОГО ЦИКЛА
965
навливаться подвергшаяся инволюции лимфоид-
дитиотреитол, L-орнитин, трис фирмы Sigma
ная ткань селезенки [13] и кишечника [14]. Со-
(США), пиридоксаль-5'-фосфат от Ferak (Герма-
хранение морфофункциональной целостности
ния), Na2-ЭДТА фирмы Acros (США), остальные
быстро обновляющихся тканей в период сезон-
реактивы отечественного производства квалифи-
ной гетеротермии свидетельствует о надежных
кации не ниже «х.ч.».
механизмах, обеспечивающих как их защиту от
В экспериментах использовали длиннохво-
повреждений при изменении в широких пределах
стых сусликов Urocitellus undulatus (прежнее на-
температуры, уровня метаболизма, циркуляции
звание Spermophillus undulatus) обоих полов мас-
крови, так и возобновление пролиферации в ко-
сой 500-800 г, средняя масса 590 ± 15 г, отловлен-
роткие периоды межбаутной нормотермии. Для
ных летом в окрестностях г. Якутска и
многих клеточных культур млекопитающих глу-
содержавшихся в стандартных условиях вивария
бокая (ниже 10°С), а для некоторых линий и уме-
ИБК РАН (температура воздуха 20-21°С, влаж-
ренная (25°С) гипотермия вызывает повреждение
ность 65%) в индивидуальных клетках при есте-
клеточных структур и апоптоз после возвращения
ственном освещении. Гнездовой материал и пи-
к оптимальным условиям культивирования [15-
щу давали ad libitum. Перед сезоном спячки сус-
19]. Важным адаптивным механизмом клеток яв-
ликов переносили в темное помещение с
ляется задержка клеточного (митотического)
температурой 1-3°С и размещали в деревянных
цикла при неблагоприятных условиях [20, 21].
боксах размером 20 × 20 × 25 см с гнездовым ма-
Снижение температуры культивирования вызы-
териалом. Для регистрации состояния животных
вает накопление клеток преимущественно в G1-,
в подстилку гнезд были вмонтированы термодат-
реже - в G2-фазе [15, 16, 22-24]. У гибернирую-
чики. Температура «подстилки» у гибернирую-
щих сусликов в состоянии оцепенения показано
щих животных была порядка 2-4°С и при выходе
накопление клеток крипт эпителия кишечника в
из спячки поднималась до 12-16°С.
G2-фазе [7]. У крыс, перенесших искусственный
Опыты на сусликах U. undulatus проводили в
гипобиоз, наблюдалось накопление тимоцитов в
летний период со второй декады июня до первой
G1-фазе клеточного цикла [25].
декады июля включительно (летние суслики) и в
Пролиферация клеток и тканей требует синте-
сезон гибернации (конец декабря - начало мар-
за полиаминов. Полиамины путресцин, сперми-
та). Суслики были разделены на пять групп: груп-
дин и спермин являются алифатическими по-
па 1 - летние (n = 18); группа 2 - межбаутные ак-
ликатионами, присутствующими в клетках эука-
тивные животные (n = 11), которых умервщляли
риот и прокариот
[26], которые связаны с
через 3-24 ч после пробуждения, с Тт 37°С; груп-
нормальным и неопластическим ростом тканей
па 3 - входящие в состояние оцепенения суслики
[26, 27]. В клетках млекопитающих ключевым
(n = 28), которых умервщляли при входе в спячку;
скорость-лимитирующим ферментом биосинтеза
группа 4 - спящие животные (n = 18), которых де-
полиаминов является орнитиндекарбоксилаза
капитировали на третьи-десятые (в среднем пя-
(ОДК, КФ 4.1.1.17), продуцирующая путресцин.
тые) сутки спячки, при Тт 1-7°С; группа 5 - про-
Стимуляция клеточной пролиферации сопро-
буждающиеся от спячки животные при Тт 6-31°С
вождается резким повышением активности ОДК,
(n = 15), которых декапитировали до завершения
что приводит к увеличению внутриклеточных
их выхода в активное состояние.
концентраций полиаминов [26-28]. Ингибиро-
вание синтеза полиаминов приводит к торможе-
Различия в средней массе у различных групп
нию пролиферации [29-31] с накоплением кле-
животных не превышали 3.5% и не были досто-
ток преимущественно в фазе G1 [30, 31]. У крыс в
верны.
условиях искусственного гипобиоза было показа-
Сусликов декапитировали с помощью гильо-
но резкое падение активности ОДК в органах си-
тины, немедленно вскрывали и замеряли темпе-
стемы крови - костном мозге [32], тимусе и селе-
ратуру в области сердца датчиком электротермо-
зенке [25]. В настоящей работе мы использовали
метра ТЭМП-60 с точностью до 0.2°С. Красный
параметры распределения клеток по стадиям ми-
костный мозг из передних конечностей (плечевая
тотического цикла (G0+G1, S, G2+М, (G2+М)/S)
кость) извлекали на льду. Распределение клеток
и активность ОДК красного костного мозга для
по фазам митотического цикла определяли мето-
изучения процессов адаптации в кроветворной
дом проточной цитофлуориметрии. Клеточную
ткани в ходе баутов спячки при гибернации якут-
суспензию готовили в среде Хенкса без ионов
ского суслика.
кальция. Фиксацию проводили добавлением хо-
лодного 96% этанола при встряхивании (1 : 1 по
объему) и выдерживали при -20°С не менее су-
МАТЕРИАЛЫ И МЕТОДЫ
ток. Окрашивали ДНК-специфичным флуорес-
центным красителем Hoechst-33258 (1 мкг/мл в
В работе использовали меченый L-[1-14С]
0.1 М трис-HCl-буфере, рН 7.4, содержащем
орнитин фирмы Amersham International (США),
0.1 М NaCl) в течение 30 мин при 37°С. Анализ
БИОФИЗИКА том 68
№ 5
2023
966
АКСЁНОВА и др.
проводили на приборе ЛАКС-1, разработанном в
подгруппы: 3а - Тт в области сердца от 35 до 25°С
ИБК РАН [33].
включительно, 3б - Тт от 25 до 20°С включитель-
Подсчет ядерных клеток костного мозга про-
но, 3в - Тт от 20 до 14°С включительно, 3г - Тт ни-
водили в камере Горяева. Навеску ткани суспен-
же 14°С. Данные, полученные в группе выходя-
дировали в 400-500 объемах 4%-й уксусной кис-
щих из спячки сусликов (группа 5), разделили на
лоты.
две подгруппы: 5а - Тт до 20°С включительно,
Для определения активности ОДК заморожен-
5б - Тт от 20°С до 31°С.
ную в жидком азоте ткань костного мозга поме-
щали в стеклянный гомогенизатор с фторопла-
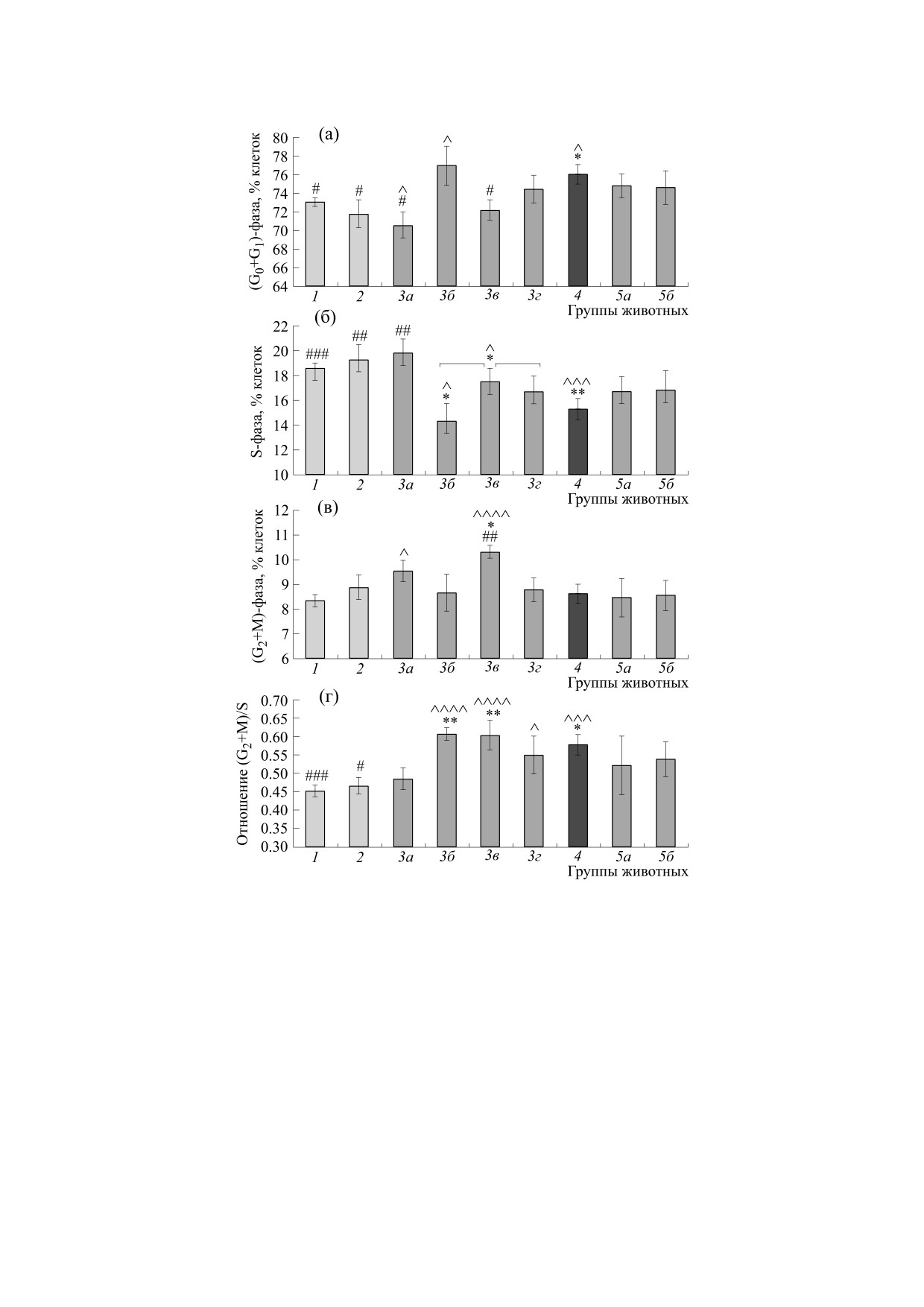
У входящих в спячку животных с температурой
стовым пестиком с добавлением 10-15 объемов
тела не ниже 25°С (подгруппа 3а), распределение
буфера (0.1 М трис-НCl (pH 7.5), 5 мМ дитиотре-
клеток костного мозга по фазам клеточного цик-
итола, 0.5 мМ ЭДТА и 40 мкМ предварительно
ла не отличалось от межбаутных активных, для
нейтрализованного пиридоксаль-5'-фосфата), и
(G0+G1)- и S-фаз сохранялось достоверное раз-
гомогенизировали в течение 0.5 мин при 2°C. Го-
личие с группой спящих животных (рис. 1). В ин-
могенат центрифугировали при 20000 g в течение
тервале температур от 25 до 20°С (подгруппа 3б)
30 мин при 2°С и в супернатанте определяли ак-
наблюдалось снижение доли клеток в S-фазе, уве-
тивность ОДК (при 37°С) радиоизотопным мето-
личение до уровня спящих сусликов - в (G0+G1)-
дом по освобождению 14СО2 из меченого L-[1-
фазе. Отношение (G2+М)/S также выросло до
14С]орнитина [34] с некоторыми модификациями
уровня спящих животных. При дальнейшем сни-
[35]. Белок в супернатанте (экстрагируемый бе-
жении температуры тела, в интервале температур
лок) определяли методом Лоури.
от 20 до 14°С (подгруппа 3в), доля клеток в
Результаты представлены как среднее ± стан-
(G0+G1)-фазе снова становилась достоверно ни-
дартная ошибка, достоверность различий оцени-
же, чем у спящих животных, при этом росла сум-
вали по t-критерию Стьюдента.
марная доля клеток в постсинтетической и мито-
тической фазах (G2+М). Однако отношение
(G2+М)/S в подгруппах 3б и 3в не менялось. У вы-
РЕЗУЛЬТАТЫ
ходящих из спячки сусликов параметры клеточ-
Для оценки изменений пролиферативной ак-
ного цикла не отличались достоверно от осталь-
тивности гемопоэтической ткани гибернирую-
ных групп.
щих сусликов U. undulatus было исследовано рас-
пределение ядерных клеток красного костного
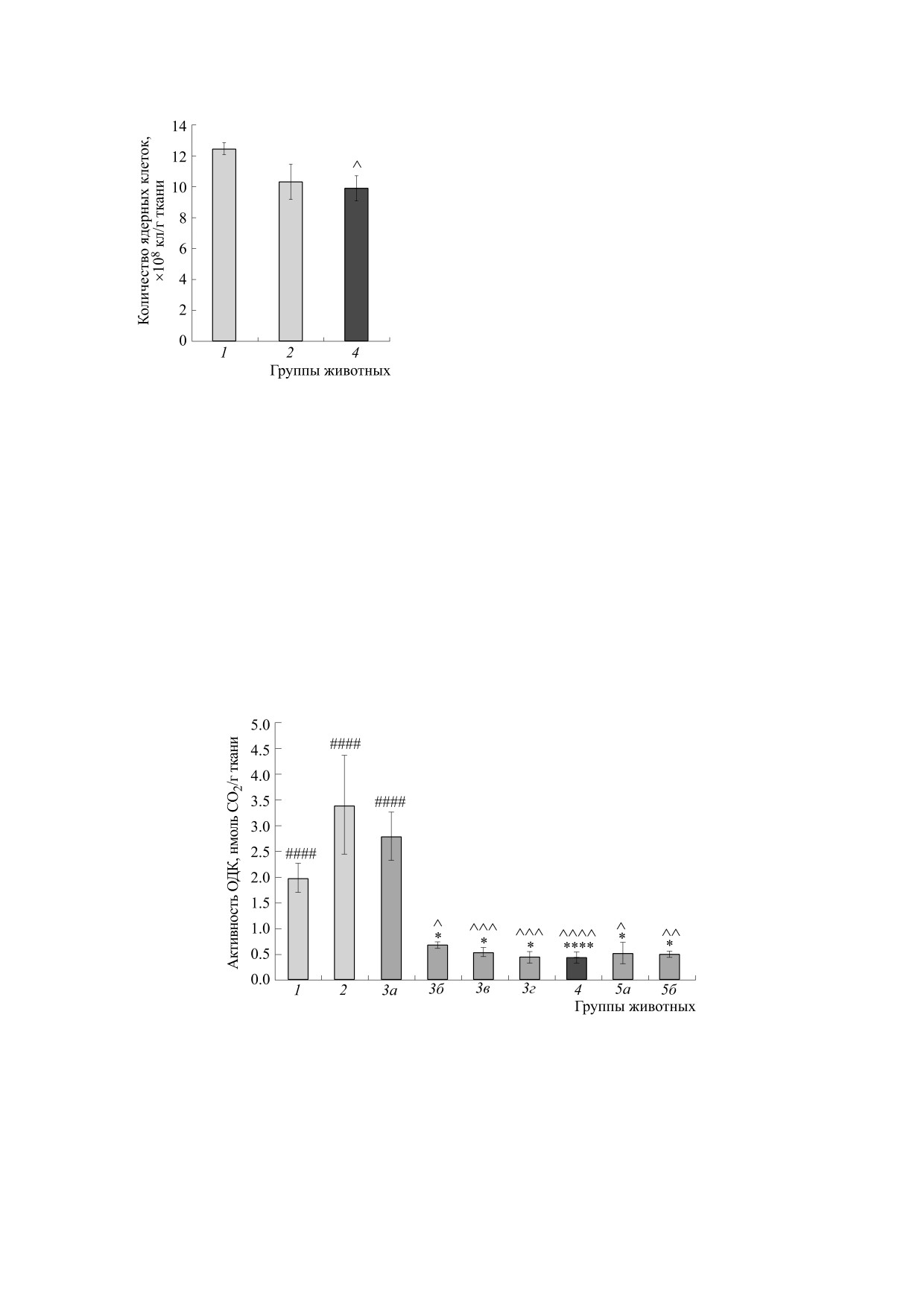
Количество ядерных клеток красного костно-
мозга (миелокариоцитов) по фазам клеточного
го мозга у спящих животных снижено по сравне-
цикла методом проточной цитофлуориметрии.
нию с летними, у межбаутных активных не отли-
Показатели клеточного цикла у летних и межба-
чалось достоверно от спящих и летних (рис. 2).
утных активных сусликов были примерно одина-
ковы (рис. 1, группы 1 и 2). В сезон гибернации у
В сезон гибернации активность орнитинде-
карбоксилазы в ткани костного мозга спящих
спящих сусликов доля клеток в фазе синтеза ДНК
(S-фаза) достоверно снижена по отношению к
сусликов U. undulatus резко, на 87%, снижена по
межбаутным активным животным (с 19.3% до
сравнению с межбаутными активными животны-
15.3% соответственно), в то же время увеличена
ми. Различия в средних значениях фермента меж-
доля суммарной популяции покоящихся клеток
ду группами нормотермных животных - летними
(фаза G0) и клеток в пресинтетической фазе G1
и межбаутными активными - не были достовер-
ны (рис. 3). При входе сусликов в состояние оце-
(G0+G1) с 71.8% до 76.0%. Доля клеток в постсин-
пенения, при температуре тела от 25°С и выше
тетической и митотической фазах (G2+М) у лет-
(подгруппа 3а), активность ОДК (в расчете на
них, зимних активных и спящих сусликов была
грамм ткани) не отличается от межбаутных ак-
примерно одинакова. Oтношение количества
тивных животных, в подгруппах 3б-г, когда тем-
клеток в (G2+М)- и S-фазах у индивидуальных
пература тела (Тт) опускается ниже 25°С, актив-
животных (G2+М)/S в состоянии оцепенения до-
ность ОДК достоверно не отличается от уровня
стоверно увеличивается по отношению к межба-
спящих животных. У выходящих из спячки сус-
утным активным и летним животным (рис. 1,
ликов активность фермента остается на уровне
группы 1, 2 и 4).
спящих (рис. 3).
Для выявления динамики изменения рассмат-
риваемых нами параметров в переходные перио-
Выход экстрагируемого белка костного мозга у
ды циклов оцепенения - межбаутной активности
летних, межбаутных активных и спящих живот-
мы разделили данные, полученные в группе вхо-
ных не отличался и составлял 75.0 ± 2.7, 70.9 ± 9.9
дящих в спячку сусликов (группа 3) на четыре
и 75.8 ± 5.3 мг/г ткани соответственно.
БИОФИЗИКА том 68
№ 5
2023
ПАРАМЕТРЫ КЛЕТОЧНОГО ЦИКЛА
967
Рис. 1. Распределение клеток красного костного мозга сусликов U. undulatus по фазам клеточного цикла в летний
период и в сезон гибернации. По оси Х - обозначения групп животных (в скобках указано количество животных в
группе): группа 1 - летние (n = 18); группа 2 - межбаутные активные (n = 11); 3 - входящие в состояние оцепенения
(спячку): группа 3а - Тт от 35°С до 25°С, средняя Тт 29.7 ± 2.0°С (n = 6); группа 3б - Тт от 25°С включительно до 20°С,
средняя Тт 22.1 ± 0.6°С (n = 5); группа 3в - Тт от 20°С включительно до 14°С, средняя Тт 16.2 ± 0.7°С (n = 8); группа 3г -
Тт от 14°С включительно и ниже, средняя Тт 10.1 ± 0.9°С (n = 9); группа 4 - спящие, средняя Тт 4.0 ± 0.5°С (n = 18);
группа 5 - пробуждающиеся (выходящие из спячки): группа 5а - Тт до 20°С включительно, средняя Тт 12.7 ± 2.3°С
(n = 5); группа 5б - Тт от 20°С до 31°С, средняя Тт 28.6 ± 1.1°С (n = 10). ^ - Различия достоверны по отношению к
летним (группа 1) сусликам, р < 0.05; ^^^ - р < 0.005; ^^^^ - р < 0.001. * - Различия достоверны по отношению к
межбаутным активным (группа 2) сусликам, р < 0.05; ** - р < 0.01. # - Различия достоверны по отношению к спящим
(группа 4) сусликам, р < 0.05; ## - р < 0.01; ### - р < 0.005.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ловых кроветворных клеток развиваются
эритроциты, нейтрофильные, эозинофильные и
Красный костный мозг представляет собой
активно пролиферирующую ткань. Это централь-
базофильные гранулоциты, моноциты, В-лимфо-
ный орган кроветворения, в котором из ство-
циты, предшественники Т-лимфоцитов и тром-
БИОФИЗИКА том 68
№ 5
2023
968
АКСЁНОВА и др.
ям (рис. 1), и мы можем предположить, что у меж-
баутных активных сусликов восстанавливается
скорость пролиферации, характерная для летних
активных животных. В пользу этого предположе-
ния свидетельствует также восстановление ак-
тивности ОДК до летнего контроля в период меж-
баутной активности (рис. 3), а также описанное
ранее восстановление митотического индекса в
красном костном мозге [8].
Параметры клеточного цикла клеток костного
мозга сусликов также достаточно стабильны в хо-
де баутов гибернации, для них характерна не-
большая амплитуда колебаний между физиологи-
ческими состояниями активности и торпора
(рис. 1). Во время торпора наблюдается накопле-
ние клеток в (G0+G1)-фазе за счет их снижения в
Рис.
2. Содержание ядерных клеток в красном
S-фазе.
костном мозге сусликов U. undulatus в летний период
В состоянии торпора в условиях глубокой ги-
и в сезон гибернации. По оси Х - обозначения групп
животных: группа 1 - летние (n = 7), группа 2 -
потермии продвижение по клеточному циклу
межбаутные активные (n = 12), группа 4 - спящие
остановлено или резко замедлено, и сохраняется
(n = 14). ^ - Различия достоверны по отношению к
летним (группа 1) сусликам, р < 0.05.
распределение, которое отражает адаптивные
процессы, происходившие на этапе вхождения в
спячку при более высоких температурах. Кроме
боциты. Несмотря на гетерогенность популяции
фактора температуры, имеет место активная не-
клеток красного костного мозга, у человека и ла-
гативная регуляция клеточного цикла, что пред-
бораторных животных показатели клеточного
ставляет собой адаптивную реакцию клеточной
системы. К увеличению доли (G0+G1)-фаз может
цикла в норме характеризуются высокой стабиль-
ностью и свидетельствуют о скорости пролифера-
приводить как задержка вступления пролифери-
ции [34, 35]. Данные параметры у нормотермных
рующих клеток в синтетическую фазу (увеличе-
ние G1), так и увеличение доли зрелых покоящих-
сусликов U. undulatus в летний период и в сезон
гибернации не отличаются по средним значени-
ся ядерных клеток (G0) в костном мозге. Это мо-
Рис. 3. Активность орнитиндекарбоксилазы красного костного мозга сусликов U. undulatus в летний период и в сезон
гибернации. Обозначения, как на рис. 1, далее указаны отличающиеся параметры: группа 1 - (n = 12); группа 2 -
(n = 7); группа 3а - средняя Тт 31.4 ± 2.8°С (n = 4); группа 3б - средняя Тт 22.1 ± 0.5°С (n = 5); группа 3в - средняя Тт
16.4 ± 0.7°С (n = 7); группа 3г - средняя Тт 11.2 ± 1.0°С (n = 5); группа 4 - средняя Тт 3.8 ± 0.5°С (n = 14); группа 5а -
средняя Тт 10.9 ± 1.8°С (n = 4); группа 5б - средняя Тт 29.4 ± 1.9°С (n = 5). ^ - Различия достоверны по отношению к
летним (группа 1) сусликам, р < 0.05; ^^ - р < 0.01;^^^ - р < 0.005; ^^^^ - р < 0.001. * - Различия достоверны по
отношению к межбаутным активным (группа 2) сусликам, р < 0.05; **** - р < 0.001. #### - Различия достоверны по
отношению к спящим (группа 4) сусликам, р < 0.001.
БИОФИЗИКА том 68
№ 5
2023
ПАРАМЕТРЫ КЛЕТОЧНОГО ЦИКЛА
969
жет происходить, в свою очередь, за счет
может приводить к стабилизации этого цитоста-
задержки выхода созревших клеток в кровоток
тического транскрипционного фактора [12].
и/или депонирования лейкоцитов крови. При
При мягкой/умеренной (до 25°С) гипотермии
этом следует отметить, что в состоянии торпора
также происходит индукция РНК-связывающих
общее количество ядерных клеток в костном моз-
белков, называемых белками холодового шока -
ге не увеличивается по сравнению с межбаутны-
CIRBP (CIRP) (cold-inducible RNA binding pro-
ми активными животными (рис. 2). По литера-
tein) и RBP3 (RNA binding motif protein 3) [15, 16].
турным данным, лейкопения у торпидных живот-
CIRBP может выступать негативным регулятором
ных обусловлена депонированием лимфоцитов в
клеточного цикла [16, 44]. При мягкой гипотер-
периферических лимфоидных органах, но не в
мии (32°C) в мышиных фибробластах индуциро-
селезенке [38, 39], нейтрофилы прикрепляются к
валась экспрессия CIRBP и замедлялся рост кле-
стенкам кровеносных сосудов в легких [40, 41].
ток. Задержка роста клеток при гипотермии ча-
Отношение (G2+М)/S) является характеристи-
стично отменялась при подавлении индукции
кой пролиферирующей клеточной популяции и
CIRBP антисмысловыми олигодезоксинуклеоти-
не зависит от возможного изменения содержания
дами. Сверхэкспрессия CIRBP вызывала замед-
в костном мозге зрелых или покоящихся клеток
ление роста при физиологической температуре с
(фаза G0). Увеличение данного отношения в со-
накоплением клеток в G1-фазе. При температуре
стоянии оцепенения свидетельствует о негатив-
25°С индукция CIRBP снижалась, а при 15°С - не
ной регуляции клеточного цикла и позволяет го-
наблюдалась [16, 44]. Эти данные также подтвер-
ворить о некотором накоплении делящихся кле-
ждают, что наиболее активно адаптивные про-
ток у спящих сусликов также и в фазе G2 (рис. 1),
цессы в клеточных популяциях развиваются при
несмотря на отсутствие разницы в доле клеток в
температурах не ниже 25°С. Количество тран-
фазе (G2+М) для общей популяции.
скриптов гена CIRBP в костном мозге тринадца-
типолосных сусликов в сезон гибернации было
Неблагоприятные условия приводят к задерж-
увеличено по сравнению с летним контролем в 1.4
ке клеточного цикла в так называемых контроль-
и 2.3 раза у межбаутных активных (37°С) и спя-
ных точках (checkpoints) - переходах G1/S и
щих (менее 10°С) животных соответственно [12].
Однако отсутствуют данные об экспрессии этого
G2/М [20]. Для клеточных культур млекопитаю-
белка в переходные периоды при оптимальной
щих, растущих при субфизиологических темпе-
для этого температуре тела около 30°С.
ратурах, характерно накопление клеток преиму-
щественно в фазе G1, так как переход G1/S наибо-
Как мы видим, в костном мозге в интервале
температур 25-20°С параметры клеточного цикла
лее чувствителен к гипотермии и его задержка
(G0+G1)-, S-, (G2+М)-фазы, отношение
происходит в интервале температур 33-25°С, ко-
торый разные авторы определяют как мягкую ли-
(G2+М)/S), уже соответствуют физиологическо-
бо умеренную гипотермию [15, 16, 18, 22]. К за-
му состоянию оцепенения (рис. 1). Учитывая
держке клеточного цикла приводит индукция
инерционность клеточного цикла, это свидетель-
белков p53 и p21. Стабилизация и активация
ствует о развитии адаптивных процессов тормо-
транскрипционного фактора р53 при генотокси-
жения (негативной регуляции) клеточного цикла
ческом и негенотоксическом клеточном стрессе
заранее, в интервале мягкой/умеренной гипотер-
приводит, в частности, к экспрессии белков-ин-
мии и, возможно, до начала падения температуры
гибиторов циклинзависимых киназ семейства
тела.
р21 (p21, p27 и p57) и задержке клеточного цикла
Изменения в подгруппе 3в (20-15°С) - вто-
в контрольной точке G1/S [21], и в ряде случаев,
ричное падение доли клеток в G1 фазе (достовер-
особенно при генотоксическом стрессе, - к апо-
ное, в том числе, по отношению к подгруппе 3б),
птозу. Холодовой стресс приводит к увеличению
рост в (G2+М) фазах, тенденция к увеличению
содержания р53 и р21 (р27) [23, 42] в клеточных
S-фазы - могут быть связаны как с продвижени-
культурах и задержке клеточного цикла, однако
ем по клеточному циклу с задержкой в контроль-
апоптоз при мягкой/умеренной гипотермии в
ной точке G2/М, так и с возможным временным
большинстве случаев ингибируется [15, 24, 43].
снижением содержания в костном мозге зрелых
Дефицит р53 может предотвращать накопление
клеток (фаза G0) в этот период. Ранее при входе в
клеток в G1-фазе при гипотермии [23]. В костном
спячку в этом же интервале температур мы на-
мозге тринадцатиполосных сусликов в сезон ги-
блюдали временное снижение содержания ядер-
бернации в семь раз увеличено количество тран-
ных клеток в селезенке сусликов [45].
скриптов гена-ингибитора циклинзависимой ки-
назы 1А CDKN1A (p21, Cip1); в состоянии оцепе-
ОДК - быстро обменивающийся, короткожи-
нения также была снижена экспрессия генов трех
вущий и динамично регулируемый фермент с пе-
убиквитинлигаз (TOPORS, UBE2L6, RFWD3),
риодом полужизни (t1/2) в нормальных тканях
которые используют р53 в качестве субстрата, что
10-30 мин [27]. Регуляция ОДК осуществляется
БИОФИЗИКА том 68
№ 5
2023
970
АКСЁНОВА и др.
на уровне транскрипции, стабилизации мРНК,
скорости адаптивные процессы индуцируются в
трансляции, деградации фермента, индукции
течение короткого времени. Крысы помещались
специфичных белков - негативных регуляторов
в закрытый сосуд на три-три с половиной часа
семейства антизимов (AZ), ингибитора антизима
при температуре 1-2°С, причем их вход в состоя-
(AZI) - и зависит от типа клеток, тканей, харак-
ние гипобиоза (с Тт 15-18°С) происходил за еще
тера воздействия [28, 46, 47]. Регуляция экспрес-
более короткое время, по мере нарастания гипо-
сии ОДК и других ферментов метаболизма поли-
ксии и гиперкапнии. За это время активность
аминов в значительной степени осуществляется
ОДК падала до 20% от контроля в тимусе, до 24%
на посттранскрипционном уровне [46]. Исследо-
в селезенке [25] и до 6% - в костном мозге [32],
вание транскриптома костного мозга тринадца-
при отсутствии сдвигов в распределении тимоци-
типолосного суслика [12] не выявило различий в
тов и миелокариоцитов по фазам клеточного
количестве мРНК орнитиндекарбоксилазы
цикла [25, 32]. После возвращения к стандартным
(транскрипт гена ODC1) у торпидных и межбаут-
условиям животные выходят из состояния гипо-
ных активных животных. Также не было разли-
биоза за два-три часа, однако наблюдаются эф-
чий в количестве мРНК основного белка - нега-
фекты последействия на клеточном и биохимиче-
тивного регулятора орнитиндекарбоксилазы ан-
ском уровне вследствие запущенных ранее про-
тизима 1 и минорного антизима 2 (транскрипты
цессов. Через
24 и
48 ч после окончания
генов OAZ1 и OAZ2 соответственно) ([12], Suppl.
охлаждения у крыс наблюдалось накопление ти-
fig. 1). Каталитически активным является гомо-
моцитов в фазе G1 со снижением доли S-фазы, и
димер продуктов гена ODC1. Связываясь с моно-
только через 72 ч происходило возвращение к
мерами ОДК, антизим разрушает активный реак-
контрольным значениям [25]. Клетки костного
ционный центр фермента и способствуют их
мозга крыс демонстрировали устойчивость к по-
быстрой деградации 26S протеосомой по убикви-
следействию гипобиоза, через 24 ч после оконча-
тин-независимому пути [46]. Мы можем пола-
ния охлаждения параметры клеточного цикла не
гать, что регуляция активности ОДК (включая ре-
отличались от контроля [32]. Активность ОДК в
гуляцию экспрессии антизимов) в костном мозге
тимусе и костном мозге полностью восстанавли-
сусликов U. undulatus в ходе баутов спячки также
валась через 48 часов [25, 32].
осуществляется на посттранскрипционном
уровне.
Поскольку в данном исследовании клетки
костного мозга сусликов были выделены из пле-
Адаптация на клеточном уровне включена в
чевых костей передних конечностей, а у крыс из
адаптивные реакции на уровне систем органов и
бедренных костей, в планируемых далее экспери-
целого организма. Ранее мы показали, что при
ментах любопытным представляется сравнение
входе в спячку активность ОДК селезенки сусли-
параметров клеточного цикла костного мозга,
ков и параметры, связанные с накоплением в се-
выделенного также и из бедренных костей сусли-
лезенке эритроцитов (масса, содержание общего
ков. Интерес в проведении таких исследований
белка, гемоглобина), принимают значения, ха-
связан не только с тем, что бедренные кости явля-
рактерные для торпора, в это же время, когда Тт
ются одним из мест наибольшего сосредоточения
падает ниже границы мягкой/умеренной гипо-
красного костного мозга, но и главным образом с
термии до 25-20°С [45]. Таким образом, у входя-
тем, что из-за особенностей кровотока разность
щих в спячку сусликов в органах системы крови -
температур между передней и задней половиной
костном мозге и селезенке - параметры, относя-
тела в максимальной точке разогрева у гибернан-
щихся к биохимическим (активность ОДК), фи-
тов достигает 14-15°С; при отогреве охлажденных
зиологическим (депонирование эритроцитов в
крыс разности температур не наблюдается [48-
селезенке) и клеточным (параметры клеточного
50].
цикла) процессам, имеющим разную скорость
Механизмы задержки клеточного цикла при
регуляции, скоординировано приводятся к зна-
гипотермии и дефиците полиаминов сходны [23,
чениям, характерным для торпора, в один и тот
30, 31, 42], однако действие ингибиторов синтеза
же период. Регулирующие торпор сигналы для
полиаминов приводит к изменениям параметров
этих процессов, по-видимому, индуцируются в
клеточного цикла более чем через сутки [31]. При
разное время заранее, и поэтому, в том числе, раз-
гипобиозе крыс истощение полиаминов может
витие торпора не является стремительным, одна-
вносить вклад в задержку клеточного цикла тимо-
ко обеспечивается оптимальная защита органов,
цитов, так как снижение и восстановление доли
тканей и клеток при прохождении баутов спячки.
клеток в S-фазе на сутки отстает от соответствую-
Разница в динамике регуляции активности
щих изменений активности ОДК [25]. У сусликов
ОДК и клеточного цикла отчетливо проявляется в
падение активности ОДК в костном мозге не сле-
модели искусственного гипобиоза. У крыс при
дует рассматривать причиной задержки вступле-
охлаждении в условиях гипоксии/гиперкапнии
ния клеток в S-фазу, так как эти эффекты наблю-
быстро развивается гипобиоз, и различные по
даются в одном интервале времени при входе в
БИОФИЗИКА том 68
№ 5
2023
ПАРАМЕТРЫ КЛЕТОЧНОГО ЦИКЛА
971
спячку. При рассмотрении адаптивного характе-
6. M. S. Vinogradova, Comp. Biochem. Physiol. A, 91
ра изменений активности ОДК костного мозга,
(2), 235 (1988).
то, что она не включена в негативную регуляцию
7. I. I. Kruman, E. N. Ilyasova, S. A. Rudchenko, and Z.
клеточного цикла при входе сусликов в спячку,
S. Khurkhulu, Comp. Biochem. Physiol. А, 90 (2), 233
может объясняться необходимостью полностью
(1988).
использовать для синтеза полиаминов короткий
8. В. М. Юнкер и Г. В. Алексеева, Эволюц. биохимия
период эутермии. Снижение активности ОДК
и физиология, № 2, 193 (1974).
может играть роль в клеточной адаптации при вы-
9. E. W. Carlier, J. Anat. Physiol., 27 (Pt 3), nil9, 354
ходе из спячки. Активность фермента не растет до
(1893).
достижения животными Тт 30°С (рис. 3). Низкий
10. Г. А, Клевезаль и А. И. Ануфриев, Зоологич. журн.,
уровень ОДК при пробуждении животных спо-
92 (4), 481 (2013).
собствует предупреждению преждевременной
11. H. R. Bouma, A. M. Strijkstra, A. S. Boerema, et al.,
стимуляции пролиферации клеток в неблагопри-
Vet. Immunol. Immunopathol., 136 (3-4), 319 (2010).
ятных условиях при быстром росте температуры и
12. S. T. Cooper, S. S. Sell, M. Fahrenkrog, et.al., Physiol.
оксигенации, что может приводить к апоптозу.
Genomics 48 (7), 513 (2016).
Культивируемые клетки, получившие поврежде-
13. Т. М. Шивачева и А. И. Хаджиолов, Арх. анат. ги-
ния в условиях гипотермии, подвергаются апо-
стол. эмбриол., 92 (5), 48 (1987).
птозу после возвращения к нормотермии [15-19].
14. T. M. Shivatcheva and A. I. Hadjioloff, Dev. Comp.
С другой стороны, было показано [51-53], что
Immunol., 11 (4), 791 (1987).
уменьшение внутриклеточного пула полиаминов
15. M. B. Al-Fageeh and C. M. Smales, Biochem. J., 397
при ингибировании ОДК, наряду с задержкой
(2), 247 (2006).
клеточного роста, может вызывать индукцию ан-
16. J. Fujita, J. Mol. Microbiol. Biotechnol., 1 (2), 243
тиапоптозных факторов и защищать клетки от
(1999).
апоптоза при повреждающих воздействиях.
17. A. Roobol, M. J. Carden, R. J. Newsam, and
В целом, приведенные в работе данные укла-
C. M. Smales, FEBS J., 276 (1), 286 (2009).
дываются в концепцию, что устойчивость и за-
18. T. Neutelings, C. A. Lambert, B. V. Nusgens, et al.,
благовременную подготовку пролиферирующих
PLoS One, 8 (7), e69687 (2013).
тканей гибернантов к прохождению периодов ги-
19. А. К. Гулевский, Ю. С. Ахатова и И. И. Щеняв-
потермии во многом обеспечивает координация
ский, Probl. Cryobiol. Cryomed., 27 (2), 97 (2017).
системных адаптивных реакций на клеточном и
20. L. Hartwell, in Cell Cycle Control, Ed. by C. Hutchison
организменном уровне.
and D. M. Glover, (Oxford University Press, 1995),
pp. 1-15.
21. C. W. Anderson, E. Appella, R. Bradshaw, and E. Den-
КОНФЛИКТ ИНТЕРЕСОВ
nis, in Regulation in organelle and cell compartment sig-
Авторы заявляют об отсутствии конфликта
naling (New York. Acad. Press, 2011), pp. 235-254.
интересов.
22. C. L. Rieder and R. W. Cole, Cell Cycle, 1 (3), 169
(2002).
23. Z. Matijasevic, J. E. Snyder, and D. B. Ludlum, Oncol.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Res., 10, 605 (1998).
Все процедуры с животными проводили в со-
24. A. Moore, J. Mercer, G. Dutina, et al., Cytotechnolo-
ответствии с требованиями Институтской комис-
gy, 23, 47 (1997).
сии по этике и Европейской конвенции по защи-
25. Г. Е. Аксенова, О. С. Логвинович, Л. А. Фиалков-
те позвоночных животных, используемых для
ская и др., Биохимия, 75 (9), 1257 (2010).
экспериментальных и других научных целей (Eu-
26. H. M. Wallace, A. V. Fraser, and A. Hughes, Biochem.
ropean
Communities
Council
Directive
J., 376 (1), 1 (2003).
(86/609/EEC)).
27. Н. К. Бердинских, С. П. Залеток, Полиамины и опу-
холевый рост (Наук. Думка, Киев, 1985).
28. A. E. Pegg, J. Biol. Chem. 281 (21), 14529 (2006).
СПИСОК ЛИТЕРАТУРЫ
29. T. Thomas, T. J. Thomas, Cell. Mol. Life Sci., 58 (2),
1. H. V. Carey, M. T. Andrews, and S. L. Martin, Physiol.
244 (2001).
Rev., 83 (4), 1153 (2003).
30. R. M. Ray, B. J. Zimmerman, S. A. McCormack, et al.,
2. F. Geiser, Annu. Rev. Physiol., 66, 239 (2004).
Am. J. Physiol., 276 (3), C684 (1999).
3. Q. Guo, X. Mi, X. Sun et al., Sci. Rep., 7 (1), 10509
31. D. L. Kramer, B.-D. Chang, Y. Chen, et al., Cancer
(2017).
Res., 61 (21), 7754 (2001).
4. Ø. Tøien, K. L. Drew, M. L. Chao, and M. E. Rice,
32. I. K. Kolomiytseva, L. N. Markevich, N. I. Perepelki-
Am. J. Physiol., 281 (2), R572 (2001).
na, et al., in Hypothermia: prevention, recognition and
5. T. R. Jinka, Ø. Tøien, and K. L. Drew, J. Neurosci., 31
treatment, Ed. by J. I.V. Delgado and V. G. F. Garza
(30), 10752 (2011).
(Nova Sci. Publ., N.Y., 2012), pp.1-42.
БИОФИЗИКА том 68
№ 5
2023
972
АКСЁНОВА и др.
33. V. N. Afanasyev, B. A. Korol, N. P. Matylevich, et al.,
44. 44. H. Nishiyama, K. Itoh, Y. Kaneko, et al., J. Cell.
Cytometry, 14 (6), 603 (1993).
Biol., 137 (4), 899 (1997).
34. J. Jänne, and H. G. Williams-Ashman, J. Biol. Chem.,
45. Г. Е. Аксенова, О. С. Логвинович, Д. А. Игнатьев и
246 (6), 1725 (1971).
И. К. Коломийцева, Биофизика, 63 (2), 311 (2018).
35. L. V. Slozhenikina, L. A. Fialkovskaya, and I. K. Kolo-
46. S. I. Hayashi and Y. Murakami, Biochem. J., 306 (1), 1
miytseva, Int. J. Radiat. Biol., 75 (2), 193 (1999).
(1995).
36. Г. И. Козинец, В. М. Погорелов, В.М. Котельни-
47. U. Mangold and E. Leberer, Biochem. J., 385 (1), 21
ков и др., Лаб. дело, № 7, 3 (1988).
(2005).
37. Д. А. Шмаров, Клин. Лаб. диагн., № 5, 40 (1993).
48. G. S. Travlos, Toxicol. Pathol., 34 (5), 548 (2006).
38. H. R. Bouma, F. G. M. Kroese, J. W. Kok, et al., Proc.
49. R. W. Bullard and G. E. Funkhouser, Am. J. Physiol.,
Natl. Acad. Sci. USA, 108 (5), 2052 (2011).
203 (2), 266 (1962).
39. C. C. Kurtz and H. V. Carey, Dev. Comp. Immunol.,
50. Н. М. Захарова, Фундаментальные исследования,
31 (4), 415 (2007).
6, 1401 (2014).
40. M. Bohr, A. R. Brooks, and C. C. Kurtz, Dev. Comp.
Immunol., 47 (2), 178 (2014).
51. H. M. Zhang, J. N. Rao, X. Guo, et al., J. Biol. Chem.,
41. H. R. Bouma, G. J. Dugbartey, A. S. Boerema, et al.,
279, 22539 (2004).
J. Leukoc. Biol., 94 (3), 431 (2013).
52. S. Bhattacharya, R. M. Ray, and L. R. Johnson, Bio-
42. T. Ohnishi, X. Wang, K. Ohnishi, and A. Takahashi,
chem J., 392, 335 (2005).
Oncogene, 16 (11), 1507 (1998).
53. P. Kucharewska, J. E. Welch, K. J. Svensson, and
43. T. Sakurai, K. Itoh, Y. Liu, et al., Exp. Cell. Res., 309
M. Belting, Biochem. Biophys. Res. Commun., 380
(2), 264 (2005).
(2), 413 (2009).
Cell Cycle Parameters and Ornithine Decarboxylase Activity in the Red Bone Marrow
of Hibernating Ground Squirrels Urocitellus undulatus
G.E. Aksyonova*, O.S. Logvinovich**, V.N. Afanasyev*, and K.I. Lizorkina*
*Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Gomel State Medical University, ul. Lange 5, Gomel, 246000, Belarus
During the hibernation season, the values for the parameters of the cell cycle of red bone marrow cells in the
hibernating ground squirrels Urocitellus undulatus, when they return to an active-like state between periods of
torpor and interbout arousal, do not differ from those observed in summer-active animals. In animals that
enter a state of torpor, the cumulative percentage of cells in the resting phase (G0 phase) and pre-synthesis
phase (G1 phase) increased from 71.8 to 76.0%, the percentage of cells in the synthesis phase (S phase) de-
creased from 19.3 to 15.3% compared to those animals that return to an active-like state between periods of
torpor and interbout arousal. The cumulative percentage of cells in the post DNA synthesis phase (G2 phase)
and mitosis (M) does not change, but (G2 + M)/S ratio increases. When animals enter a state of torpor,
changes in parameter values are observed when the animal’s body temperature drops below 25°C, this effect
refers to a system whose thermal relaxation time is a nonmonotonic function of the initial temperature. The
activity of the key enzyme of polyamine synthesis ornithine decarboxylase, a marker of cell activation and
proliferation during interbout arousal does not significantly differ from that observed in summer-active ani-
mals; the enzymatic activity decreases sharply, when animals decrease their body temperature below 25°C
and enter a state of torpor, and this activity remains at a low level during hibernation and arousal until body
temperature reaches 30°C. The role of changes in the parameter values associated with proliferative activity
in adaptation of hematopoietic tissue during hibernation of the Yakutian ground squirrel is discussed.
Keywords: hibernation, bone marrow, cell cycle, proliferation, ornithine decarboxylase
БИОФИЗИКА том 68
№ 5
2023