БИОФИЗИКА, 2023, том 68, № 5, с. 954-963
БИОФИЗИКА КЛЕТКИ
УДК 577.3
КЛЕТОЧНЫЙ ОТВЕТ НА ВОЗДЕЙСТВИЕ ИОНИЗИРУЮЩЕГО
ИЗЛУЧЕНИЯ И СВЕТА В ПРИСУТСТВИИ ФОТОСЕНСИБИЛИЗАТОРА
© 2023 г. С.В. Акулиничев*, **, #, С.И. Глухов*, ***, ##, А.В. Ефременко****,
Д.А. Коконцев*, **, Е.А. Кузнецова***, В.В. Мартынова*,
А.В. Феофанов****, *****, И.А. Яковлев*, **
*Институт ядерных исследований РАН, Физическая ул., 27, Москва, Троицк, 108840, Россия
**Российский научный центр хирургии имени академика Б.В. Петровского,
Абрикосовский пер., 2, Москва, 119991, Россия
***Институт теоретической и экспериментальной биофизики РАН,
Институтская ул., 3, Пущино Московской области, 142290, Россия
****Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН,
ул. Миклухо-Маклая, 16/10, Москва, 117997, Россия
*****Биологический факультет Московского государственного университета имени М.В. Ломоносова,
Ленинские горы, 1/12, Москва, 119234, Россия
#E-mail: akulinic@inr.ru
##E-mail: serglukhovmb@gmail.com
Поступила в редакцию 28.06.2023 г.
После доработки 28.06.2023 г.
Принята к публикации 02.08.2023 г.
Исследовано совместное использование рентгеновского облучения и фотодинамической терапии
на модели клеток аденокарциномы легкого человека А549. Установлено, что синхронное
воздействие двух видов облучения способствует более сильному снижению уровня выживаемости
опухолевых клеток, чем их последовательное применение или каждый вид облучения по
отдельности. Для различных комбинаций двух указанных видов облучения в клетках определены
уровни РНК и экспрессии ряда генов, вовлеченных в контроль клеточного цикла (р21, DINOL),
апоптоз (BAX, PUMA) и репарацию ДНК (PARP1, OGG1, Rad51, Lig4). Наибольший уровень
экспрессии при всех воздействиях наблюдался для гена длинной некодирующей РНК DINOL.
Обнаруженное повышение экспрессии генов BAX и PUMA свидетельствует о развитии апоптоза.
Полученные результаты подтверждают синергизм лучевой и фотодинамической терапии при их
синхронном применении.
Ключевые слова: рентгеновское излучение, производные хлорина, фотодинамическая терапия, клетки
А549.
DOI: 10.31857/S0006302923050162, EDN: PHMLHS
Действие ФДТ основано на образовании в опухо-
Лучевая терапия (ЛТ) опухолей является стан-
левых клетках, содержащих фотосенсибилизатор
дартным методом лечения многих видов онколо-
(ФС) и облучаемых светом заданной длины вол-
гических заболеваний. Однако часто ее эффек-
ны, активных форм кислорода с высокой цито-
тивность ограничена из-за радиорезистентности
токсичностью (синглетный кислород и др.) и ма-
раковых клеток и разной оксигенации участков
лой диффузией, что снижает поражение прилега-
солидных опухолей, а также из-за ее неизбира-
ющих здоровых тканей. В дополнение к высокой
тельного воздействия на опухолевые и нормаль-
конформности, обеспечиваемой концентрацией
ные клетки. В качестве альтернативы или допол-
ФС только в опухолевых клетках, ФДТ характе-
нения к местной радиотерапии большое значение
ризуется минимальной приобретенной рези-
приобрела фотодинамическая терапия (ФДТ) [1].
стентностью [2]. Более широкому клиническому
применению ФДТ, особенно для терапии глубо-
Сокращения: ЛТ - лучевая терапия, ФДТ - фотодинамиче- колежащих опухолей, препятствуют проблемы с
ская терапия, ФС - фотосенсибилизатор, ПЦР - полиме-
разная цепная реакция, РТА - рентгеновский терапевти-
доставкой света через оптически непрозрачные
ческий аппарат.
биологические ткани. Кроме того, эффектив-
954
КЛЕТОЧНЫЙ ОТВЕТ НА ВОЗДЕЙСТВИЕ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ
955
ность самостоятельной ФДТ ограничивается ал-
генов репарации ДНК в разных механизмах репа-
лергическими и другими нежелательными реак-
рации такой выбор позволяет оценить вклад каж-
циями организма пациента на введенный ФС, а
дого механизма репарации ДНК в ликвидацию
слишком мощное световое воздействие может
радиационных повреждений при оценке влияния
приводить к перегреву нормальных тканей. Пред-
сочетания ЛТ и ФДТ. Увеличение экспрессии ге-
лагаемые методы доставки света в ткани, напри-
нов репарации происходит, как правило, на тре-
мер, с помощью использования миниатюрных
тий-шестой час после облучения [12], что может
имплантируемых излучателей [3], пока являются
быть обнаружено методом количественной поли-
экспериментальными и находятся в стадии разра-
меразной цепной реакции (ПЦР). Продукт гена
ботки. Поэтому в последние годы делались по-
Lig4 является эксклюзивным для репарации двух-
пытки объединить преимущества ФДТ и ЛТ для
цепочечных разрывов ДНК по каноническому
повышения эффективности лечения новообразо-
механизму негомологичного соединения концов
ваний [4]. В ряде работ обнаружено, что комбина-
(c-NHEJ) - главному механизму репарации ДНК
ция ФДТ и ЛТ позволяет снизить дозу ионизиру-
в соматических клетках высших эукариот, нахо-
ющего излучения или световой поток и/или кон-
дящихся в фазах G1/G0 [13]. Продукт гена Rad51
центрацию ФС для достижения того же
является уникальным для репарации двухцепо-
клинического эффекта, что и при самостоятель-
чечных разрывов ДНК, направляемой по меха-
ной ЛТ или ФДТ [5].
низму гомологичной рекомбинации (HRR) -
наиболее точному механизму репарации ДНК,
В настоящее время в качестве ФС используют-
более часто реализуемому в фазах S-G2-M [14] и
ся соединения различных классов, например,
активно транскрибирующихся участках эухрома-
производные бензопорфирина, цианиновые кра-
тина [15]. Продукт гена Ogg1 отвечает за удаление
сители, хлорины и другие [5, 7-9]. Особый инте-
из ДНК 8-оксогуанина, одного из самых распро-
рес представляют ФС на основе производных
страненных типов окисления оснований ДНК.
хлорофилла - хлорины [10]. В клинической прак-
Продукт гена Parp1, хроматиновый белок, являет-
тике используются такие препараты на основе
ся участником координации множества репара-
хлорина е6, как радахлорин, фотолон и фотодита-
ционных процессов одноцепочечных разрывов
зин. Синтез новых производных хлорина е6 и их
ДНК, эксцизионной репарации нуклеотидов, а
биологическое исследование продолжаются до
также низкоспецифической репарации ДНК по
сих пор. Одним из подобных соединений являет-
механизмам альтернативного или опосредован-
ся
32-(4-метоксифенил)-152-аспартилхлорин e6
ного микрогомологией соединения концов (alt-
(производное хлорина, названное DYSP-C34),
NHEJ и MHEJ соответственно), с-NHEJ и HRR
который обладает такими полезными биологиче-
[16].
скими свойствами как улучшенная раствори-
мость в воде и клеточная проницаемость, таргет-
Анализ активации клеточной гибели в ответ на
ное накопление в опухолях и повышенная фото-
повреждения ДНК был сосредоточен вокруг сиг-
токсичность при облучении низкой световой
нального каскада, опосредованного участием ге-
дозой. Кроме того, было показано, что DYSP-C34
на p53. Была проведена оценка активации следу-
может эффективно накапливаться в подкожной
ющих подконтрольных p53-генов: p21/CDKN1A,
ксенотрансплантатной опухоли мыши и демон-
DINOL, PUMA и BAX. Ген p21/CDKN1A кодирует
стрировать существенную регрессию опухоли по-
ингибитор циклинзависимых киназ, рост его
сле облучения крайне низкой плотностью света
концентрации приводит к остановке клеточного
[11].
цикла в ответ на многие виды стресса, в том числе
и на повреждение ДНК. Продукт гена DINOL,
Настоящая работа посвящена исследованию
длинная некодирующая РНК, является важней-
возможной синергии ФДТ и ЛТ на примере мо-
шим компонентом положительной обратной свя-
нослойной клеточной культуры рака легкого
зи в p53-зависимой активации процессов поддер-
A549, недорогой и доступной модели новообразо-
жания целостности генома. Это реализуется, во-
ваний человека, и ФС на основе аминоалкила-
первых, в препятствии транскриптом DINOL
мидного производного хлорина е6.
протеолитической деградации p53 при участии
В работе оценивали клеточный ответ на сов-
MDM-2 (убиквитинлигазы), во-вторых, в усиле-
местное использование рентгеновского излуче-
нии связывания p53 с подконтрольными ему про-
ния и фотодинамического воздействия по следу-
моторами генов p21/CDKN1A, GADD45A и многих
ющим критериям: выживаемость клеток А549 и
других генов [17]. Для выявления опосредован-
уровень экспрессии генов, вовлеченных в ответ
ной повреждением ДНК апоптотической гибели
на генотоксический стресс, начиная от распозна-
клеток была оценена экспрессия проапоптотиче-
вания и ликвидации повреждений ДНК до кле-
ских генов, активируемых генотоксическим
точной гибели. Среди генов репарации ДНК бы-
стрессом, генов PUMA (p53-upregulated modulator
ли выбраны для анализа гены Lig4, Rad51, Parp1,
of apoptosis) и BAX. Белковым продуктом гена PU-
Ogg1. С учетом уникальности и незаменимости
MA является ингибитор антиапоптотического
БИОФИЗИКА том 68
№ 5
2023
956
АКУЛИНИЧЕВ и др.
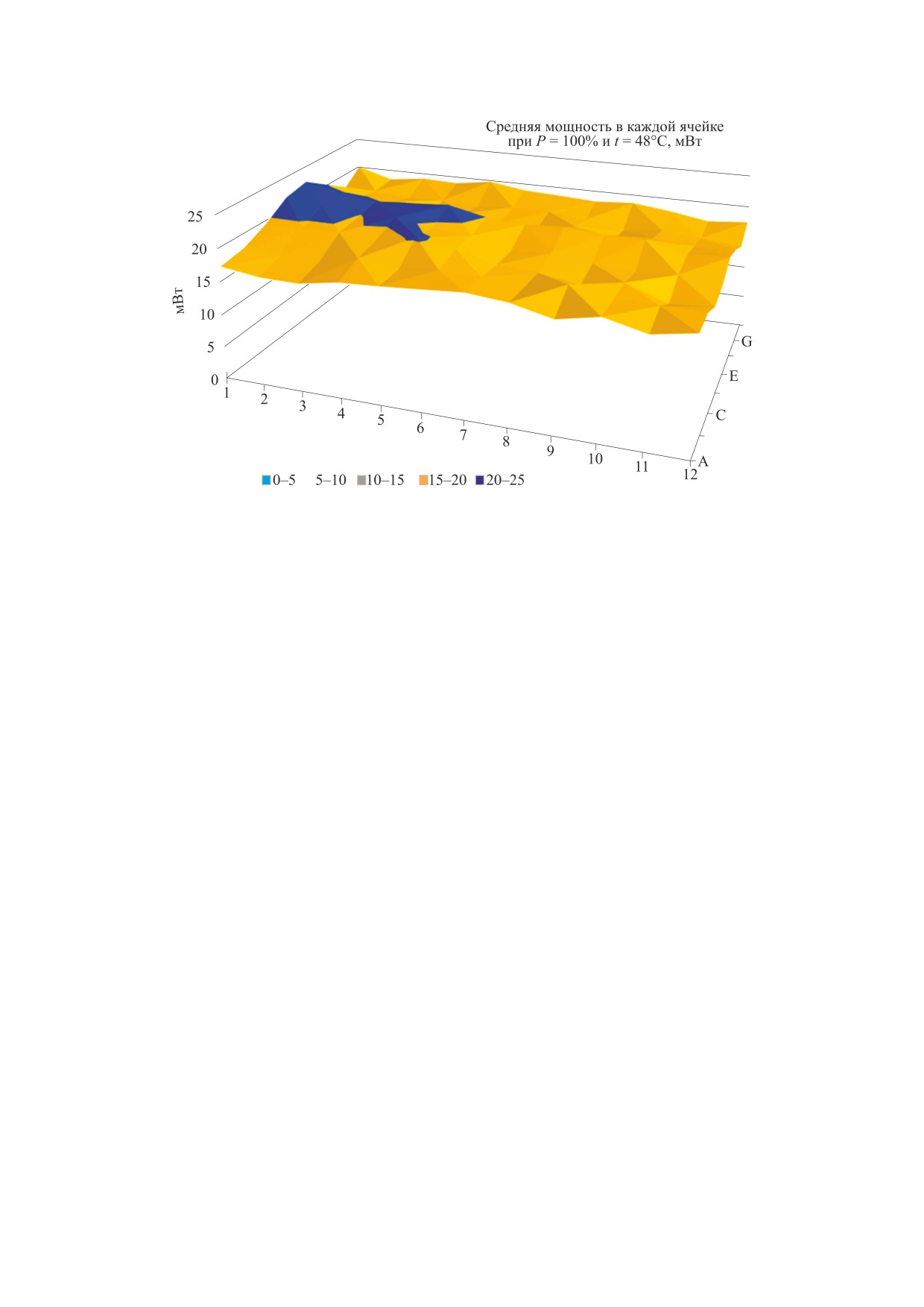
Рис. 1. Распределение мощности света по 96 лункам планшета на длине волны 663 нм.
белка BCL-2. Белковым продуктом гена BAX яв-
MULTIDOS (PTW, Германия) и радиохромной
ляется эффекторный белок апоптоза, активация
пленки EBT2 и EBT-XD (Gafhromic, США). Дозу
которого реализуется в образовании пор во внеш-
в выбранном режиме сначала измеряли с иониза-
ней мембране митохондрий, сопровождаемым
ционной камерой в твердотельном фантоме, си-
выходом в цитоплазму цитохрома С, а также в ак-
мулирующем планшет с клетками, а затем - с по-
тивации каспаз и собственно запуске апоптоти-
мощью пленок при их размещении непосред-
ческой гибели
[18]. Для генов p21/CDKN1A,
ственно над и под планшетом или чашкой Петри
DINOL, PUMA, BAX увеличение экспрессии про-
с клетками. При этом значение поглощенной
исходит прямо пропорционально уровню гено-
клетками дозы определяли как среднее между по-
токсического воздействия, что не всегда наблю-
казаниями пленок, расположенных над и под
дается для генов контроля клеточного цикла и
планшетом или чашкой Петри.
апоптоза [19].
Источник излучения света и фотосенсибилиза-
тор. Для исследования фотодинамических эф-
МАТЕРИАЛЫ И МЕТОДЫ
фектов в клеточной культуре, а в дальнейшем и в
живых организмах, разработан и изготовлен све-
Источник ионизирующего излучения. В качестве
товой облучатель, позволяющий подводить свет
источника ионизирующего излучения использо-
строго заданной длины волны к биологическим
ван клинический близкофокусный рентгенотера-
образцам одновременно с рентгеновским или
певтический аппарат РЕНТГЕН-ТА-02 (РТА)
другим ионизирующим излучением. Источник
производства ООО «Севкаврентген-Д» (Россия).
излучения света выполнен на основе 24-х свето-
Максимальное напряжение на трубке этого аппа-
диодов (мощность каждого - 2 Вт) с регулируе-
рата составляет 100 кВ, однако в работе использо-
мой длиной волны в диапазоне 658-665 нм. Для
вали рентгеновское излучение при напряжении
лабораторного 96-луночного планшета плотность
60 кВ, которое ближе к видимому свету по глуби-
не прохождения в тканях. Дозу облучения подби-
мощности света составляла 80 мВт/см2. Измере-
рали путем изменения тока аппарата и длитель-
ния спектра света проводили с использованием
ности облучения так, чтобы время набора дозы
спектрометра ASP-150 («Авеста-Проект», Рос-
рентгеновским излучением и время облучения
сия), а плотность светового потока измеряли с ис-
светом совпадали. Это дает возможность реализо-
пользованием сенсорного прибора на основе тер-
вать полностью синхронное воздействие рентге-
моэлемента S425C (Thorlabs, США). Пример из-
на и света. Дозиметрию ионизирующего излуче-
меренного распределения мощности света по
ния проводили двумя независимыми методами: с
лункам 96-луночного планшета показан на рис. 1.
использованием миниатюрной ионизационной
При обработке результатов использовали лунки с
камеры 34013 (PTW, Германия) с электрометром
отклонением мощности света не более 15%. Дли-
БИОФИЗИКА том 68
№ 5
2023
КЛЕТОЧНЫЙ ОТВЕТ НА ВОЗДЕЙСТВИЕ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ
957
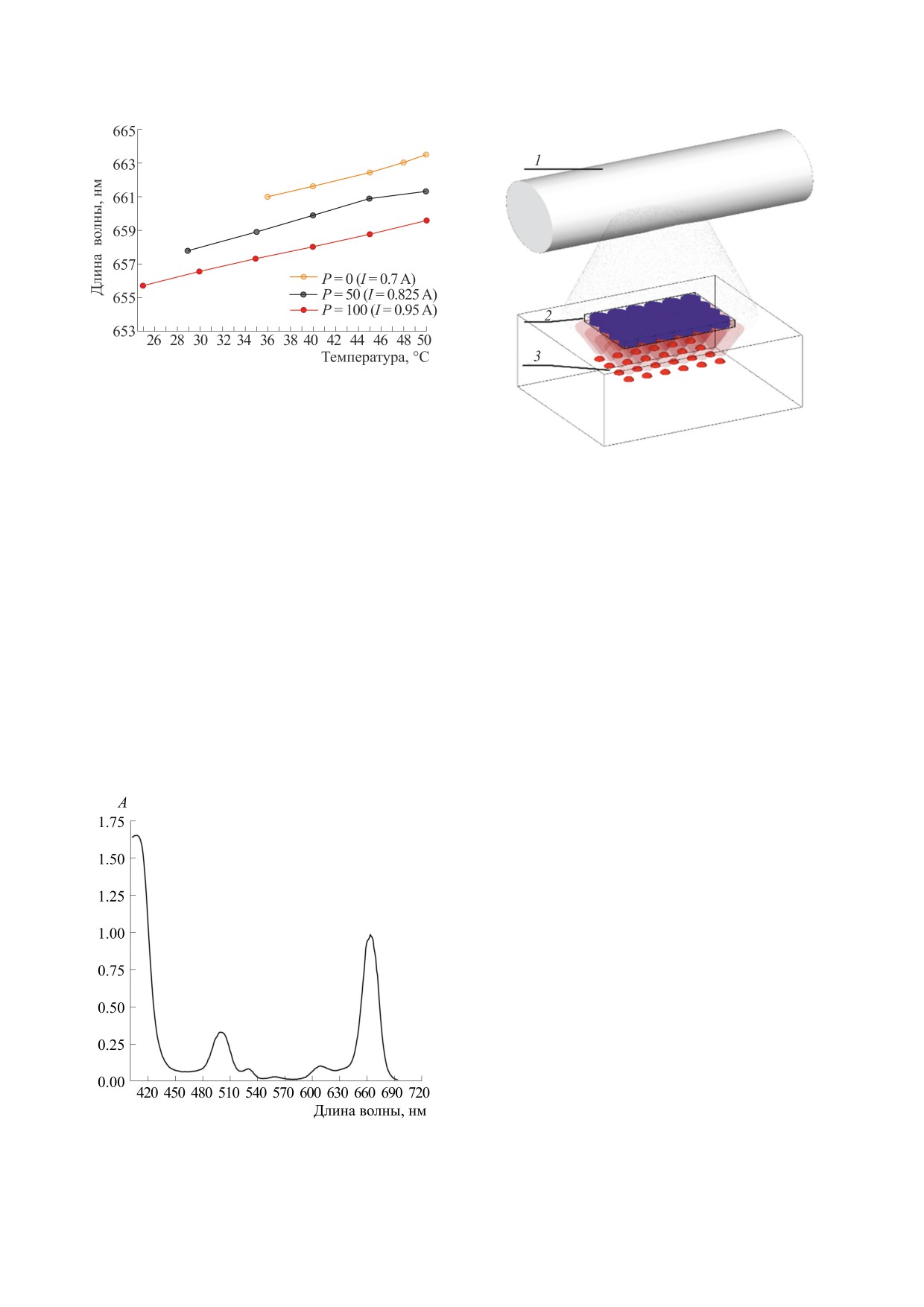
Рис. 2. Зависимость длины волны света от температу-
ры диодов и тока, задаваемого параметром мощности
излучателя P.
на волны светового излучения определяется тем-
Рис. 4. Принципиальная схема установки для сочета-
пературой диодов и подаваемым на них током, за-
ния воздействия ФДТ и РТА на примере облучения 24-
даваемым параметром мощности (Р) излучателя
луночного планшета с клетками: 1 - трубка РТА, 2 -
(рис. 2).
планшет с клетками, 3 - излучатель света.
В качестве ФС был использован раствор ами-
ноалкиламида хлорина е6 (ААЕ6) в 5%-й эмуль-
ность. Аналогичные виды ФС исследовались и в
сии кремофора EL [20-22]. Спектр поглощения в
других работах [10, 23, 24].
1%-й эмульсии раствора кремофора EL (CrEL)
Общая схема эксперимента показана на рис. 4.
представлен на рис. 3. Максимум Q-полосы по-
Воздействие на клетки осуществлялось либо са-
глощения находится на длине волны 663 нм, что
мостоятельно (РТА или ФДТ), либо последова-
соответствует длине волны использованного из-
тельно (РТА → ФДТ или ФДТ → РТА), либо одно-
лучателя при температуре диодов 47-48°С при
временно (РТА+ФДТ). Преимуществом исполь-
максимальной мощности излучателя (рис.
2).
зованного оборудования является возможность
Близкий по свойствам ФС был использован в
синхронного воздействия света и ионизирующе-
предыдущих исследованиях сочетанной терапии
го излучения на клетки или на другой биологиче-
ФДТ и ЛТ [8] и показал свою высокую эффектив-
ский материал. Эксперимент проводили в каньо-
не для рентгеновской терапии, поэтому все
управление излучателями проводилось дистан-
ционно с использованием кабелей длиной около
10 м.
Клеточная линия и условия выращивания кле-
ток. В экспериментах использовали клетки аде-
нокарциномы легкого человека А549 (получены
из ИБХ РАН, Москва). Клетки выращивали в
чашках Петри диаметром 35 мм в концентрации
1.5
× 105 клеток в чашке в среде DMEM
(«ПанЭко», Россия) с добавлением 4 мМ глута-
мина («ПанЭко», Россия), антибиотика (пени-
циллин-стрептомицин, 250 ЕД, «ПанЭко», Рос-
сия) и 10% эмбриональной телячьей сыворотки
(Biosera, Аргентина). Перед посевом культуру
клеток проверяли на количество живых/мертвых
клеток с красителем трипановым синим [25]. Как
правило, количество мертвых клеток в экспери-
ментах не превышало 3%.
Облучение клеток. Клетки А549 облучали в
полной среде (2 мл) в закрытых чашках Петри.
Рис. 3. Спектр поглощения ААЕ6 в 1%-м CrEL.
Воздействие рентгеновскими лучами проводили
БИОФИЗИКА том 68
№ 5
2023
958
АКУЛИНИЧЕВ и др.
в дозе 6 Гр. Воздействие светом в присутствии ФС
акции с интеркалирующим красителем с исполь-
на клетки осуществляли в течение 200 с в дозе
зованием набора RNA BR на флуориметре Qubit
(Thermo Scientific, США).
5 Дж/см2. Предварительно раствор ФС в концен-
трации 0.1 мкМ был приготовлен в полной среде
Обратная транскрипция и количественная поли-
из 1.6 мМ стокового раствора (в 5%-й эмульсии
меразная цепная реакция. Синтез кДНК проводи-
кремофора EL). В чашке Петри с клетками 1 мл
ли с помощью случайного гексамерного прайме-
среды заменяли на свежеприготовленный рас-
ра в реакции обратной транскрипции с фермен-
твор ФС, при этом конечная концентрация ФС
том M-MLV
-RH
(«Biolabmix», Россия) в
составила 0.05 мкМ. После облучения клетки ин-
присутствии ингибитора РНКаз RiboLock (Ther-
кубировали 1-24 ч в стандартных условиях.
mo Scientific, США). ПЦР в реальном времени
проводили с использованием Hot Start Taq DNA
Клоногенный тест. После облучения клетки
polymerase («Biolabmix», Россия) с детекцией про-
культивировали в инкубаторе 1 ч в стандартных
дуктов по накоплению флуоресценции SybrGreen I.
условиях, затем каждую чашку промывали 1 мл
Программа ПЦР: 1×(94°C - 4'45''); 42×(92°C -
фосфатно-солевого буфера, буфер полностью
15'', 60°C - 15'', 72°C - 10” - детекция флуорес-
удаляли и добавляли 0.5 мл 0.25%-го трипсина.
ценции в канале SybrGreen/FAM). Качество реак-
Далее чашки инкубировали 15 мин. Каждую чаш-
ций контролировали по кривым плавления.
ку проверяли под микроскопом на факт полного
Праймеры к целевым генам, подобранные в про-
открепления клеток. Клетки ресуспендировали в
цессе работы, приведены в табл. 1. Относительное
4 мл среды и переносили в пятимиллилитровые
усиление экспрессии на уровне мРНК определя-
пробирки типа Эппендорф, далее центрифугиро-
ли по методу 2-ΔΔCt [26]. В качестве нормировоч-
вали при 1400 g в течение 5 мин. При подсчете
ного гена был взят ген GAPDH.
клеточной суспензии в камере Горяева и провер-
ке на наличие поврежденных клеток с трипано-
Статистический анализ. Анализ статистиче-
вым синим мертвые клетки не были обнаружены.
ской достоверности отличий проводили методом
Клетки высевали в чашки Петри диаметром 35 мм
однофакторного дисперсионного анализа (one-
(SPL Lifesciences, Южная Корея) в концентрации
way ANOVA), расчет p-value достоверности уров-
300 клеток/чашку, в такой же концентрации вы-
ней значимости проводили методом последую-
севали контрольные клетки. Все колонии выра-
щего теста Туки [27].
щивали в течение одной недели после воздей-
ствия, затем проводили их подсчет. Окрашивание
и фиксацию колоний проводили с помощью 57%-
РЕЗУЛЬТАТЫ
го этанола и 0.5%-го бриллиантового зеленого в
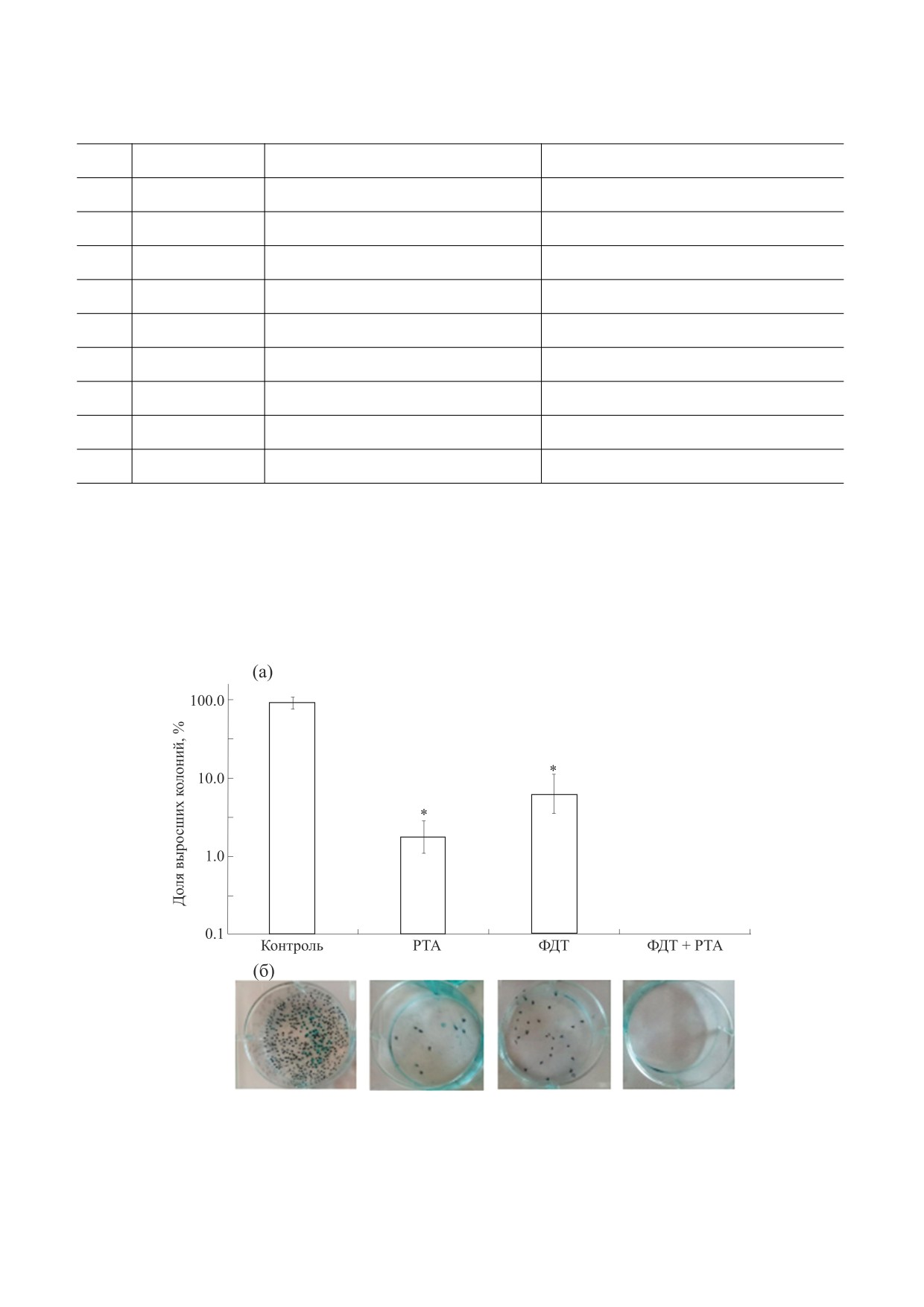
Определяли выживаемость клеток (клоноген-
течение получаса.
ный тест) при отдельном или синхронном воз-
действии ЛТ и ФДТ, эти результаты представле-
Консервация клеток и анализ уровня РНК.
ны на рис. 5. Как видно из рис. 5, выживаемость
Клетки в чашках Петри после облучения подвер-
клеток существенно снижалась при самостоя-
гали консервации в растворе IntactRNA (Евроген,
тельном воздействии рентгеновского или фото-
Россия). Для этого полная клеточная среда
динамического облучения, в то время как при их
(DMEM, 10% эмбриональной телячьей сыворот-
синхронном воздействии образование колоний
ки) заменялась на DMEM без эмбриональной те-
совсем не выявлялось, что говорит о полной гибе-
лячьей сыворотки (согласно рекомендациям про-
ли клеток в данных условиях эксперимента.
изводителя IntactRNA), далее среда удалялась и
заменялась на 1 мл раствора IntactRNA на чашку
Определение концентрации РНК было прове-
Петри. Дальнейшие инкубации проводились по
дено в образцах, полученных в двух разделенных
методике производителя (1 ч при комнатной тем-
по времени на несколько месяцев сеансах облуче-
пературе, 24 ч при +4°С, далее до момента анали-
ния. Во время каждого сеанса были облучены по
за при -20°С). Облученные и необлученные (кон-
два обособленных биологических образца для
трольные) клетки в реагенте IntactRNA хранили
каждого режима. Концентрация РНК была опре-
при -20°С менее 2 месяцев. Перед выделением
делена в равных по объему образцах, взятых из
РНК консервант IntactRNA удалялся, клетки
однотипно засеянных чашек Петри в рамках каж-
промывались от избытка консерванта в фосфат-
дого из сеансов облучения. Результаты показали,
но-солевом буфере. Лизис клеток производили с
что в течение 6-24 ч после фотоиндуцированного
использованием реагента на основе кислого фе-
и лучевого воздействия в клетках А549 происхо-
нола и гуанидина тиоцианата ExtractRNA (Евро-
дит значительное снижение концентрации РНК
ген, Россия). Очистку РНК из фенольного рас-
как при последовательном, так и при синхронном
твора производили с помощью набора Direct-zol
применении ЛТ и ФДТ (рис. 6). При этом кон-
RNA Microprep (Zymo Reseacrh, США), включая
центрация РНК в клетках при последовательном
удаление примесей геномной ДНК в реакции с
воздействии ЛТ и ФДТ выше, чем при синхрон-
ДНКазой I. Концентрацию РНК определяли в ре-
ном облучении в каждом соответствующем вре-
БИОФИЗИКА том 68
№ 5
2023
КЛЕТОЧНЫЙ ОТВЕТ НА ВОЗДЕЙСТВИЕ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ
959
Таблица 1. Праймеры, подобранные к целевым генам
№
Ген
Прямой праймер 5' → 3'
Обратный праймер 5' → 3'
1
BAX
TTCTGACGGCAACTTCAACTG
AATGTCCAGCCCATGATGGTTC
2
DINOL
TGGGAGAGGTGACCTAGTGAG
ACTCTGGCAGGCAAGGATTTAC
3
GAPDH
TTCAACAGCGACACCCACTC
TGGTCCAGGGGTCTTACTCC
4
HPRT1
ATTGTAGCCCTCTGTGTGCTC
TACTTTTATGTCCCCTGTTGACTG
5
LIG4
ACTCCCTGGAACTGTATTGCC
TGTGAGGCAGCCATCAAAGC
6
OGG1
ACTGTATCACCACTGGGGTTC
CAGTGATGCGGGCGATGTTG
7
p21
AGGGGACAGCAGAGGAAGAC
AGAAGATCAGCCGGCGTTTG
8
p53
GTGAGCGCTTCGAGATGTTC
ATGGCGGGAGGTAGACTGAC
9
PARP1
TGTCCCAGGGTCTTCGGATAG
AGACGTATGGCAGTAGTTGGC
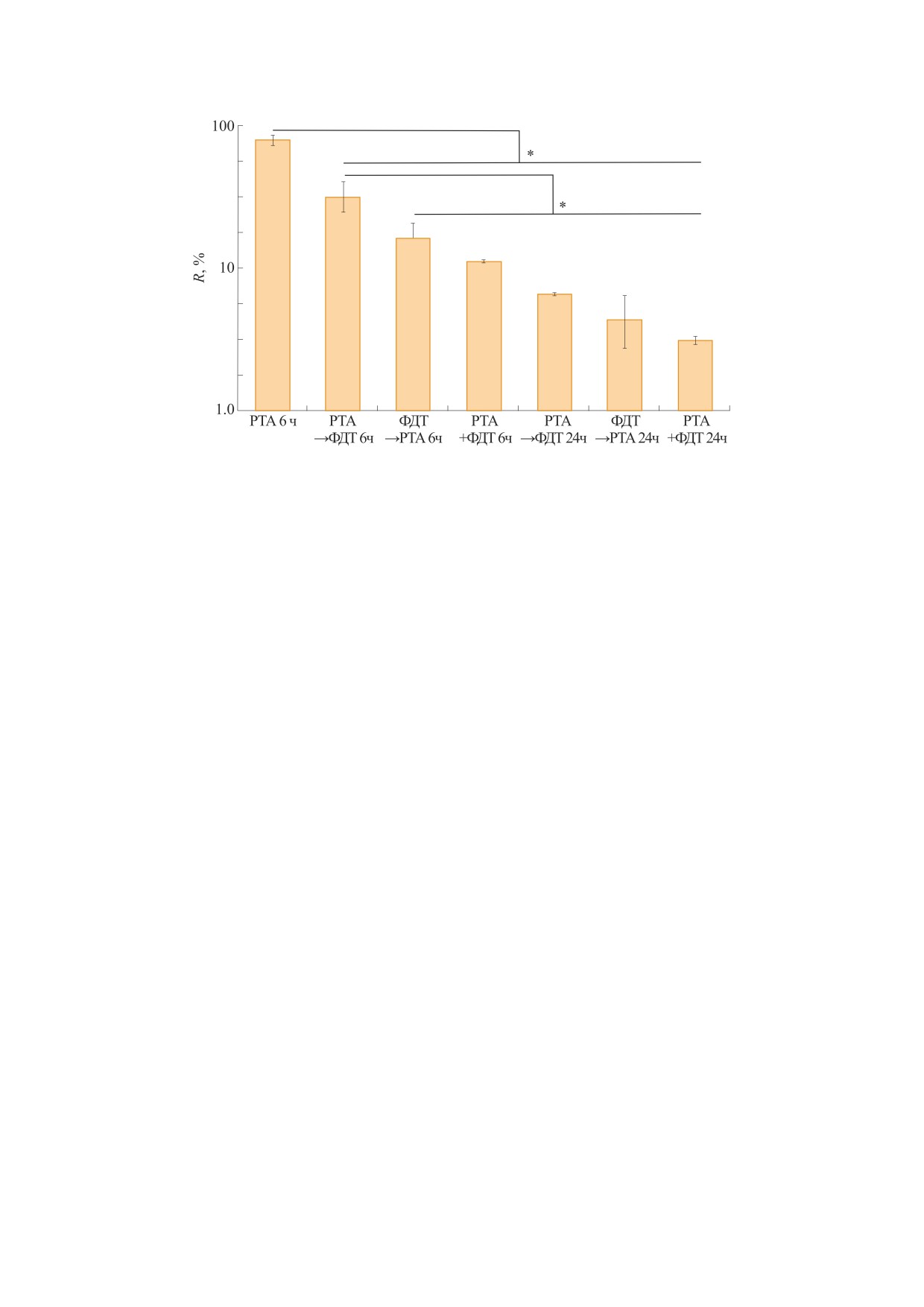
менном периоде. Облучение клеток А549 только с
именно при синхронном воздействии ФДТ и
помощью РТА приводит к снижению РНК на
РТА.
~20%, в то время как синхронное облучение сни-
Анализ генов контроля клеточного цикла и
жает уровень РНК приблизительно в 9 раз. Зна-
апоптоза показал, что после последовательного и
чительное падение определяемой концентрации
синхронного воздействий ФДТ и ЛТ на клетки
РНК говорит о наибольшем поражении РНК
А549 в них наблюдается существенный рост экс-
Рис. 5. Выживаемость (а) и фото чашек Петри с колониями (б) клеток А549 после самостоятельного и синхронного
воздействия рентгеновского излучения и света в присутствии ФС (значения и погрешности на графике представлены
как M ± SD); * - выделены достоверные отличия от контроля, p < 0.05.
БИОФИЗИКА том 68
№ 5
2023
960
АКУЛИНИЧЕВ и др.
Рис. 6. Уровни РНК при самостоятельном (РТА или ФДТ), последовательном (РТА → ФДТ и ФДТ → РТА) и синхронном
(РТА+ФДТ) воздействии рентгеновского излучения и света в присутствии ФС на клетки А549. R - отношение в %
количества РНК для облученных образцов к аналогичным уровням в необлученных образцах (показаны значения и
погрешности в виде M ± SD); * - отмечены достоверные отличия от контроля, p < 0,05.
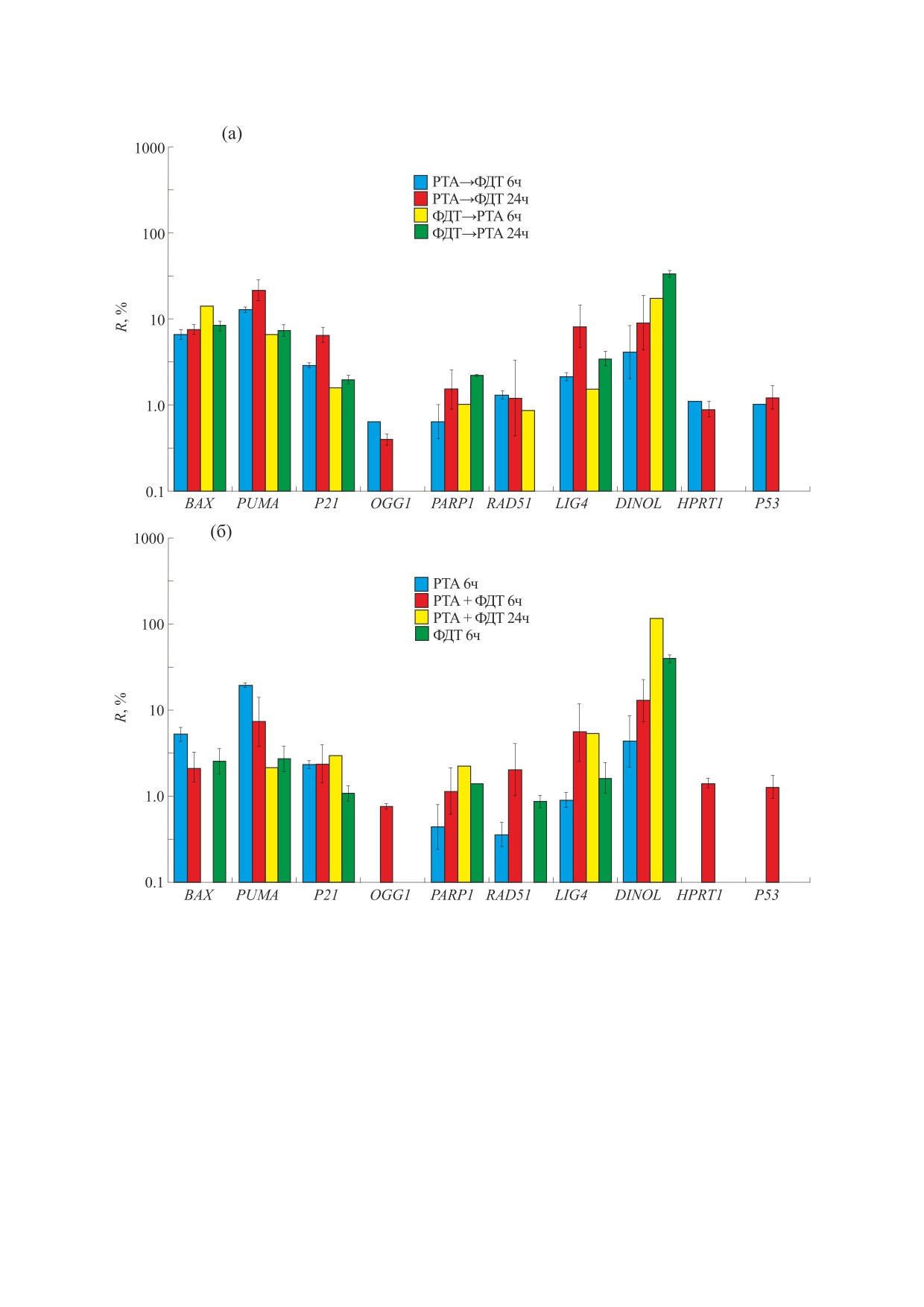
прессии генов p21, DINOL, PUMA, BAX уже к ше-
При последовательном воздействии концен-
стому часу после воздействия, этот рост продол-
трация РНК заметно снижалась по сравнению с
жается до 24 часов (рис. 7). Обнаружено, что для
самостоятельным воздействием, однако ее уро-
гена р53, а также для большинства генов репара-
вень был все равно заметно выше, чем при син-
ции ДНК PARP1, RAD51 и Ogg1 уровень экспрес-
хронном воздействии (рис. 6). Значительная де-
сии при разных режимах облучения практически
градация РНК не позволила провести даже фраг-
не менялся. Наблюдалась некоторая тенденция к
ментарный ПЦР-анализ для трех из четырех
увеличению экспрессии гена RAD51 к 6 ч и PARP1
образцов, полученных через 24 ч после синхрон-
к 24 часам при всех вариантах синхронного воз-
ного воздействия ФДТ и РТА. Избранная схема
действия. Для гена Ogg1, наоборот, наблюдалось
количественной ПЦР требовала наличия целост-
некоторое снижение уровня экспрессии со вре-
ных фрагментов целевой РНК длиной хотя бы в
менем. Экспрессия гена HPRT1 приведена для
300 нуклеотидов (так как был использован слу-
сравнения экспрессии второго нормировочного
чайный гексамерный праймер вместо олиго-дТ в
гена, используемого наряду с GAPDH в исследо-
реакции синтеза кДНК). Дизайн праймеров был
ваниях. Из сопоставления всех результатов экс-
подобран для получения продуктов ПЦР длиной
прессии генов репарации следует, что наиболь-
не более 250 нуклеотидов. Это еще раз свидетель-
шая активация наблюдалась для гена Lig4. Это
ствует об особенно сильном воздействии син-
вполне соответствует тому, что данный ген вовле-
хронного облучения.
чен в наибольшее число процессов репарации по
механизму c-NHEJ в соматических клетках эука-
Как правило, ген p53 не меняет своей экспрес-
риот, находящихся преимущественно в фазах
сии на уровне мРНК, так как в основном его ак-
G1/G0 клеточного цикла, когда этот механизм
тивность регулируется за счет протеолиза, пост-
репарации ДНК имеет доминирующее значение.
трансляционных модификаций, тетрамеризации
и связывания с промоторами подконтрольных ге-
нов [28]. Однако для мишеней белка p53, для ко-
ОБСУЖДЕНИЕ
торых свойственна активация экспрессии в ответ
В работе исследована возможность получения
на генотоксический стресс (CDKN1A, DINOL,
синергического эффекта при воздействии двух
BAX, PUMA), показана существенная активация в
видов облучения, используемых в терапии злока-
ответ на комбинированное воздействие ФДТ и
чественных новообразований, - воздействия све-
РТА. Уменьшение уровня РНК в совокупности с
та в присутствии ФС и ионизирующего (рентге-
ростом экспрессии генов Lig4 и DINOL свиде-
новского) излучения. Облучение проводили в
тельствуют о мощном генотоксическом эффекте
разных режимах - самостоятельно или последо-
примененных воздействий. Известно, что DINOL
вательно ФДТ и РТА и синхронно ФДТ +РТА.
усиливает экспрессию примерно в 100 раз в пер-
БИОФИЗИКА том 68
№ 5
2023
КЛЕТОЧНЫЙ ОТВЕТ НА ВОЗДЕЙСТВИЕ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ
961
Рис. 7. Уровни экспрессии генов BAX, PUMA, p21, Lig4, DINOL, PARP1, Rad51, OGG1, р53 и HPRT в клетках А549 при
самостоятельном, последовательном и синхронном воздействии рентгеновского излучения и света в присутствии ФС.
R - отношение в % уровней экспрессии генов для облученных образцов к аналогичным уровням в необлученных
образцах.
вичных фибробластах человека в ответ на повре-
ня экспрессии DINOL над CDKN1A. Обнаружен-
ждение ДНК, вызванное доксорубицином (гено-
ное значительное повышение экспрессии p21, DI-
токсическим химиотерапевтическим агентом),
NOL и вовлеченных в апоптоз генов BAX и PUMA
достигая пика через 10-24 ч после воздействия
может также свидетельствовать о существенном
[17]. Тем не менее, известный ген-мишень p53
повреждении ДНК облученных клеток и разви-
CDKN1A (p21) в тех же условиях активируется
тии апоптоза под контролем механизма, опосре-
только в 5-10 раз. В наших экспериментах на-
дованного работой p53. Экспрессия DINOL, BAX
блюдалась похожая тенденция опережения уров-
БИОФИЗИКА том 68
№ 5
2023
962
АКУЛИНИЧЕВ и др.
и PUMA также была высокой при воздействии
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
только самостоятельной РТА или ФДТ.
Настоящая работа не содержит описания ка-
Выживаемость клеток существенно снижалась
ких-либо исследований с использованием людей
при воздействии обоих видов облучения в отдель-
и животных в качестве объектов.
ности, а при их синхронном воздействии образо-
вание колоний практически не выявлялось. Это
свидетельствует о существенном повреждающем
СПИСОК ЛИТЕРАТУРЫ
воздействии именно синхронного режима
1.
L. He, X. Yu, and W. Li, ACS Nano, 16 (12), 19691
ФДТ+РТА. Существенно худшее состояние РНК
(2022). DOI: 10.1021/acsnano.2c07286
после синхронного воздействия РТА и ФДТ, что
2.
A. Bansal, F. Yang, T. Xi, et al., Proc. Natl. Acad. Sci.
следует из невозможности провести даже фраг-
USA,
115
(7),
1469
(2018). DOI:
10.1073/
ментарный ПЦР анализ кДНК, вероятнее всего
pnas.1717552115
обусловлено пролонгированным окислительным
3.
Y. Fatma and T. Ayça, Nov. Appro. in Can. Study, 1 (2),
стрессом, возникающим под действием ионизи-
000506 (2018). DOI: 10.31031/NACS.2018.01.000506
рующего излучения и поддерживающимся на
4.
A. Colasanti, A. Kisslinger, M. Quarto, et al., Acta Bio-
chim. Pol., 51 (4), 1039 (2004).
протяжении нескольких суток после облучения
5.
A. R. Montazerabadi., A. Sazgarnia, M. H. Bahreyni-
по причине, очевидно, дисфункции митохон-
Toosi, et al., J. Photochem Photobiol B, 109, 42 (2012).
дрий, генерации и диффузии из митохондриаль-
DOI: 10.1016/j.jphotobiol.2012.01.004
ного пространства во внутриклеточное большого
6.
B. W. Pogue, J. A. O'Hara, E. Demidenko, et al., Can-
количества непогашенных активных форм кис-
cer Res., 63 (5), 1025 (2003).
лорода [29]. Исходя из полученных результатов
7.
М. А. Каплан, А. И. Малыгина, Г. В. Пономарев
для выживаемости, экспрессии генов и обнару-
и др., Рос. биотерапевтич. журн., 14, 79 (2015).
женной деградации РНК, можно сделать вывод,
8.
Ю. С. Романко, А. Ф. Цыб, М. А. Каплан и др.,
что наибольшее поражающее клетки воздействие
Бюл. эксперим. биологии и медицины, 139 (4), 456
оказывает синхронное облучение, что подтвер-
(2005).
ждает синергизм ФДТ и ЛТ именно при их сов-
9.
D. Xu, A. Baidya, K. Deng, et al., Oncol. Rep., 45 (2),
местном воздействии.
547 (2021). DOI: 10.3892/or.2020.7871
Таким образом, полученные результаты по ак-
10.
A. Hak, M. S. Ali, S. A. Sankaranarayanan, et al., ACS
тивации генов репарации ДНК и запуску апопто-
Appl. Bio Mater.,
6
(2),
349
(2023). DOI:
10.1021/acsabm.2c00891
за под контролем p53 соответствуют динамике
11.
L .Wang, G. Li, L. Cao, et al., ACS Pharmacol. Transl.
развития постлучевой гибели клеток при разных
Sci., 5 (2), 110 (2022). DOI: 10.1021/acsptsci.1c00249
комбинациях воздействия ФДТ и ЛТ. В совокуп-
12.
J. S. Russell, K. Brady, W. E. Burgan, et al., Cancer
ности с фактором деградации РНК данные по
Res., 63 (21), 7377 (2003).
экспрессии генов и клеточной гибели свидетель-
13.
H. H. Y. Chang, N. R. Pannunzio, N. Adachi, et al.,
ствуют о большем поражающем эффекте син-
Nat. Rev. Mol. Cell. Biol., 18 (8), 495 (2017). DOI:
хронной комбинации ФДТ и ЛТ по сравнению с
10.1038/nrm.2017.48
их последовательным применением.
14.
K. Tsouroula, A. Furst, M. Rogier, et al., Mol. Cell, 63
(2), 293 (2016). DOI: 10.1016/j.molcel.2016.06.002
15.
F. Aymard, B. Bugler, C. K. Schmidt, et al., Nat.
БЛАГОДАРНОСТИ
Struct. Mol. Biol.,
21
(4),
366
(2014). DOI:
Выражаем искреннюю благодарность д.б.н.
10.1038/nsmb.2796
М.Г. Шарапову, С.И. Державину, А.А. Игнато-
16.
A. Ciccia and S. J. Elledge, Mol. Cell, 40 (2), 179
вой, Д.Н. Мамонову и Г.В. Мерзликину за по-
(2010). DOI: 10.1016/j.molcel.2010.09.019
мощь в проведении экспериментов, а также
17.
A. M. Schmitt, J. T. Garcia, T. Hung, et al., Nat. Gen-
М.А. Грину за предоставление фотосенсибилиза-
et., 48 (11), 1370 (2016). DOI: 10.1038/ng.3673
тора для исследований.
18.
M. P. A. Luna-Vargas and J. E. Chipuk, Trends Cell Bi-
ol., 26 (12), 906 (2016). DOI: 10.1016/j.tcb.2016.07.002
19.
H. Rezaeejam, A. Shirazi, M. Valizadeh, et al., J. Can-
ФИНАНСИРОВАНИЕ РАБОТЫ
cer Res. Ther., 11 (3), 549 (2015). DOI: 10.4103/0973-
1482.160912
Работа выполнена при финансовой поддержке
20. M. A. Grin, I. S. Lonin, S. V. Fedyunin, et al., Mende-
Российского фонда фундаментальных исследова-
leev Commun., 17, 209 (2007).
ний (грант № 20-02-00102 «Исследование эффек-
21. A. V. Efremenko, A. A. Ignatova, A. A. Borsheva, et al.,
тивности синхронной фотодинамической и луче-
Photochem. Photobiol. Sci., 11 (4), 645 (2012).
вой терапии»).
22. A. V. Efremenko, A. A. Ignatova, M. A. Grin, et al.,
Photochem. Photobiol. Sci., 13, 92 (2014).
23. Г. В. Пономарев, Рос. биотерапевтич. журн., 6 (1),
КОНФЛИКТ ИНТЕРЕСОВ
24 (2007).
Авторы заявляют об отсутствии конфликта
24. Г. В. Пономарев, С. Ю. Егоров, А. А. Стрижаков и
интересов.
др., Рос. биотерапевтич. журн., 12 (2), 68 (2013).
БИОФИЗИКА том 68
№ 5
2023
КЛЕТОЧНЫЙ ОТВЕТ НА ВОЗДЕЙСТВИЕ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ
963
25. И. А. Кондратьева, Н. В. Воробьева, О. В. Буракова
28. A. Hafner, M. L. Bulyk, A. Jambhekar, et al., Nat. Rev.
и др., в кн. Практикум по иммунологии, под ред. И.
Mol. Cell Biol.,
20
(4),
199
(2019), DOI:
Кондратьева и В. Самуилова (Изд. МГУ, М., 2001),
10.1038/s41580-019-0110-x
сс. 17-32.
26. K. J. Livak and T. D. Schmittgen, Methods, 25 (4), 402
29. S. Kobashigawa, K. Suzuki, and S. Yamashita, Bio-
(2001), DOI: 10.1006/meth.2001.1262
chem. Biophys. Res. Commun., 414 (4), 795 (2011),
27.
27. J.W. Tukey, Biometrics, 5 (2), (1949).
DOI: 10.1016/j.bbrc.2011.10.006
Cellular Response to Exposure to Ionizing Radiation and Light in the Presence
of a Photosensitizer
S.V. Akulinichev*, **, S.I. Glukhov*, ***, A.V. Efremenko****, D.A. Kokontsev*, **,
E.A. Kuznetsova***, V.V. Martynova*, A.V. Feofanov****, *****, and I.A. Yakovlev*, **
*Institute for Nuclear Research, Russian Academy of Sciences, Fizicheskaya ul. 27, Troitsk, Moscow, 108840 Russia
**B.V. Petrovsky Russian Research Center of Surgery, Abrikosovskii per. 2, Moscow, 119991Russia
***Institute for Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
****Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences,
ul. Miklukho-Maklaya 16/10, Moscow, 117997 Russia
*****Department of Biology, Lomonosov Moscow State University, Leninskie Gory 1/12, Moscow, 119234 Russia
This study has been conducted to investigate the effects of X-ray irradiation in combination with photody-
namic therapy on human lung adenocarcinoma cell line A549 used as a lung cancer model. It has been estab-
lished that the concomitant use of these two types of radiation leads to much lower survival rate of tumor cells
than that observed after the sequential use of these types of radiation or exposure to each type of radiation
measured separately. For different combinations of the two mentioned types of radiation, the mRNA expres-
sion levels of some genes involved in cell cycle regulation (p21, DINOL), apoptosis (BAX, PUMA), and DNA
repair (PARP1, OGG1, Rad51, Lig4) were determined in cells. The highest level of expression after exposure
to different combinations of radiation was observed for the lncRNA DINOL gene. The increased expression
of the BAX and PUMA genes indicates the development of apoptosis. The results obtained confirm that there
is synergism in X-ray radiation and photodynamic therapy due to the concomitant use of these types of radi-
ation.
Keywords: X-rays, chlorine derivatives, photodynamic therapy, A549 cells
БИОФИЗИКА том 68
№ 5
2023