БИОФИЗИКА, 2023, том 68, № 5, с. 949-953
БИОФИЗИКА КЛЕТКИ
УДК 576.32/.36
ВЛИЯНИЕ ДИСУЛЬФИДСОДЕРЖАЩЕГО ИММУНОМОДУЛЯТОРА
МОЛИКСАНА НА ТРАНСПОРТ Na+ В ЭПИТЕЛИИ КОЖИ ЛЯГУШКИ
© 2023 г. А.В. Мельницкая*, #, З.И. Крутецкая*, В.Г. Антонов**, Н.И. Крутецкая*
*Санкт-Петербургский государственный университет,
Университетская наб., 7/9, Санкт-Петербург, 199034, Россия
**Санкт-Петербургский государственный педиатрический медицинский университет,
Литовская ул., 2, Санкт-Петербург, 194100, Россия
#E-mail: a.melnitskaya@spbu.ru
Поступила в редакцию 29.12.2022 г.
После доработки 29.12.2022 г.
Принята к публикации 17.01.2023 г.
Рассматривается влияние фармакологического аналога окисленного глутатиона - дисульфидсо-
держащего иммуномодулятора моликсана на транспорт Na+ в эпителии кожи лягушки. С использо-
ванием метода фиксации потенциала впервые показано, что моликсан модулирует транспорт Na+ в
эпителии кожи лягушки. Обнаружено, что приложение моликсана со стороны апикальной поверх-
ности кожи подавляет транспорт Na+, тогда как при добавлении со стороны базолатеральной по-
верхности моликсан имитирует действие инсулина и стимулирует транспорт Na+. Результаты сви-
детельствуют о том, что окисленный глутатион и его фармакологические аналоги моликсан и глу-
токсим однонаправленно модулируют транспорт Na+ в коже лягушки.
Ключевые слова: моликсан, GSSG, транспорт Na+, эпителий кожи лягушки.
DOI: 10.31857/S0006302923050150, EDN: PHJODD
нентную систему, в работе которой принимают
Исследование механизмов трансэпителиаль-
ного транспорта веществ является интенсивно
участие различные Na+-транспортирующие бел-
развивающимся направлением современной
ки и сигнальные каскады, локализованные в раз-
биофизики, физиологии и медицины. Для прак-
личных мембранах клетки, которые являются ми-
тической медицины большой интерес имеет изу-
шенью для окислительного стресса. В реабсорби-
чение транспорта ионов в почке, являющейся
рующих эпителиях ключевую роль в транспорте
уникальным органом по разнообразию, интен-
Na+ играют амилоридчувствительные эпители-
сивности и избирательности транспортных про-
альные Na+-каналы (ENaC). Многочисленные
цессов, а также по многообразию механизмов их
остатки цистеина, локализованные в различных
селективного регулирования. Классическими
сегментах ENaC, определяют его редокс-чувстви-
модельными объектами для исследования меха-
тельность и являются мишенью для внутри - и
низмов транспорта ионов через биологические
мембраны являются кожа и мочевой пузырь ам-
внеклеточных окисляющих и восстанавливаю-
щих агентов [2, 3]. Внеклеточные фрагменты
фибий. По способности к транспорту электроли-
тов и реакции на некоторые гормоны кожа и мо-
ENaC содержат CRD1 и CRD2 домены, богатые
чевой пузырь амфибий сходны с дистальными от-
остатками цистеина, которые являются высоко-
делами почечных канальцев, что позволяет
консервативными среди членов семейства деге-
использовать данные, получаемые на этих объек-
нерины/ENaC. Эти внеклеточные остатки цисте-
тах, для выяснения механизмов трансэпители-
ина, вероятно, участвуют в образовании дисуль-
ального транспорта воды и ионов в клетках почки
фидных связей, важных для правильного
[1].
фолдинга белка [3] и транслокации каналов к
плазмалемме [2, 3]. Трансмембранные сегменты
Транспорт Na+ в осморегулирующих эпители-
и N- и C-терминальные фрагменты α-, β- и
ях представляет собой сложную, многокомпо-
γ-субъединиц ENaC также содержат остатки ци-
стеина, которые доступны для окисляющих и
Сокращения: ENaC - амилоридчувствительные эпители-
альные Na+-каналы, GSH - восстановленная форма глу-
восстанавливающих агентов со стороны цитозоля
татиона, GSSG - окисленная форма глутатиона.
[4]. Согласно двухмембранной модели активного
949
950
МЕЛЬНИЦКАЯ и др.
приложение этих агентов со стороны апикальной
транспорта Na+ эпителиальными клетками,
предложенной Кефед-Джонсеном и Уссингом,
поверхности кожи подавляет транспорт Na+, то-
гда как при добавлении со стороны базолатераль-
Na+ удаляется из клетки при помощи Nа+/K+-
ной поверхности кожи GSSG и глутоксим имити-
ATФазы, локализованной во внутренней (базола-
руют действие инсулина и стимулируют транс-
теральной или серозной) мембране эпителиаль-
порт Na+. В связи с этим, целью настоящей
ных клеток [5]. Na+/K+-АТФаза, как и другие
ион-транспортирующие системы, чувствительна
работы было исследование влияния другого ди-
сульфидсодержащего препарата - моликсана -
к действию окисляющих и восстанавливающих
агентов [6]. Однако, большая часть данных о ре-
на транспорт Na+ в эпителии кожи лягушки.
докс-регуляции Na+/K+-АТФазы получена для
очищенного фермента или ферментного ком-
МАТЕРИАЛЫ И МЕТОДЫ
плекса, экспрессированного в гетерологичных
системах. В то же время влияние окислителей и
Эксперименты проводили на самцах лягушки
Rana temporaria в период с ноября по март. Кожу с
восстановителей на транспорт Na+ в нативных
эпителиальных системах, таких как эпителий ко-
брюшка лягушки срезали и помещали в камеру
жи лягушки, практически не изучено.
Уссинга (World Precision Instruments, Inc., Герма-
ния) с диаметром внутреннего отверстия 12 мм.
Важнейшую роль в редокс-регулируемых
Камеру заполняли раствором Рингера для холод-
внутриклеточных сигнальных путях играют эндо-
нокровных, содержащим (в мМ): NaCl - 110,
генные системы глутатиона. Глутатион (γ-глута-
KCl - 2.5, CaCl2 - 3, Tris-HCl - 5, pH 7.4. Опыты
милцистеинилглицин) существует в клетке в вос-
проводили при комнатной температуре
(22-
становленной (GSH) и окисленной (GSSG) фор-
23°С).
мах и является универсальным тиолсодержащим
трипептидом, обнаруженным в большинстве кле-
Для измерения электрических параметров ко-
ток растений, микроорганизмов и млекопитаю-
жи лягушки Rana temporaria использовали авто-
щих. Глутатион предотвращает окисление SH-
матизированную установку фиксации потенциа-
групп или восстанавливает S-S-связи, индуциро-
ла и регистрации вольт-амперных характеристик.
ванные окислительным стрессом, инактивирует
Для измерения вольт-амперных характеристик на
свободные радикалы, участвует в детоксикации
кожу подавали линейно изменяющееся напряже-
токсических ксенобиотиков (лекарственных ве-
ние (ramp) со скоростью 20 мВ/с. В интервалах
ществ, канцерогенов) [7], участвует в активации
между измерениями вольт-амперных характери-
транскрипции генов, в том числе некоторых ан-
стик трансэпителиальный потенциал (VT) кожи
тиоксидантных ферментов, а также ингибирова-
поддерживали при 0 мВ (режим короткого замы-
нии редоксзависимых путей активации апоптоза;
кания) или при потенциале открытой цепи VOC
входит в систему детоксикации и антиоксидант-
(VOC = VT при трансэпителиальном токе IT = 0).
ной защиты, предупреждения и ограничения
Из вольт-амперных характеристик определяли
окислительного стресса [8, 9].
электрические параметры кожи - ток короткого
На основе дисульфидсодержащих окисляю-
замыкания ISC (ISC = IT при VT = 0), VOC и транс-
щих агентов синтезирован и успешно применен в
эпителиальную проводимость gT.
клинической практике целый ряд фармакологи-
ческих препаратов, которые были объединены в
Транспорт Na+ оценивали как амилоридчув-
группу тиопоэтинов, характеризующихся си-
ствительный ток ISC. В конце каждого экспери-
стемным цитопротекторным эффектом [10, 11].
мента в раствор, омывающий апикальную по-
Фармакологические аналоги GSSG глутоксим®
верхность кожи, добавляли блокатор амилорид-
(динатриевая соль GSSG с d-металлом в нано-
чувствительных эпителиальных Na+-каналов
концентрации, «ФАРМА-ВАМ», Санкт-Петер-
амилорид (20 мкМ).
бург) и моликсан® (комплекс глутоксима и нук-
леозида инозина, «ФАРМА-ВАМ», Санкт-Петер-
Использовали реактивы фирмы Sigma (США).
бург) используются как иммуномодуляторы и
Маточный раствор амилорида (10 мМ) готовили
цитопротекторы в комплексной терапии бакте-
на воде. Моликсан был предоставлен фирмой
риальных, вирусных и онкологических заболева-
«ФАРМА-ВАМ» (Санкт-Петербург). Маточный
ний. Эти препараты оказывают комплексное вли-
раствор моликсана (50 мг/мл) готовили на воде.
яние на процессы редокс-регуляции в клетках,
Фармакологические агенты добавляли к апикаль-
однако тонкие биофизические механизмы их
ной или базолатеральной поверхности кожи ля-
действия далеки от полного понимания.
гушки.
Ранее нами было впервые обнаружено, что
Статистический анализ проводили с примене-
GSSG и глутоксим модулируют транспорт Na+ в
нием t-критерия Стьюдента. Данные представле-
эпителии кожи лягушки [12]. Обнаружено, что
ны в виде x ± sx. Достоверными считали различия
БИОФИЗИКА том 68
№ 5
2023
ВЛИЯНИЕ ДИСУЛЬФИДСОДЕРЖАЩЕГО ИММУНОМОДУЛЯТОРА МОЛИКСАНА
951
сле добавления 200 мкг/мл моликсана к апикаль-
ной поверхности кожи было следующим: ISC
уменьшился на 30.34 ± 4.82%, VOC уменьшился
на 26.35 ± 12.24%, а gT уменьшилась на 9.32 ±
± 2.74%. В случае обработки моликсаном базола-
теральной поверхности кожи лягушки изменение
электрических характеристик в среднем было
следующим: ISC увеличился на 36.46 ± 5.2%,
VOC увеличился на 40.08 ± 8.34%, а gT - на
8.15 ± 3.01%. Таким образом, полученные резуль-
таты свидетельствуют о том, что влияние молик-
сана на транспорт Na+ различается в зависимости
от приложения агента со стороны апикальной
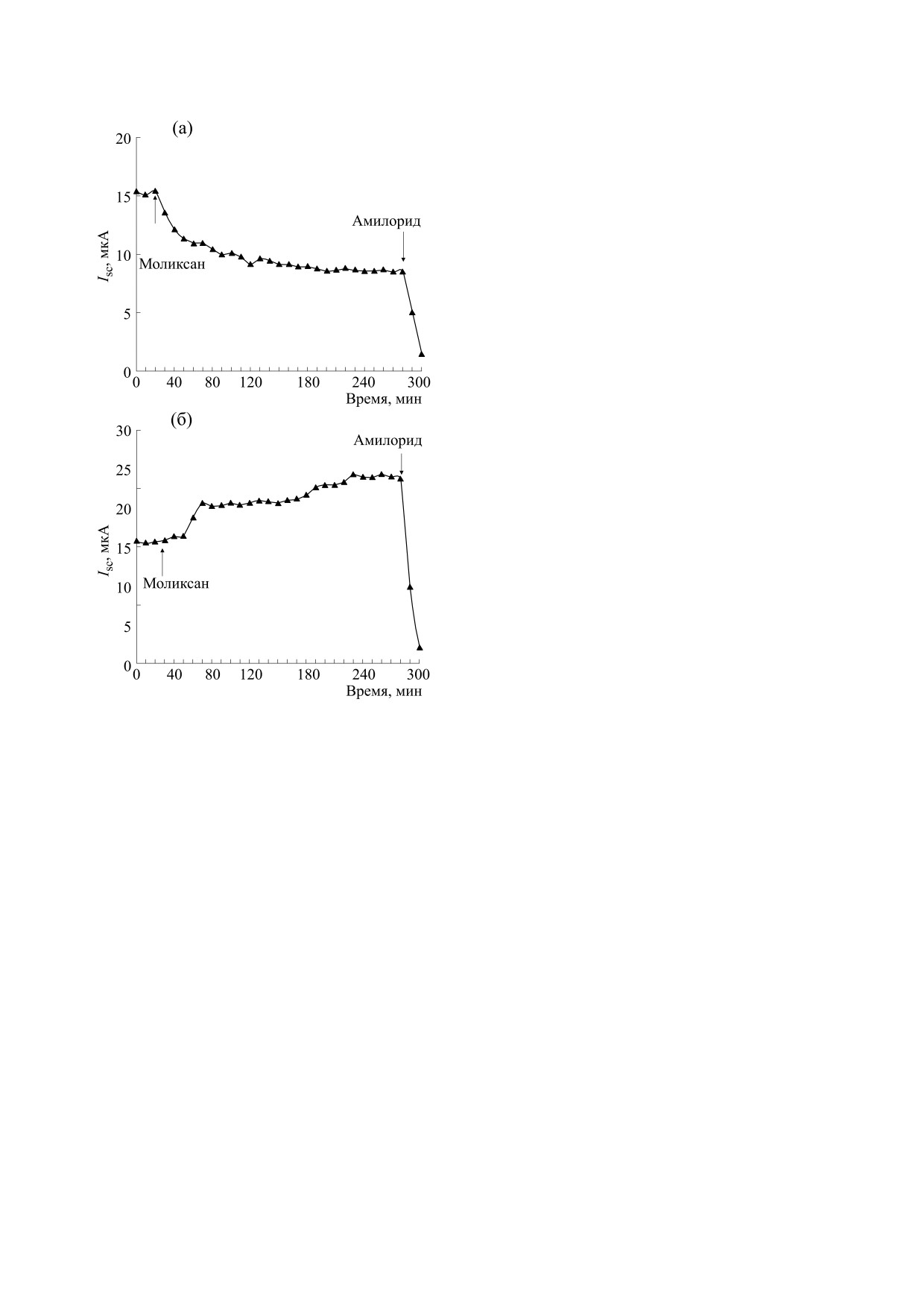
или базолатеральной поверхности кожи (рис.
1а,б) аналогично эффекту GSSG и глутоксима,
показанному нами ранее [12].
Обработка апикальной поверхности кожи ля-
гушки моликсаном подавляет транспорт Na+
(рис. 1а). Наиболее вероятно предположить, что
ингибирующее влияние моликсана может быть
связано с его способностью взаимодействовать с
функционально значимыми остатками цистеина
Na+-транспортирующих белков, что приводит к
ингибированию их активности и подавлению
транспорта Na+. Полученные результаты согласу-
ются с литературными данными, согласно кото-
рым ENaC и другие Na+-транспортирующие бел-
ки быстро и обратимо ингибируются агентами,
окисляющими SH-группы остатков цистеина [2,
3, 6]. Кроме того, с использованием метода ло-
кальной фиксации потенциала на альвеолярных
клетках I крысы было показано, что GSSG в мик-
ромолярных концентрациях снижает вероят-
ность открытого состояния ENaC, экспрессируе-
Рис. 1. Кинетика изменения тока короткого замыка-
через кожу лягушки в ответ на приложение
ния ISC
мых в апикальных мембранах пневмоцитов, а
фармакологического аналога окисленного глутатиона
также приводит к снижению клиренса альвеоляр-
(GSSG) - дисульфидсодержащего иммуномодулятора
моликсана (200 мкг/мл), добавленного со стороны
ной жидкости в экспериментах in vivo. В данном
апикальной (а) или базолатеральной (б) поверхности
исследовании продемонстрировано также, что
кожи лягушки. В конце каждого эксперимента в рас-
сдвиг окислительно-восстановительного потен-
твор, омывающий апикальную поверхность кожи, до-
циала к более окисленному состоянию при до-
бавляли блокатор амилоридчувствительных эпители-
бавлении GSSG вызывает обратимое снижение
альных Na+-каналов (ENaC) - амилорид (20 мкМ).
активности ENaC, которое можно устранить с
помощью добавление GSH. Более того, за это из-
при р ≤ 0.05. На рисунках представлены результа-
менение активности ENaC ответственна прямая
ты типичных экспериментов.
обратимая модификация ENaC с помощью
GSSG (S-глутатионилирование субъединиц
ENaC). В целом эти результаты показывают, что
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
обратимое S-глутатионилирование субъединиц
ENaC может играть важную роль в регуляции ба-
Значения электрических характеристик кожи
ланса жидкости в легких [13].
лягушки в контроле в среднем (здесь и далее по
тексту число опытов n
=
10) составляют:
В то же время, моликсан, приложенный со
ISC = 14.51 ± 2.35 мкА; VOC = -27.03 ± 4.16 мВ;
стороны базолатеральной поверхности кожи,
стимулирует транспорт Na+ (рис. 1б). Получен-
gT= 0.53 ± 0.25 мСм.
ные результаты согласуются с данными литерату-
Обнаружено, что моликсан модулирует транс-
ры о способности GSSG и его фармакологиче-
порт Na+ в коже лягушки. В среднем изменение
ских аналогов оказывать рецептор-опосредован-
электрических характеристик кожи лягушки по-
ное влияние на клеточные процессы. Так, в
БИОФИЗИКА том 68
№ 5
2023
952
МЕЛЬНИЦКАЯ и др.
клетках эпидермоидной карциномы человека ли-
ФИНАНСИРОВАНИЕ РАБОТЫ
нии А431 GSSG и глутоксим вызывают трансак-
Работа выполнена в рамках Договоров СПбГУ
тивацию (лиганд-независимую активацию) ре-
на выполнение научно-исследовательских работ
цептора эпидермального фактора роста и актива-
№ 01/18-НИОКР от 05.03.2018 и № 05/03-20 от
цию его собственной тирозинкиназной
12.03.2020.
активности [14, 15]. Также нами ранее было пока-
зано, что в случае приложения к базолатеральной
поверхности кожи лягушки, GSSG и глутоксим
КОНФЛИКТ ИНТЕРЕСОВ
действуют как инсулиномиметики и стимулиру-
ют трансэпителиальный транспорт Na+
[12].
Авторы заявляют об отсутствии конфликта
интересов.
Можно предположить, что GSSG и его фармако-
логические аналоги моликсан и глутоксим могут
взаимодействовать с богатыми цистеином экс-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
траклеточными доменами α-субъединиц инсули-
нового рецептора, вызывать трансактивацию ре-
Содержание животных и все манипуляции с
цептора и запускать сигнальный каскад, приво-
ними выполняли в соответствии с нормативными
дящий к активации Na+-транспортирующих
документами и требованиями Приказа Минздра-
белков и стимуляции транспорта Na+.
ва России № 267 от 19.06.03 «Об утверждении
правил лабораторной практики в Российской Фе-
Известно, что ключевые Na+-транспортирую-
дерации».
щие белки (ENaC, Na+-K+-ATФазы и Na+/H+-
обменники) содержат многочисленные остатки
СПИСОК ЛИТЕРАТУРЫ
цистеина, которые являются мишенями для дей-
ствия внутри- и внеклеточных окислителей и вос-
1.
Ю. В. Наточин, Основы физиологии почки (Наука,
становителей [2-4, 6]. Однако добавление блока-
Л., 1982).
тора ENaC амилорида (20 мкМ) в раствор, омыва-
2.
D. J. Benos and B. A. Stanton, J. Physiol., 520, 631
ющий апикальную поверхность кожи лягушки,
(1999).
вызывало полное подавление транспорта Na+.
3.
D. Firsov, M. Robert-Nicoud, S. Gruender, et al., J.
Можно предположить, что влияние моликсана на
Biol. Chem., 274, 2743 (1999).
транспорт Na+ обусловлено в основном модуля-
цией активности ENaC.
4.
S. Kellenberger, I. Gautschi, Y. Pfister, et al., J. Biol.
Chem., 280, 7739 (2005).
Таким образом, в настоящей работе показано
модулирующее влияние моликсана на транспорт
5.
V. Koefoed-Johnsen and H. H. Ussing, Acta. Physiol.
Na+ в эпителии кожи лягушки. Полученные ре-
Scand., 42, 298 (1958).
зультаты свидетельствуют также о том, что мо-
6.
A. A. Boldyrev and E. R. Bulygina, Ann. N.Y. Acad.
ликсан, GSSG и глутоксим однонаправленно мо-
Sci., 834, 666 (1997).
дулируют транспорт Na+ в коже лягушки. Можно
7.
J. D. Hayes and L. I. McLellan, Free Rad. Res., 31, 273
предположить, что влияние этих дисульфидсо-
(1999).
держащих окислителей на транспорт Na+ опосре-
довано сходными регуляторными механизмами.
8.
В. И. Кулинский и Л. С. Колесниченко, Биомед.
химия, 55 (4), 365 (2009).
Полученные нами данные о влиянии моликса-
9.
J. D. Uys, P. J. Mulholland, and D. M. Townsend,
на, GSSG и глутоксима на трансэпителиальный
Biomed. Pharmacother., 68, 799 (2014).
транспорт Na+ способствуют также более деталь-
ному пониманию молекулярных механизмов
10.
A. E. Borisov, L. A. Kozhemyakin, A. E. Antushevich,
действия этих дисульфидсодержащих окисляю-
et al., Vestn. Hirurgii im. I. I. Grekova, 4 (2), 32 (2001).
щих агентов, широко применяемых в клиничес-
11.
О. Б. Жуков, А. Р. Зубарев, М. В. Мезенцева и др.,
кой практике в качестве препаратов, обладающих
Врачебное сословие, 5 (6), 51 (2004).
иммуномодулирующим, гемопоэтическим и ге-
патопротекторным действием, а также для смяг-
12.
Z. I. Krutetskaya, O. E. Lebedev, A. V. Melnitskaya,
чения окислительного стресса и купирования
et al., Dokl. RAN, 421 (5), 709 (2008).
процессов воспаления. Кроме того, обнаружение
13.
C. A. Downs, L. Kreiner, X. M. Zhao, et al., Am. J.
новых соединений, влияющих на активность
Physiol., 308, L943 (2015).
ENaC и других Na+-транспортирующих белков,
14.
Е. Б. Бурова, К. П. Василенко, В. Г. Антонов и др.,
актуально для биомедицинских исследований
Докл. РАН, 404, 1 (2005).
многих патологических процессов и является
предпосылкой для разработки новых фармаколо-
15.
К. П. Василенко, Е. Б. Бурова, В. Г. Антонов и др.,
гических средств в терапии подобных состояний.
Цитология, 48 (6), 500 (2006).
БИОФИЗИКА том 68
№ 5
2023
ВЛИЯНИЕ ДИСУЛЬФИДСОДЕРЖАЩЕГО ИММУНОМОДУЛЯТОРА МОЛИКСАНА
953
The Effect of Molixan, a Disulfide-Containing Immunomodulator,
on Na+ Transport across Frog Skin Epithelium
A.V. Melnitskaya*, Z.I. Krutetskaya*, V.G. Antonov**, and N.I. Krutetskaya*
*Saint Petersburg State University, Universitetskaya nab. 7/9, Saint Petersburg, 199034 Russia
** Saint Petersburg State Pediatric Medical University, Litovskaya ul. 2, Saint Petersburg, 194100 Russia
The effect of molixan, a disulfide-containing immunomodulator which is an analogue of oxidized glutathi-
one, on Na+ transport across frog skin epithelium has been studied. Using the voltage-clamp technique, the
capacity of molixan to modulate Na+ transport across frog skin epithelium has been revealed for the first time.
It was also found that when molixan is applied to the apical surface of frog skin, it suppresses Na+ transport,
while molixan added on the basolateral surface may mimic the effect of insulin and stimulate Na+ transport.
The results obtained indicate that oxidized glutathione and its analogs molixan and glutoxim unidirectionally
modulate Na+ transport across frog skin.
Keywords: molixan, GSSG, Na+ transport, frog skin epithelium
БИОФИЗИКА том 68
№ 5
2023