БИОФИЗИКА, 2023, том 68, № 5, с. 900-910
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
МЕХАНИЗМ ДЕЙСТВИЯ НИЗКОЧАСТОТНОГО ЭЛЕКТРОМАГНИТНОГО
ПОЛЯ НА ВОДНЫЕ РАСТВОРЫ БИОПОЛИМЕРОВ
© 2023 г. Е.Е. Текуцкая*, #, Г.П. Ильченко*, М.Г. Барышев**
*Кубанский государственный университет, Ставропольская ул., 149, Краснодар, 350040, Россия
**Кубанский государственный технологический университет, Московская ул., 2, Краснодар, 350000, Россия
#Е-mail: tekytska@mail.ru
Поступила в редакцию 27.12.2022 г.
После доработки 24.01.2023 г.
Принята к публикации 01.02.2023 г.
Предложен механизм преобразования сигнала магнитной составляющей низкочастотного электро-
магнитного поля, имеющего крайне низкую энергию, в химический и биохимический отклик в вод-
ных растворах биополимеров на основе нуклеиновых кислот и белков. Из разработанной теорети-
ческой модели следует, что в основе окислительных повреждений ДНК и конформационных пере-
ходов белков лежит универсальный механизм, связанный с изменением количества наиболее
долгоживущей формы - перекиси водорода в химическом осцилляторе взаимопревращений актив-
ных форм кислорода под действием низкоинтенсивного электромагнитного поля. Эксперимен-
тально определено, что количественное содержание перекиси водорода в растворах биополимеров
резонансоподобно зависит от частоты воздействующего поля. Конформационные изменения бел-
ков сопровождаются увеличением доступности и активности нуклеофильных центров, являющихся
потенциальными мишенями для активных форм кислорода. Полное разворачивание и денатурация
аминокислотной цепи белка под действием низкочастотного электромагнитного поля не происхо-
дит. Показано, что повышенное образование перекиси водорода при частотах 3 и 50 Гц приводит к
окислительной модификации азотистых оснований ДНК.
Ключевые слова: низкочастотное электромагнитное поле, активные формы кислорода, перекись
водорода, биополимеры, ДНК, альбумин, флуоресцентная спектроскопия.
DOI: 10.31857/S0006302923030095, EDN: PIZWON
сверхнизкочастотное ЭМП в последние десяти-
Значительное количество магнитобиологиче-
летия занимает особое место в медицинских ис-
ских эффектов приходится на крайне низкоча-
следованиях, особенно в области лечения рака в
стотный (3-30 Гц) и сверхнизкочастотный (30-
сочетании с химиотерапевтическими препарата-
300 Гц) диапазоны электромагнитного поля
(ЭМП), но первичные механизмы этого дей-
ми и обезболиваниями [8, 9]. Предполагается, что
под действием ЭМП может изменяться скорость
ствия, несмотря на многочисленные исследова-
диффузии через биологические мембраны, ори-
ния и предлагаемые модели, до сегодняшнего дня
ентация и конформация биологических макро-
остаются до конца не ясными [1-4]. Между тем,
молекул, а также состояние свободных ради-
воздействие ЭМП крайне низкочастотного и
сверхнизкочастотного диапазонов на живые си-
калов.
стемы может носить двоякий характер. С одной
Одним из важных источников мутаций высту-
стороны, негативное влияние ЭМП связано с не-
пает эндогенный и экзогенный окислительный
обходимостью защиты организма человека, по-
стресс, которому подвергается ДНК всех живых
скольку действие ЭМП на живые системы может
организмов. Повышенный уровень образования
приводить к повреждению ДНК, инициировать
активных форм кислорода (АФК), опосредован-
окислительную модификацию азотистых основа-
ный физическими, химическими или биологиче-
ний и появлению одно- и двунитевых разрывов, а
скими факторами среды является наиболее гено-
также к сбою в системе репарации ДНК, как по-
токсическим процессом, воздействующим на
казали исследования [5-7]. C другой стороны,
ДНК [10-11].
Цель работы заключалась в разработке физи-
Сокращения: ЭМП - электромагнитное поле, АФК -
активные формы кислорода, ЧСА
- человеческий
ко-химического механизма генерации АФК в
сывороточный альбумин.
водных растворах под действием низкочастотно-
900
МЕХАНИЗМ ДЕЙСТВИЯ НИЗКОЧАСТОТНОГО ЭЛЕКТРОМАГНИТНОГО ПОЛЯ
901
го электромагнитного поля и инициации повре-
проводилась по Шапиро-Уилксу, а также с помо-
ждений биополимеров.
щью определения ординат нормированной гаус-
совой функции распределения согласно реко-
мендациям, изложенным в монографии
[13].
МАТЕРИАЛЫ И МЕТОДЫ
Сравнение групп по количественным признакам
Объектами исследований были водные рас-
проводили с использованием двухвыборочного t-
творы ДНК, получаемого химической и ультра-
критерия Стьюдента. Различия считали статисти-
звуковой обработкой водного экстракта молок
чески значимыми при р < 0.05.
лососевых и осетровых рыб (ICN, США), и чело-
веческого сывороточного альбумина (ЧСА). Вод-
РЕЗУЛЬТАТЫ
ные растворы ЧСА получали путем разведения
белка до концентрации 5 мкМ в буферной систе-
Процесс образования АФК в водных растворах
ме с различными значениями рН. Концентрацию
нуклеиновых кислот изучали с использованием
ДНК в конечном растворе определяли спектро-
растворов ДНК с известным нуклеотидным со-
фотометрически, используя коэффициент экс-
ставом. Длины волн возбуждения флуоресценции
тинкции, равный Е260нм = 200.
λвозб в растворах ДНК подбирали таким образом,
чтобы возбуждались пиримидиновые основания
Обработка проб электромагнитным полем. В хо-
де экспериментов использовали разработанное
ДНК. Учитывали, что полоса поглощения УФ-
нами устройство для автоматизированного ис-
излучения молекулами ДНК составляет от 160 до
320 нм и наибольшее разрушающее действие на
следования биологических жидкостей в ЭМП,
ДНК оказывает излучение с длиной волны λmax
подробное описание и структурная схема которо-
го приведены в работе [12]. Обработку растворов
253.7 нм. Оптимальной длиной волны возбужде-
ДНК и ЧСА низкочастотным ЭМП, в котором
ния выбрана λвозб = 320 нм, поскольку резонанс-
преобладает магнитная составляющая, проводи-
ный пограничный УФ-диапазон (3.94 эВ) не раз-
ли в химически чистой стерильной пластиковой
рушает, а лишь возбуждает молекулу ДНК.
посуде при толщине слоя 2 мм согласно методи-
На спектрах флуоресценции растворов ДНК с
ке, изложенной в работе [6]. Образец помещали в
концентрациями 2.5, 0.25, 0.025 мкг/мл в диапа-
центр соленоида, где ЭМП с достаточной точно-
зоне от 320 до 720 нм отмечали два характерных
стью можно считать однородным, поскольку раз-
максимума интенсивности флуоресценции в об-
меры соленоида много больше размеров образца.
ласти длин волн 410 ± 3 нм и 645 ± 5 нм. Первый
Эффективное значение напряженности поля, из-
максимум связан с наличием в составе молекул
мерение которой производили прибором «Эко-
ДНК хромофоров, поглощающих УФ-излучение,
физика-110А» с цифровым измерительным пре-
- сопряженные π-связи азотистых оснований.
образователем П3-80-ЕН50, в месте нахождения
Появление второго максимума, по-видимому,
образца составляло 550 ± 30 А/м. Частоту ЭМП
связано с изменением содержания АФК в раство-
варьировали от 0 до 50 Гц с шагом 0.5, 1 или 5 Гц.
ре и косвенно свидетельствует о наличии в вод-
Задавали начальную частоту ЭМП и соответству-
ном растворе ДНК синглетного кислорода. Из-
ющую напряженность и проводили обработку об-
вестно, что молекулы синглетного кислорода мо-
разца в течение 15 или 30 мин. Затем регистриро-
гут образовывать возбужденные эксимеры (1O2)2,
вали спектр флуоресценции образца при соответ-
которые переходят в основное состояние с испус-
ствующей длине волны возбуждения. В растворе
канием фотона в видимом диапазоне в районе
ДНК измеряли количественное содержание пе-
640-645 нм [14].
рекиси водорода.
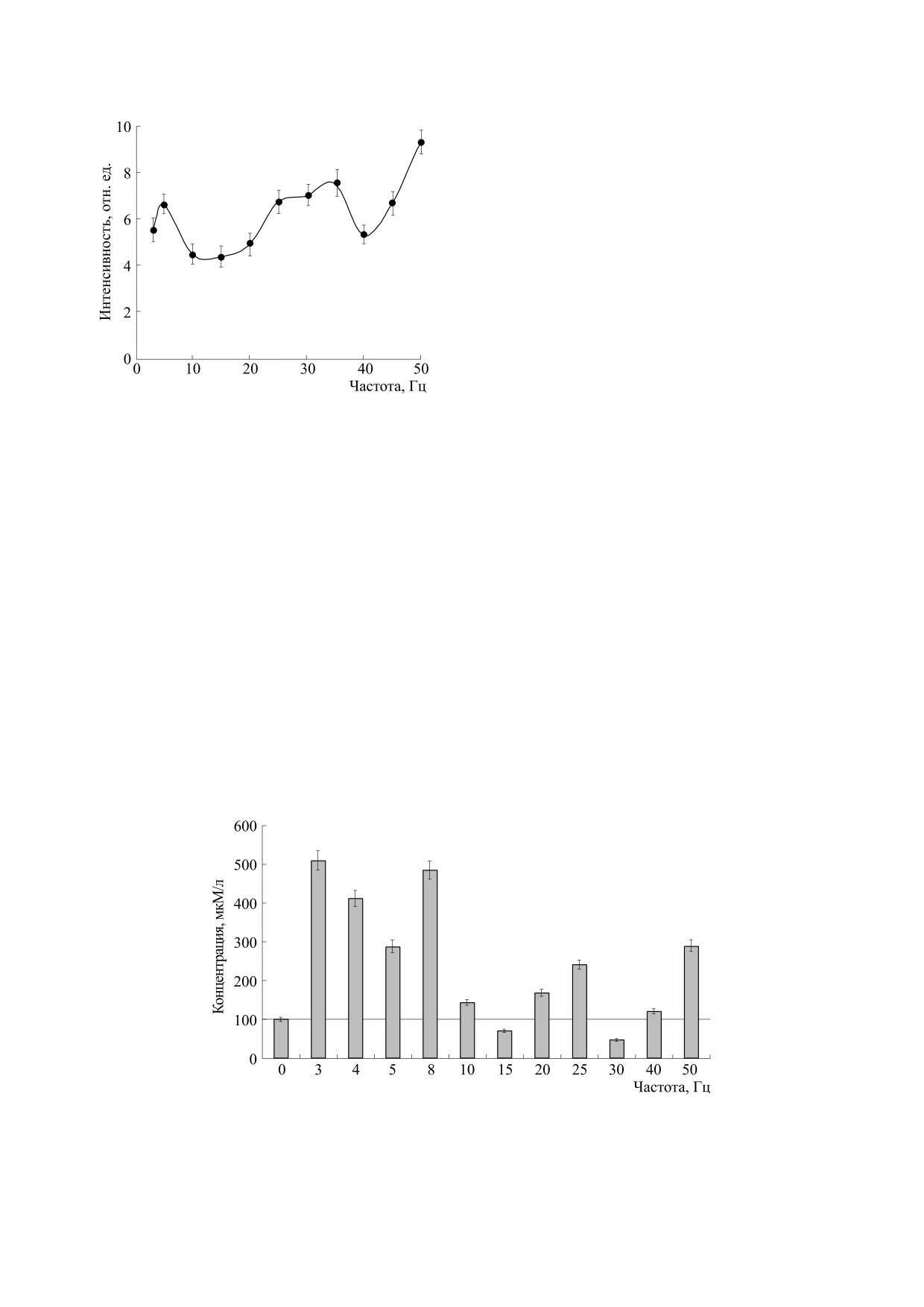
Получены зависимости интенсивности флуо-
Флуоресцентные исследования проводили на
ресценции разбавленных водных растворов ДНК с
спектрофлуориметре F-2700 (Hitachi, Япония).
концентрацией 0.025 мкг/мл от частоты ЭМП с ша-
Определение содержания перекиси водорода в
гом 5 Гц в области второго максимума 645 ± 5 нм
водных растворах ДНК проводили с помощью
(рис. 1). Наблюдается увеличение интенсивности
спектрофотометрического метода, используя на-
флуоресценции области 645 ± 5 нм по сравнению
бор «PerOx Метод определения перекисей в об-
с контролем (раствором ДНК соответствующей
разцах ЭДТА плазмы» (Immun Diagnostic AG,
концентрации без обработки ЭМП) всех исследу-
Германия) на микропланшетном ридере Mul-
емых растворов ДНК при обработке низкоинтен-
tiskan (Thermo Fisher Scientific, Финляндия). Ка-
сивным ЭМП с частотами 3-5, 25-35 и 50 Гц, что
либровочный график линеен в диапазоне 1·10-5 -
косвенно свидетельствует об изменении количе-
5·10-2 М.
ства АФК, в частности, синглетного кислорода, в
Статистическая обработка. Полученные дан-
водном растворе (рис. 1).
ные анализировали в пакете статистического ана-
Время жизни радикалов АФК, как правило,
лиза Statistica 6.0. Проверка гипотезы о нормаль-
очень мало, поэтому об их появлении удобно су-
ном (гауссовом) типе распределения результатов
дить по накоплению наиболее долгоживущей
БИОФИЗИКА том 68
№ 5
2023
902
ТЕКУЦКАЯ и др.
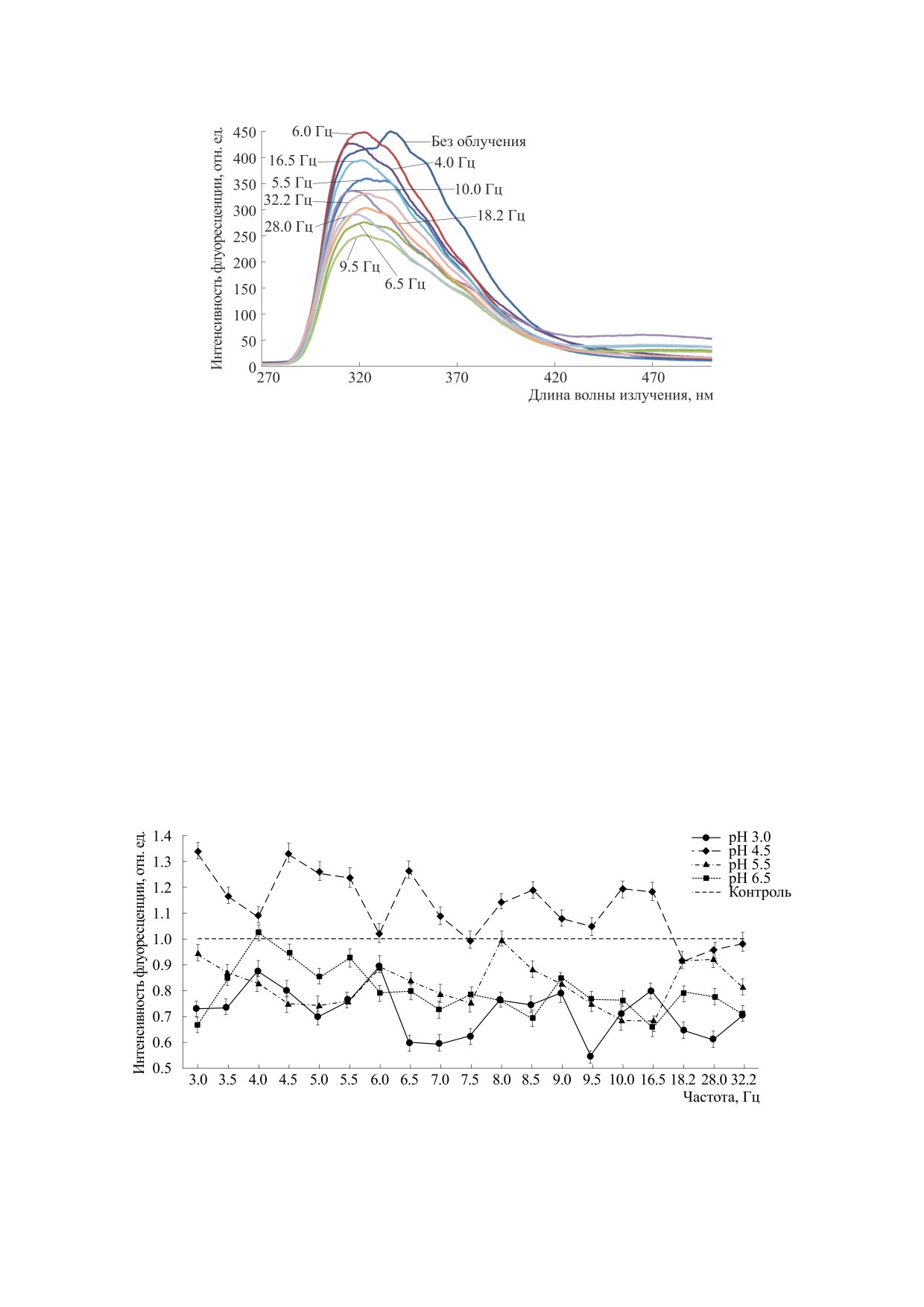
флуоресценции значительно смещались. Харак-
тер изменения спектров триптофановой флуо-
ресценции ЧСA также различался при разных
значениях рН.
На рис. 3 в качестве примера приведено семей-
ство спектров триптофановой флуоресценции
ЧСA с концентрацией 1·10-6 М при рН 3.0 после
обработки ЭМП с разными частотами. В белко-
вом растворе после обработки ЭМП наблюдали,
кроме полосы флуоресценции триптофана, до-
полнительные полосы флуоресценции при всех
изученных рН. Возможно, что данные полосы по-
являются в растворе ЧСА вследствие образования
новых флуорофоров при окислении АФК амино-
кислотных остатков белка. Как видно из рис. 3,
при рН
3.0 интенсивность флуоресценции
Iфлмакс после обработки раствора ЧСA ЭМП
Рис.
1. Усредненная зависимость интенсивности
уменьшается с 440 (без обработки ЭМП) до 230
флуоресценции при λmax = 645 ± 5 нм растворов ДНК
отн. ед., при этом максимум флуоресценции
с концентрацией 0.025 мкг/мл от частоты ЭМП.
Время обработки образцов 30 мин, t = 21°C.
Iфлмакс батохромно смещается в коротковолно-
вую область на 15-20 нм.
формы — перекиси водорода. В водных растворах
Это свидетельствует о наличии хорошо извест-
ДНК после обработки низкоинтенсивным ЭМП
ного эффекта - сдвига стационарного спектра
с соответствующими частотами определили со-
испускания белков в коротковолновую область в
держание перекиси водорода. Из рис. 2 видно,
присутствии тушителя [15].
что содержание Н2О2 в растворах ДНК увеличи-
Из спектров триптофановой флуоресценции
вается после обработки ЭМП с частотами 3-8, 25
ЧСA в диапазоне длин волн от 270 до 440 нм рас-
и 50 Гц.
считана интегральная интенсивность флуорес-
ценции растворов ЧСА при разных значениях рН
Мы изучали действие низкочастотного ЭМП
по формуле:
на растворы ЧСA при значениях рН от 3.0 до 7.0
после обработки ЭМП с частотами от 3 до 32 Гц в
течение 15 мин с шагом 0.5 Гц. Величина интен-
I
сивности триптофановой флуоресценции изме-
I
= сум.f
,
от.
нялась от 230 до 500 отн. ед. в зависимости от ис-
I
сум.K
пользуемой частоты ЭМП, максимумы спектров
Рис. 2. Содержание перекиси водорода до (0 Гц) и после воздействия ЭМП с различными частотами в водных
растворах ДНК с концентрацией 0.025 мкг/мл, время обработки образцов 30 мин, t = 21°C.
БИОФИЗИКА том 68
№ 5
2023
МЕХАНИЗМ ДЕЙСТВИЯ НИЗКОЧАСТОТНОГО ЭЛЕКТРОМАГНИТНОГО ПОЛЯ
903
Рис. 3. Спектры триптофановой флуоресценции растворов ЧСA (1·10-6 М) после обработки ЭМП разной частоты при
рН 3.0. Время обработки образцов 15 мин, t = 23°C, λвозб = 295 нм.
где Iсум.f - интегральная флуоресценция раствора
кислотных остатков альбумина в центре, содер-
ЧСA в диапазоне от 270 до 440 нм после обработ-
жащем триптофан, для молекул воды и АФК и об
ки ЭМП с соответствующей частотой, Iсум.К -
уплотнении гидрофобного окружения Тrp-214.
интегральная флуоресценция раствора ЧСA в от
При других значениях рН величина Iот ниже ин-
270 до 440 нм без обработки ЭМП.
тегральной флуоресценции раствора ЧСА без об-
На рис. 4. приведены зависимости интеграль-
работки ЭМП (на рис. 4 показана пунктиром).
ных значений флуоресценции Iот водных раство-
Значения квантовых выходов триптофановой
ров ЧСA от частоты ЭМП при значениях рН от 3.0
до 6.5.
флуоресценции растворов ЧСA изменяются при
рН 4.5-5.5 c 0.041 до 0.070 и при рН 7.0 - с 0.040
Видно, что воздействие ЭМП приводит к уве-
до 0.048 после обработки ЭМП частотой 8 Гц
личению Iот растворов ЧСA, имеющих рН 4.5, что
(табл. 1). Это также является доказательством из-
близко к значению изоэлектрической точки. По-
менений окружения флуорофоров в молекуле
ложение максимума флуоресценции при этом
оставалось практически неизменным. Это свиде-
альбумина, происходящих под действием низко-
тельствует об уменьшении доступности амино-
интенсивного электромагнитного поля.
Рис. 4. Усредненные зависимости интегральной интенсивности флуоресценции растворов ЧСA (1·10-6 М) от частоты
ЭМП при разных значениях рН. Время обработки образцов 15 мин, t = 23°C.
БИОФИЗИКА том 68
№ 5
2023
904
ТЕКУЦКАЯ и др.
Таблица 1. Квантовый выход триптофановой флуоресценции водных растворов сывороточного альбумина (1·10-6 М)
с различными значениями рН после обработки ЭМП частотой 8 Гц
Квантовый выход
рН
Квантовый выход после обработки ЭМП
до обработки ЭМП
3.0
0.069 ± 0.001
0.072 ± 0.002
3.5
0.065 ± 0.002
0.068 ± 0.001
4.5
0.041 ± 0.001
0.057 ± 0.002
5.5
0.058 ± 0.001
0.071 ± 0.001
6.5
0.035 ± 0.002
0.035 ± 0.001
7.0
0.040 ± 0.002
0.048 ± 0.002
МОДЕЛЬ ВОЗДЕЙСТВИЯ
Освободившийся в результате протекания ре-
НИЗКОЧАСТОТНОГО
акции (5) протон снова может взаимодействовать
ЭЛЕКТРОМАГНИТНОГО ПОЛЯ НА ВОДНЫЕ
с ридберговским е-Rg макромолекулы. Таким об-
РАСТВОРЫ БИОПОЛИМЕРОВ
разом, протекание реакций (1)-(4) приводит к
В разбавленных растворах биополимеров про-
накоплению в водном растворе биополимера пе-
цессы образования АФК протекают по типу хи-
рекиси водорода, синглетного кислорода и су-
мического осциллятора [17]. Начальной стадией
пероксид-иона. С ростом содержания перекиси
является инициация процесса - присоединение
водорода супероксид-ион способствует ее разло-
жению с образованием гидроксильного радикала
электрона е- с ридберговски возбужденных уров-
[20]:
ней макромолекул (например, ДНК) [18] к сво-
бодным протонам воды с образованием радикала
Н2О2 + О2-• → ОН- + ОН• + О2.
(6)
водорода:
Присутствие синглетного кислорода в ней-
Н+ + е-Rg → H•.
(1)
тральной и слабощелочной среде приводит к
дальнейшему образованию супероксид-иона:
При нейтральном рН радикал водорода взаи-
модействует с молекулами растворенного кисло-
ОН- + 1О2 → ОН• + О2-•.
(7)
рода, концентрация которых на 3 порядка выше,
Дисмутация гидроксильного радикала приво-
чем концентрация протонов и гидроксид-ионов
дит к образованию перекиси водорода:
(1017 против 1014 молекул/см3) [19], образуя гид-
2ОН• → Н2О2.
(8)
роперекисный радикал:
С ростом рН перекись способна самопроиз-
Н• + О2 → HO2-•.
(2)
вольно распадаться с подкислением среды:
Дальнейшее образование перекиси происхо-
Н2О2 → Н+ + HO2- (рКа ~ 11.5)
(9)
дит двумя способами:
или с образованием синглетного кислорода:
HO2-• + H• → Н2О2
(3)
Н2О2 → 2 Н2О + 1О2.
(10)
или
Самораспад перекиси по реакции (10) имеет
2HO2-• → Н2О2 + 1О2 + hv.
(4)
порядок от 1 до 2 и приводит к образованию син-
глетного кислорода 1О2, который вновь участвует
По мере увеличения концентрации перекиси
водорода по реакциям (3) и (4) рН раствора рас-
в цикле взаимопревращений АФК. Введя обозна-
тет. При нейтральных и щелочных рН водного
чение ki для констант скоростей реакций (1)-
окружения гидроперекисный радикал распадает-
(10), запишем соответствующие кинетические
ся с образованием супероксид-иона:
уравнения для скорости образования в разбав-
ленных водных растворах биополимеров разных
HO2-• → Н+ + О2-• (рКа ~ 4.8).
(5)
АФК в общем виде:
БИОФИЗИКА том 68
№ 5
2023
МЕХАНИЗМ ДЕЙСТВИЯ НИЗКОЧАСТОТНОГО ЭЛЕКТРОМАГНИТНОГО ПОЛЯ
905
d [Н•] = k1[Н+][е-Rg] - k2[Н•][О2] - k3[Н•][НО2-•],
(11)
dt
d [НО2•] = k2[Н•][НО2-•] - k4[НО2-•]2 - k3 [НО2-•][Н•] - k5[НО2-•],
(12)
dt
d [1О2] = k4[НО2-•]2 - k7[1О2][OН-] + k10[Н2О2],
(13)
dt
d [О2-•] = k5[НО2-•] - k6[Н2О2][О2-•] + k7[ОН-],
(14)
dt
d
[OH•] = k6[Н2О2][О2-•-] + k7[OH-][1О2] - k8[OH•],
(15)
dt
d [Н2О2] = k3[Н•][НО2•] + k4[НО2•]2 + k8[OH•]2 - k6[Н2О2][О2-•] - k9[Н2О2] - k10[Н2О2].
(16)
dt
Используем условие постоянства промежуточ-
уравнений (11)—(16) получаем выражение для
ных продуктов в системе (1)—(10) и упрощение
скорости образования наиболее устойчивой и
кинетической модели производства и убыли пе-
долгоживущей АФК — перекиси водорода:
рекиси водорода. В результате решения системы
2
k
k
k
1
4
2
d [Н2О2] =
[OH-][е-Rg] +
[О2]2 - k10[Н2О2].
(17)
dt
2
2
k
3
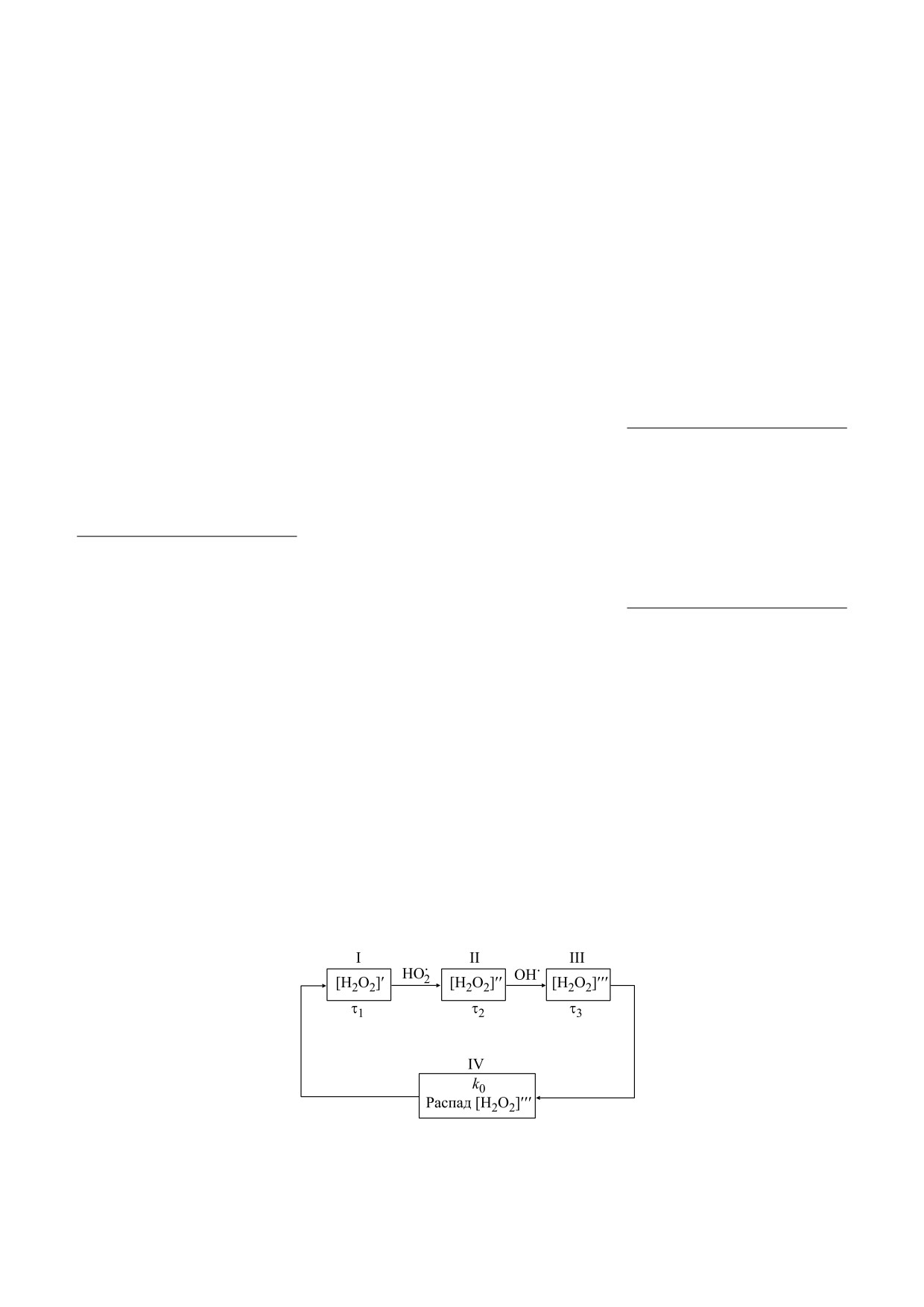
Из уравнения (17) следует, что в разбавленных
биополимеров. Реакции образования перекиси
растворах биополимеров скорость накопления
водорода, протекающие согласно уравнениям
перекиси водорода зависит от рН раствора, кон-
(1)-(8), разделим на три группы: первая группа -
инициация цикла и первоначальное образования
центрации электронов е-Rg с ридберговски воз-
Н2О2 описывается уравнениями (1)-(3), на рис. 5
бужденных уровней макромолекул и концентра-
обозначена как I; вторая группа - реакции с уча-
ции растворенного кислорода, что частично сов-
стием синглетного кислорода, описываются
падает с выводами, приведенными в работе [21].
уравнениями (4)-(8), на рис. 5 обозначена как II;
Периодическое накопление и разложение пере-
третья группа - уравнение (8), обозначена как III.
киси водорода и определяют периодичность всего
Отдельным блоком IV выделены процессы распа-
цикла взаимопревращений в химическом осцил-
да перекиси водорода согласно реакциям (9)-
ляторе АФК.
(10), они протекают эффективно при накоплении
Рассмотрим образование химического осцил-
достаточного количества Н2О2 в растворе, k0 -
лятора взаимопревращений АФК в водных рас-
степень распада перекиси водорода.
творах биополимеров. На рис. 5 приведена упро-
щенная схема превращений Н2О2 в ходе протека-
Введем величину τ - время увеличения кон-
ния химических реакций в водных растворах центрации [Н2О2] в каждом цикле реакций в е
Рис. 5. Схема взаимопревращений перекиси водорода в водном растворе биополимера в ходе протекания реакций (1)—(10).
БИОФИЗИКА том 68
№ 5
2023
906
ТЕКУЦКАЯ и др.
раз. Величина τ учитывает не только время на-
d
IV
1
IV
1
III
[H
O
]
+
[H
O
]
=
[H
O
]
,
(20)
копления перекиси водорода, но и время жизни и
2
2
2
2
2
2
dt
τ
3
τ
3
диффузии соответствующих ионов и радикалов в
каждой группе реакций.
I
IV
[H
2
O
2
]
=-k
0
[H
2
O
2
]
(21)
Для процесса взаимопревращения переки-
С учетом протекания реакций распада переки-
си водорода в химическом осцилляторе АФК
си водорода и уменьшения ее концентрации по-
можно записать:
казатель k0 в уравнении (21) имеет знак «-». Пре-
II
d[H
O
]
1
II
1
I
образовав систему уравнений (18)-(21) и отбро-
2
2
+
[H
O
]
=
[H
O
]
,
(18)
2
2
2
2
сив член, содержащий третью производную,
dt
τ
τ
1
1
ввиду его малости, получим окончательное урав-
d
III
1
III
1
II
нение для изменения концентрации перекиси во-
[H
2
O
2
]
+
[H
2
O
2
]
=
[H
2
O
2
]
,
(19)
dt
τ
τ
дорода в водном растворе биополимера:
2
2
2
d
τ
+
τ
+
τ
d
k
+1
1
2
3
0
[H
O
+
[H
O
+
[H
O
]
=
0.
(22)
2
2
2
2
2
2
2
dt
ττ
1
2
+
1
3
ττ + τ τ
2
3
dt
ττ1
2
+
1
3
ττ + τ τ
2
3
Уравнение (22) является дифференциальным
жет воздействовать на магнитные моменты элек-
уравнением свободных колебаний, возникающих
тронов с ридберговски возбужденных уровней
в гармоническом осцилляторе [22]. В этом урав-
макромолекул [17]. Кроме того, в водных раство-
нении выражение перед [Н2О2] есть квадрат ча-
рах биополимеров имеются радикальные пары с
стоты собственных колебаний в химическом ос-
различными g-факторами партнеров (например,
цилляторе:
Н•, НО2-•, ОН•). Магнитная составляющая
2
k
+1
ЭМП, по-видимому, ориентирует спины биради-
0
ω
0
=
,
τ
τ
+
τ
τ
+
τ
τ
кальных пар (например, Н• и О2), меняя их по-
1
2
1
3
2
3
движность, что возвращает нас к теории взаимо-
d
а выражение перед
[H
O
]— показатель затуха-
действия триплет-синглетных пар, разработан-
2
2
dt
ной А.Л. Бучаченко
[23]. При действии
ния колебаний концентраций перекиси водорода
магнитной составляющей ЭМП на растворенный
в химическом осцилляторе:
в воде О2 (триплетный, парамагнитный) возмож-
τ
1
+
τ
2
+
τ
3
но изменение скорости реакции (2) с образовани-
δ
=
ем гидроперекисного радикала - лимитирующей
τ
1
τ
2
+
τ
1
τ
3
+
τ
2
τ
3
стадии и ключевой реакции цикла образования
С учетом этого уравнение (22) примет вид:
АФК, ответственной за суммарный выход пере-
2
киси водорода и синглетного кислорода. Таким
d
d
2
[H
O
+
δ
[H
O
+
ω
[H
O
]
=
0.
(23)
2
2
2
2
2
0
2
2
образом, возможно преобразование сигнала маг-
dt
dt
нитной составляющей вначале в химический, а
Рассмотрим влияние низкочастотного ЭМП, в
затем и в биохимический отклик.
котором преобладает магнитная составляющая,
Все вышесказанное позволяет предположить,
на выход перекиси водорода в водном растворе
что под влиянием ЭМП приращение концентра-
биополимера. Магнитная составляющая ЭМП,
ции перекиси водорода изменяется пропорцио-
изменяющаяся синусоидально, описывается
нально напряженности магнитной составляю-
уравнением H = Hm sinωt.
щей:
Как отмечалось выше, согласно уравнению
Δ[H2O2] = αHmsinωt,
(17) в растворах биополимеров скорость накопле-
ния перекиси водорода зависит от рН, концен-
где α — коэффициент пропорциональности.
трации электронов с ридберговски возбужденных
В результате колебания, возникающие в хими-
уровней макромолекул и концентрации раство-
ческом осцилляторе, станут вынужденными и для
ренного О2. Магнитная составляющая ЭМП мо-
них будет справедливо уравнение
2
d
d
2
[H
O
+
δ
[H
O
+
ω
[H
O
]
=
αH t
(24)
2
2
2
2
2
0
2
2
m
dt
dt
БИОФИЗИКА том 68
№ 5
2023
МЕХАНИЗМ ДЕЙСТВИЯ НИЗКОЧАСТОТНОГО ЭЛЕКТРОМАГНИТНОГО ПОЛЯ
907
Решение такого неоднородного уравнения
Для определения амплитуды вынужденных
равно сумме общего решения однородного урав-
колебаний [H2O2]м в уравнение (24) подставим
нения (22), характеризующего затухающий про-
значения первой и второй производной уравне-
цесс образования перекиси водорода, возникаю-
ния
щий после скачкообразного приложения внеш-
d
него воздействия, и частного решения, которое
[H
O
]
=
[H
O
] cos(ωt
+
φ),
(27)
2
2
2
2
м
описывает установившийся колебательный про-
dt
цесс под действием приложенной вынуждающей
2
d
2
[H
O
]
=-ω
[H
O
] sin(ωt
+
φ)
(28)
силы.
2
2
2
2
2
м
dt
Общее решение записывается в виде:
Подставляя выражение (28) в уравнение (25),
[H2O2] = [H2O2]м0e-δtsin(ω0t + φ0),
(25)
получим значение амплитуды вынужденного
колебания концентрации перекиси водорода под
где [H2O2]м0 - амплитуда свободных колебаний
воздействием ЭМП:
концентрации
перекиси
водорода,
1/2
2
2
2
2
2
2
2 1/2
[H
O
]
=
αH
(ω
−
δ
)
+
4δ
ω
(29)
ω
=
(ω
-
δ
)
2
2
м
m
(
0
)-
0
Частное решение имеет вид:
Если потери в химическом осцилляторе неве-
лики, а частота вынуждающей силы незначитель-
[H2O2] = [H2O2]мsin(ω0t + φ0),
(26)
но отличается от собственной частоты взаимо-
где [H2O2]м - амплитуда вынужденных колеба-
превращений перекиси водорода в химическом
ний концентрации перекиси водорода под воз-
осцилляторе, то получим решение исходного
действием ЭМП.
уравнения (24) в следующем виде:
[H2O2] = [H2O2]м0e-δtsin(ω0t + φ) + [H2O2]мsin(ωt + φ),
(30)
2
2
2
2
2
1/2
ω картина меняется. Частота генерации
где
[H
2
O
2
]
м
=
αH
m
(
(ω
0
−
δ
)
+
4δ
ω
)-
,
ϕ - на-
ω0 «подтягивается» к частоте внешнего ЭМП и
чальная фаза, которая при сделанных допущени-
при некотором значении Δω = ω0 - ω, зависящем
ях одинакова как для затухающих, так и для неза-
от соотношения амплитуд, химической осцилля-
тухающих колебаний.
тор начинает работать точно на частоте ω0 = ω без
Из анализа выражения (30) следует, что ре-
каких-либо признаков модуляции. Частота хими-
зультирующее колебание содержания перекиси
ческого осциллятора перекиси водорода оказыва-
водорода является суммой двух колебаний, име-
ется синхронизирована частотой вынуждающего
ющих разные частоты. Численное соотношение
между частотами колебаний в системе химиче-
воздействия - ЭМП. При увеличении внешней
ского осциллятора и внешнего поля в целом
частоты ω период автоколебаний концентрации
определяет характер переходного процесса.
перекиси водорода может перестраиваться таким
образом, чтобы быть кратным периоду внешних
Таким образом, поведение химического ос-
циллятора АФК, находящегося под действием
колебаний. Таким образом, может происходить
внешнего низкоинтенсивного ЭМП, существен-
резонансное взаимодействие внешнего воздей-
но зависит от амплитуды и частоты ω этого поля.
ствующего ЭМП и химического осциллятора.
При этом различаются отдельные случаи:
Предложенная модель не касается биофизиче-
1. Если частота ω0 химического осциллятора
ской природы мишени и учитывает лишь харак-
взаимопревращений перекиси водорода значи-
тер ее взаимодействия с окружением.
тельно больше частоты ω внешнего ЭМП, то дей-
ствие поля сводится к эффекту модуляции авто-
Рассмотренный нами цикл автоколебаний в
колебаний осциллятора колебаниями поля, кото-
водных растворах биополимеров перекиси водо-
рый проявляется в изменении амплитуды
рода является, возможно, доминирующим. Хотя
колебаний концентрации перекиси водорода.
одновременно могут существовать и несколько
Это приводит к увеличению/уменьшению выхода
параллельно действующих химических осцилля-
перекиси водорода в растворе биополимера.
торов превращений отдельных форм АФК, каж-
2. С приближением частоты химического ос-
дый из которых будет иметь собственную частоту
циллятора перекиси водорода ω0 к частоте ЭМП колебаний.
БИОФИЗИКА том 68
№ 5
2023
908
ТЕКУЦКАЯ и др.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
процессов тушения вследствие разрушения тре-
тичной̆ структуры белка. При действии ЭМП
Предложенная модель преобразования сигна-
происходят изменения в центре связывания мо-
ла магнитной составляющей низкочастотного
лекулы альбумина, содержащий Trp, а именно
электромагнитного поля в химический и биохи-
увеличение (разрыхление) F-формы ЧСA и от-
мический отклик в водных растворах биополиме-
крытие гидрофобной зоны (F'→F-переход). Это
ров на основе нуклеиновых кислот и белков
приводит к проникновению молекул воды в дан-
находится в качественном соответствии с полу-
ный центр, взаимодействию образующихся в во-
ченными экспериментально частотными зависи-
де АФК с ароматическим кольцом Тrp и тушению
мостями. Так, значительное резонансоподобное
его флуоресценции. Среди других мест окисле-
увеличение содержания перекиси водорода в рас-
ния ЧСA возможны гистидин и метионин.
творах ДНК при воздействии электромагнитным
полем частотами 3-8 и 50 Гц (рис. 2), а также по-
Тушение триптофановой флуоресценции ЧСA
явление синглетного кислорода (рис. 1), приво-
при обработке ЭМП указывает на одностадий-
дят к увеличению уровня окисленных модифика-
ный характер денатурации альбумина при pH > pI
ций азотистых оснований в ДНК. Как было экс-
ЧСA - разрыхлении белковых глобул и измене-
периментально показано в работе [6], обработка
ние конформационных состояний с разными
образцов крови магнитным полем данными ча-
временами жизни возбужденного состояния. В
стотами (3 и 50 Гц) приводит к достоверному (в
такиx cоcтоянияx флуоресцентные характеристи-
1.5 раза) повышению уровня содержания 8-гид-
ки Тrp в ЧСA опpеделяютcя не только положени-
рокси-2-деоксигуанозина (8-ОНdG) в геномной
ем индольного кольца как таковым, но и xаpак-
ДНК - одного из ключевых биомаркеров окисли-
теpом взаимодейcтвия флуоpофоpа c аминокис-
тельных повреждений нуклеиновых кислот, опо-
лотным окpужением, котоpое также может
средованных с генерацией АФК. При нарушении
влиять на cтепень завеpшенноcти pелакcацион-
процессов репарации ДНК накопление окисли-
ныx пpоцеccов за вpемя жизни возбужденного
тельных повреждений может привести к дальней-
cоcтояния [15]. Полученные эффекты согласуют-
шим структурным изменениям ДНК, в частно-
ся с выводами авторов статьи [24], в которой по-
сти, к появлению одно- и двунитевых разрывов.
казано, что обработка ЭМП водных растворов
альбуминов приводит к существенным измене-
Образующиеся в ходе резонансного взаимо-
ниям белковых макромолекул и обусловлены, хо-
действия низкочастотного электромагнитного
тя бы частично, изменением свойств водной фа-
поля и химического осциллятора повышенные
зы. О возможностях оценки параметров измене-
количества АФК атакуют нуклеофильные центры
ния гидратной оболочки белков при различных
белков, повреждая их. Кислотные (N → F`→ F → Е)
внешних воздействиях указывают и авторы рабо-
и основные (N → B) переходы альбумина сопро-
ты [25].
вождаются увеличением доступности и актив-
Иными словами, деформация молекулярной
ности этих нуклеофильных центров при измене-
структуры альбумина при не очень больших воз-
нии рН.
действиях низкочастотным ЭМП может быть
В ЧСA многие аминокислоты подвержены мо-
связана с окислением аминокислотных остатков
дификациям, обусловленным действием АФК, в
и локализоваться именно в неплотно упакован-
частности, гидроксильными радикалами и су-
ных участках, не приводя к полному разрушению
пероксид-анион-радикалами. Так, аминокисло-
структуры молекулы. При этом могут происхо-
ты, входящие в состав ЧСA, активно снижают вы-
дить окислительно-восстановительные модифи-
ход перекиси водорода, являясь эффективными
кации сульфгидрильных и гидроксильных групп
белков. Это предотвращает дальнейшую денату-
перехватчиками гидроксильных радикалов: Trp -
рацию белка.
на 70%, Tyr - на 80% и His - на 36%. Как извест-
но, из всех аминокислот наиболее эффективным
Таким образом, основываясь на теоретических
тушителем синглетного кислорода является Trp,
выкладках и экспериментальных результатах,
константа скорости тушения синглетного кисло-
можно сделать вывод о возможности увеличе-
ния/уменьшения выхода перекиси водорода в
рода триптофаном, полученная с помощью урав-
водных растворах биополимеров в процессе воз-
нения Штерна-Фольмера, составляет
(4.6
±
действия на них низкоинтенсивным низкоча-
± 0.6)·107 1/М·с [16]. Наблюдаемые батоxpомные
стотным электромагнитным полем. Если воздей-
сдвиги соответствующих спектров флуоресцен-
ствие низкочастотного электромагнитного поля,
ции ЧСА (рис. 3) связаны, вероятно, c увеличени-
опосредованное генерацией АФК в водной среде,
ем подвижности микроокружения аминокислот-
на ДНК носит в основном повреждающий харак-
ных остатков Тrp и Tyr в альбумине и усилением
тер (либо окислительный, либо структурный), то
БИОФИЗИКА том 68
№ 5
2023
МЕХАНИЗМ ДЕЙСТВИЯ НИЗКОЧАСТОТНОГО ЭЛЕКТРОМАГНИТНОГО ПОЛЯ
909
белки претерпевают в основном конформацион-
5.
D. Lingvay, A. G. Bors, and A. M. Bors, Electrotehni-
ные переходы. Изменения состояния биополиме-
ca, Electronica, Automatica, 66 (2), 5 (2018).
ров вызывают дальнейшие изменения на уровне
6.
Е. Е. Текуцкая, М. Г. Барышев, Л. Р. Гусарук и
систем, клеток [26] и поведения целого организма
Г. П. Ильченко, Биофизика, 65 (4), 664 (2020).
[27].
DOI: 10.31857/S0006302920040055
7.
Y. Wang, X. Liu, Y. Zhang, et al., Biol. Open, 8,
bio041293 (2019). DOI: 10.1242/bio.041293
ЗАКЛЮЧЕНИЕ
8.
C. A. Buckner, A. L. Buckner, S. A. Koren, et al., PloS
Предложен механизм преобразования сигнала
One, 10 (4), e0124136 (2015). DOI: 10.1371/jour-
магнитной составляющей низкочастотного элек-
nal.pone.0124136
тромагнитного поля в химический и биохимиче-
9.
F. Sanie-Jahromi and M. Saadat, Mol. Biol. Reports,
ский отклик в водных растворах биополимеров на
45, 807 (2018). DOI: 10.1007/s11033-018-4223-7
основе нуклеиновых кислот и белков. Результа-
10.
С. В. Смирнова, С. В. Гудков и В. И. Брусков, 8-Ок-
том описанного механизма является изменение
согуанин и продукты его окисления. Образование в
концентрации перекиси водорода, определяемое
ДНК под действием тепла, ионов уранила и гамма-
выражением (30), под действием электромагнит-
излучения (Lambert Acad. Publ., Saarbrucken, 2011).
ного поля в химическом осцилляторе АФК. Этот
процесс имеет резонансный характер. Резонанс
11.
Е. Б. Менщикова, В. З. Ланкин, Н. Л. Зенков и др.,
наступает, когда частота внешнего поля совпада-
Окислительный стресс. Прооксиданты и антиокси-
ет (или кратна) собственной частоте химического
данты (Слово, М., 2006).
осциллятора. Изменение концентрации АФК в
12.
Е. Е. Текуцкая, М. Г. Барышев, Е. Е. Тумаев и
водном растворе позволяет объяснить экспери-
Г. П. Ильченко, Биофизика, 65 (3), 479 (2020).
ментально наблюдаемые эффекты влияния низ-
DOI: 10.31857/S0006302920030060
кочастотного электромагнитного поля на биохи-
13.
А. Н. Герасимов, Медицинская статистика (ООО
мические процессы.
«Медицинское информационное агентство», М.,
Следует учесть, что предложенная модель не
2007).
рассматривает биофизическую природу мишени
14.
С. В. Гудков, О. Э. Карп, С. А. Гармаш и др., Био-
и учитывает лишь характер ее взаимодействия с
физика, 57 (1), 5 (2012).
окружением. Магнитная составляющая низкоча-
15.
Е. В. Немцева, О. О. Лащук и М. А. Герасимова,
стотного электромагнитного поля может воздей-
Биофизика, 61 (2), 231 (2016).
ствовать на бирадикальные магнитохимические
16.
Д. Н. Буторина, А. А. Красновский мл. и А. В. При-
реакции химического осциллятора АФК, изме-
езжев, Биофизика, 48 (2), 201 (2003).
няя константы скорости их образования. Исходя
17.
С. В. Гудков, О. Э. Карп, С. А. Гармаш и др., Био-
из этого, рассматриваемая проблема требует бо-
физика, 57 (1), 5 (2012).
лее детального изучения с учетом биофизической
природы мишени, что авторы предполагают сде-
18.
С. В. Авакян и Л. А. Баранова, Биофизика, 64 (1),
лать в дальнейшем.
12 (2019).
19.
Л. В. Беловолова, Оптика и спектроскопия, 128
(7), 923 (2020).
КОНФЛИКТ ИНТЕРЕСОВ
20. Н. Л. Лаврик и Н. М. Бажин, Биофизика, 56 (3),
Авторы заявляют об отсутствии конфликта
574 (2011).
интересов.
21. В. О. Пономарев и В. В. Новиков, Биофизика, 54
(2), 235 (2009).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
22. Т. И. Трофимова, Курс физики. Учебное пособие для
вузов (Издательский центр «Академия», М., 2006).
Настоящая работа не содержит описания ка-
23. А. Л. Бучаченко, Успехи химии, 83 (1), 1 (2014).
ких-либо исследований с использованием людей
и животных в качестве объектов.
24. Ю. В. Цейслер, В. С. Мартынюк, А. Ю. Артеменко
и Н. С. Мирошниченко, Физика живого, 17 (1), 94
(2009).
СПИСОК ЛИТЕРАТУРЫ
25. Е. В. Рубцова, А. Б. Соловей и В. И. Лобышев,
1. В.Н. Бинги, Биофизика, 61 (1), 201 (2016).
Биофизика, 59 (6), 1071 (2014).
2. J. L. Phillips, N. P. Singh, and H. Lay, Pathophysiolo-
26. Е. Е. Текуцкая, Л. Р. Гусарук и Г. П. Ильченко,
gy, 16, 79 (2009).
Биофизика,
67
(1),
113
(2022).
DOI:
3. Л. Н. Галль, Физические принципы функционирова-
10.31857/S0006302922010112
ния материи живого организма (Изд-во политехн.
27. Е. Е. Текуцкая, И. С. Рябова, С. В. Козин и др.,
ун-та, СПб., 2014).
Бюл. эксперим. биологии и медицины, 172 (11),
4. В. В. Новиков, В. О. Пономарев, Г. В. Новиков
602 (2021). DOI: 10.47056/0365-9615-2021-172-11-
и др., Биофизика, 55 (4), 631 (2010).
602-606
БИОФИЗИКА том 68
№ 5
2023
910
ТЕКУЦКАЯ и др.
Mechanism of Action of the Low-Frequency Electromagnetic Field on Aqueous
Solutions of Biopolymers
E.E. Tekutskaya*, G.P. Ilchenko*, and M.G. Baryshev**
*Kuban State University, Stavropol’skaya ul. 149, Krasnodar, 350040 Russia
**Kuban State Technological University, Moskovskaya ul. 2, Krasnodar, 350000 Russia
This paper presents the mechanism of signal transformation by which a signal from the magnetic component
of the low-frequency electromagnetic field with extremely low energy is changed into chemical and biochem-
ical signals which elicit a biological response in aqueous solutions of biopolymers based on nucleic acids and
proteins. A theoretical model developed shows that the basis of oxidative DNA damage and conformational
transitions of proteins is a universal mechanism associated with a change in the amount of the most long-lived
form - hydrogen peroxide in a chemical oscillator of mutual transformations of reactive oxygen species under
the influence of low-intensity electromagnetic field exposure. It has been experimentally established that the
quantitative content of hydrogen peroxide in solutions of biopolymers resonantly depends on the frequency
of applied field. Conformational changes in proteins are accompanied by an increase in the availability and
activity of the nucleophilic centers that are potential targets for reactive oxygen species. Complete unfolding
and denaturation of the amino acid chain of the protein under the influence of low-frequency electromag-
netic field exposure do not occur. It has been shown that enhanced hydrogen peroxide formation at 3 Hz and
50 Hz leads to oxidative modification of nitrogenous bases in DNA.
Keywords: low-frequency electromagnetic field, reactive oxygen species, hydrogen peroxide, biopolymers, DNA,
albumin, fluorescent spectroscopy
БИОФИЗИКА том 68
№ 5
2023