БИОФИЗИКА, 2023, том 68, № 5, с. 878-884
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
ИССЛЕДОВАНИЕ С ПОМОЩЬЮ СПЕКТРОСКОПИИ
КОМБИНАЦИОННОГО РАССЕЯНИЯ КОНФОРМАЦИИ
ФЛАВИНАДЕНИНДИНУКЛЕОТИДА -
КОФЕРМЕНТА ОКСИДАЗЫ D-АМИНОКИСЛОТ
© 2023 г. Ж.В. Бочкова*, В. Лю**, Н.А. Браже*, А.А. Жгун***, Г.В. Максимов*, #
*Биологический факультет, Московского государственного университета имени М.В. Ломоносова,
Ленинские горы, 2/12, Москва, 119234, Россия
**Биологический факультет Университета МГУ-ППИ,
ул. Гоцзидасюеюань, 1, район Лунган, Даюньсиньчэн, Шэньчжэнь, Провинция Гуандун, 518172, Китай
***ФИЦ «Фундаментальные основы биотехнологии» РАН, Ленинский просп., 33/2, Москва, 119071, Россия
#E-mail: gmaksimov@mail.ru
Поступила в редакцию 10.06.2023 г.
После доработки 26.06.2023 г.
Принята к публикации 05.07.2023 г.
С помощью серебряных наночастиц зарегистрированы и проанализированы спектры гигантского
комбинационного рассеяния оксидазы D-аминокислот из почки свиньи, а также выявлены харак-
терные спектральные параметры изменения конформации кофактора флавинадениндинуклеотида
при активации фермента D-аминокислотами. Установлено, что от субстратной специфичности
фермента зависит время, в течение которого регистрируются изменения конформации флавинаде-
ниндинуклеотида: в присутствии D-аланина на это требуется несколько секунд, а в присутствии D-
серина — минуты.
Ключевые слова: спектроскопия комбинационного рассеяния, серебряные наноструктуры, FAD, оксида-
за D-аминокислот.
DOI: 10.31857/S000630292305006X, EDN: PGUDSC
соответствующей α-кетокислоты и аммиака
Известно, что оксидаза D-аминокислот
[3].
(DAAO) является флавопротеином, актив-
ным центром которого служит флавинаде-
Известно, что фермент DAAO содержится в
ниндинуклеотид (FAD). DAAO вступает в
клетках дрожжей (например, Rhodotorula gracilis,
окислительно-восстановительные реакции
Trigonopsis variabilis [4]) и тканей высших организ-
селективно с D-аминокислотами (преимуще-
мов, в том числе человека. Различия в функцио-
нальности фермента DAAO, полученного из раз-
ственно нейтральными, такими как D-ала-
ных источников, определяются минимальными
нин, D-пролин и D-серин) [1]. На первой
отличиями в его трехмерной структуре [5]. Начи-
стадии ферментативной реакции образуется
ная с 1940-х годов структура фермента и его фи-
промежуточный комплекс (так называемый
зиологическая роль активно изучались. С одной
purple complex), включающий восстанов-
стороны, DAAO представляет интерес в качестве
ленный фермент и производную аминокис-
участника катаболизма D-аминокислот, вовле-
лоты - иминокислоту [2]. Далее, в аэробных
ченных в регуляторные процессы, например,
нейромодулятора D-серина в центральной нерв-
условиях фермент окисляется кислородом,
ной системе. D-серин является ко-агонистом
продуцируя пероксид водорода (Н2О2), а
N-метил-D-аспартатных рецепторов (NMDAR) и
иминокислота гидролизуется с образованием
накапаливается в астроцитах. Там же синтезиру-
ется фермент DAAO, который контролирует до-
Сокращения: DAAO - оксидаза D-аминокислот, FAD -
ступность этой аминокислоты в синапсах, в ко-
флавинадениндинуклеотид, КР - комбинационное рассе-
нечном счете влияя на уровень активации
яние, ГКР - гигантское комбинационное рассеяние.
878
ИССЛЕДОВАНИЕ С ПОМОЩЬЮ СПЕКТРОСКОПИИ
879
NMDAR-рецепторов, критически важных для
нии избытка аминокислот D-аланина или D-се-
обучения и памяти [5].
рина.
С другой стороны, H2O2, как продукт реакции,
Спектры ГКР регистрировали на конфокаль-
ном КР-микроспектрометре NTEGRA Spectra
также может влиять на ряд клеточных процессов
(NT-MDT, Зеленоград, Россия), соединенном с
в качестве сигнальной молекулы, окислителя и
инвертированным микроскопом IX-71 (Olympus,
защитного агента. Так, нарушения в продукции
H2O2 за счет изменений работы DAAO связывают
Япония) в диапазоне 300-2000 см-1, с шагом из-
с хроническими болезнями почек, где этот фер-
мерения 0.8 см-1, регистратор - ССD-детектор с
мент содержится в наибольшем количестве [6].
Пельтье-охлаждением (-50°С).
Ранее была доказана роль DAAO в нейронах
Кристаллический препарат DAAO (получен из
спинного мозга, как фактора, участвующего в
почки свиньи, Shanghai Yuanye Bio-Technology Co
развитии гиперчувствительности к боли [7]. Так-
Ltd, Китай) растворяли в натрий-фосфатном бу-
же известно, что в эпителиальных клетках кишеч-
фере (конечная концентрация белка 1 мг/мл).
ника фермент DAAO метаболизирует D-амино-
Раствор объемом 20 мкл помещали на дно чашки
кислоты, образуемые микробиотой, и выделяе-
Петри со стеклянным основанием (Metex), затем
мый пероксид водорода защищает организм от
в каплю опускали фрагмент стекла с серебряны-
возбудителя холеры и участвует в изменении со-
ми наноструктурами так, чтобы сторона с напы-
става микробиоты [8].
ленными серебряными наноструктурами была
В последнее время DAAO приобретает значи-
повернута ко дну чашки Петри - навстречу лазер-
мость в качестве инструмента локальной контро-
ному лучу. Фокусировали лазер на слое жидкости
лируемой продукции H2O2 для проведения ис-
около наноструктурированной поверхности, при
этом использовали объектив 20× с числовой
следований влияния активных форм кислорода
апертурой 0.45; диаметр области регистрации
на конкретные процессы, например, синаптиче-
~800 нм. Использовали лазерное возбуждение с
скую передачу в нейронах [9] и в качестве биосен-
длиной волны 532 нм и мощностью лазера не бо-
сера на различные D-аминокислоты [10].
лее 1 мВт, время накопления сигнала варьирова-
Ввиду перспективности использования DAAO
ло в разных сериях экспериментах и составляло 1
в биотехнологии, как селективного инструмента
или 60 с.
детекции D-аминокислот и способа локальной
Реакцию DAAO c субстратом инициировали,
генерации H2O2, становятся актуальными иссле-
примешивая к капле раствора (1 мг/мл) эквива-
дования различных этапов реакции DAAO с D-
лентную по объему каплю раствора D-аланина
аминокислотами. Метод спектроскопии комби-
(100 мМ) или D-серина (100 мМ) в натрий-фос-
национного рассеяния (КР) позволяет зафикси-
фатном буфере. Для регистрации динамики сиг-
ровать изменения в конформациях молекуляр-
нала КР от FAD-группы DAAO из почки свиньи в
ных структур, особенно обладающих сопряжен-
присутствии субстратов спектр снимали каждую
ными связями, каковыми являются флавиновые
секунду на протяжении первой минуты с момента
кофакторы. Сигнал КР можно усилить за счет эф-
внесения D-аминокислоты, а затем с интервалом
фекта плазмонного резонанса при использова-
в минуту.
нии наноструктур благородных металлов [11].
Синтез серебряных наноструктур осуществля-
В связи с этим мы поставили целью исследо-
ли по методике, разработанной ранее [12]. Для
вать изменение конформации FAD при взаимо-
начала 2.93 г нитрата серебра растворяли в 40 мл
действии DAAO с D-аминокислотами при
воды Milli-Q. Параллельно растворяли 7 г NaOH
помощи спектроскопии гигантского комбинаци-
в 30 мл воды и затем приливали тонкой струей
онного рассеяния (ГКР) с использованием сереб-
при перемешивании к раствору нитрата серебра.
ряных плазмонных наноструктур.
Выпавший в ходе реакции осадок оксида серебра
трижды промывали водой Milli-Q (по 100 мл), за-
тем к нему при постоянном перемешивании до-
МАТЕРИАЛЫ И МЕТОДЫ
бавляли 25 мл воды Milli-Q и 5 мл концентриро-
С помощью метода ГКР мы исследовали кон-
ванного раствора аммиака. В результате получали
формацию кофактора-FAD очищенного препа-
прозрачный раствор - аммиачный комплекс се-
рата оксидазы D-аминокислот, выделенной из
ребра. Покровные стекла, отмытые в детергенте и
почки свиньи, (Shanghai Yuanye Bio-Technology
выдержанные в течение 5 мин в ультразвуковой
Co Ltd, Китай) в окисленной форме и при внесе-
ванне, высушивали на воздухе и помещали в тер-
БИОФИЗИКА том 68
№ 5
2023
880
БОЧКОВА и др.
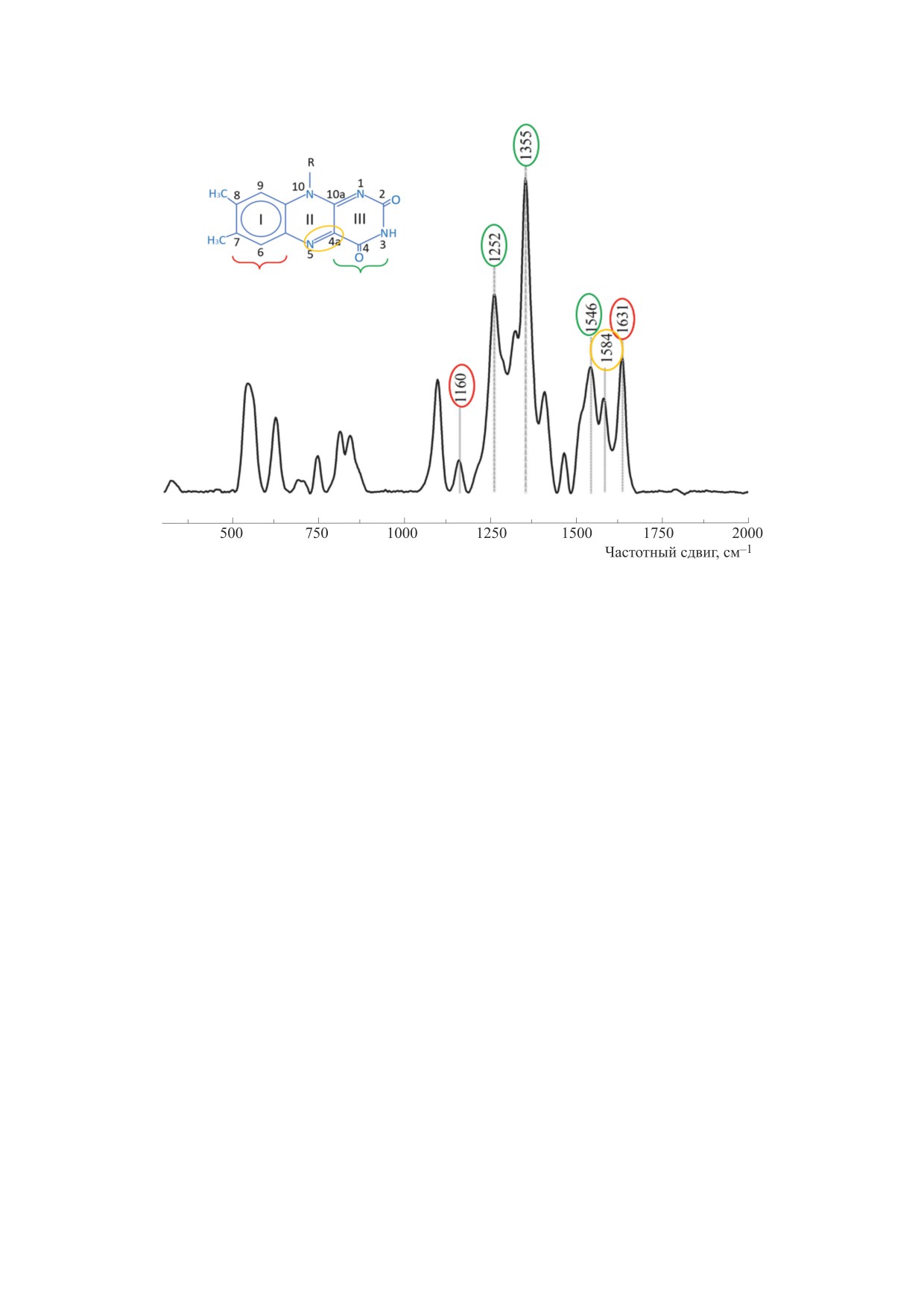
Рис. 1. Спектр ГКР фермента DAAO (раствор фермента в концентрации 1 мг/мл) в окисленном состоянии. Спектр
соответствует спектру окисленного кофактора-FAD. Длина волны возбуждения - 532 нм, мощность лазера - не более
1 мВт на область регистрации с диаметром 800 нм, время накопления спектра 60 с. Разными цветами обведены
положения максимумов характерных пиков на спектре и соответствующие им группы атомов на структурной формуле
FAD.
мически устойчивый стеклянный стакан на 1 л,
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
который устанавливали на поверхность, предва-
На рис. 1 представлен спектр ГКР FAD-груп-
рительно разогретую до 380°С. Раствор аммиач-
пы DAAO в окисленной форме. Отметим, что ре-
ного комплекса серебра переливали в емкость
ультразвукового распылителя (Альбедо ПМП, ТУ
гистрация КР-спектров без использования сереб-
9444-001-49917419-2010, Россия) (30 мл) и распы-
ряных наноструктур при тех же параметрах изме-
ляли на поверхность покровных стекол медлен-
рения и концентрации фермента не позволяла
ными круговыми движениями при нагревании до
определить положение отдельных пиков в одной
380°С, делая перерывы по 5 мин через каждые
группе (данные не представлены). В результате
3 мин. Расстояние сопла распылителя до покров-
анализа ГКР-спектров показано, что среди полос
ных стекол составляло 1.5-2.0 см. Далее стекла
наиболее выражены пики с положениями макси-
выдерживали в течение 15 мин при 400°С, после
мумов 1630, 1584, 1546, 1355, 1252, 1160 см-1, свя-
чего охлаждали и упаковывали в светонепрони-
занные с колебанием связей в одном из трех аро-
цаемые капсулы. В результате на стеклах форми-
матических колец кофермента FAD (табл. 1).
ровались сложные иерархические наноструктуры
из металлического серебра в виде пересекающих-
Известно, что у восстановленной формы фла-
ся колец максимальным диаметром в районе
вина меньше характерных пиков на КР-спектрах
50 мкм, покрытых сферическими частицами с
по сравнению с окисленной формой, что обу-
диаметром от нескольких единиц до десятков нм.
словлено изменениями в делокализации π-элек-
Полученные наноструктуры сохраняли плазмон-
тронных орбиталей в N(5)- и N(10)-атомах [16].
ные свойства в течение нескольких месяцев.
При добавлении к DAAO субстрата D-аланина
уже в течение 10 с были выявлены изменения по-
лос спектра ГКР, которые через 60 с стабилизиро-
вались.
БИОФИЗИКА том 68
№ 5
2023
ИССЛЕДОВАНИЕ С ПОМОЩЬЮ СПЕКТРОСКОПИИ
881
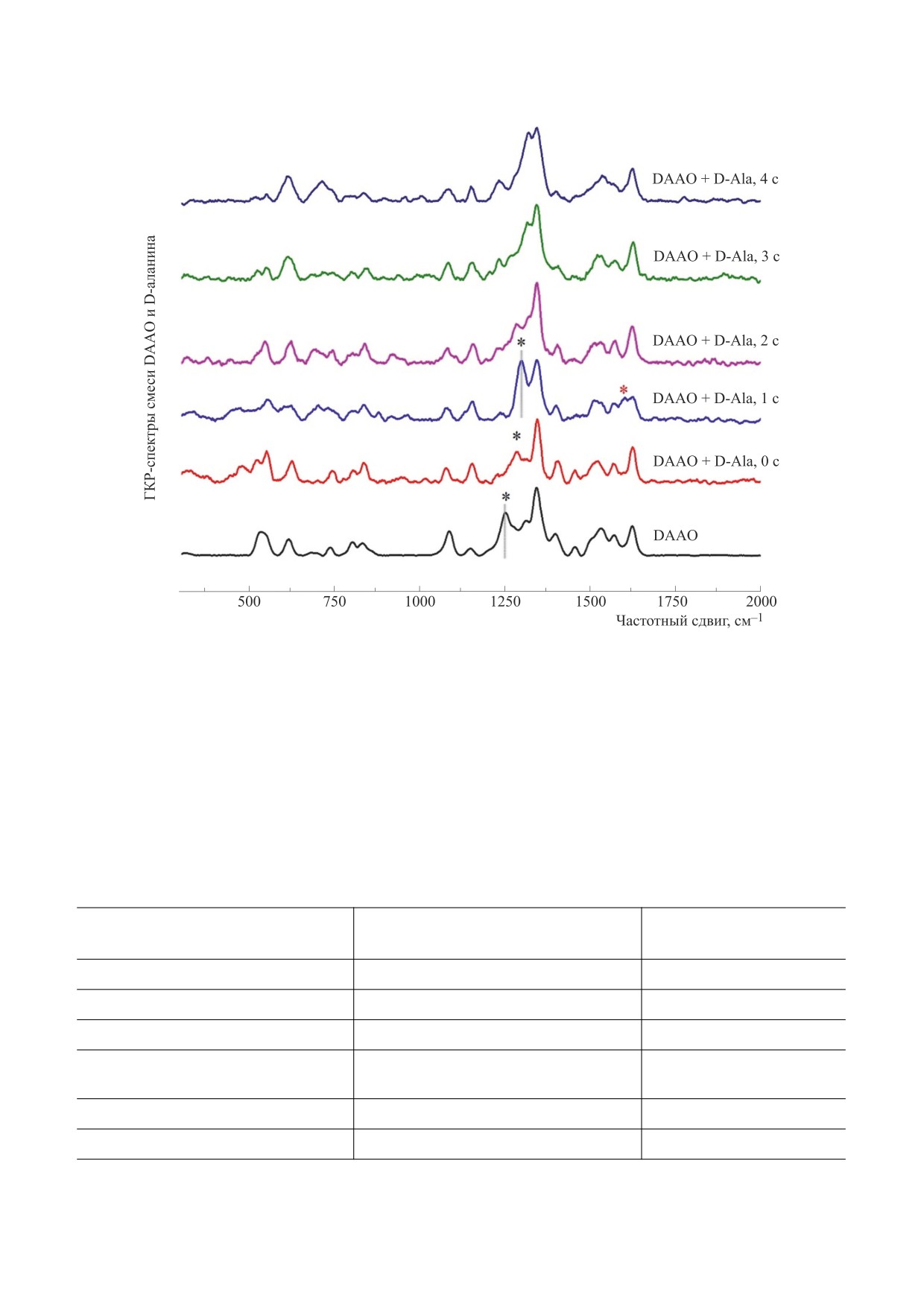
Рис. 2. ГКР-спектр DAAO при внесении избытка субстрата D-аланина (концентрация DAAO - 1 мг/мл, конечная
концентрация D-аланина в растворе с ферментом - 50 мМ). Длительность регистрации спектров составляла 1 с. На
спектре, зарегистрированном через 1 с после внесения D-аланина (спектр с пометкой «1 с»), звездочкой отмечен пик
1612 см-1, соответствующий восстановленной молекуле FAD. Символом # на спектрах «0 c» и «1 c» отмечен сдвиг пика
1252 см-1 к положению около 1300 см-1, что, вероятно, обусловлено изменением вклада колебаний водородной связи в
положении кольца III молекулы FAD-группы при стабилизации комплекса с D-аланином.
На рис. 2 представлена серия спектров ГКР,
спустя 1 с появляется пик 1612 см-1 (помечен
полученных через одну секунду после внесения
звездочкой на спектре «1 с»), который исчезает на
D-аланина к раствору DAAO. Установлено, что
3-й и последующих секундах и обусловлен либо
Таблица 1. Соотнесение пиков спектра ГКР фермента DAAO с колебаниями связей FAD-группы
Полосы спектра ГКР окисленного FAD
Предполагаемые колебания связей
Ссылка
из DAAO из почки свиньи, см-1
кофермента FAD
1160
Связи кольца I
[13]
1252
[C(2)-N(3)H-C(4)] кольца III
[13-15]
1355
[C(4a)-C(10a)-N(1)-C(2)] кольца III
[13, 14, 16]
[C(4a)-C(4)], [C(4a)-(10a)] связи
1546
[15, 16]
кольца III
1584
[C(4a)-N(5)] кольца II
[13-16]
1631
Связи кольца I
[14, 15]
БИОФИЗИКА том 68
№ 5
2023
882
БОЧКОВА и др.
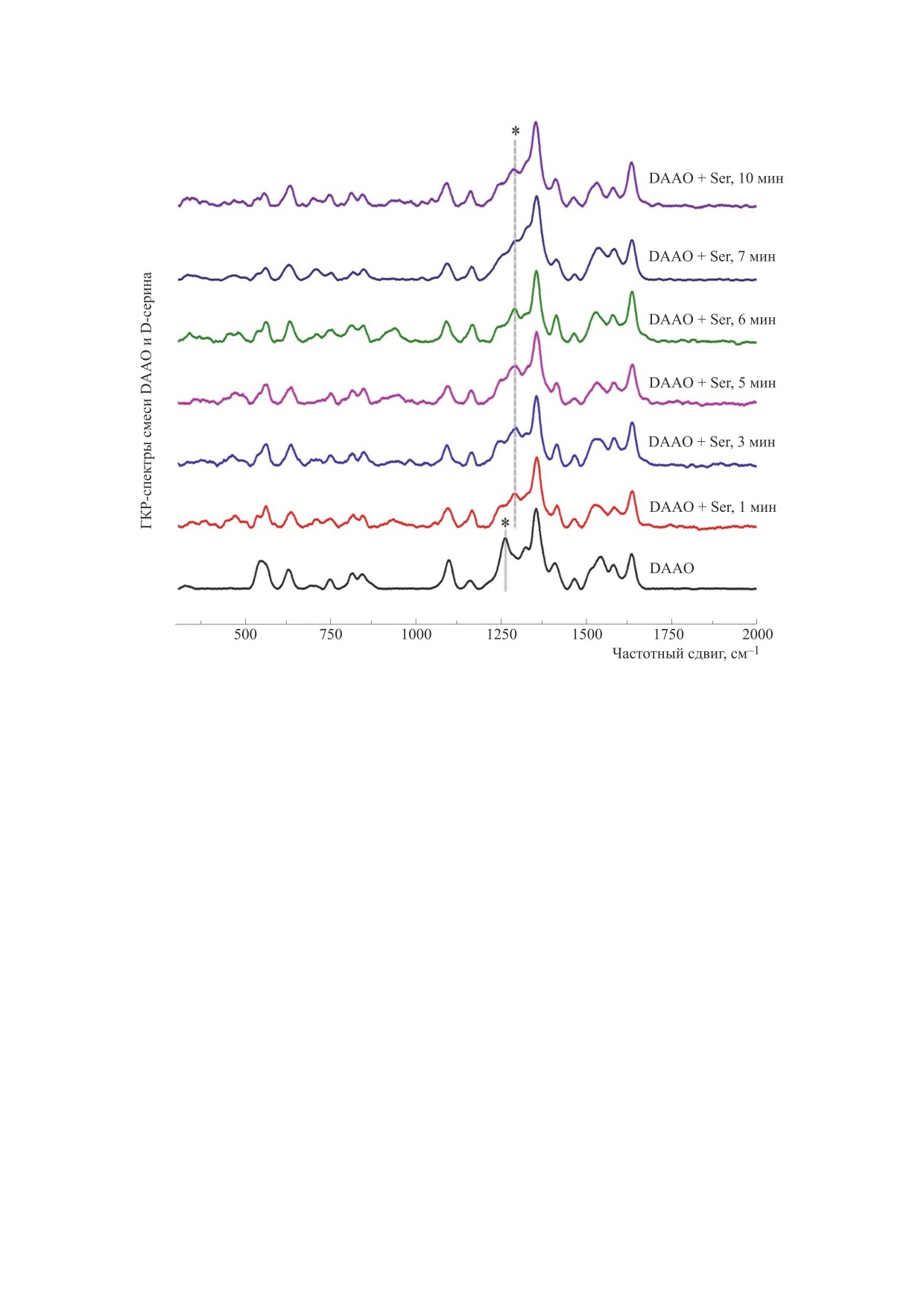
Рис. 3. ГКР-спектры DAAO в присутствии D-серина (концентрация фермента - 1 мг/мл, конечная концентрация D-
серина - 50 мМ). Звездочками обозначены изменение положения пика 1252 см-1.
семихинонной формой FAD [17], либо полностью
счет также электростатических взаимодействия
восстановленной формой флавина [18]. Также на
атомов в молекуле [5].
КР-спектре полученном через одну секунду по-
Вероятно, N(3)-Н-группа флавина непосред-
сле добавления D-аланина, пик 1252 см-1 исчеза-
ственно не участвует в ходе ферментативной ре-
акции, но стабилизация молекулы кофактора от-
ет, но появляется пик в районе 1300 см-1, кото-
носительно лиганда может влиять на изменение
рый также исчезает ко второй и третьей секундам.
водородной связи N(3)-Н∙∙∙R, что мы наблюдаем
Подобный сдвиг полос ГКР-спектра флавина
при внесении D-аланина к DAAO. Затем осу-
был обнаружен при замене водорода в позиции
ществляется повторное окисление восстановлен-
N(3)-H на дейтерий, а также при формировании
ного комплекса «фермент-аминокислота», и на
водородной связи N(3)-Н∙∙∙R [14]. В связи с этим
второй секунде мы видим исчезновение пика
полоса 1252 см-1 может служить индикатором со-
1612 см-1, в то время как пик в области 1600 см-1
стояния взаимодействия N(3)-H∙∙∙белок.
снова смещается в низкочастотную область ГКР-
спектра.
В ходе ферментативной реакции DAAO с ами-
нокислотой происходит ее дегидрирование и пе-
На рис.
3 представлены спектры DAAO
ренос водорода на N(5) флавина. При этом стаби-
(1 мг/мл), характеризующие динамику измене-
лизацию субстрата относительно фермента обес-
ния конформации FAD в присутствие D-серина
печивают несколько водородных связей, а после
(100 мМ). Известно, что константа Михаэлиса
дегидрирования этот процесс осуществляется за
(КМ) реакции человеческого фермента DAAO и
БИОФИЗИКА том 68
№ 5
2023
ИССЛЕДОВАНИЕ С ПОМОЩЬЮ СПЕКТРОСКОПИИ
883
D-серина в четыре раза выше КМ реакции DAAO
ФИНАНСИРОВАНИЕ РАБОТЫ
и D-аланина [19]. Также известно, что относи-
Исследование выполнено при финансовой
тельная активность фермента DAAO, выделенно-
поддержке Российского научного фонда (грант
го из почки свиньи, в отношении D-аланина бо-
№ 23-74-00006 для Ж.В. Бочковой и Н.А. Браже),
лее чем вдвое превышает активность в отноше-
а также Междисциплинарной научно-образова-
нии D-серина
[20]. Сказанное согласуется c
тельной школы МГУ имени М.В. Ломоносова
наблюдаемым эффектом: изменения на спектре
«Молекулярные технологии живых систем и син-
тетическая биология».
FAD-группы DAAO при внесении D-серина про-
исходят в течение более длительного времени.
При внесении же D-аланина изменения были вы-
КОНФЛИКТ ИНТЕРЕСОВ
явлены уже на первых секундах ферментативной
Авторы заявляют об отсутствии конфликта
реакции. Установлено, что при активации DAAO
интересов.
D-серином за 60 с меняется положение пика
1252 см-1 и появляется пик в районе 1300 см-1, но
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
в течение 7-10 мин область 1200-1355 см-1 ГКР-
Настоящая работа не содержит описания ка-
спектра FAD перестает изменяться.
ких-либо исследований с использованием людей
и животных в качестве объектов.
Итак, с помощью серебряных наночастиц бы-
ли зарегистрированы ГКР-спектры и исследова-
ны изменения конформации кофактора-FAD
СПИСОК ЛИТЕРАТУРЫ
при активации DAAO субстратами с различной
1.
L. Pollegioni and G. Molla. Cell Press, 29 (6), 276
специфичностью. Выявлены характерные спек-
(2011).
тральные полосы с положениями максимумов:
2.
K. Yagi, K. Okamura, et al., Biochim. Biophys. Acta,
146, 77 (1967).
1630, 1584, 1546, 1355, 1252, 1160 см-1, связанные с
3.
R. Upadhya, H. Nagajyothi, and S. G. Bhat. Process
колебаниями групп атомов отдельных колец
Biochem., 35, 7 (1999).
FAD-группы в окисленном состоянии. Показано,
4.
L. Pollegioni, B. Langkau, and W. Tischer, J. Biol.
что в ходе окислительно-восстановительной ре-
Chem., 268 (19), 1385 (1993).
акции с субстратом происходит смещение пика
5.
L. Pollegioni, S. Sacchi, and G. Murtas, Front. Mol.
1252 см-1 в длинноволновую область, что, пред-
Biosci., 5, 107 (2018).
положительно, связано с процессами координа-
6.
R. Konno, et al. Arch. Toxicol., 74, 473 (2000).
ции активного центра DAAO относительно ами-
7.
H. Wei, N. Gong, et al., Pharmacol. Biochem. Behav.,
нокислоты. Также в случае с взаимодействия
111, 30 (2013).
фермента с D-аланином удалось зарегистриро-
8.
J. Sasabe, Y. Miyoshi, et al., Nat. Microbiol., 1 (10),
16125 (2016).
вать появление пика 1612 см-1, связанного с вос-
9.
A. L. Kalinichenko, et al., Redox Biol., 60, 2213 (2023).
становлением флавиновой части FAD. Мы также
обнаружили разницу во времени, необходимом
10.
S. Moussa, G. Murtas, et al., ACS Appl. BioMater., 4,
5598 (2021).
для регистрации изменений в ГКР-спектре FAD-
11.
L. Rodriguez-Lorenzo, L. Fabris, and R. A. Alvarez-
группы фермента DAAO в присутствии D-алани-
Puebla. Anal. Chim. Acta, 745, 10 (2012).
на и D-серина. Так, во взаимодействии DAAO с
12.
A. A. Semenova, E. A. Goodilin, N. A. Brazhe, et al. J.
D-аланином изменения ГКР-спектров происходи-
Mater. Chem., 22, 24530 (2012).
ли в течение нескольких секунд, а при добавлении
13.
Y. Nishina, T. Kitagawa, K. Shiga., J. Biochem., 84,
D-серина для аналогичных результатов требова-
925 (1978).
лись минуты, что подтверждает литературные дан-
14.
T. Kitagawa, Y. Nishina, et al., Biochemistry, 18, 1804
ные о разной активности фермента DAAO при вза-
(1979).
имодействиях с указанными аминокислотами.
15.
Y. Nishina, H. Tojo, and K. Shiga, J. Biochem., 104,
227 (1988).
Предложенный подход на основе спектроско-
16.
Y. Nishina, R. Miura, and H. Tojo. J. Biochem., 99,
пии ГКР с серебряными плазмонными нано-
329 (1986).
структурами может быть использован в дальней-
17.
Y. Nishina, K. Shiga, et al., J. Biochem., 88, 411 (1980).
ших исследованиях механизмов реакции DAAO с
18.
Y. Nishina, K. Shiga, and R. Miura, J. Biochem., 94,
D-аминокислотами и определения эффективности
1979 (1983).
генерации Н2О2 различными формами DAAO.
19.
БИОФИЗИКА том 68
№ 5
2023
884
БОЧКОВА и др.
20. M. Gabler, M. Hensel, and L. Fischer, Enzyme Mi-
crob. Technol., 27 (8), 605 (2000).
A Raman Spectroscopic Investigation of Conformation of Flavin Adenine Dinucleotide,
a CoEnzyme of D-Amino Acid Oxidase
J. Bochkova*, W. Liu**, N.A. Brazhe*, A.A. Zhgun***, and G.V. Maksimov*
*Department of Biology, Lomonosov Moscow State University, Leninskie Gory 2/12, Moscow, 119234 Russia
**Department of Biology, MSU-BIT University,
International University Park Road 1, Dayun New Town, Longgang District, Shenzhen,
Guangdong Province, 518172 China
***Federal Research Center "Fundamentals of Biotechnology", Russian Academy of Sciences,
Leninsky prosp. 33/2, Moscow, 119071, Russia
Based on silver nanoparticles application, surface-enhanced Raman scattering spectra of D-amino acid oxi-
dase from pig kidney were recorded and analyzed. Spectral parameters characteristic of conformational
changes in cofactor flavin adenine dinucleotide during activation of the enzyme by D-amino acids were re-
vealed. It was found that enzyme substrate specificity determines the amount of time from the start of of the
conformational changes of flavin adenine dinucleotide until they no longer occur: in the presence of D-ala-
nine, registration of the said conformational changes takes up just a few seconds, while it takes 10 min in the
presence of D-serine .
Keywords: Raman spectroscopy, silver nanostructures, FAD, D-amino acid oxidase
БИОФИЗИКА том 68
№ 5
2023