БИОФИЗИКА, 2023, том 68, № 5, с. 856-862
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.32, 577.114.083
СОСТАВ И МИТОГЕННАЯ АКТИВНОСТЬ ПОЛИСАХАРИДА
ИЗ Solanum tuberosum L.
© 2023 г. Е.А. Генералов*, **, #, Л.В. Яковенко*
*Физический факультет Московского государственного университета имени М.В. Ломоносова,
Ленинские горы, 1/2, Москва, 119991, Россия
#E-mail: generals1179@gmail.com
**Первый Московский государственный медицинский университет им. И. М. Сеченова Минздрава России
(Сеченовский университет), Трубецкая ул., 8/2, Москва, 119991, Россия
Поступила в редакцию 30.03.2023 г.
После доработки 30.03.2023 г.
Принята к публикации 07.06.2023 г.
Полисахарид STP был выделен из водного экстракта Solanum tuberosum L. и очищен с помощью
ионообменной хроматографии и гель-фильтрации. Его молекулярную массу определяли с помо-
щью гельпроникающей хроматографии и высокоэффективной жидкостной хроматографии, а его
моносахаридный состав анализировали методами высокоэффективной жидкостной хроматогра-
фии и газовой хроматографии с использованием пламенно-ионизационного детектора и капилляр-
ной колонки. Было показано, что полисахарид STP состоял из галактозы и арабинозы в количествах
37.5% и 23.5% соответственно, а также уроновых кислот (9.7%), остатков моносахарида глюкозы
(15%) и белков (не менее 9%). Молекулярная масса STP составляла 70 кДа. Для структурного анали-
за STP использовали метод ИК-Фурье-спектроскопии. Митогенная активность экстрагированного
полисахарида сравнима с активностью липополисахарида.
Ключевые слова: Solanum tuberosum, полисахариды, моносахаридный состав, митогенная активность.
DOI: 10.31857/S0006302923050034, EDN: PGFGEA
Solanum tuberosum L. (картофель) относится к
ли приобретены у Sigma (США), DEAE-целлюло-
семейству пасленовых. Это всемирно известное
за и сефадекс G-100 - у Whatman (Великобрита-
культурное растение, дающее высокие урожаи
ния) и Pharmacia LKB Biotechnology AB (Швеция)
ценных в питательном отношении продуктов пи-
соответственно. Содержание углеводов в различ-
тания в виде клубней. Сырой картофель, карто-
ных фракциях элюата контролировали с исполь-
фельный сок и ткани использовались в качестве
зованием фенол-сернокислотного метода с помо-
лекарственного средства [1, 2] для лечения желу-
щью спектрофотометра UV-1800 UV-Vis (Shimad-
дочно-кишечных дисфункций и в качестве про-
zu Corporation, Япония).
тивовоспалительного средства [3-6]. Существу-
Растительный материал. Полисахариды были
ют хорошо известные способы экстракции кле-
экстрагированы из клубней картофеля сортов
точных стенок картофеля и исследования их
Жуковский Ранний и Red Scarlet, отобранных в
состава и структуры содержащихся в них полиса-
Московской сельскохозяйственной академии им.
харидов [7-9]. К сожалению, нет данных по рас-
К.А. Тимирязева. Использовали клубни техниче-
творимым полисахаридам картофельного сока. В
ской спелости.
настоящем исследовании мы экстрагировали,
Приготовление экстрактов. Клубни картофеля
выделили и очистили полисахаридные компо-
промывали под проточной водой и высушивали
ненты из Solanum tuberosum, определили их моле-
на воздухе. Затем 1 кг клубней гомогенизировали
кулярные массы, а также их моносахаридный со-
в 1 л ледяной деионизированной воды, содержа-
став для дальнейшего изучения механизма их
щей
1 мM фенилметилсульфонилфторида, в
действия.
охлажденном блендере для измельчения. После
шнекового прессования гомогената оставшуюся
выжимку снова смешивали с 1 л ледяной деиони-
МАТЕРИАЛЫ И МЕТОДЫ
зированной воды, содержащей 1 мм фенилметил-
Стандарты (моносахариды, уроновые кисло-
сульфонилфторида, и перемешивали при 40°C.
ты, производные моносахаридов, декстраны) бы- Полученную суспензию снова отжимали и цен-
856
СОСТАВ И МИТОГЕННАЯ АКТИВНОСТЬ ПОЛИСАХАРИДА
857
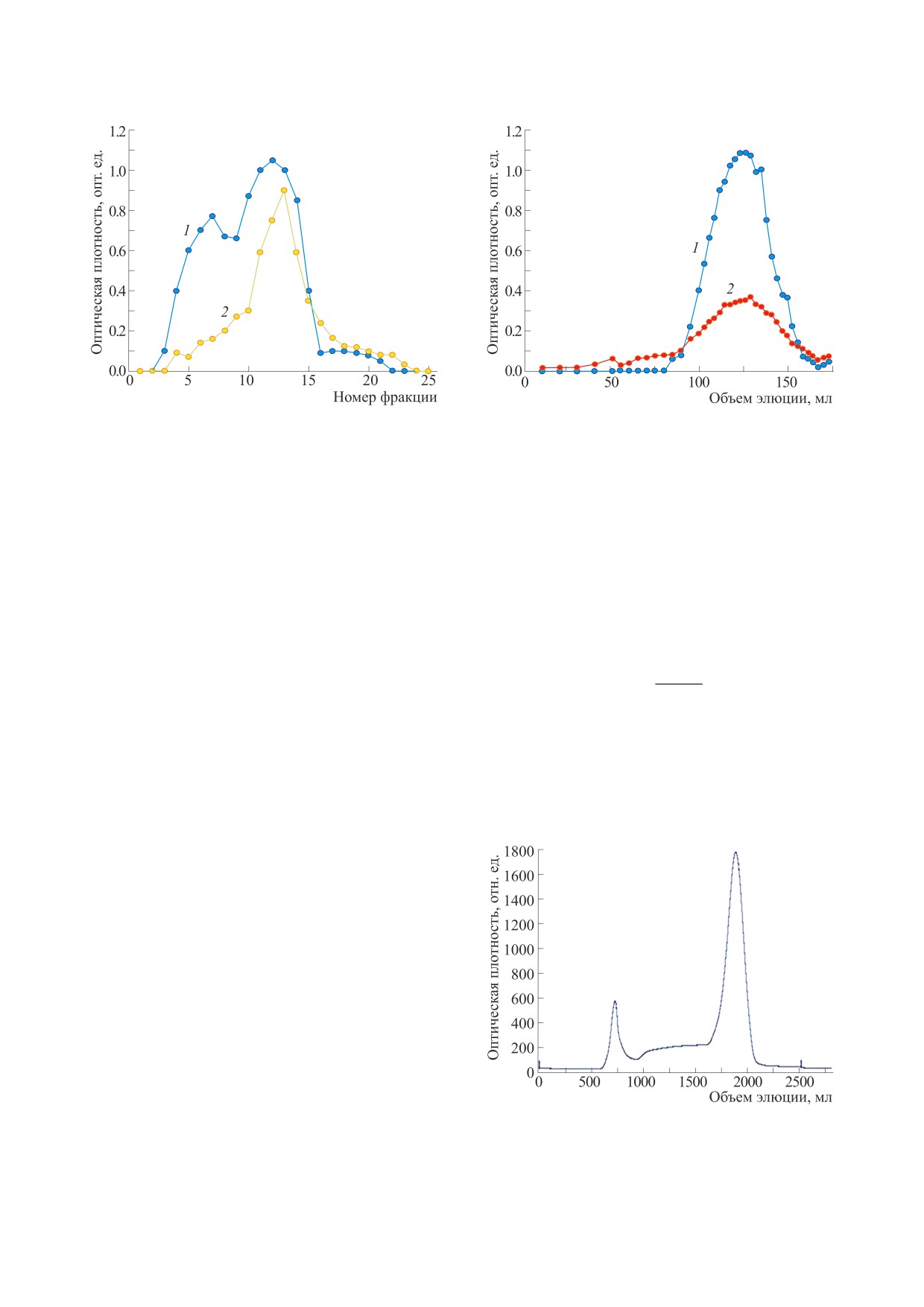
Рис. 1. Кривые элюирования при 490 нм (1) и 220 нм
Рис. 2. Кривые элюирования объединенных фракций
(2) на ДЭАЭ-целлюлозе.
11-14 при 490 нм (1) и 220 нм (2) на ДЭАЭ-целлюлозе.
трифугировали при 4°C/20000 g в течение 30 мин.
сконцентрированы и в дальнейшем обозначены
Супернатанты объединяли и фракционировали
как фракция STP.
методом ультрафильтрации на системе Slice
Определение молекулярной массы. Молекуляр-
Crossflow System (Sartorius Stedim Biotech, США).
ную массу фракции STP рассчитывали с исполь-
Фракции с молекулярной массой 10-100 кДа со-
зованием калибровочной кривой, на которой ло-
бирали с помощью соответствующих кассет Sar-
гарифм молекулярной массы стандартов декстра-
tocon Slice Cassetes. Концентрат нагревали до
на в диапазоне от 1 до 100 кДа откладывался в
100°C при постоянном перемешивании. Затем
зависимости от коэффициента распределения
экстракт охлаждали до комнатной температуры и
для гель-фазы Kav:
центрифугировали при 4°C/15000 g в течение
10 мин. Полученный супернатант подвергали
V
e
-V
0
K
av
=
,
сублимационной сушке для фракционирования и
V
-V
c
0
дальнейшего анализа.
где Ve - объем элюирования; V0 - свободный объ-
Выделение и очистка. Лиофилизированную
ем в колонке (определяется с использованием си-
фракцию растворяли в цитратном буфере (0.01 М,
него декстрана) и Vc - объем колонки.
рН 6.6) до концентрации 1% (вес.), центрифуги-
Метод ВЭЖХ-ГПХ. Была использована систе-
ровали при 5000 g в течение 20 мин и подвергали
ма ВЭЖХ серии Prominence (Shimadzu Corpora-
хроматографии на колонке с ДЭАЭ-целлюлозой
(650 S TSK (2.6 × 35 см) с элюированием дистил-
лированной водой и ступенчатым градиентом
хлорида калия (0.1-1 М). На рис. 1 представлены
кривые элюирования при 220 нм и 490 нм. На
кривой элюирования при 490 нм видны три пика,
поэтому для дальнейшего анализа были выбраны
фракции 11-14, которые объединили, концен-
трировали и лиофилизировали. Затем смесь под-
вергали колоночной хроматографии с ДЭАЭ-
целлюлозой. Содержание углеводов во фракциях
контролировали фенол-сернокислотным мето-
дом [14]. На рис. 2 представлены кривые элюиро-
вания объединенных фракций 11-14. Далее этот
материал подвергали хроматографии на колонке
с сефадексом G-100 (5.0 × 100 см) с элюированием
дистиллированной водой и контролем фенол-
сернокислотным методом. Соответствующая
кривая элюции показана на рис. 3. Фракции с
Рис.
3. Кривая элюирования STP на колонке с
объемом элюции 600-800 мл были объединены,
сефадексом G-100.
БИОФИЗИКА том 68
№ 5
2023
858
ГЕНЕРАЛОВ, ЯКОВЕНКО
tion, Япония) с детектором на фотодиодной мат-
держка 2 мин, подъем до 250°C (5°C/мин), вы-
рице (для детектирования был выбран диапазон
держка 10 мин, подъем до 265°C (15°C/мин), вы-
220 нм) и колонкой TSKgel G4000PW из нержаве-
держка 5 мин.
ющей стали (7.5 × 300 мм) (Tosoh Bioscience Gm-
ИК-Фурье-спектроскопия.
Инфракрасные
bH, Германия). Хроматографию проводили в
спектры образца/таблетки KBr регистрировали
обычном режиме с использованием буферного
на спектрометре Spectrum 100 FT-IR (Shimadzu
раствора 0.1 м Na2HPO4 с 0.1 М NaCl (рН 6.8) при
Corporation, Япония) при комнатной температуре
постоянной скорости потока 1 мл/мин при тем-
в диапазоне 4000-400 см-1.
пературе окружающей среды. Обычно 10 мкл 1%-
го раствора образца растворяли в подвижной фазе
Животные. Мыши (F1(CBAxC57Bl/6), самцы,
и вводили в колонку.
возраст 8 недель) были получены из филиала Ин-
Анализ моносахаридного состава. Гидролиз по-
ститута
биоорганической
химии
им.
лисахаридов проводили 2 М трифторуксусной
М.М. Шемякина и Ю.А. Овчинникова РАН в Пу-
кислотой с дальнейшим восстановлением моно-
щино (Московская область). Животных помеща-
сахаридов до соответствующих полиолацетатов
ли в карантин на 2 недели. Селезенки собирали
[10, 11]. После гидролиза образцы центрифугиро-
асептическим методом.
вали при 6000 g в течение 5 мин и фильтровали че-
Забор селезенки и выделение клеток. Удален-
рез шприц-фильтр 0.22 мкм (Millipore, США).
ные у мышей селезенки собирали в стерильный
Конечные полиолацетаты анализировали мето-
сбалансированный солевой раствор Хэнка (Milli-
дом ГХ-ПИД.
pore, Sigma-Aldrich, Supelco) в стерильную цен-
Перед анализом ГХ-ПИД для метанолиза по-
трифужную пробирку объемом 15 мл на льду. С
лисахаридов использовали 0.5 М HCl в метаноле
помощью стерильных пинцетов и марли селезен-
(4 ч при 85°C) и триметилсилил для дериватиза-
ки промокали для удаления лишней жидкости и
ции [12]. Затем состав определяли путем калиб-
взвешивали. После регистрации веса селезенки
ровки со стандартными моносахаридами/уроно-
промывали примерно в 5 мл среды RPMI с добав-
выми кислотами и количественно определяли с
ками в стерильной культуральной чашке. Среда
использованием внутреннего стандарта сцилло-
RPMI с добавками содержала 10% эмбриональ-
инозитола.
ной телячьей сыворотки (Hyclone, США), 1% пе-
Гидролиз полисахаридов проводили с помо-
нициллина/стрептомицина (Cambrex, США) и
щью 2 М трифторуксусной кислоты [10, 11]. По-
1% L-глютамина (Cambrex, США). Предметные
сле гидролиза образцы центрифугировали при
стекла микроскопа стерилизовали пламенем и их
6000 g в течение 5 мин и фильтровали через
охлажденные концы использовали для гомогени-
шприц-фильтр 0.22 мкм. Окончательное разделе-
зации селезенки. Изолированные спленоциты
ние моносахаридов проводили с помощью ВЭ-
оставляли на льду до тех пор, пока не были выде-
ЖХ. Затем состав определяли путем калибровки
лены все образцы, а затем центрифугировали при
стандартными моносахаридами/уроновыми кис-
400 g в течение 20 мин. Осажденные спленоциты
лотами и количественно определяли с использо-
ресуспендировали в 2 мл среды RPMI с указанны-
ванием внутреннего стандарта мальтита.
ми добавками. Лимфоциты подсчитывали и
Метод ВЭЖХ. Были использованы ВЭЖХ-си-
определяли жизнеспособность каждого образца
стема Prominence Series (Shimadzu Corporation,
путем исключения трипанового синего на гемо-
Япония) с матричным фотодиодным детектором
цитометре. Количество и жизнеспособность ре-
(для детектирования была выбрана полоса
гистрировали и использовали для нормализации
количества лимфоцитов во время посева клеток
190 нм), колонка Shodex Asahipak NH2P-50 4E
(4.6 × 250 мм) (Showa Denko America, Inc., США)
для анализа иммунной функции.
) и защитная колонка NH2P-50G 4A (4,6 × 10 мм)
Митогенная активность. Митогенную актив-
(Showa Denko America, Inc., США). Хроматогра-
ность исследовали с использованием метода Ер-
фию проводили в низкоградиентном режиме при
не-Нордина [13]. В этих экспериментах исполь-
50°С с использованием в качестве элюента ацето-
зовали мышей линий F1 (CBAxC57Bl/6) - самцов
нитрила и смеси 3% H3PO4 (75/25%). Скорость
с массой тела 18-20 г. В качестве антигена для им-
потока - 1 мл/мин, объем ввода - 5 мкл.
мунизации использовали эритроциты барана.
Метод ГХ-ПИД. В этом методе систему Shi-
Субстанцию STP растворяли в 0.9% NaCl,
madzu GC-2014 GC-FID (Shimadzu Corporation,
фильтровали через фильтр 0.22 мкм и вводили
Япония) с колонкой ZB5-ms (30 м, внутр. диаметр
мышам внутрибрюшинно в дозах 100 мкг/мышь
0.25 мм, толщина пленки 0.25 мкм) (Phenomenex
или 500 мкг/мышь однократно в 0.5 мл раствора.
Inc., США) и Shimadzu Split/Splitless FocusLiner,
инжектор с внутренним диаметром 3.4 мм был
Мышей умерщвляли на пятые сутки после им-
установлен на 300°C, вводили 1 мкл, детектор был
мунизации путем смещения шейных позвонков и
установлен на 300°C. Программа печи: 140°C, вы-
извлекали селезенки. Селезенки помещали в сре-
БИОФИЗИКА том 68
№ 5
2023
СОСТАВ И МИТОГЕННАЯ АКТИВНОСТЬ ПОЛИСАХАРИДА
859
ду RPMI, содержащую глутамат (4 мл на одну се-
США), 1% 100 мМ пирувата натрия (Cambrex,
лезенку).
США) и 0.5% гентамицина (Gibco, США). Эрит-
роциты барана (1% клеток в среде по объему)
Эритроциты дефибринированной бараньей
(Colorado Serum, США) промывали и суспенди-
крови трижды промывали центрифугированием в
ровали в среде RPMI с добавками и добавляли в
50-кратном объеме раствора Хэнка, затем ресус-
соответствующие лунки 48-луночного планшета.
пендировали в том же растворе. Контрольным
Каждый образец иммунизировали эритроцитами
мышам вводили эритроциты барана
(2×106),
барана в двух повторностях. Среду, не содержа-
опытным мышам вводили эритроциты барана
щую эритроцитов, использовали для неиммуни-
(2×106) и STP в количестве
100 или
500
зированных контрольных лунок для каждого об-
мкг/мышь, мышам из группы положительного
разца. Клетки инкубировали в течение четырех
контроля вводили эритроциты барана (2×106) и
суток при 37°С в 5% СО2. После иммунизации
10 мкг/мл липополисахарида (LPS из E. coli
клеток селезенки их промывали и ресуспендиро-
0127:B8, Sigma-Aldrich, США) внутрибрюшинно.
вали в среде с указанными добавками. Раствор
Каждая группа состояла из десяти подопытных
0.8% агарозы (SeaPlaque, Cambrex, Rockland, ME)
животных. Уровень иммунного ответа у мышей
в среде 2×RPMI (Gibco, США) нагревали до 43°C
F1(CBAxC57Bl/6), иммунизированных эритро-
в стеклянных пробирках. В пробирки добавляли
цитами барана, определяли по количеству анти-
эритроциты барана и клетки селезенки, затем
телообразующих клеток, выявляемых в селезенке
распределяли на предметные стекла микроскопа,
по количеству зон лизиса в агаре и клеточности
покрытые агарозой, и инкубировали лицевой
селезенки прямым подсчетом клеток через пять
стороной вниз на специальных лотках для пред-
суток после иммунизации. Эксперимент был по-
метных стекол во влажном пластиковом боксе
вторен три раза.
при 37°C в течение 1 ч.
Для формирования агарозного слоя 150 мг 3%
Комплемент морской свинки (Colorado Serum,
агарозы растворяли в 48 мл раствора PBS:RPMI
США) разбавляли 1:20 в фосфатно-солевом бу-
(1:2 по объему) на кипящей водяной бане в тече-
фере Дульбекко, содержащем Ca2+ и Mg2+ (Sig-
ние часа. Доводили pH до диапазона 6.9 ± 0.5 и
ma-Aldrich, США), и нагревали до 37°C на водя-
раствор помещали на кипящую баню на 5 мин.
ной бане. Предметные стекла заливали разбав-
Горячую агарозу термостатировали при 47°С в те-
ленным комплементом после инкубации в
чение 10 мин и добавляли предварительно про-
течение 1 ч. Предметные стекла извлекали из ин-
мытые эритроциты до 20% конечного объема.
кубатора и хранили в холодном 0.85% растворе
Полученный раствор тщательно перемешивали и
хлорида натрия. Лизис эритроцитов барана опре-
аликвотами по 3 мл разливали в чашки Петри
деляли количественно путем подсчета бляшек на
(d = 8.5 см), нагретые до 47°С, встряхивая для рав-
газоне «эритроциты барана/агар» с использова-
номерного распределения раствора. Агарозному
нием препаровального микроскопа.
слою давали остыть на равновесном столе, после
чего его накрывали крышкой и термостатировали
в течение 90 мин при 37°С в инкубаторе с СО2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Раствор комплемента (1 ампула объемом 1 мл су-
В нашем способе приготовления картофель-
хого комплемента на 10 мл стерильного изотони-
ного сока мы применили мягкое разрушение
ческого разового фосфатно-солевого буфера)
мякоти картофеля, что позволяет сохранить
медленно добавляли по 0.5 мл вдоль стенки, по-
структуру пектина из клеточных стенок. Клубни
крывая слой агарозы, после чего инкубировали в
картофельного пюре гомогенизировали в де-
течение 15 мин - 1 ч (в зависимости от активность
ионизированной воде с фенилметилсульфонил-
реакции комплемента для предотвращения пол-
фторидом. После шнекового прессования гомо-
ного лизиса) и подсчитывали зоны лизиса. Коли-
гената, последующего повторного смешивания с
чество зон лизиса соответствует количеству анти-
деионизированной водой с фенилметилсульфо-
телообразующих клеток. Рассчитывали количе-
нилфторидом и центрифугирования полученные
ство антителообразующих клеток на селезенку и
супернатанты объединяли и фракционировали
коэффициент стимуляции.
ультрафильтрацией. Собранные фракции с моле-
Клетки селезенки суспендировали в 3 мл сре-
кулярной массой 10-100 кДа повторно центри-
фугировали и полученный супернатант лиофили-
ды RPMI с добавками в концентрации 4×106 кле-
зировали для фракционирования и дальнейшего
ток/мл. Для анализа бляшек по Ерне-Нордину
анализа.
среда с добавками содержала инактивированную
нагреванием эмбриональную телячью сыворотку
После окончательной хроматографической
(Hyclone, США), 1% пенициллина/стрептомици-
очистки выделяли и концентрировали фракцию с
на (Cambrex, США), 1% L-глутамина (Cambrex,
молекулярной массой ~70 кДа (STP-фракцию).
США), 0.09% 55 мМ 2-меркаптоэтанола (Gibco,
Молекулярную массу (MW) STP-фракции рас-
БИОФИЗИКА том 68
№ 5
2023
860
ГЕНЕРАЛОВ, ЯКОВЕНКО
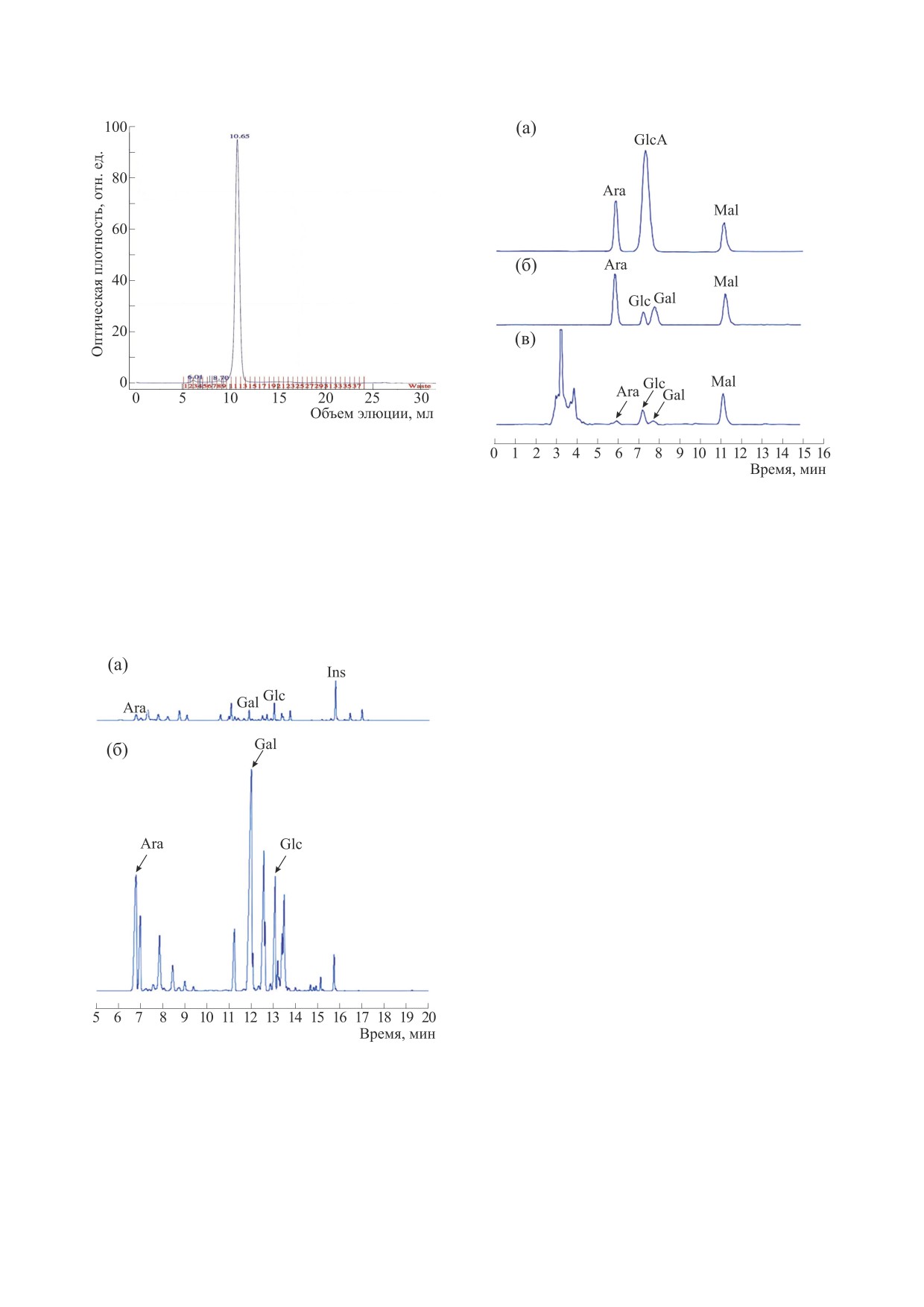
Рис. 4. Хроматограмма STP, полученная методом
ВЭЖХ-ГПХ.
Рис. 6. Анализ методом ВЭЖХ: (а) - смешанные
считывали на основе калибровочной кривой для
стандарты (арабиноза, глюкуроновая кислота,
мальтит); (б) - смешанные стандарты (арабиноза,
декстрана, описываемой уравнением lg(MW) =
галактоза, глюкоза, мальтит); (в) - гидролизат STP.
5.0354 - 0.7553Kav - 3.6489Kav2, где Kav - коэффи-
циент распределения для гелевой фазы) [15].
на рис. 4, наблюдался симметричный пик, что
Далее фракцию STP подвергали ВЭЖХ-ГПХ-
указывает на гомогенность полисахаридного
хроматографии. На хроматограмме, приведенной
компонента. Молекулярную массу STP (70 кДа)
рассчитывали на основе калибровочной кривой
для декстрана: lg(MW) = -3.1086 + 1.8812RT -
0.1103 RT2 (RT - время удерживания).
Анализ моносахаридного состава проводили
методом ГХ-ПИД. Хроматограмма, представлен-
ная на на рис. 5, показывает, что STP в основном
состоит из галактозы и арабинозы - 39.7-41.9% и
27.1-28.3% соответственно, а также остатков мо-
носахаридов глюкозы
(8.5-9.2%), других ве-
ществ, идентифицированных колориметриче-
ским методом с 3,5-диметилфенолом с использо-
ванием d-галактуроновой кислоты в качестве
стандарта [16] как уроновые кислоты (9.2-10.1%),
и белков, определенных методом Бредфорда с ис-
пользованием бычьего сывороточного альбумина
в качестве стандарта [13] (не менее 9%).
ВЭЖХ-хроматограмма на рис. 6 показывает
присутствие галактозы и арабинозы (37.5% и
23.5% соответственно), а также остатков моноса-
харидов глюкозы и глюкуроновой кислоты.
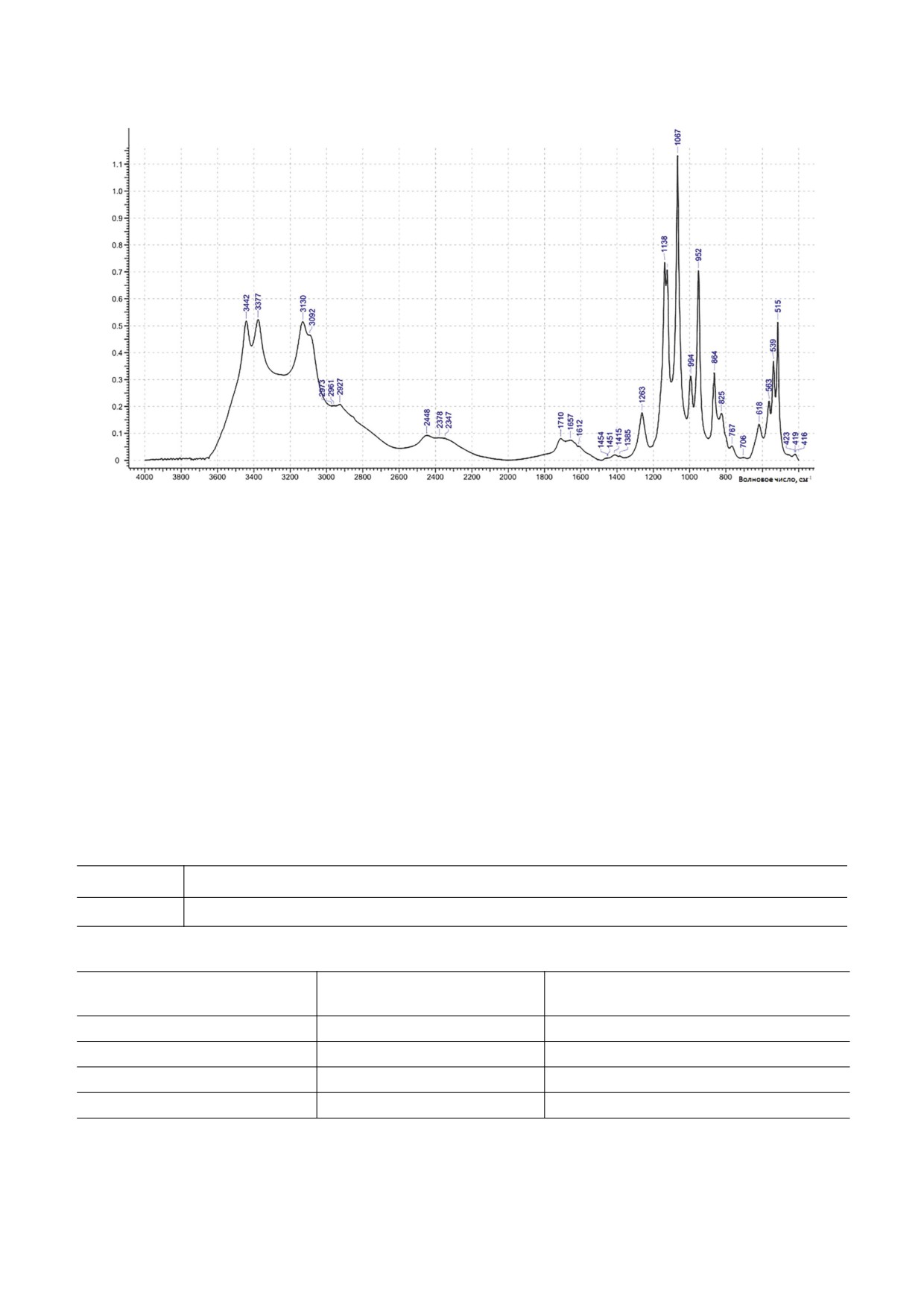
Пики на ИК-Фурье-спектре представлены на
рис. 7 и перечислены в табл. 1. Пики при 3442,
3377 и 3130 см-1 соответствуют -C-H групп СН2.
Рис. 5. Анализ методом ГХ-ПИД: (а) - смешанные
Растягивающие колебания C-O, C-C и кольце-
стандарты: арабиноза, рамноза, фукоза, ксилоза, ман-
вых структур доминируют в области 1200-800 см-1.
ноза, галактоза, глюкоза, глюкуроновая кислота, га-
лактуроновая кислота, N-ацетилглюкозамин и N-аце-
Было обнаружено, что изгибные колебания
тилгалактозамин; (б) - STP после кислотного гидро-
(деформации) групп СН2 полезны для идентифи-
лиза с последующей дериватизацией.
БИОФИЗИКА том 68
№ 5
2023
СОСТАВ И МИТОГЕННАЯ АКТИВНОСТЬ ПОЛИСАХАРИДА
861
Рис. 7. ИК-Фурье-спектр STP.
кации полисахаридов. Сообщалось, что полосы
Была выделена одна значимая по биологиче-
ской активности фракция с молекулярной мас-
при 1138, 1124 и 1067 см-1 являются основными
сой 70 кДа, установлен ее моносахаридный состав
областями поглощения уроновых кислот. Полоса
и некоторые оптические свойства.
поглощения в диапазоне 1100-1030 см-1 с макси-
мумом при 1067 см-1 может быть отнесена к га-
ЗАКЛЮЧЕНИЕ
лактозе [17, 18]. В ИК-спектрах представлены об-
щие для всех углеводов пики [10, 11, 19].
Сочетание различных методов экстракции
(ультрафильтрация) и очистки (гель-фильтрация,
Результаты анализа митогенной активности
ионообменная хроматография) позволило полу-
представлены в табл. 2. STP статистически значи-
чить гомогенную высокоочищенную полисаха-
мо стимулирует как количество клеток селезенки,
ридную фракцию. Данные ИК-Фурье-спектро-
так и зоны лизиса в чашке с агаром. Таким обра-
скопии свидетельствовали о наличии уроновых
зом, можно сделать вывод, что STP проявляет ми-
кислот и галактозы в структуре соединения. Дан-
тогенную активность.
ные ВЭЖХ-ГПХ и ГХ-ПИД позволяют заклю-
Таблица 1. Данные ИК-Фурье-спектроскопии STP
Метод анализа
Пики (см-1)
ИК-Фурье
3442, 3377, 3130, 2448, 1710, 1415, 1263, 1138, 1124, 1067, 994, 952, 864, 825, 618, 563, 539, 515, 419
Таблица 2. Данные анализа митогенной активности STP в селезенке мышей
Количество клеток селезенки,
Количество антителообразующих клеток
млн
на селезенку
Контроль
102,4±11,3
70,5±9,1
LPS (10 мкг/мл)
223,9±14,8*
69,4±8,9
STP 100 мкг/мышь
216,0±22,5*
102,3±13,9*
STP 500 мкг/мышь
240,7±17,7*
144,0±12,1*
Примечание. Приведены средние значения ± средние квадратичные отклонения; *p < 0.05 - статистически значимое
отклонение от контроля.
БИОФИЗИКА том 68
№ 5
2023
862
ГЕНЕРАЛОВ, ЯКОВЕНКО
чить, что данная молекула полисахарида, воз-
2.
M. Kujawska, A. Olejnik, G. Lewandowicz, et al., Nu-
можно, относится к группе арабиногалактана.
trients, 10 (2), 259 (2018).
Данный полисахарид показал высокую биологи-
3.
J. E. Vlachojannis, M. Cameron, and S. Chrubasik,
Phytother. Res., 24 (2), 159 2010.
ческую активность у мышей
- митогенную
4.
H. Chen, J. Sun, J. Liu, et al., Int. J. Biol. Macromol.,
активность, что, скорее всего, связано с его
131, 484 (2019).
структурой.
5.
S. Chrubasik, T. Boyko, Y. Filippov, and T. Torda,
Phytomedicine, 13 (8), 596 (2006).
6.
M. G. Basilicata, G. Pepe, S. F. Rapa, et al., Int. J.
БЛАГОДАРНОСТИ
Mol. Sci., 20 (23), 6087 (2019).
Автор выражает благодарность компании Gly-
7.
W. G. Jardine, C. H. L. Doeswijk-Voragen,
coMar Limited, в частности доктору Ч.Д. Бэвинг-
I. M. R. MacKinnon, et al., J. Sci. Food Agric., 82 (8),
тону и доктору Д.С. Томсону за проведение ана-
834 (2002).
лиза STP методом ГХ-ПИД, SGS Testing & Control
8.
D. T. Do, J. Singh, I. Oey, and H. Singh. Food Hydro-
Services Singapore Pte Ltd, в частности С. Рагупати
colloids, 108, 105972 (2020).
и Ч. М. Э. Орзалес за ИК-спектроскопию STP.
9.
M. C. Jarvis, M. A. Hall, D. R. Threlfall, J. Friend,
Planta, 152 (2), 93 (1981).
10.
A. I. Usov, M. I. Bilan, and N. G. Klochkova, Botanica
КОНФЛИКТ ИНТЕРЕСОВ
Marina, 38, 43 (1995).
11.
M. M. Bradford, Anal. Biochem., 72 (1-2), 248
Авторы заявляют об отсутствии конфликта
(1976).
интересов.
12.
R. Hori and J. Sugiyama, Carbohydr. Polym., 52 (4),
449 (2003).
13.
N. K. Jerne, A. A. Nordin, Science. 140 (3565), 405
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ НОРМ
(1963).
Статья не содержит каких-либо исследований
14.
W. S. York, A. G. Darvill, M. McNeil, et al., in Methods
с участием людей в экспериментах, выполненных
in Enzymology, vol. 118, Plant Molecular Biology, Ed.
кем-либо из авторов, в отношении использован-
by A. Weissbach and H. Weissbach (Acad. Press, Lon-
don, New York, San Diego, 1986), pp. 3-40.
ных в исследовании животных были соблюдены
15.
C. C. Sweeley, R. V. P. Tao, in Methods in Carbohydrate
применимые стандарты исследований.
Chemistry, Ed. by R. L. Whistler (Acad. Press, London,
New York, San Diego, 1972), pp. 23-25.
ДОСТУПНОСТЬ ОБРАЗЦОВ
16.
C. C. Sweeley, R. Bentley, M. Makita, and W. W. Wells,
J. Am. Chem. Soc., 85 (16), 2497 (1963).
Образцы соединений Solanum tuberosum L. до-
17.
M. DuBois, K. A. Gilles, J. K. Hamilton, et al., Anal.
ступны по запросу.
Chem., 28 (3), 350 (1956).
18.
K. Wilson, and J. Walker, Principles and Techniques of
Practical Biochemistry (Cambridge University Press,
СПИСОК ЛИТЕРАТУРЫ
Cambridge, 2000).
1. M. E. Camire, S. Kubow, and D. J. Donnelly, Crit.
19.
M. Černá, A. S. Barros, A. Nunes, et al., Carbohydr.
Rev. Food Sci. Nutr., 49 (10), 823 (2009).
Polym., 51 (4), 383 (2003).
Composition and Mitogenic Activity of Polysaccharide from Solanum tuberosum L.
E.A. Generalov*, ** and L.V. Yakovenko*
*Department of Physics, Lomonosov Moscow State University, Leninskiye Gory, 1/2, Moscow, 119991 Russia
**I.M. Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation (Sechenov University),
Trubetskaya ul. 8/2, Moscow, 119991 Russia
Solanum tuberosum polysaccharide (STP) was isolated from the water extract of Solanum tuberosum L. and
purified by ion-exchange and gel-filtration chromatography. Its molecular weight was determined by using
gel permeation chromatography method and high performance liquid chromatography technique and its
monosaccharide composition was analyzed using high performance liquid chromatography and gas chroma-
tography with a flame ionization detector and a capillary column. It was shown that STP was consisted of ga-
lactose (Gal) and arabinose (Ara) (37.5 and 23.5%, respectively), along with uronic acids (9.7%), glucose
monosaccharide residues (15%) and proteins (no less than 9%). The molecular weight of STP was 70 kDa.
The Fourier-transform infrared technique was used for structural analysis of STP. The mitogenic activity of
extracted polysaccharide is comparable to that of lipopolysaccharide.
Keywords: Solanum tuberosum, polysaccharides; monosaccharide composition, mitogenic activity
БИОФИЗИКА том 68
№ 5
2023