БИОФИЗИКА, 2022, том 67, № 3, с. 555-561
БИОФИЗИКА КЛЕТКИ
УДК 57.088.1
ИЗМЕРЕНИЕ АДСОРБЦИИ АНТИТЕЛ КЛАССА IgG
НА ЭЛЕКТРОФОРМОВАННЫЕ МЕМБРАНЫ ИЗ НЕЙЛОНА-6
© 2022 г. А.М. Сенковенко*, А.М. Мойсенович*, А.А. Маслакова*,
Е.Р. Павлова*, **, Д.В. Багров*
*Биологический факультет Московского государственного университета имени М.В. Ломоносова,
119234, Москва, Ленинские горы, 1/12
**Федеральный научно-клинический центр физико-химической медицины ФМБА России,
119435, Москва, Малая Пироговская ул., 1а
E-mail: bagrov@mail.bio.msu.ru
Поступила в редакцию 28.02.2022 г.
После доработки 28.02.2022 г.
Принята к публикации 06.04.2022 г.
Биосенсоры на основе электроформованных мембран имеют ряд преимуществ перед традицион-
ными биосенсорами, в которых рецепторный слой иммобилизован на плоском носителе. Развитая
поверхность электроформованной мембраны позволяет увеличить количество сайтов связывания
аналита, но не препятствует использованию классических методов детекции, например, электрохи-
мических. В работе изучена способность электроформованных мембран из нейлона-6 адсорбиро-
вать антитела класса IgG. Показано, что при концентрации антител 2.5-10 мкг/мл связывающая
способность мембран имеет порядок ~100 мкг/г, а доля антител, адсорбированных из раствора, со-
ставляет 40-45%. Методом конфокальной лазерной сканирующей микроскопии показано, что ад-
сорбированные антитела более эффективно вымываются с внешних слоев мембраны, чем с внут-
ренних. Методика измерения связывающей способности мембран, описанная в данной работе, мо-
жет быть полезна для разработки иммуносенсоров.
Ключевые слова: электроспиннинг, полимерная мембрана, адсорбция, нейлон-6, антитела, иммуно-
анализ.
DOI: 10.31857/S0006302922030140, EDN: AOOXHP
и оптических биосенсорах [2]. Для иммобилиза-
Биосенсоры - это устройства, предназначен-
ные для обнаружения аналита в пробе и измере-
ции биологически активных молекул на поверх-
ности волокон существует множество процедур
ния его концентрации. Основополагающим эта-
[3]. В простейшем случае рецепторный слой им-
пом создания биосенсора является функциона-
мобилизуют с помощью физической адсорбции.
лизация поверхности подложки молекулами,
Ее используют при проведении иммунофермент-
распознающими аналит, например, антителами
или высокоаффинными лигандами. Процедура
ного анализа в полистирольных планшетах [4],
при изготовлении устройств бумажной микро-
создания рецепторного слоя должна не только
флюидики [5] и тест-полосок [6], а также сенсо-
иммобилизовать молекулы на поверхности, но
ров, использующих электроформованные мем-
также сохранять их функциональность и обеспе-
браны в качестве носителей [7, 8]. При разработке
чивать диффузию аналита [1].
биосенсоров возникают задачи оценки связыва-
В качестве твердого носителя для иммобили-
ющей способности подложки по отношению к
зации рецепторного слоя могут служить мембра-
молекулам рецепторного слоя, а также контроля
ны, сформированные методом электроспиннин-
его однородности. В данной работе эти задачи ре-
га (электроформования). Обычно они состоят из
шены на примере электроформованных мембран
нановолокон с диаметрами в диапазоне 100 нм -
из нейлона-6 и мышиных антител класса IgG.
1 мкм, что обеспечивает большую площадь по-
Нейлоны - это класс синтетических термо-
верхности и потенциально высокую связываю-
пластичных полиамидов, широко применяемых в
щую способность. Электроформованные мем-
производстве одежды и напольных покрытий,
браны находят применение в электрохимических
для упаковки пищевых продуктов, армирования
Сокращения: КЛСМ - конфокальная лазерная сканирую-
резины и т.д. Коммерчески доступные нейлоны
щая микроскопия, PBS - фосфатно-солевой буфер.
включают нейлон-6, нейлон-4/6, нейлон-6/6,
555
556
СЕНКОВЕНКО и др.
нейлон-6/10, нейлон-6/12, нейлон-11 и нейлон-
12. Числовая номенклатура нейлона отражает ко-
личество атомов углерода в одном мономерном
звене (например, нейлон-6), а в случае, если зве-
но нейлона образовано димером, первое число
отражает количество атомов углерода в диамине,
а второе - в дикарбоновой кислоте (например,
Рис. 1. Химическая структура нейлона-6.
нейлон-4/6).
Нейлоны часто используются для иммобили-
зации белков, в том числе антител. Пористые
Мечение антител флуорофором. Лиофилизиро-
мембраны из нейлона более активно адсорбиру-
ванные иммуноглобулины мыши IgG («Имтек»,
ют альбумин, чем мембраны из поливинили-
Москва) растворяли в фосфатно-солевом буфере
денфторида или большинство мембран из нитро-
(PBS) с 0.05% азида натрия (PBS/NaN3) в течение
целлюлозы [9]. Нейлоновые мембраны могут ис-
10 мин при легком покачивании. Проводили до-
пользоваться в разных типах блоттинга [10, 11],
полнительную процедуру перевода препарата ан-
для создания электрохимических иммуносенсо-
тител в буфер PBS/NaN3 методом ультрафильтра-
ров [12] и в других приложениях. Нейлон-6 (рис.
ции в фильтрующих блоках с порогом 3 кДа (Am-
1) гидрофилен (краевой угол смачивания сплош-
icon® Ultra-4 Centrifugal Filter Unit, UFC800324,
ной пленки, приготовленной из расплава, состав-
Millipore, США). 200 мкг антител метили флуоро-
ляет 70° [13]), поэтому мембраны из него хорошо
фором Сy3 с помощью реагента Cy3-NHS
смачиваются водными растворами. Если элек-
(PA13101, Cytiva, США) в термостате при 37°С в
троформованная мембрана используется в каче-
течение часа. Препарат IgG-Cy3 очищали от сво-
стве элемента биосенсора и не полностью смачи-
бодного красителя ультрафильтрацией с порогом
вается анализируемой пробой, предел детекции
30 кДа в фильтрующих блоках (Amicon Ultra-0.5
может ухудшаться [14].
Centrifugal Filters, UFC503096, Millipore, США).
В данной работе описана методика измерения
Определение связывающей способности. Мем-
адсорбции антител класса IgG на электроформо-
браны из нейлона-6 индивидуально взвешивали
ванные мембраны. В основе этой методики лежит
на аналитических весах Analytical Plus (Ohaus,
флуориметрия; для визуализации структуры мем-
США) и помещали в лунки 96-луночного поли-
бран использованы методы сканирующей элек-
стирольного планшета с плоским дном (Greiner
тронной микроскопии и конфокальной лазерной
Bio-One, США). Готовили разведения антител в
сканирующей микроскопии (КЛСМ).
PBS в концентрациях 10, 5 и 2.5 мкг/мл и добав-
ляли в лунки планшета с мембранами по 100 мкл
раствора, а также в пустые лунки для калибровки.
МАТЕРИАЛЫ И МЕТОДЫ
На каждую концентрацию антител брали по че-
Электроспиннинг. Мембраны были изготовле-
тыре мембраны. Далее продолжали титровать ан-
ны из раствора нейлона-6 (Sigma-Aldrich, США) в
титела в пробирках Protein LoBind Tube
1,1,1,3,3,3-гексафторизопропаноле
(«ПиМ-Ин-
(022431081, Eppendorf AG, Германия) с шагом в
вест», Россия) с концентрацией 100 мг/мл. Элек-
два раза до нижней концентрационной точки, со-
троспиннинг проводили на установке Nanofiber
ответствующей 9.77 нг/мл антител, и добавляли
Electrospinning Unit (Китай). Расстояние и раз-
по 100 мкл в соответствующие лунки. Планшет
ность потенциалов между иглой шприца и кол-
герметично закрывали клейкой пленкой, накры-
лектором составляло 30 см и 30 кВ соответствен-
вали фольгой и инкубировали в течение полутора
но. Подача полимерного раствора осуществля-
часов при комнатной температуре при покачива-
лась с помощью шприцевого насоса со скоростью
нии со скоростью 200 об/мин. Далее каждую мем-
2 мл/ч. Для оценки сорбционной емкости были
брану трижды отмывали PBS с 0.05% Tween-20 в
подготовлены круглые мембраны диаметром
объеме 100 мкл, затем трижды в PBS. Для этого
6 мм, которые были вырезаны с помощью лазер-
мембраны аккуратно подхватывали пинцетом и
ной гравировальной машины LaserPro Spirit GLS
переносили в следующий ряд планшета.
(GSS, Тайвань), оснащенной инфракрасным СО2
После последней отмывки мембраны извлекали
лазером мощностью 100 Вт.
из растворов и готовили для исследования мето-
дом КЛСМ.
Сканирующая электронная микроскопия. Об-
разцы мембран из нейлона-6 покрывали слоем
Флуориметрия. Измерения флуоресценции от
золота толщиной 20 нм c использованием уста-
ячеек планшета проводили на многофункцио-
новки IonCoaterIB-3 (Eiko Engineering, Япония).
нальном планшетном ридере CLARIOstar (BMG
Исследования проводили на сканирующем элек-
LABTECH, Германия), оснащенном ксеноновой
тронном микроскопе TM 3000 (Hitachi, Япония)
лампой. Возбуждение флуоресценции происхо-
при напряжении 15 кВ.
дило на длине волны 530 нм (с использованием
БИОФИЗИКА том 67
№ 3
2022
ИЗМЕРЕНИЕ АДСОРБЦИИ АНТИТЕЛ КЛАССА IgG
557
помещали на предметный столик микроскопа,
определяли верхнюю и нижнюю поверхности
мембраны и фокусировали лазер на равном рас-
стоянии от них для настройки динамического
диапазона. Коррекцию настроек по оси z прово-
дили в соответствии с рекомендациями произво-
дителя с использованием программного обеспе-
чения NIS-Elements.
Для визуализации структуры мембран и изме-
рения их толщины настройки (мощность лазера,
коэффициент усиления, скорость сканирования,
количество точек) оптимизировали для каждого
образца. Изображения получали с помощью объ-
ективов CFI Plan Apo VC 20×/0.75 и Apo TIRF
Plan Fluor 63×/1.49. Для оценки количества ад-
сорбированных антител изображения получали
Рис. 2. Изображение поверхности электроформован-
ной мембраны из нейлона-6, полученное методом
при одинаковой мощности лазера, чувствитель-
сканирующей электронной микроскопии.
ности детектора и скорости сканирования; ис-
пользовали объектив CFI Plan Apo VC 20×/0.75.
фильтра 530/20 нм), регистрация эмиссии - на
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
580 нм (с использованием фильтра 580/30 нм).
Перед экспериментом проводили предваритель-
Электроформованные мембраны были оха-
ную оптимизацию фокусного расстояния и регу-
рактеризованы с помощью сканирующей элек-
лировку усиления сигнала относительно лунки с
тронной микроскопии (рис. 2). Мембраны состо-
заведомо максимальным сигналом (точка калиб-
яли из гладких цилиндрических волокон без
ровки с максимальной концентрацией IgG-Cy3).
утолщений и «бусин» на их поверхности. Сред-
Флуоресценцию регистрировали с помощью
ний диаметр волокон мембраны составил
верхней оптической системы.
280 ± 150 нм (среднее ± стандартное отклонение).
По величине флуоресцентных сигналов вы-
Электроформованные мембраны имели диа-
числяли массы антител в каждой из лунок. Ка-
метр 6 мм и толщину ~30-70 мкм - их массы со-
либровочную кривую, т.е. зависимость массы ан-
ставляли менее 1 мг. Масса антител, адсорбиро-
тител в лунке от интенсивности флуоресценции,
ванных на такую мембрану, еще на несколько по-
строили в двойных логарифмических координа-
рядков меньше, и зарегистрировать ее на весах
тах. Связывающую способность мембраны Q вы-
практически невозможно. Тем не менее, ее мож-
числяли по формуле
но вычислить с помощью оптических измерений.
Для растворов иммуноглобулинов мыши с
m
нач
-
m
ост
−
m
отм i
i
концентрациями 2.5, 5 и 10 мкг/мл были вычис-
Q
=
,
лены связывающие способности мембран, а так-
m
мембраны
же доли белка, адсорбированного мембраной
долю адсорбированного белка A вычисляли по
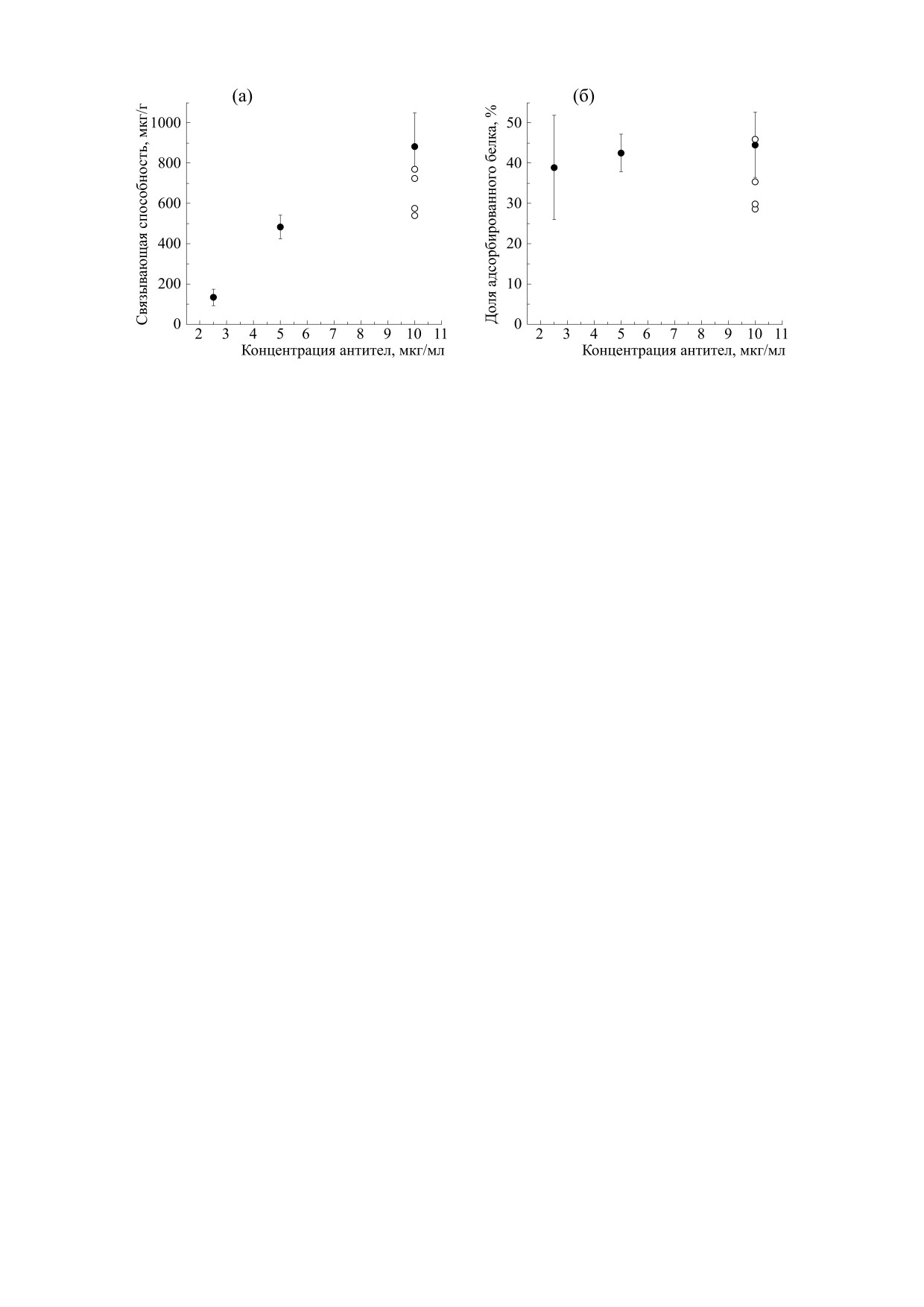
(рис. 3). Связывающая способность увеличива-
формуле
лась при увеличении концентрации антител, что
можно ожидать при малых концентрациях. По
m
-
m
−
m
нач
ост
отм i
данным атомно-силовой микроскопии при ад-
i
A
=
,
сорбции глобулярных белков на плоскую поверх-
m
нач
ность из раствора с концентрацией
~1-
где mнач - начальная масса антител в растворе, в
10 мкг/мл, формируется не монослой, а покрытие
который помещали мембрану с массой mмембраны,
из отдельных молекул [15].
mост - масса антител, оставшихся в лунке после
Для сравнения: при адсорбции липазы на во-
инкубации мембраны в ней, mотмi - масса анти-
локнистые мембраны из нейлона-6 также наблю-
тел в тех лунках, в которых мембрану отмывали.
дались линейные зависимости связывающей спо-
собности от концентрации белка в растворе [16].
Конфокальная лазерная сканирующая микро-
Эти эксперименты выполнялись с растворами,
скопия. Измерения методом КЛСМ проводили на
имеющими концентрации порядка ~1 мг/мл, что
микроскопе Eclipse Ti-E с конфокальным моду-
лем А1 (Nikon Corporation, Япония). Мембраны,
как минимум на два порядка больше, чем кон-
обработанные растворами флуоресцентно мече-
центрации, использованные в данной работе. Ве-
ных антител, размещали между парой покровных
личина связывающей способности нейлоновых
стекол в смеси глицерина и желатина. Образец
мембран по отношению к IgG составляла менее
БИОФИЗИКА том 67
№ 3
2022
558
СЕНКОВЕНКО и др.
Рис. 3. Зависимости удельной связывающей способности мембраны (а) и доли адсорбированного белка (б) от концен-
трации антител в растворе. Светлые кружки соответствуют экспериментам с мембранами из нейлона, которые инку-
бировали в PBS, а затем погружали в раствор антител с концентрацией 10 мкг/мл.
1 мг/г (рис. 3а) - настолько малые значения, ско-
объясняться тем, что инкубация мембран в PBS
рее всего, также объясняются низкими концен-
компенсирует электростатический заряд, кото-
трациями антител. Для количественного измере-
рый остается после электроспиннинга [19].
ния адсорбции антител на электроформованные
После инкубации в растворах флуоресцентно
мембраны массу антител иногда нормируют на
меченых антител мембраны исследовали методом
площадь мембраны. При таких расчетах мы полу-
КЛСМ. Типичное изображение мембраны пока-
чаем адсорбцию в диапазоне 0.35-1.4 мкг/см2 -
зано на рис. 4.
это близко к адсорбции антител на мембраны из
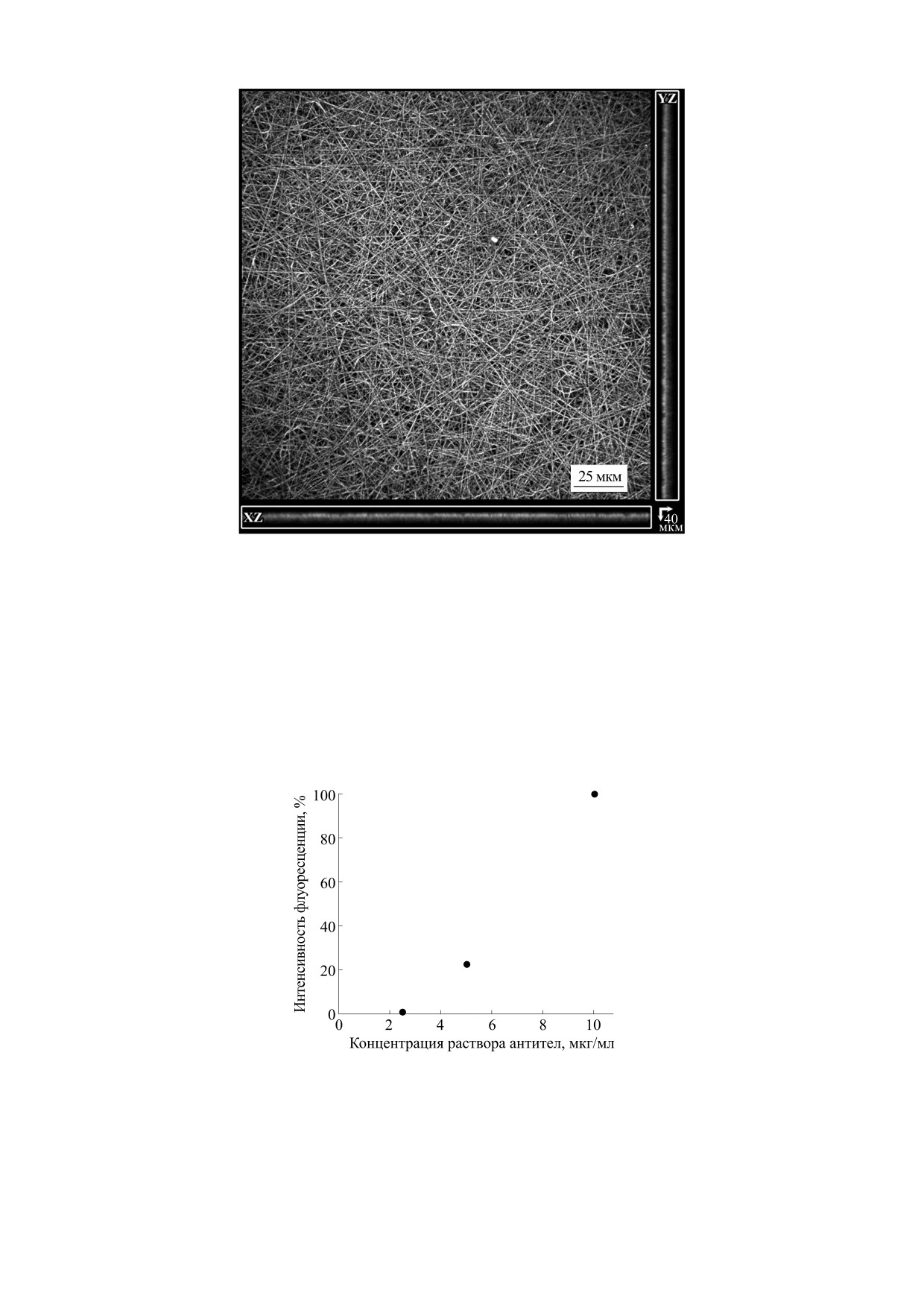
Характерная яркость увеличивалась по мере
нитроцеллюлозы (1.36 ± 0.64 мкг/см2) и полилак-
увеличения концентрации - это заметно, если
тида (6.35 ± 0.64 мкг/см2) из раствора с концен-
получить изображения всех мембран при одних и
трацией 20 мкг/мл [17].
тех же настройках (рис. 5). Действительно, при
постоянстве динамического диапазона на полу-
По проведенным измерениям можно оценить
ченных изображениях мембран, обработанных
долю молекул белка, адсорбированных на мем-
антителами, мода интенсивности увеличивалась
брану после ее инкубации в растворе (рис. 3б).
по мере увеличения концентрации антител.
Эта величина слабо зависела от концентрации
Метод КЛСМ позволяет увидеть волокнистую
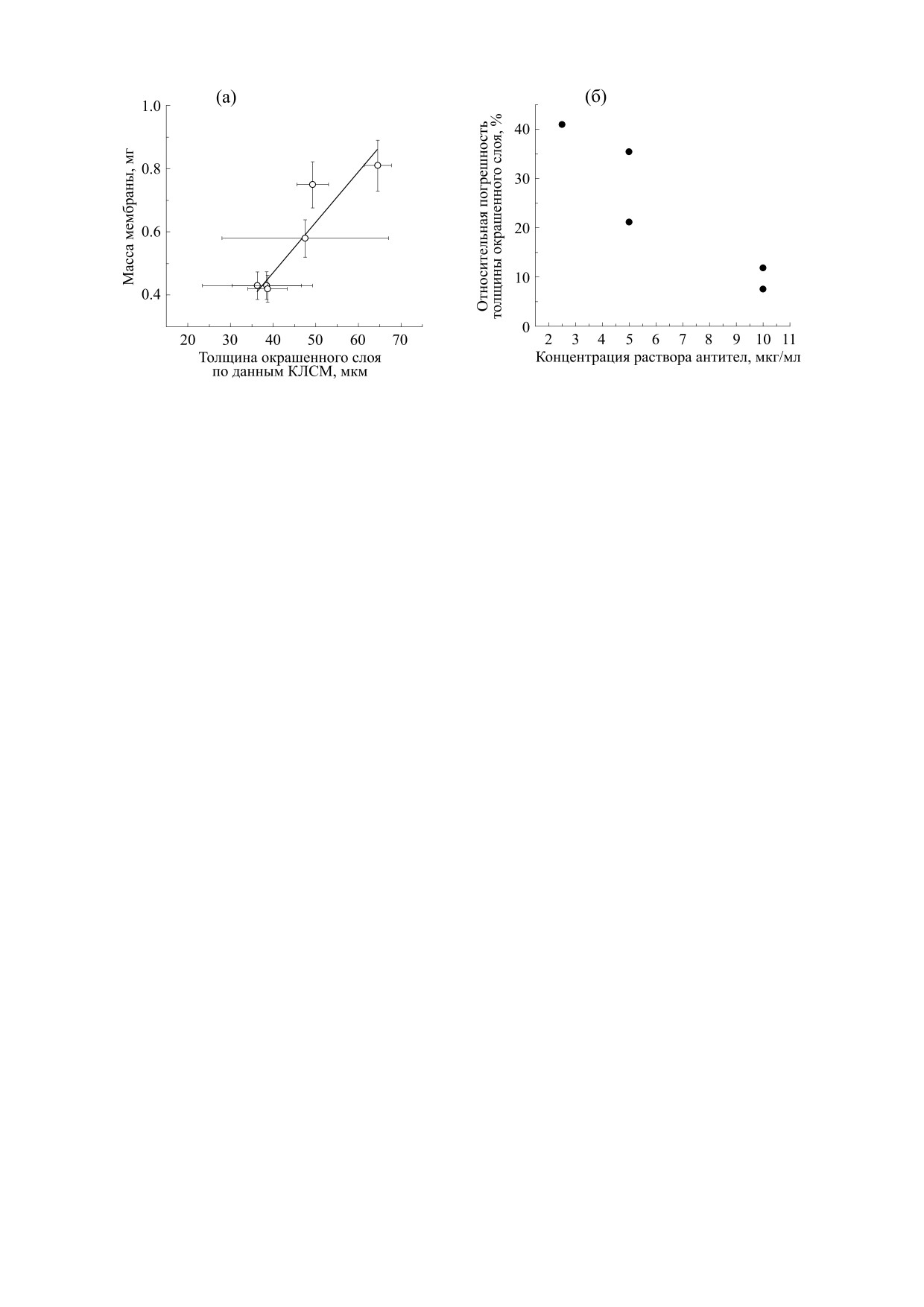
антител, и составляла 40-45%. Для сравнения:
структуру и измерить толщину окрашенного слоя
электроформованные мембраны из поли(ε-ка-
мембран - она была линейно связана с их массой
пролактона) в аналогичных экспериментах ад-
сорбировали 35% антител, и эту долю можно бы-
(рис. 6а), (коэффициент детерминации R2 = 0.88).
ло увеличить до 52%, если добавить в раствор
Согласно полученным изображениям (рис. 4),
200 мМ Na2SO4 [18]. Указанная доля определяет-
центральная область мембраны (слои) флуоресци-
ся прежде всего энергией взаимодействия между
рует более интенсивно, чем поверхность, т. е. с по-
антителами и поверхностью нейлоновых мем-
верхности антитела были смыты. Действительно,
бран. Оказалось, что если мембраны предвари-
молекулы белка, иммобилизованного на поверх-
тельно проинкубировать в PBS в течение 12 ч, то
ности с помощью физической адсорбции, могут
доля адсорбированных антител снижается. Такой
быть десорбированы с нее сравнительно легко, что
эксперимент был проведен с растворами антител,
было показано для многих поверхностей и, в част-
концентрация которых составляла 10 мкг/мл -
ности, для нейлона-6 [9]. Таким образом, толщина
окрашенного слоя систематически оказывалась
соответствующие количественные характеристи-
меньше, чем толщина мембраны.
ки адсорбции антител показаны на рис. 3 светлы-
ми кружками (приводятся индивидуальные экс-
Электроформованные мембраны, полученные
периментальные точки, среднее значение состав-
в одинаковых условиях, могут иметь вариации
ляет
35
± 7%). Снижение адсорбции может
толщины, а также вариации диаметров волокон и
БИОФИЗИКА том 67
№ 3
2022
ИЗМЕРЕНИЕ АДСОРБЦИИ АНТИТЕЛ КЛАССА IgG
559
Рис. 4. Изображение мембраны, обработанной раствором флуоресцентно меченых антител с концентрацией
10 мкг/мл, полученное с использованием КЛСМ.
плотности их укладки [20]. Наблюдаемая линей-
измеряемых значений толщины мембраны. Дей-
ная зависимость толщины окрашенного слоя от
ствительно, при увеличении концентрации сни-
массы мембран косвенно указывает на постоян-
жалось стандартное отклонение толщины окра-
ство их плотности - с учетом неоднородностей
шенного слоя и относительная погрешность из-
флуоресцентного окрашивания. Эти неоднород-
мерения толщины (отношение стандартного
ности, в частности, приводили к разбросу отклонения к средней толщине, рис. 6б).
Рис. 5. Зависимость моды интенсивности флуоресценции на изображениях мембран от концентрации раствора анти-
тел, в котором их инкубировали.
БИОФИЗИКА том 67
№ 3
2022
560
СЕНКОВЕНКО и др.
Рис. 6. Взаимосвязь между массой мембраны и ее толщиной (а) и влияние концентрации раствора антител на
относительную погрешность толщины мембран, измеряемой КЛСМ (б). Каждая точка на графике соответствует
одной мембране.
ЗАКЛЮЧЕНИЕ
ФИНАНСИРОВАНИЕ РАБОТЫ
Методом электроспиннинга были изготовле-
Работа выполнена при финансовой поддержке
ны электроформованные мембраны с толщиной
Российского научного фонда, проект № 21-74-
~40-70 мкм, состоящие из волокон со средним
10042.
диаметром 280 ± 150 нм. Была измерена адсорб-
ция антител IgG на поверхность этих мембран;
КОНФЛИКТ ИНТЕРЕСОВ
после полутора часов инкубации связывающая
способность составляла порядка ~100 мкг/г и уве-
Авторы заявляют об отсутствии конфликта
личивалась при увеличении концентрации анти-
интересов.
тел в растворе.
При разработке биосенсоров необходимо кон-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
тролировать рецепторный слой - его структуру,
однородность, стабильность и воспроизводи-
Настоящая работа не содержит описания ис-
мость. Если подложкой для его иммобилизации
следований с использованием людей и животных
является электроформованная мембрана, то ис-
в качестве объектов.
следование свойств рецепторного слоя может
оказаться сложным, вследствие гибкости и опти-
ческой непрозрачности (диффузного рассеяния
СПИСОК ЛИТЕРАТУРЫ
света) мембран. Описанные в данной работе ме-
1. L. A. Mercante, A. Pavinatto, T. S. Pereira, et al., Sen-
тодики помогают преодолеть эти сложности, из-
sors and Actuators Reports 3, 100048 (2021).
мерить связывающую способность электрофор-
2. N. Aliheidari, N. Aliahmad, M. Agarwal, and
мованных мембран и проконтролировать одно-
H. Dalir, Sensors 19, 3587 (2019).
родность адсорбции молекул на поверхности
3. S. Smith, K. Goodge, M. Delaney, A. Struzyk, et al.,
волокон.
Nanomaterials 10, 1 (2020).
4. A. Nieto, A. Gayá, C. Moreno, et al., Ann. l’Institut
Pasteur / Immunol. 137, 161 (1986).
БЛАГОДАРНОСТИ
5. R. C. Murdock, L. Shen, D. K. Griffin, et al., Anal.
Измерения методами сканирующей электрон-
Chem. 85, 11634 (2013).
ной микроскопии и КЛСМ выполнены с исполь-
6. Z. Chen, K. Zhou, W. Ha, et al., Food Agric. Immu-
зованием оборудования, приобретенного в рам-
nol. 30, 497 (2019).
ках Программы развития Московского государ-
7. D. Yang, X. Niu, Y. Liu, et al., Adv. Mater. 20, 4770
ственного университета имени М.В. Ломоносова
(2008).
до 2020 года. Авторы работ благодарят Научно-
8. J. Wang, Q. S. Kang, X. G. Lv, et al., PLoS One 8, 1
образовательную школу МГУ имени М.В. Ломо-
(2013).
носова «Молекулярные технологии живых си-
9. E. R. Tovey and B. A. Baldo, J. Biochem. Biophys.
стем и синтетическая биология».
Methods 19, 169 (1989).
БИОФИЗИКА том 67
№ 3
2022
ИЗМЕРЕНИЕ АДСОРБЦИИ АНТИТЕЛ КЛАССА IgG
561
10. S. Pierotti, C. Albano, A. Milandri, et al., Toxicon 49,
16. H. Y. Y. Zeng, X. Y. Y. Liu, P. He, et al., Biocatal. Bio-
36 (2007).
transformation 32, 188 (2014).
11. A. Dubitsky, D. DeCollibus, and G. A. Ortolano, J.
17. F. Ma, L. He, E. Lindner, and D. Y. Wu, Appl. Surf.
Biochem. Biophys. Methods 51, 47 (2002).
Sci. 542, 21 (2021).
12. R. Shaimi and S. C. Low, J. Appl. Polym. Sci. 135, 40
(2018).
18. D. Wu, D. Han, and A. J. J. Steckl, ACS Appl. Mater.
13. Contact Angle, Wettability and Adhesion, Ed. By
Interfaces 2, 252 (2010).
F. M. Fowkes (Advances in Chemistry, Am. Chem.
19. H. Esfahani, M. P. Prabhakaran, E. Salahi, et al., J.
Soc., Washington, DC, 1964), vol. 43.
Colloid Interface Sci. 443, 143 (2015).
14. J. S. Hersey, A. Meller, and M. W. Grinstaff, Anal.
Chem. 87, 11863 (2015).
20. L. D. Burke, K. A. Blackwood, and F. Z. Volpato, in
15. G. C. Ratcliff and D. A. Erie, J. Am. Chem. Soc. 123,
Electrospun Biomater. Relat. Technol., Ed. by J. Almo-
5632 (2001).
dovar (Springer Int. Publ., Cham, 2017), pp. 1-19.
Measurements of IgG Antibodies Adsorption onto Electrospun Nylon-6 Membranes
A.M. Senkovenko*, A.M. Moysenovich*, A.A. Maslakova*,
E.R. Pavlova*, **, and D.V. Bagrov*
*Lomonosov Moscow State University, Leninskie Gory 1/12, Moscow, 119234 Russia
**Federal Research and Clinical Center of Physical-Chemical Medicine, Federal Medical Biological Agency of the Russian
Federation, Malaya Pirogovskaya ul. 1a, Moscow, 119435 Russia
Biosensors based on electrospun membranes have some advantages over the traditional biosensor devices that
include a receptor layer immobilized on a flat support. Due to the large surface area of the electrospun mem-
brane, the number of analyte-binding sites increases but it does not interfere with traditional detection meth-
ods (e.g., electrochemical detection). In this study, the adsorption of IgG antibodies onto electrospun nylon-
6 membranes was explored. It was shown that at an antibody concentration of 2.5-10 μg/ml, the membrane
had a binding capacity of ~100 μg/g and the volume fraction of the adsorbed antibodies was 40-45%. Using
laser scanning confocal microscopy, it was found that the adsorbed antibodies were washed from the outer
layers of the membrane more efficiently than from the inner layers. The procedure for measuring the binding
capacity of membranes introduced in this paper can be a useful tool in developing immunosensors.
Keywords: electrospinning, polymer membrane, adsorption, nylon-6, antibodies, immunoassay
БИОФИЗИКА том 67
№ 3
2022