БИОФИЗИКА, 2022, том 67, № 3, с. 516-523
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС: ИССЛЕДОВАНИЕ
МЕХАНИЗМОВ РЕГУЛЯЦИИ СВЕТОВЫХ СТАДИЙ ФОТОСИНТЕЗА
РАСТЕНИЙ
© 2022 г. Э.К. Рууге*, **, А.Н. Тихонов*, ***
*Физический факультет Московского государственного университета имени М.В. Ломоносова,
119991, Москва, Ленинские горы, 1/2
**Национальный медицинский исследовательский центр кардиологии имени академика Е.И. Чазова
Минздрава России,
121552, Москва, 3-я Черепковская ул., 15а
E-mail: ruuge@mail.ru
***Институт биохимической физики имени Н.М.Эмануэля РАН, 119334, Москва, ул. Косыгина, 4
E-mail: an_tikhonov@mail.ru
Поступила в редакцию 20.02.2022 г.
После доработки 20.02.2022 г.
Принята к публикации 09.03.2022 г.
Метод ЭПР находит широкое применение в биофизике фотосинтеза, поскольку он служит эффек-
тивным инструментом для изучения процессов электронного и протонного транспорта в различных
фотосинтетических системах. Работа посвящена исследованию регуляции электронного транспор-
та в хлоропластах методом ЭПР, выполненному при непосредственном участии авторов. Показаны
возможности использования метода ЭПР для изучения кинетики переноса электронов в хлоропла-
стах высших растений in situ (листья высших растений) при комнатных температурах и рассмотрены
спектры ЭПР хлоропластов при криогенных температурах. Последнее имеет особое значение для
обоснования используемого нами «кинетического» метода измерения рН внутри тилакоидов.
Ключевые слова: электронный парамагнитный резонанс, фотосинтез, электронный транспорт.
DOI: 10.31857/S0006302922030097, EDN: ANNGVU
ферменты, которые обеспечивают усвоение CO2
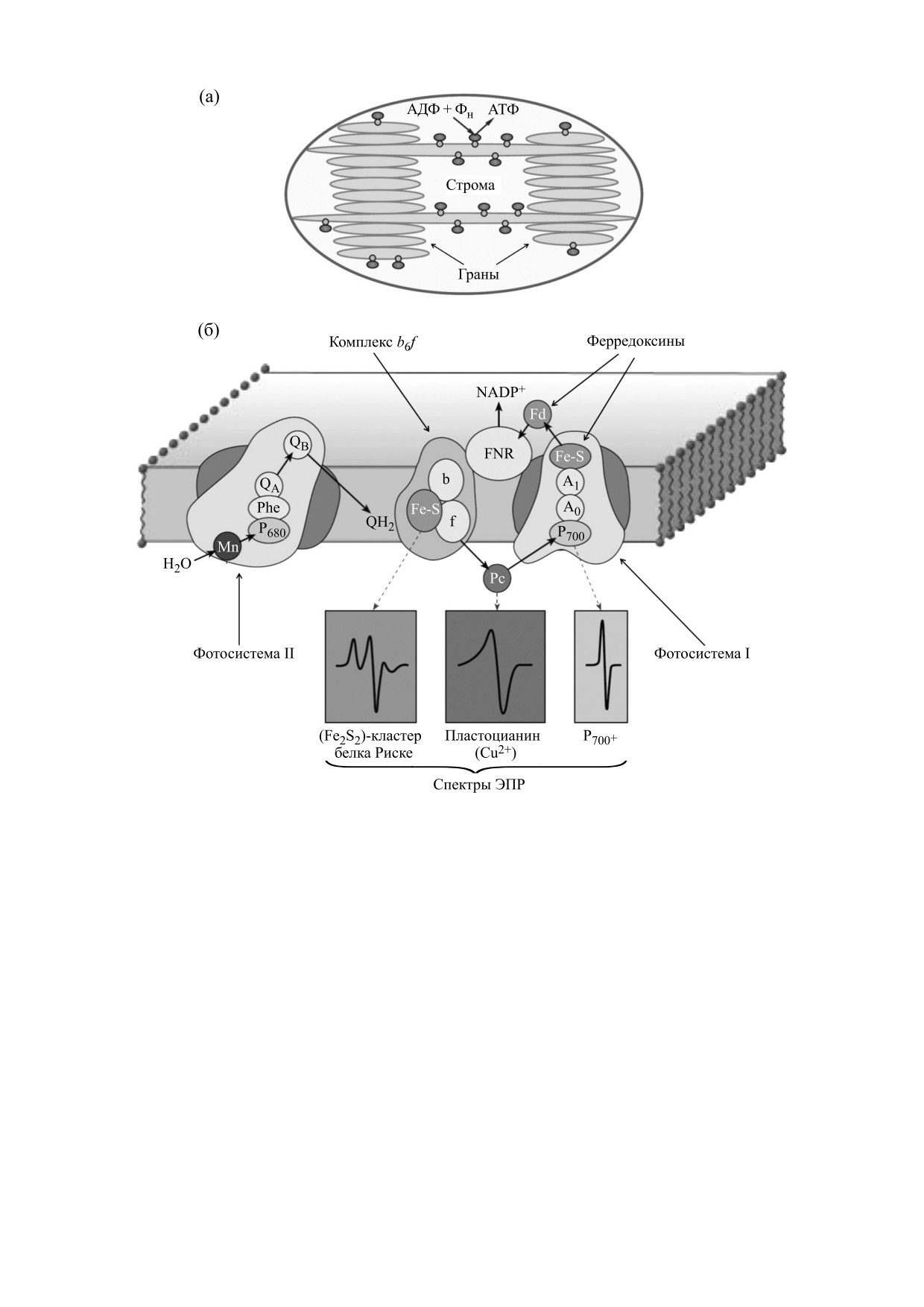
У высших растений процессы оксигенного
фотосинтеза протекают в хлоропластах - специа-
растениями. Тилакоидные мембраны содержат
лизированных энергопреобразующих органеллах
пигмент-белковые комплексы, участвующие в
растительной клетки [1]. Схематическое изобра-
фотосинтетическом транспорте электронов, а
жение хлоропласта показано на рис. 1а. Под
также АТР-синтазные комплексы, катализирую-
двойной оболочкой хлоропласта, состоящей из
щие образование ATФ из AДФ и неорганического
наружной и внутренней мембран, находятся про-
фосфата (Фн).
тяженные мембранные структуры, которые обра-
Биофизические методы исследования сыграли
зуют замкнутые везикулы, имеющие форму дис-
решающую роль в выяснении механизмов транс-
ков и называемые тилакоидами. Мембраны тила-
порта электронов у растений. Методами абсорб-
коидов содержат фотосинтетические пигмент-
ционной спектроскопии высокого временного
белковые комплексы (рис. 1б). У высших расте-
разрешения были идентифицированы и охарак-
ний тилакоиды группируются в граны - стопки
теризованы переносчики электрон-транспорт-
сплюснутых и тесно прижатых друг к другу тила-
ной цепи хлоропластов; флуоресцентный анализ
коидов. Продолжением отдельных тилакоидов
пигментов фотосинтетического аппарата лежит в
гран служат выступающие из них межгранные
основе диагностики функционального состояния
(стромальные) тилакоиды. В строме (простран-
хлоропластов in vivo. Особую роль в изучении
ство между оболочкой хлоропласта и тилакоида-
оксигенного фотосинтеза сыграл метод элек-
ми) содержатся молекулы РНК, ДНК, рибосомы,
тронного парамагнитного резонанса (ЭПР), с по-
крахмальные зерна, а также многочисленные
мощью которого в хлоропластах были идентифи-
Сокращения: ЭПР - электронный парамагнитный резонанс,
цированы электронные переносчики, практиче-
ФС I - фотосистема I, ФС II - фотосистема II.
ски невидимые традиционными оптическими
516
ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС
517
Рис. 1. Схематические изображения тилакоидной системы хлоропласта (а) и фотосинтетической цепи переноса
электронов (б).
методами, поскольку сравнительно слабые спек-
Он был одним из первых в мире, кто начал такие
тры поглощения этих молекул замаскированы
исследования в конце 50-х годов XX века (см.
интенсивными спектрами поглощения фотосин-
очерк С.Э. Шноля в книге [9]). В научном насле-
тетических пигментов и цитохромов. К таким пе-
дии Л.А. Блюменфельда значительная часть ис-
реносчикам относятся кофакторы электронного
следований посвящена изучению фотосинтети-
транспорта, содержащие негемовое железо
-
ческих систем методом ЭПР [10-20]. Эти работы
белки, входящие в пигмент-белковый комплекс
проводились в течение многих лет на кафедре
фотосистемы I (ФС I) [2], медь-содержащий бе-
биофизики физического факультета МГУ имени
лок пластоцианин [3] и железо-серный кластер
М.В. Ломоносова и в Институте химической фи-
(Fe2S2) белка Риске [4], входящего в цитохром-
зики Академии наук. Охватить в краткой статье
ный b6 f-комплекс хлоропластов [5-8].
все многообразие исследований в области биофи-
Л.А.Блюменфельду принадлежит приоритет в
зики фотосинтеза, выполненных под руковод-
изучении биологических систем методом ЭПР. ством Л.А. Блюменфельда, не представляется
БИОФИЗИКА том 67
№ 3
2022
518
РУУГЕ, ТИХОНОВ
возможным. Отметим лишь некоторые из наибо-
МАТЕРИАЛЫ И МЕТОДЫ
лее важных научных достижений в этой области.
Объектами исследования служили листья
Методом ЭПР была детально изучена кинетика
комнатного растения китайской розы (Hibiscus
фотоиндуцированных превращений Р700 в хлоро-
rosa-sinensis), листья бобов (Vicia faba) и изоли-
пластах высших растений in situ (листья) и выяв-
рованные из них хлоропласты. Методика выде-
лены два участка регуляции фотосинтетического
ления хлоропластов класса Б из проростков бо-
переноса электронов - акцепторный участок
бов сорта «Русские черные» описана в работах
ФС I и стадия окисления пластохинола (PQH2)
[18, 26]. Хлоропласты суспендировали в среде
инкубации, содержащей 10 мМ буфер трицин
цитохромным b6f-комплексом [21-24]. В работе
(рН 7.5). В качестве искусственного акцептора
Блюменфельда с сотрудниками Института хими-
электронов в ФС I использовали 10 мкМ раствор
ческой физики [20] было показано функциони-
метилвиологена. Спектры ЭПР, измеряемые
рование двух-электронного «затвора», связанно-
при комнатной температуре (22-24оС), реги-
го с двух-электронным восстановлением пласто-
стрировали при СВЧ-мощности 10 мВт и ампли-
хинона (PQ) на акцепторном участке
туде ВЧ-модуляции, равной 0.4 мТл. Для реги-
фотосистемы 2 (ФС II) до его полностью восста-
страции кинетики окислительно-восстанови-
новленной формы - пластохинола (PQH2). Пла-
тельных превращений фотореакционного
стохинол окисляется цитохромным b6 f-комплек-
центра фотосистемы I (Р700) магнитное поле
сом, содержащим железо-серный кластер Fe2S2
фиксировали на низкополевом экстремуме сиг-
белка Риске. Анализируя релаксационные харак-
нала ЭПР от окисленных центров Р700+. Образ-
теристики Fe2S2 центров в цепях электронного
цы освещали белым светом от лампы накалива-
транспорта митохондрий и хлоропластов, Блю-
ния (300 Вт), возбуждающим обе фотосистемы,
или дальним красным светом (λмакс = 707 нм,
менфельд предположил, что в белках Риске цито-
хромных комплексов bc1 и b6f происходят сравни-
8 Вт), выделяемым с помощью интерференци-
онного фильтра IF707 (Karl Zeiss Jena, Герма-
тельно медленные конформационные перестрой-
ния) и возбуждающим преимущественно ФС I.
ки белковой глобулы. Согласно релаксационной
Измерения спектров ЭПР исследуемых объек-
концепции ферментативного катализа, выдвину-
тов проводили с помощью ЭПР-спектрометров
той Блюменфельдом [11-14], эти перестройки
Е-4 и Е-9Е (Varian, США), укомплектованных
инициируются быстрыми реакциями переноса
приставками для варьирования температуры об-
электронов в электрон-транспортных цепях ми-
разцов в широком диапазоне. Измерения спек-
тохондрий и хлоропластов. Впоследствии пред-
тров ЭПР при криогенных температурах прово-
положение о конформационных изменениях бел-
дили с использованием установки ESR-9 (Oxford
ка Риске нашло убедительное экспериментальное
Instruments, Великобритания). Препараты выде-
доказательство [25] (см. также обзорные статьи
ленных хлоропластов помещали в кварцевые ам-
[5-8]).
пулы и затем адаптировали к темноте или осве-
щали белым светом в течение 1 мин. Затем ампу-
Л.А. Блюменфельд с большим интересом от-
лы с образцами быстро замораживали путем
носился к работам в области биофизики фото-
охлаждения их в жидком бутане до 77 К и поме-
синтеза, которые велись на кафедре биофизики
щали в резонатор спектрометра Е-109Е. Темпера-
физического факультета МГУ имени М.В. Ло-
туру измеряемых образцов варьировали в интер-
моносова. В краткой статье нет возможности рас-
вале 6-30 К, СВЧ-мощность - в интервале 0.01-
сказать обо всех направлениях этих исследова-
10 мВт. Температуру образцов в резонаторе спек-
ний. Мы остановимся на работах, посвященных
трометра измеряли с помощью калиброванной
изучению регуляции электронного транспорта в
термопары. Особое внимание было уделено тща-
хлоропластах методом ЭПР, которые были
тельному выбору кварцевых ампул, которые не
выполнены под руководством и при непосред-
давали паразитных сигналов ЭПР при криоген-
ственном участии авторов данной статьи.
ных температурах.
Мы проиллюстрируем возможности использова-
ния метода ЭПР для изучения кинетики переноса
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
электронов в хлоропластах высших растений
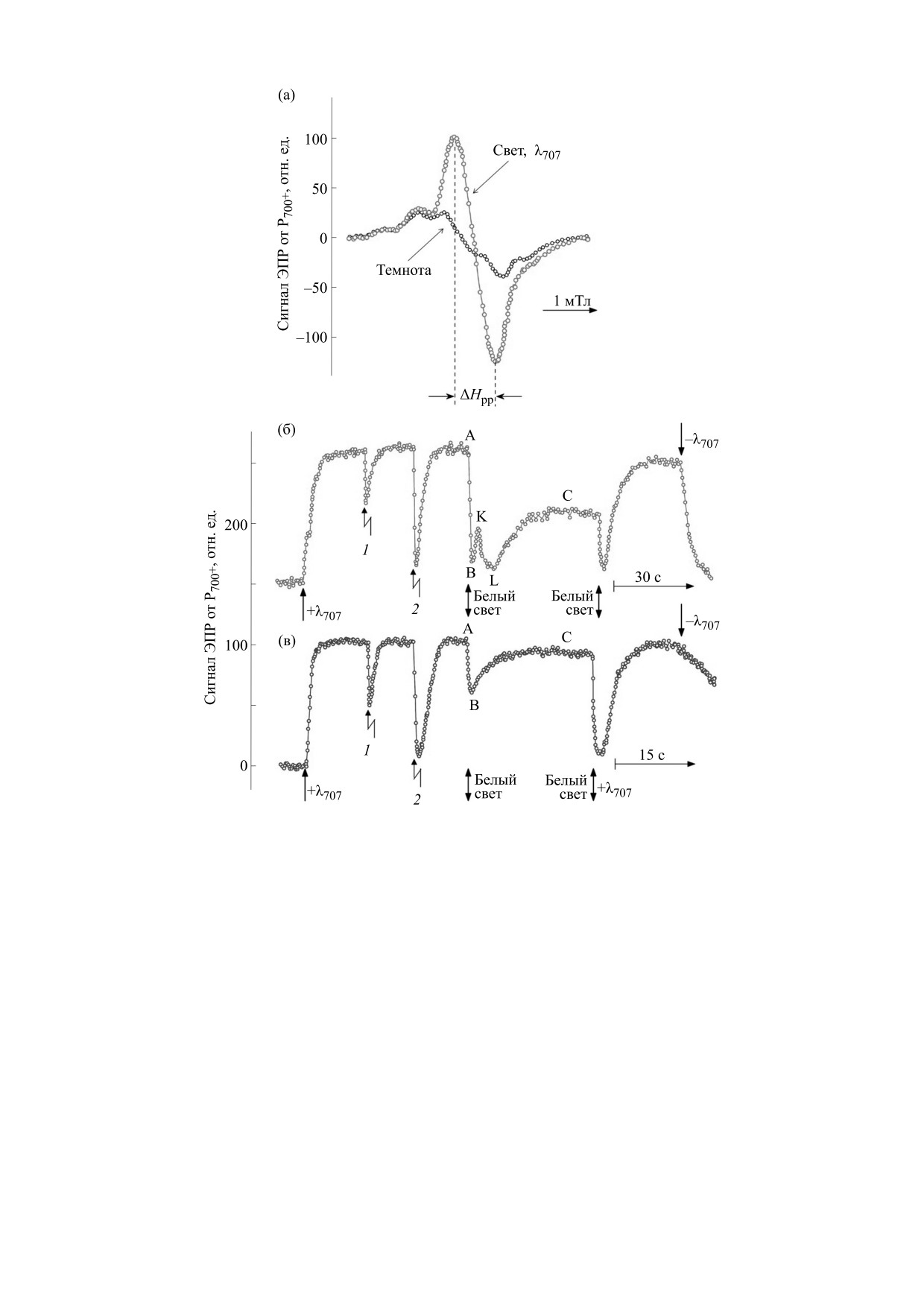
Кинетика фотоиндуцированных редокс-превра-
in situ (листья высших растений) при комнатных
щений Р700 в хлоропластах. На рис. 2 показаны
температурах и рассмотрим спектры ЭПР хлоро-
спектры ЭПР хлоропластов бобов и кинетики
пластов при криогенных температурах. Послед-
фотоиндуцированных изменений величины сиг-
нее имеет особое значение для обоснования ис-
пользуемого нами «кинетического» метода изме-
нала ЭПР от окисленных центров Р700+ в листьях
рения рН внутри тилакоидов.
и в изолированных хлоропластах бобов. Из
БИОФИЗИКА том 67
№ 3
2022
ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС
519
Рис. 2. Спектры ЭПР хлоропластов бобов ((а), первая производная спектра поглощения) и кинетики фотоиндуциро-
ванных изменений величины сигнала ЭПР от Р700+ в листьях (б) и изолированных хлоропластах бобов (в). Зигзагооб-
разными стрелками показаны моменты подачи вспышек белого света длительностью t1/2 = 7 мкс (1) или t1/2 = 750 мкс (2).
рис. 2а видно, что освещение хлоропластов даль-
После включения непрерывного белого света
ним красным светом (λмакс = 707 нм) вызывает
происходили немонотонные фотоиндуцирован-
окисление Р700. Об этом однозначно свидетель-
ные изменения сигнала ЭПР от Р700+. В листьях
ствуют параметры сигнала ЭПР, индуцированного
бобов (рис. 2б) мы наблюдали многофазную ки-
дальним красным светом (значение g-фактора, рав-
нетику, включающую несколько стадий измене-
ного 2.0025, и полуширина сигнала ΔHpp = 0.9 мТл)
ний величины сигнала (кривая A-B-K-L-C). В
[27]. В ответ на вспышки белого света различной
случае изолированных хлоропластов класса Б на-
длительности, подаваемые на фоне дальнего
блюдалась более простая кинетическая кривая
красного света, происходит сначала восстановле-
(так называемый «перехлест» А-В-С, рис. 2в).
ние Р700+, вслед за которым наблюдается ре-окис-
Нами была изучена зависимость кинетики
ление Р700 за счет действия света с λмакс = 707 нм. окислительно-восстановительных превращений
БИОФИЗИКА том 67
№ 3
2022
520
РУУГЕ, ТИХОНОВ
нов к Р700+, зависящей от pHin [18, 29, 34]. «Кине-
тический» метод измерения pHin был использо-
ван в наших работах для измерения транс-
тилакоидной разности рН (ΔpH) в различных ме-
таболических состояниях хлоропластов (см. по-
дробнее обзор [37]). Одно из условий для адекват-
ного использования этого метода заключается в
том, что состояние электронных переносчиков
как в сопряженных, так и в разобщенных хлоро-
пластах, используемых для построения калибро-
вочной зависимости скорости переноса электро-
нов между ФС II и ФС I от pHin, должно быть оди-
наковым. Для обоснования этого метода
положения нами были проведены описанные ни-
же измерения низкотемпературных спектров
ЭПР хлоропластов.
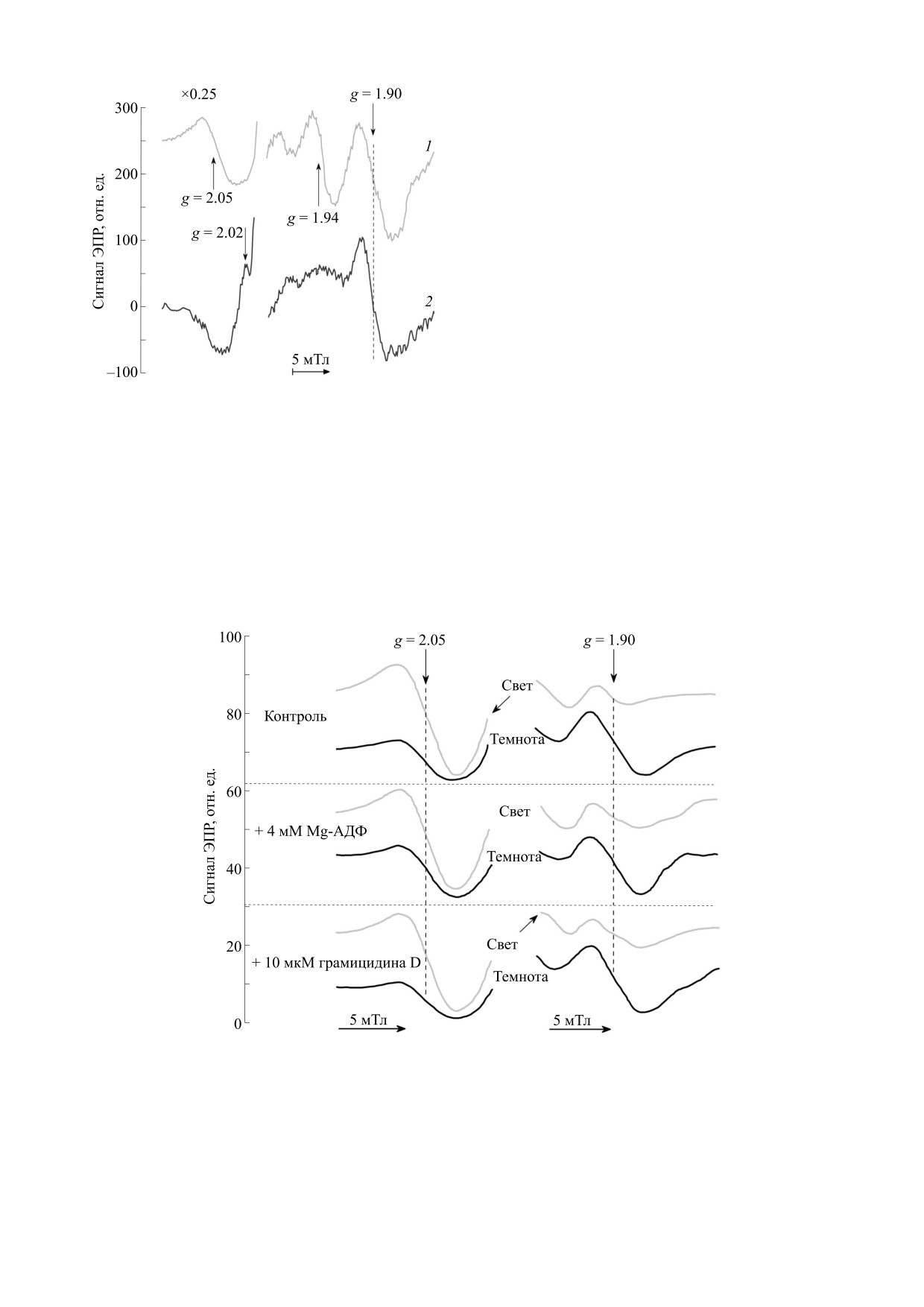
Окислительно-восстановительное состояние пе-
реносчиков электрон-транспортной цепи (по дан-
ным низкотемпературной ЭПР-спектроскопии). На
Рис. 3. Спектр ЭПР хлоропластов бобов, замороженных
рис. 3 представлены спектры ЭПР хлоропластов
на свету в присутствии 20 мМ дитионита натрия.
бобов, восстановленных дитионитом и заморо-
Температура образца при регистрации спектров равна
женных непосредственно во время их освещения
20 К.
белым светом. В спектре ЭПР видны интенсив-
ные линии, принадлежащие восстановленным
акцепторам ФС I - железо-серным центрам FА и
Р700 от предыстории освещения образцов (дли-
FB. Сопоставление g-факторов этих сигналов с
тельность адаптации к темноте или к свету опре-
деленного спектрального состава) и от действия
литературным данными свидетельствует о том,
ингибиторов или медиаторов электронного
что в наблюдаемый спектр могут вносить вклад
транспорта, а также разобщителей, подавляющих
как взаимодействующие, так и не взаимодейству-
трансмембранную разность электрохимических
ющие друг с другом центры FА и FB (сигналы с
потенциалов в хлоропластах (см. подробнее рабо-
g = 1.94 и g = 1.92) (об идентификации линий
ты [22-24, 28-32]). На основании этого было вы-
ЭПР в хлоропластах при криогенных температу-
яснено, какие факторы регуляции электронного
рах cм. обзорные работы [38-40]). Как и следова-
транспорта определяют немонотонную кинетику
ло ожидать, в спектре ЭПР отсутствует сигнал,
который мог бы принадлежать к фракции водо-
изменений сигнала ЭПР от Р700+ в хлоропластах
растворимого феррредоксина, вымываемого при
листьев, адаптированных к темноте. Установле-
выделении хлоропластов класса Б. Наиболее ин-
но, что основной вклад в наблюдаемые явления
тенсивная линия сигнала с gy = 1.89-1.90 близка к
вносят: 1) фотоиндуцированное увеличение ак-
полосе с gx = 1.89, принадлежащей акцептору FB
тивности ферментов цикла Кальвина-Бенсона,
и/или FА (при условии, что он взаимодействует с
вызывающее ускорение оттока электронов от ФС
I; 2) уменьшение скорости притока электронов к
восстановленным акцептором FВ).
Р700+ [18, 23, 24, 32]. Ослабление потока электро-
Для однозначного отнесения сигнала с gy = 1.90
нов от ФС II к ФС I может происходить по раз-
к восстановленному Fe2S2 кластеру белка Риске
ным причинам, включая уменьшение фотохими-
нам необходимо было доказать, что он отличается
ческой активности ФС II вследствие усиления
по своим характеристикам от компоненты сигна-
нефотохимического тушения возбуждения хло-
ла с gx = 1.89, принадлежащего восстановленному
рофилла в светособирающей антенне ФС II и за-
центру FB. Мы смогли убедиться в этом, измеряя
медления скорости окисления пластохинола
зависимости интенсивностей линий с различны-
(PQH2) цитохромным b6f-комплексом в результа-
ми значениями g-тензора в зависимости от СВЧ-
те фотоиндуцированного закисления внутри-
мощности и температуры образца (данные не
тилакоидного пространства (pHin) [33-37].
приведены).
Последнее представляет особый интерес, по-
В верхней части рис. 4 показаны спектры ЭПР
скольку на этом явлении основан «кинетиче-
в хлоропластах, замороженных в темноте после
ский» метод неинвазивного измерения pHin в
предварительного освещения хлоропластов бе-
хлоропластах in situ и in vitro. Суть метода заклю-
лым светом в присутствии грамицидина D. Четко
чается в измерении скорости переноса электро-
видны сигналы, принадлежащие окисленному
БИОФИЗИКА том 67
№ 3
2022
ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС
521
сигнал наблюдается в хлоропластах, инкубиро-
ванных в темноте в присутствии 10 мМ аскорбата.
В этом случае линии сигнала ЭПР с g = 1.94 и
g = 1.92, относящиеся к восстановленным цен-
трам FA и FB, отсутствовали. Вместе с тем наряду
с линией при g = 1.90 наблюдалась компонента с
g = 2.02, относящаяся к низкополевой компонен-
те сигнала ЭПР от восстановленного железо-сер-
ного кластера белка Риске.
На рис. 5 показаны фрагменты спектров ЭПР
образцов хлоропластов для компонент сигнала с
g = 2.05 (окисленный пластоцианин) и с g = 1.90
(восстановленный Fe2S2 центр белка Риске). Об-
разцы были получены путем быстрого заморажи-
вания хлоропластов в разных метаболических со-
стояниях на свету или в темноте (через 30 с после
выключения света). Из этих данных видно, что во
Рис. 4.
Спектры ЭПР хлоропластов бобов, измеренные
время освещения хлоропластов непрерывным бе-
при 17 К: спектр 1 - хлоропласты замороженные в
лым светом большая часть молекул пластоциани-
темноте после предварительного освещения белым
на и Fe2S2 центра Риске находятся в окисленном
светом в течение 30 с; спектр
2
- хлоропласты,
состоянии. После выключения света эти пере-
адаптированные в течение
40 мин к темноте в
присутствии 10 мМ аскорбата натрия.
носчики восстанавливаются за счет пластохино-
нового пула, который поддерживается, по край-
ней мере частично, в восстановленном состоя-
пластоцианину (g = 2.05), восстановленному Fe-
нии. О состоянии пластохинонового пула в
S центру FA (g = 1.94) и восстановленному центру
условиях освещения мы можем судить по кинети-
Риске (g = 1.90). Принадлежность сигнала с
ке окислительно-восстановительных превраще-
g = 1.90 центру Риске доказывается тем, что этот
ний Р700, показанной на рис. 2в. Быстрое восста-
Рис. 5. Спектры ЭПР хлоропластов бобов, измеренные при 20 К. Образцы были получены путем быстрого замораживания
суспензий хлоропластов, находившихся в разных метаболических состояниях при освещении и в темноте (после выключе-
ния света). Контроль - хлоропласты без добавок; хлоропласты в условиях синтеза АТР (в присутствии 10 мМ Mg-ADP);
разобщенные хлоропласты (в присутствии 10 мкМ грамицидина D).
БИОФИЗИКА том 67
№ 3
2022
522
РУУГЕ, ТИХОНОВ
Блюменфельда, одного из пионеров применения
новление Р700+ сразу после выключения белого
ЭПР в изучении биологических систем.
света свидетельствует о том, что в цепи электрон-
Мы благодарны нашим коллегам, Г.Б. Хо-
ного транспорта между ФС II и ФС I имеются
мутову, А.А. Тимошину и С.Б. Рыжикову, сов-
восстановленные молекулы пластохинола.
местно с которыми была выполнена часть тех на-
Приведенные на рис. 5 данные свидетельству-
ших ранних работ по исследованию механизмов
ют о том, что во все трех метаболических состоя-
регуляции электронного транспорта в хлоропла-
ниях - в контроле (без добавок), в условиях фото-
стах высших растений, на которые мы ссылаемся
фосфорилирования (в присутствии 4 мМ Mg-
в данной работе. Мы также признательны
AТФ) и в разобщенных хлоропластах (при добав-
Ю.А. Кокшарову и Б.В. Трубицину за компьюте-
лении 10 мкМ грамицидина D), состояние донор-
ризацию спектрометров ЭПР моделей Е-4 и
ного участка цепи переноса электронов между
Е-109Е, использованных в нашей работе. Наша
цитохромным b6f-комплексом и Р700 было прак-
особая благодарность Б.В. Трубицину за помощь
тически одинаковым. На основании этого мы мо-
в оцифровке спектров ЭПР.
жем утверждать, что одно из основных требова-
ний, необходимых для корректного измерения
ФИНАНСИРОВАНИЕ РАБОТЫ
внутритилакоидного рН (рНin) «кинетическим»
методом, в наших опытах выполняется. Различие
Работа выполнена при финансовой поддержке
Российского научного фонда (проект № 21-74-
в скоростях восстановления Р700+, наблюдавшее-
20047).
ся нами в разных метаболических состояниях
хлоропластов [18, 29], обусловлено разными зна-
чениями внутритилакоидного pHin, а не разными
КОНФЛИКТ ИНТЕРЕСОВ
состояниями электрон-транспортной цепи на
Авторы заявляют об отсутствии конфликта
участке между цитохромным b6 f-комплексом и
интересов.
Р700. Отметим, что развитый нами «кинетиче-
ский» метод измерения pHin имеет одно неоспо-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
римое преимущество - с его помощью можно
Настоящая статья не содержит каких-либо ис-
проводить неинвазивные (in situ) измерения рНin
следований с участием людей или животных в ка-
в хлоропластах, находящихся в листьях.
честве объектов исследований.
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
Отметим, что метод ЭПР нашел широкое при-
1. Дж. Эдвардс и Д. Уокер, Фотосинтез С3 и С4
менение в биофизике фотосинтеза, поскольку он
растений: механизмы и регуляция (Мир, М., 1986).
служит эффективным инструментом для изуче-
2. R. Malkin and A. J. Bearden, Proc. Natl. Acad. Sci.
ния процессов электронного и протонного транс-
USA 68, 16 (1971).
порта в различных фотосинтетических системах.
3. R. Malkin and A. J. Bearden, Biochim. Biophys. Acta
Выше мы рассмотрели лишь некоторые направ-
292, 169 (1973).
ления в исследованиях биоэнергетических про-
4. R. Malkin and P. J. Aparicio, Biochim. Biophys. Res.
цессов в фотосинтезирующих системах путем ре-
Commun. 63, 1157 (1975).
гистрации электрон-транспортных процессов в
5. W.A. Cramer and S. S. Hasan, Adv. Photosynth. Res-
хлоропластах и листьях высших растений мето-
piration 41, pp.177-207 (2016).
дом ЭПР. Другие возможности использования
6. A. N. Tikhonov, In Membrane protein complexes: struc-
метода ЭПР в изучении фотосинтеза связаны с
ture and function, sub-cellular biochemistry, Ed. by
использованием стабильных радикалов (спино-
J. R. Harris and E. J. Boekema (Springer, Singapore,
вых меток). С помощью стабильных радикалов,
2018), Vol. 87, pp. 287-328.
служащих парамагнитными зондами, чувстви-
7. L. A. Malone, M. S. Proctor, A. Hitchcock, et al., Bio-
тельными к их локальному окружению, можно
chim. Biophys. Acta -Bioenergetics, 1862, 148380
следить за структурными перестройками в пиг-
(2021).
мент-белковых комплексах, а также измерять
8. M. Sarewicz, S. Pintscher, R. Pietras, et al., Chem.
транс-тилакоидную разность электрохимических
Rev. 121, 2020 (2021).
потенциалов ионов водорода [37, 41].
9. С. Э. Шноль, Герои, злодеи, конформисты отече-
ственной науки, изд. 6, испр. (URSS, М., 2022).
10. Л. А. Блюменфельд, Изв. АН СССР. Сер. биол.,
БЛАГОДАРНОСТИ
№ 3, 285 (1957).
Данная работа посвящена 100-летию со дня
11. Л. А. Блюменфельд, Проблемы биологической фи-
рождения нашего учителя, Льва Александровича
зики (Москва: Наука, 1974).
БИОФИЗИКА том 67
№ 3
2022
ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС
523
12.
L. A. Blumenfeld, Physics of Bioenergetic Processes
27. A. N. Webber and W. Lubitz, Biochim. Biophys. Acta
(Springer-Verlag, Heidelberg, 1983).
1507, 61 (2001).
13.
L. A. Blumenfeld and A. N. Tikhonov, Biophysical
28. А. Н. Тихонов и Э. К. Рууге, Биофизика 22, 839
Thermodynamics of Intracellular Processes. Molecular
(1978).
Machines of the Living Cell (Springer-Verlag, New-
29. A. N. Tikhonov, G. B. Khomutov, and E. K. Ruuge,
York, 1994).
Photobiochem. Photobiophys. 8, 261 (1984).
14.
L. A. Blumenfeld, R. M. Davydov, and A. N. Tik-
30. А. Н. Тихонов., Г. Б. Хомутов и Э. К. Рууге, Моле-
honov, J. Mol. Liquids 42, 231 (1989).
куляр. биология 13, 1085 (1979).
15.
Э. К. Рууге, А. Н. Тихонов и Л. А. Блюменфельд,
31. Г. Б. Хомутов, А. Н. Тихонов и Э. К. Рууге, Моле-
Биофизика 19, 938 (1974).
куляр. биология 15, 182 (1981).
16.
Э. К. Рууге, А. Н. Тихонов и Л. А. Блюменфельд,
32. B. V. Trubitsin, A. V. Vershubskii, V. I. Priklonskii,
Биофизика 19, 1033 (1974).
et al., J. Photochem. Photobiol. B: Biology 152, 400
17.
А. Н. Тихонов, Э. К. Рууге, В. К. Субчински и др.,
(2015).
Физиол. растений 22, 5 (1975).
33. B. Rumberg and U. Siggel, Naturwissenschaften 56,
18.
A. N. Tikhonov, G. B. Khomutov, E. K. Ruuge, et al.,
130 (1969).
Biochim. Biophys. Acta 637, 321 (1981).
34. A. N. Tikhonov, Photosynth. Res. 116, 511 (2013).
19.
А. Н. Тихонов, А. А. Тимошин и Л. А. Блюмен-
35. D. M. Kramer, C. A. Sacksteder, and J. A. Cruz, Pho-
фельд, Молекуляр. биология 17, 1236 (1983).
tosynth. Res. 60, 151 (1999).
20.
L. A. Blumenfeld, M. G. Goldfield, A. I. Tzapin,
36. A. N. Tikhonov, R. V. Agafonov, L. A. Grigor’ev,
et al., Photosynthetica 8, 168 (1974).
et al., Biochim. Biophys. Acta 1777, 285 (2008).
21.
А. Н. Тихонов и Э. К. Рууге, Биофизика 20, 1049
(1975).
37. A. N. Tikhonov, Cell Biochem. Biophys. 75, 421
(2017).
22.
Э. К. Рууге и А. Н. Тихонов, Биофизика 22, 268
(1977).
38. K. Brettel, Biochim. Biophys. Acta 1318, 322 (1997).
23.
С. Б. Рыжиков и А. Н. Тихонов, Биофизика 33,
39. J. H. Golbeck, Photosynth. Res. 61, 107 (1999).
642 (1988).
40. I. R. Vassiliev, M. L. Antonkine, and J. H. Golbeck,
24.
A. N. Tikhonov, Photosynthesis Research 125, 65
Biochim. Biophys. Acta 1507, 139 (2001).
(2015).
41. A. N. Tikhonov and W. K. Subczynski, In Biomedical
25.
Z. Zhang, L. Huang, V. M. Schulmeister, et al., Na-
EPR - Part A: Free radicals, metals, medicine, and
ture 392, 677 (1998).
physiology, Ed. by S. S. Eaton, G. R. Eaton, and
26.
S. Izawa, R. Kraayehof, E. K. Ruuge, et al., Biochim.
L. J. Berliner (Kluwer Academic/Plenum Publishers,
Biophys. Acta 314 (3), 328 (1973).
Boston, MA, 2005), Vol. 23, pp. 147-194.
Electron Paramagnetic Resonance: Study of the Regulatory Mechanisms
of Light Phases of Photosynthesis in Plants
E.K. Ruuge*, ** and A.N. Tikhonov*, ***
*Faculty of Physics, Lomonosov Moscow State University, Leninskie Gory 1/2, Moscow, 119991 Russia
**Chazov National Medical Research Centre for Cardiology, Ministry of Healthcare of the Russian Federation,
3-ya Cherepkovskaya ul. 15a, Moscow, 121552 Russia
***Emanuel Institute of Biochemical Physics, Russian Academy of Sciences, ul. Kosygina 4, Moscow, 119334 Russia
Electron paramagnetic resonance (EPR) is a method widely used in biophysics of photosynthesis, since it
serves as an effective tool for studying the processes of electron and proton transport in different photosyn-
thetic systems. The aim of this study was to investigate the regulation of electron transport in chloroplasts us-
ing the EPR method, carried out by researchers who prepared this research paper. This paper provides infor-
mation regarding the use of the EPR method for studying the kinetics of electron transfer in chloroplasts of
higher plants in situ (leaves of higher plants) at room temperatures and considers the EPR spectra of chloro-
plasts at cryogenic temperatures. The latter holds particular significance for substantiation of the "kinetic"
method we use for measuring pH inside the thylakoids.
Keywords: electron paramagnetic resonance, photosynthesis, electron transport
БИОФИЗИКА том 67
№ 3
2022