Почвоведение, 2022, № 8, стр. 1035-1045
Молекулярно-биологическая характеристика почвенного микробиома северной части архипелага Новая Земля
Д. А. Никитин a, *, Л. В. Лысак b, Д. В. Бадмадашиев b
a Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
b МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: dimnik90@mail.ru
Поступила в редакцию 10.01.2022
После доработки 11.02.2022
Принята к публикации 24.02.2022
- EDN: KBFSZG
- DOI: 10.31857/S0032180X22080135
Аннотация
Молекулярно-биологическими методами изучен микробиом пелоземов сильноскелетных остаточно-карбонатных (Skeletic Leptosols (Loamic)), карбопетроземов (Calcaric Leptosols (Protic)), петроземов (Skeletic Leptosols (Protic)) и криоземов (Oxyaquic Cryosols (Loamic)) севера Новой Земли. Численность архей колебалась от 2.30 × 107 до 1.63 × 109 копий 16S рРНК генов/г почвы. Количество бактерий варьировало от 3.47 × 108 до 2.26 × 1011 копий 16S рРНК генов/г почвы. Численность грибов изменялась от 8.87 × 106 до 7.56 × 109 копий ITS рРНК генов/г почвы. Содержание копий рибосомальных генов всех групп микроорганизмов резко сокращалось вниз по профилю. Среди прокариот доминировали (до 90% обилия) бактерии. Наибольшим обилием (>20%) характеризовались филумы Proteobacteria, Actinobacteria и Acidobacteria, а также Bacteroidetes, Firmicutes, Verrucomicrobia, Gemmatimonadetes и Chloroflexi (обилие 1–10%). На долю домена Archaea, представленного в основном родом Ferroplasma (филум Euryarchaeota), приходилось ≤4% прокариот. Таксономическое разнообразие прокариот увеличивалось вниз по профилям почв и принимало максимальные значения в надмерзлотных горизонтах, где велика численность филумов-кандидатов типичных для морских экосистем: Latescibacteria, Tectomicrobia, Parcubacteria, Saccaribacteria, Hydrogenedentes, Peregrinibacteria, Ignavibacteria, Gracilibacteria.
ВВЕДЕНИЕ
Изучение полярных регионов приобретает все большую актуальность из-за чрезвычайно быстрого потепления в экосистемах Арктики и Антарктики по сравнению с другими территориями Земли. С конца XX в. температура воздуха за Полярным кругом возросла в среднем на 2°С, а для остальной территории Земли на 0.8°С [32]. В связи с этим все чаще отмечают феномен “позеленения Арктики” (“greening of Arctic”), когда безжизненные ландшафты пустошей стремительно покрываются тундровой растительностью [41]. По-видимому, это явление приводит к повышению биологической активности почвы, усиленной эмиссии парниковых газов в атмосферу [16] и увеличению микробного разнообразия [31]. Почвенные микроорганизмы играют ключевую роль в осуществлении биогеохимических циклов и обеспечении питательными элементами экосистемы в целом [25]. Исследование почвенного микробиома полярных регионов дает возможность оценить степень их устойчивости к изменению климата и продуктивности экосистем [20, 36]. Информация о структуре микробиома позволяет сделать выводы о специфике почвообразования и зональности почвенного покрова в целом [9, 42]. Состав и активность почвенного микробиома – высокочувствительный индикатор состояния экосистем в условиях наметившегося потеплении климата [16].
Новая Земля (НЗ) – самый большой, но и самый малоизученный архипелаг Европейской Арктики в связи с проведением на его территории испытаний ядерного оружия в середине ХХ в. [10]. НЗ является одним из “белых пятен” для биогеографии микроорганизмов и почвенной биоты в целом [23]. Открытию архипелага для научных исследований способствовало развитие проекта “Арктический плавучий университет”, благодаря которому осуществлен отбор образцов, исследованных в настоящей работе. Пока опубликовано лишь две статьи по таксономическому разнообразию микроорганизмов о. Северный [10, 15]. Только одна из этих работ посвящена почвенному микробиому [10]. Информация, представленная в ней, получена с помощью метода посева, который способен выявить лишь 1–2% всех микроорганизмов [38]. Для наиболее полной количественной и таксономической характеристики почвенного микробиома эти данные необходимо дополнять результатами молекулярно-биологических исследований [12].
Цель работы – количественная и качественная таксономическая характеристика почвенного микробиома северной части НЗ с использованием молекулярно-биологических методов.
ОБЪЕКТЫ И МЕТОДЫ
Исследования проводили в северной части о. Северный (архипелаг НЗ) в окрестностях заливов Русская Гавань, Ледяная Гавань и Бухта Благополучия, а также на мысе Желания. Условия отбора и хранения образцов, а также детальное описание растительности, почвенных разрезов и их фото приведены ранее [9]. Координаты ключевых точек, классификационный статус почв и некоторые физико-химические свойства исследованных образцов представлены в табл. S1 .
Количественную оценку содержания рибосомальных генов микроорганизмов осуществляли методом количественной полимеразной цепной реакции (ПЦР) в реальном времени. Для учета архей и бактерий использовали праймеры на ген 16S рРНК, для учета грибов – на регион ITS. Реакцию проводили в амплификаторе Real-Time CFX96 Touch (Bio-Rad). Реакционную смесь готовили из препарата SuperMix Eva Green (Bio-Rad). В качестве количественных стандартов концентрации генов 16S рРНК для бактерий использовали растворы клонированных фрагментов рибосомального оперона штамма К12 Escherichia coli, для архей – штамма FG-07 Halobacterium salinarum, для грибов – штамма дрожжей Saccharomyces cerevisiae Meyen 1B-D1606. Для каждого образца реакцию проводили в трех повторностях. Концентрацию генов рассчитывали с помощью программного обеспечения CFX Manager, пересчитывая в препаратах ДНК количество генов на 1 г почвы (сух. в.) с учетом разведений и массы навески.
Таксономическую структуру прокариотного сообщества определяли методом высокопроизводительного секвенирования (Next Generation Sequencing: NGS) с использованием платформы Illumina MiSeq методом парно-концевого чтения (2 × 300 пар оснований) генерацией не менее 10 000 парных прочтений на образец по последовательностям гена гипервариабельного региона V3–V4 16S рРНК. Образцы готовили по двухстадийной ПЦР: амплификация V3–V4 16S рРНК, а затем амплификация ПЦР продукта с целью баркодирования библиотеки. Получаемые ампликоны после очистки на магнитных частицах и измерения концентрации флуориметрическим методом являлись готовыми ДНК-библиотеками.
Обработку данных секвенирования проводили с использованием автоматизированного алгоритма QIIME [17] включающего объединении прямых и обратных прочтений, удаление технических последовательностей, фильтрации последовательностей с низкими показателями достоверности прочтения отдельных нуклеотидов (качество < Q20), фильтрации химерных последовательностей. Для разбиения последовательностей на операционные таксономические единицы (ОТЕ) использовали алгоритм с открытым референсным порогом классификации 97%. Выравнивание прочтений на последовательность 16S рРНК и распределение последовательностей по таксономическим единицам проводили с использованием базы данных Silva версии 132 [33].
Разнообразие и сходство бактериальных сообществ исследованных субстратов оценивали с помощью индексов α-разнообразия, рассчитанных при объединении сиквенсов в ОТЕ с уровнем схожести нуклеотидного состава сиквенсов в 97%. Использовали следующие индексы: индекс разнообразия Шеннона (H = Σpilg2pi, где pi – доля i‑го вида в сообществе) и индекс выровненности Пиелу, который является нормировкой индекса Шеннона между 0 и 1.
РЕЗУЛЬТАТЫ
Количественная оценка содержания рибосомальных генов методом ПЦР в реальном времени. Численность копий рибосомальных генов 16S рРНК архей мала и изменялась от 2.30 × 107 до 1.63 × 109 копий генов/г почвы. Минимум архей выявлен в минеральном горизонте Rca петрозема остаточно-карбонатного сильноскелетного на м. Желания (профиль CJ-24-25), а максимум – в поверхностном горизонте ОТ-W пелозема перегнойно-гумусового остаточно-карбонатного сильноскелетного района Ледяной Гавани (профиль LG-15-17) (рис. 1). Для большинства исследованных профилей обилие архей резко сокращалось от поверхностных горизонтов к надмерзлотным самым глубоким в профиле. Однако в криоземе грубогумусовом остаточно-карбонатном района Бухты Благополучия (профиль ВВ-9-10), пелоземе гумусовом криотурбированном остаточно-карбонатном сильноскелетном района Ледяной Гавани (профиль LG-12-14) и криоземе глееватом скелетном Русской Гавани (профиль RG-1-3) доля архей была максимальна в подповерхностном горизонте CR (4–11 см) разреза. Среди всех проанализированных локаций НЗ наименьшая численность копий генов архей характерна для мыса Желания, а наибольшая – для района Ледяной Гавани.
Количество копий генов 16S рРНК бактерий варьировало от 3.47 × 109 до 2.26 × 1011/г почвы. Минимальные значения выявлены в минеральном горизонте Rca петрозема остаточно-карбонатного сильноскелетного на мысе Желания (профиль CJ-24-25), а максимальные – в верхнем горизонте Wca пелозема гумусового остаточно-карбонатного сильноскелетного (профиль LG-12-14) района Ледяной Гавани. Для большинства исследованных профилей количество генетического материала бактерий уменьшалось от поверхностных горизонтов к надмерзлотным. Однако в криоземе грубогумусовом остаточно-карбонатном районы Бухты Благополучия (профиль ВВ-9-10) обилие бактерий максимально в нижнем минеральном горизонте CR (10–19 см). Среди всех проанализированных локаций НЗ наименьшая численность копий генов бактерий характерна для мыса Желания, а наибольшая – для района Ледяной Гавани.
Численность рибосомальных генов ITS рРНК грибов изменялась от 8.87 × 106 до 7.56 × 109 копий генов/г почвы (рис. 2). Наименьшие значения выявлены в минеральном горизонте Rca петрозема остаточно-карбонатного сильноскелетного на мысе Желания (профиль CJ-24-25), а максимальные – в моховом очесе О криозема глееватого скелетного района Русской Гавани (профиль RG-1-3). Для большей части проанализированных почв количество рибосомальных генов ITS рРНК грибов составляло 108–109/г почвы. Рибосомальные гены ITS рРНК грибов не выявлены в петроземе района Русской Гавани (профиль RG-4), поверхностного горизонта ОТ-W пелозема перегнойно-гумусового остаточно-карбонатного района Ледяной Гавани (профиль LG-15-17) и поверхностного горизонта WС криозема остаточно-карбонатного сильноскелетного, отобранного на мысе Желания (профиль CJ-24-25). Практически для всех исследованных профилей количество генетического материала грибов уменьшалось от поверхностных горизонтов к надмерзлотным самым глубоким в профиле. Однако в криоземе грубогумусовом остаточно-карбонатном района Бухты Благополучия (профиль ВВ-9-10), пелозема гумусового криотурбированного остаточно-карбонатного сильноскелетного района Ледяной Гавани (профиль LG-12-14) доля микобиоты была максимальна в подповерхностном горизонте разреза. Среди всех проанализированных локаций НЗ наименьшая численность копий генов архей характерна для района Ледяной Гавани, а наибольшая – для района Русской Гавани.
Как для архей, так и бактерий, и грибов минимум численности копий рибосомальных генов отмечен в минеральном горизонте Rca петрозема остаточно-карбонатного сильноскелетного на мысе Желания (профиль CJ-24-25). Для всех рассматриваемых групп микроорганизмов характерен максимум обилия в подповерхностном горизонте криозема грубогумусового остаточно-карбонатного района Бухты Благополучия (профиль ВВ-9-10).
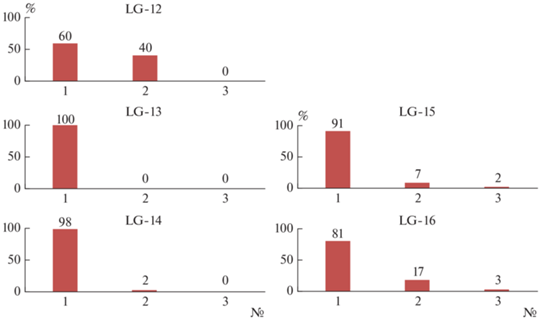
Таксономическая структура прокариотного сообщества определена методом высокопроизводительного секвенирования (баркодинг гена 16Sр РНК) для двух профилей из Ледяной Гавани (LG-12-14 и LG-15-16). Число детектированных филумов прокариот увеличивалось от поверхностных органогенных к глубинным минеральным горизонтам. Доминировали филумы Proteobacteria, Actinobacteria и Acidobacteria (рис. 3, табл. 1). Меньше было содержание филумов Bacteroidetes, Firmicutes, Verrucomicrobia, Gemmatimonadetes и Chloroflexi. Минорными компонентами сообщества прокариот во всех исследованных образцах (<1% обилия) являлись филумы: Planctomycetes, Chlorobia, Nitrospirae, Cyanobacteria, Gemmatimonadetes. Исключением был образец LG-13, где содержание филума Nitrospirae составляло 95%, Firmicutes – 4%, а филумов Actinobacteria, Acidobacteria и Bacteroidetes – <1% от числа детектированных бактерий.
Рис. 3.
Таксономическая структура бактериального сообщества (% от общего количества последовательностей): 1 – Actinobacteria; 2 – Proteobacteria; 3 – Firmicutes; 4 – Verrucomicrobia; 5 – Chloroflexi; 6 – Acidobacteria; 7 – Chlorobia; 8 – Bacteroidetes; 9 – Nitrospirae; 10 – Gemmatimonadetes; 11 – Cyanobacteria; 12 – прочие.

Таблица 1.
Распределение филумов по горизонтам в исследованных почвах
| Параметр | Пелозем гумусовый остаточно-карбонатный | Пелозем перегнойно-гумусовый остаточно-карбонатный | |||
|---|---|---|---|---|---|
| LG-12, Wca, 0–4 см | LG-13, Сca, 4–19 см | LG-14, Сca, 19–32 см | LG-15, OT-W, 0–4 см | LG-16, Сca, 4–17 см | |
| Bacteria | |||||
| Основные филумы (>20%) | Firmicutes, Proteobacteria, Actinobacteria | Nitrospirae | Proteobaсteria, Actinobacteria | Proteobacteria, Bacteroidetes, Actinobacteria, Acidobacteria | Proteobacteria, Actinobacteria, Acidobacteria |
| Прочие филумы (1–10%) | Chlorobia Verrucomicrobia, Chloroflexi, Acidobacteria, Bacteroidetes | Firmicutes, Proteobacteria | Acidobacteria, Gemmatimonadetes, Chloroflexi, Bacteroidetes, Nitrospirae, Verrucomicrobia, Chlorobia | Verrucomicrobia, Chloroflexi, Cyanobacteria, Gemmatimonadetes | Bacteroidetes, Chloroflexi, Gemmatimonadetes, Verrucomicrobia, Nitrospirae |
| Минорные филумы (<1%) | Planctomycetes, Nitrospirae, Cyanobacteria, Fibrobacteres, Gemmatimonadetes | Elusimicrobia, Actinobacteria, Bacteroidetes, Acidobacteria, Cyanobacteria | Elusimicrobia, Planctomycetes, Firmicutes, Cyanobacteria, Armatimo-nadetes, Fusobacteria, Fibrobacteres, Chlamydia | Planctomycetes, Elusimicrobia, Chlorobiа, Nitrospirae, Armatimonadetes, Fibrobacteres, Firmicutes, Chlamydia | Chlorobia, Planctomycetes, Elusimicrobia, Cyanobacteria, Fibrobacteres, Armatimonadetes, Firmicutes, Fusobacteria |
| Филумы-кандидаты (<1%) | Saccaribacteria, Ignavibacteria, Tectomicrobia, Gracilibacteria, TM6 | Не обн. | Latescibacteria, Tectomicrobia, Parcubacteria, Saccaribacteria, Hydro-genedentes, Peregrinibacteria, Ignavibacteria, Gracilibacteria, TM6, BRC1, GAL15, WWE3, WS2, SR1 | Saccaribacteria, Parcubacteria, Latescibacteria, Hydrogenedentes, Peregrinibacteria, Tectomicrobia, Gracilibacteria, TM6, BRC1 | Latescibacteria, Tectomicrobia, Saccaribacteria, Parcubacteria, Gracilibacteria, Peregrinibacteria, Hydrogenedentes, Ignavibacteria, TM6, BRC1, GAL15, WS2 |
| Archaea | |||||
| Филумы | Euryarchaeota, Taumarchaeota | Euryarchaeota, (Ferroplasma) | Euryarchaeota, (Ferroplasma), Taumarchaeota | Euryarchaeota, (Ferroplasma), Taumarchaeota, Woesearchaeota | Euryarchaeota, (Ferroplasma), Taumarchaeota, Woesearchaeota |
| Всего филумов | 20 | 9 | 33 | 28 | 31 |
Преобладающим для большинства образцов классом доминирующего среди бактерий филума Proteobacteria являлись Alphaproteobacteria. Меньше содержалось представителей класса Betaproteobacteria, который присутствовал в основном в минеральных горизонтах. Представители класса Deltaproteobacteria обнаружены исключительно в органогенных горизонтах.
Цианобактерии, содержание которых в исследованных образцах не превышало 0.1–0.2%, представлены преимущественно группой Melainabacteria.
Максимальное разнообразие (до 14 филумов) бактериальных филумов-кандидатов (Latescibacteria, Tectomicrobia, Parcubacteria, Saccaribacteria, Hydrogenedentes, Peregrinibacteria, Ignavibacteria, Gracilibacteria, TM6, BRC1, GAL15, WWE3, WS2, SR1) приурочено к образцам LG-14 и LG-16 почвенного профиля пелозема перегнойно-гумусового остаточно-карбонатного.
Содержание архей во всех исследованных почвах было незначительным, от 0.1 до 3.8% от числа всех прокариот, за исключением образца LG-13, где их содержание доходило до 36% (рис. 4). Среди архей детектированы три филума: Euryarchaeota, Thaumarchaeota и Woesearchaeota. Причем, наиболее часто обнаруживены представители филума Euryarchaeota, содержание которые колебалось от 60 до 100% (рис. 5). Филум Euryarchaeota в основном представлен родом Ferroplasma.
ОБСУЖДЕНИЕ
Количественная оценка содержания рибосомальных генов методом ПЦР в реальном времени. Численность копий рибосомальных генов 16S рРНК бактерий в исследованных почвах по порядку значений соответствует данным для оторфованных почв Большеземельской тундры [42] и тундровых почв Аляски [27, 39]. Это подтверждает многочисленные свидетельства о повышенной устойчивости бактерий к экстремально низким температурам и олиготрофным условиям полярных областей [4, 14, 29]. В то же время количество копий рибосомальных генов 16S рРНК архей проанализированных образцов на 2 порядка меньше по сравнению с результатами для других арктических территорий [11, 39, 42]. Представители данного домена обычно характеризуются адаптацией лишь к специфическим условиям окружающей среды и чрезвычайно чувствительны к ее изменениям [21], что, по-видимому, ставит археи в минорные позиции почвенного микробиома севера НЗ.
Странным представляется относительно низкое (на порядок меньше) содержание копий рибосомальных генов ITS рРНК грибов по сравнению с данными для более северных территорий архипелага Земля Франца-Иосифа [11]. Вероятно, это можно объяснить локально большим содержанием органического вещества в некоторых почвах Земли Франца-Иосифа [7, 11] по сравнению с образцами НЗ.
Закономерным кажется максимальное обилие копий рибосомальных генов всех групп микроорганизмов в поверхностных органогенных горизонтах, поскольку в этих локусах содержится максимальное количество органического углерода и общего азота. Исключение составляли профили с максимальным содержанием копий рибосомальных генов микроорганизмов в подповерхностных и надмерзлотных горизонтах. Это явление можно объяснить избеганием биотой негативных абиотических факторов (резкие перепады температура, повышенный уровень ультрафиолетового излучения, сильные ветры и др.), а также относительно низким содержанием органического вещества даже в поверхностном горизонте. Для высокой Арктики и Антарктики характерен подобный эффект аккумуляции микроорганизмов в подповерхностных слоях безгумусных почв, “каменных мостовых” и реголитов [4–6].
Количество копий генов 16S рРНК бактерий на 2 порядка больше, чем архей и грибов. Такое соотношение типично для почвенных микроорганизмов различных природных зон [3, 8]. Невысокая численность архей может быть связана с усиливающейся конкуренцией представителей данного домена с бактериями в условиях ограниченности ресурсов питания и энергии [12], характерных для полярных экосистем. Небольшое количество грибов в проанализированных почвах, по-видимому, обусловлено преобладанием покоящихся форм (спор, конидий и др.), содержание генетического материала в которых меньше, чем в клетках мицелия [22].
Полученные в данном исследовании результаты по количеству копий рибосомальных генов бактерий коррелируют с выявленными ранее показателями численности клеток прокариот в исследованных почвенных профилях севера НЗ [9]. Этот факт подтверждает гипотезу о сопоставимости результатов для характеристики почвенного микробиома, полученных с помощью методов количественной ПЦР в реальном времени и люминесцентной микроскопии [1, 2].
Таксономическая структура прокариотного сообщества. В проанализированных образцах наиболее обильны филумы Proteobacteria и Actinobacteria, содержание их достигало 30–40%. В меньшей степени представлены филумы Acidobacteria, Verrucomicrobia, Bacteroidetes, Chloroflexi, Gemmatimonadetes, Firmicutes и Nitrospirae (не более 10–14%). В минимальных количествах присутствовали филумы Planctomycetes, Fibrobacters, Fusobacteres, Armatimonadetes и Cyanobacteria (содержание <1%). Известно, что почвенное бактериальное сообщество, по данным молекулярно-генетических исследований, сформировано преимущественно девятью филумами: Proteobacteria, Acidobacteria, Actinobacteria, Verrucomicrobia, Bacteroidetes, Chloroflexi, Planctomycetes, Gemmatimonadetes и Firmicutes [24, 26], содержание представителей других филумов, как правило, не превышает десятых долей процента [30].
Обращает на себя внимание таксономический состав прокариотного сообщества образца LG13 (горизонт Сса пелозема гумусового остаточно-карбонатного), где среди бактерий доминировал филум Nitrospirae, а среди архей – Euryarchaeota, представленный единственным родом Ferroplasma. Можно предположить, что в исследованном локусе активно протекают процессы трансформации железа, на что указывает высокое содержание рода Ferroplasma [18], а также процессы нитрификации, которые активно проводятся бактериями филума Nitrospirae [28].
Наиболее часто в исследованных почвах (пелозем гумусовый остаточно-карбонатный) обнаружены археи филумов Euryarchaeota, Taumarchaeota, а в образцах LG-15 и LG-16 некультивируемый филум Woesarchaeota. В горизонтах, где визуально обнаружены процессы трансформации железа (охристые пятна, глееобразование), обнаружены прокариоты: представители домена Archaea, филума Euryarchaeota (род Ferroplasma). Известно, что представители рода Ferroplasma филума Euryarchaeota – хемолитоавтотрофы, окисляющие ионы Fe2+ до Fe3+ для получения энергии [18].
Обнаружение в исследованных образцах пелоземов филума бактерий Nitrospirae и филума архей Taumarchaeota предполагает возможность участия этих организмов в процессах трансформации соединений азота, нитроспиры – активные участники нитрификации осуществления [28], а таумархеоты (анаммокс-бактерии) – анаэробного окисления аммония [37].
Максимальное разнообразие филумов прокариот выявлено в надмерзлотных наиболее глубоких в профиле минеральных горизонтах, где помимо других, характерных для почвы филумов, обнаружено значительное количество (от 9 до 14) филумов-кандидатов: Latescibacteria, Tectomicrobia, Parcubacteria, Saccaribacteria, Hydrogenedentes, Peregrinibacteria, Ignavibacteria, Gracilibacteria. Интересно, что многие из них ранее обнаружены в морских экосистемах [19, 34, 35]. Видимо, присутствие этих филумов связано с близким расположением к морю проанализированных профилей.
Важной экологической характеристикой любого сообщества является обилие таксонов или α-разнообразие сообщества. Для полученных данных по представленности ОТЕ на уровне сходства 97% рассчитаны индексы Шеннона и Пиелу (табл. 2). Наибольшие показатели таксономического богатства обнаружены во влажном и относительно богатом органическим углеродом и азотом горизонте мохового очеса, где значение индекса Шеннона составляло 8.62 (LG-15). Более низкие значения индекса Шеннона были в горизонте мохового очеса (LG-12) и минеральных горизонтах (LG-14 и LG-16). Минимальное значение индекса, а также количества ОТЕ отмечено для минерального горизонта LG-13 и составляло 1.85 и 32 соответственно. Количество детектированных ОТЕ зависело от тех же факторов, что и индекс Шеннона: наибольшие значения обнаружены в более влажных горизонтах. Значения индекса выровненности Пиелу говорят о примерно одинаковой и высокой степени выровненности в рамках сообщества исследуемых почв.
Таблица 2.
Экологические показатели разнообразия прокариотного сообщества и некоторые свойства почв
| Горизонт, глубина, см | ОТЕ | Индекс Шеннона | Индекс Пиелу | pHводн | Влажность почвы, % массы |
Cорг | Nобщ | Cорг/Nобщ |
|---|---|---|---|---|---|---|---|---|
| % | ||||||||
| Wca, 0–4 | 339 | 7.49 | 0.89 | 7.61 | 6.2 | 0.82 | 0.14 | 8.9 |
| Cca, 4–19 | 32 | 1.85 | 0.40 | 7.89 | 9.1 | 1.16 | 0.14 | 10.1 |
| Cca, 19–32 | 639 | 7.32 | 0.79 | 7.98 | 38.6 | 1.52 | 0.17 | 15.2 |
| Wca, 0–4 | 1167 | 8.62 | 0.88 | 7.36 | 52.8 | 18.69 | 1.23 | 9.8 |
| Cca, 4–17 | 959 | 7.94 | 0.84 | 7.97 | 14.8 | 1.37 | 0.14 | 7.0 |
Данные, полученные при анализе результатов секвенирования, показывают высокую степень разнообразия прокариотных сообществ в исследуемых почвах, что согласуется с литературными данными [15]. Не исключено, что важным фактором, влияющим на таксономическое разнообразие сообщества, является влажность почв. Прослеживается положительная корреляция содержания филума Proteobacteria в сообществе с увеличением влажности, что также согласуется с данными других исследователей [40].
ЗАКЛЮЧЕНИЕ
Впервые дана молекулярно-биологическая характеристика почвенного микробиома северной части архипелага НЗ.
В микробиоме изучаемых территорий преобладали бактерии филумов Proteobacteria, Actinobacteria и Acidobacteria, а также археи филума Euryarchaeota. Численность копий рибосомальных генов всех микроорганизмов уменьшается, а таксономическое разнообразие прокариот – увеличивается вниз по почвенным профилям севера НЗ.
Судя по данным, полученным методом количественной ПЦР в реальном времени, в микробиоме исследованных почв доминировали бактерии, а не археи или грибы. Это противоречит результатам, полученным ранее методом люминесцентной микроскопии [9], согласно которым в почвах северной части архипелага НЗ превалировали грибы. По-видимому, такое несоответствие объясняется преобладанием покоящихся форм (спор, конидий и др.), содержание генетического материала в которых меньше, чем в клетках мицелия. Для подтверждения или опровержения факта доминирования одной из групп микроорганизмов в исследуемых объектах необходимы дополнительные исследования другими методами (например, методом субстрат-индуцированного дыхания со специфическим ингибированием антибиотиками грибов/бактерий или биомаркерным методом определение содержания жирных кислот фосфолипидов).
Несмотря на суровые климатические условия Арктики, почва НЗ в полном объеме выполняет экологическую функцию сохранения прокариотного разнообразия, что выражается как в присутствии доминирующих таксонов, так и в широком разнообразии филумов-кандидатов, некоторые из которых связаны с морскими местообитаниями.
Список литературы
Благодатская Е.В., Семенов М.В., Якушев А.В. Активность и биомасса почвенных микроорганизмов в изменяющихся условиях окружающей среды. М.: Товарищество научных изданий КМК, 2016.
Корнейкова М.В., Никитин Д.А., Долгих А.В., Сошина А.С. Микобиота почв города Апатиты (Мурманская область) // Микология и фитопатология. 2020. № 54(4). С. 264–277. https://doi.org/10.31857/S0026364820040078
Корнейкова М.В., Никитин Д.А. Качественные и количественные характеристики почвенного микробиома в зоне воздействия выбросов Кандалакшского алюминиевого завода // Почвоведение. 2021. № 6. С. 725–734. https://doi.org/10.31857/S0032180X21060083
Лысак Л.В., Максимова И.А., Никитин Д.А., Иванова А.Е., Кудинова А.Г., Соина В.С., Марфенина О.Е. Микробные сообщества почв Восточной Антарктиды // Вестник Моск. ун-та. Сер. 16. Биология. 2018. Т. 73. № 3. С. 132–140.
Марфенина О.Е., Никитин Д.А., Иванова А.Е. Структура грибной биомассы и разнообразие культивируемых микромицетов в почвах Антарктиды (станции Прогресс и Русская) // Почвоведение. 2016. № 8. С. 991–999. https://doi.org/10.7868/S0032180X16080074
Никитин Д.А., Марфенина О.Е., Максимова И.А. Использование сукцессионного подхода при изучении видового состава микроскопических грибов и содержания грибной биомассы в антарктических почвах // Микология и фитопатология. 2017. № 51(4). С. 211–219.
Никитин Д.А., Семенов, М.В., Семиколенных А.А., Максимова И.А., Качалкин А.В., Иванова А.Е. Биомасса грибов и видовое разнообразие культивируемой микобиоты почв и субстратов о. Нортбрук (Земля Франца-Иосифа) // Микология и фитопатология. 2019. № 53(4). С. 210–222. https://doi.org/10.1134/S002636481904010X
Никитин Д.А., Иванова Е.А., Железова А.Д., Семенов М.В., Гаджиумаров Р.Г., Тхакахова А.К., Чернов Т.И., Ксенофонтова Н.А., Кутовая О.В. Оценка влияния технологии no-till и вспашки на микробиом южных агрочерноземов // Почвоведение. 2020. № 12. С. 1508–1520. https://doi.org/10.31857/S0032180X20120084
Никитин Д.А., Лысак Л.В., Бадмадашиев Д.В., Холод С.С., Мергелов Н.С., Долгих А.В., Горячкин С.В. Биологическая активность почв в условиях покровного оледенения в северной части архипелага Новая Земля // Почвоведение. 2021. № 10. С. 1207–1230. https://doi.org/10.31857/S0032180X21100087
Никитин Д.А., Лысак Л.В., Кутовая О.В., Грачева Т.А. Эколого-трофическая структура и таксономическая характеристика сообществ микроорганизмов почв северной части архипелага Новая Земля // Почвоведение. 2021. № 11. С. 1346–1362. https://doi.org/10.31857/S0032180X21110101
Никитин Д.А., Семенов М.В. Характеристика микобиоты почв Земли Франца-Иосифа методами микробиологического посева и ПЦР в реальном времени // Микробиология. 2022. Т. 91. № 1. С. 1–13. (в печати)https://doi.org/10.31857/S0026365622010098
Семенов М.В. Метабаркодинг и метагеномика в почвенно-экологических исследованиях: успехи, проблемы и возможности // Журн. общ. биол. 2019. Т. 80(6) С. 403-417. https://doi.org/10.1134/S004445961906006X
Семенов М.В., Манучарова Н.А., Степанов А.Л. Распределение метаболически активных представителей прокариот (архей и бактерий) по профилям чернозема и бурой полупустынной почвы // Почвоведение. 2016. Т. 2. С. 239–248. https://doi.org/10.7868/S0032180X16020106
Baldrian P. The known and the unknown in soil microbial ecology // FEMS microbiology ecology. 2019. V. 95(2). P. fiz005. https://doi.org/10.1093/femsec/fiz005
Belov A.A., Cheptsov V.S., Manucharova N.A., Ezhelev Z.S. Bacterial communities of Novaya Zemlya archipelago ice and permafrost // Geosciences. 2020. V. 10(2). P. 67. https://doi.org/10.3390/geosciences10020067
Box J.E., Colgan W.T., Christensen T.R., Schmidt N.M., Lund M., Parmentier F. J.W., Brown R. et al. Key indicators of Arctic climate change: 1971–2017 // Environ. Res. Lett. 2019. V. 14(4). P. 045010. https://doi.org/10.1088/1748-9326/aafc1b
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N. et al. QIIME allows analysis of high-throughput community sequencing data // Nat Methods. 2010. V. 7(5). P. 335–336. https://doi.org/10.1038/nmeth.f.303
Dopson M., Baker-Austin C., Hind A., Bowman J.P., Bond P.L. Characterization of Ferroplasma Isolates and Ferroplasma acidarmanus sp. nov., Extreme Acidophiles from Acid Mine Drainage and Industrial Bioleaching Environments // Appl. Environ. Microbiol. 2004. V. 70(4). P. 2079–2088.
Figueroa-Gonzalez P.A., Bornemann T.L., Adam P.S., Plewka J., Révész F., Hagen C., Táncsics A., Probst J. Saccharibacteria as Organic Carbon Sinks in Hydrocarbon-Fueled Communities // Front. Microbiol. 2020. https://doi.org/10.3389/fmicb.2020.587782
Flocco C.G., Mac Cormack W.P., Smalla K. Antarctic Soil Microbial Communities in a Changing Environment: Their Contributions to the Sustainability of Antarctic Ecosystems and the Bioremediation of Anthropogenic Pollution / The Ecological Role of Microorganisms in the Antarctic Environment. 2019. P. 133–161. Springer Polar Sciences. Springer, Cham. https://doi.org/10.1007/978-3-030-02786-5_7
Garrett R.A., Klenk H.P. Archaea: evolution, physiology, and molecular biology. John Wiley Sons, 2008.
Glöckner F.O., Yilmaz P., Quast C., Gerken J., Beccati A., Ciuprina A., Brunsa G., Yarzac P., Pepliesc J., Westram R., Ludwig W. 25 years of serving the community with ribosomal RNA gene reference databases and tools // J. Biotechnology. 2017. V. 261. P. 169–176. https://doi.org/10.1016/j.jbiotec.2017.06.1198
Guerra C.A., Heintz-Buschart A., Sikorski J., Chatzinotas A., Guerrero-Ramírez N., Cesarz S., Beaumelle L. et al. Blind spots in global soil biodiversity and ecosystem function research // Nature communications. 2020. V. 11(1). P. 1–13. https://doi.org/10.1038/s41467-020-17688-2
Hansel C.M., Fendorf S., Jardine P.M., Francis C.A. Changes in bacterial and archaeal community structure and functional diversity along a geochemically variable soil profile // Appl. Environ. Microbiol. 2008. V. 74. P. 1620–1633. https://doi.org/10.1128/AEM.01787-07
Jacoby R., Peukert M., Succurro A., Koprivova A., Kopriva S. The role of soil microorganisms in plant mineral nutrition—current knowledge and future directions // Frontiers Plant Sci. 2017. V. 8. P. 1617. https://doi.org/10.3389/fpls.2017.01617
Janssen P.H. Identifying the dominant soil bacterial taxa in libraries of 16S rRNA and 16S rRNA genes // Appl. Environ. Microbiol. 2006. V. 72(3). P. 1719 – 1728. https://doi.org/10.1128/AEM.72.3.1719-1728.2006
Kim H.M., Jung J.Y., Yergeau E., Hwang C.Y., Hinzman L., Nam S., Hong S.G., Kim O., Chun J., Lee Y.K. Bacterial community structure and soil properties of a subarctic tundra soil in Council, Alaska // FEMS Microbiol. Ecology. 2014. V. 89(2). P. 465–475. https://doi.org/10.1111/1574-6941.12362
Kits K.D., Sedlacek C.J., Lebedeva E.V., Han P., Bulaev A., Pjevac P., Daebeler A. et al. Kinetic analysis of a complete nitrifier reveals an oligotrophic lifestyle // Nature. 2017. V. 549. P. 269–272. https://doi.org/10.1038/nature23679
Malard L.A., Pearce D.A. Microbial diversity and biogeography in Arctic soils // Environ. Microbiol. Rep. 2018. V. 10(6). P. 611–625. https://doi.org/10.1111/1758-2229.12680
Podar M., Abulencia C.B., Walcher M., Hutchison D., Zengler K., Garcia J.A., Holland T., Cotton D., Hauser L., Keller M. Targeted access to the genomes of low-abundance organisms in complex microbial communities // Appl. Environ. Microbiol. 2007. V. 10(73). P. 3205–3214. https://doi.org/10.1128/AEM.02985-06
Pold G., Schimel J.P., Sistla S.A. Soil bacterial communities vary more by season than with over two decades of experimental warming in Arctic tussock tundra // Elementa: Science of the Anthropocene. 2021. V. 9(1). https://doi.org/10.1525/elementa.2021.00116
Post E., Alley R.B., Christensen T.R., Macias-Fauria M., Forbes B.C., Gooseff M.N. et al. Virginia and Muyin Wang. The polar regions in a 2°C warmer world // Sci. Adv. 2019. V. 5. 12. P. 12. https://doi.org/10.1126/sciadv.aaw9883
Pruesse E., Quast C., Knittel K., Fuchs B.M., Ludwig W., Peplies J., Glöckner F.O. SILVA: a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB // Nucleic Acids Res. 2007. V. 35(21). P. 7188–7196. https://doi.org/10.1093/nar/gkm864
Rinke C., Schwientek P., Sczyrba A., Ivanova N.N., Anderson I.J., Cheng J.-F., Darling A. et al. Insights into the phylogeny and coding potential of microbial dark matter // Nature. 2013. V. 499(7459). P. 431–437. https://doi.org/10.1038/nature12352
Sieber C.M., Probst A.J., Sharrar A., Thomas B.C., Hess M., Tringe S.G., Banfield J.F. Recovery of genomes from metagenomes via a dereplication, aggregation and scoring strategy // Nature Microbiol. 2018. V. 3(7). P. 836.
Singh J.S., Gupta V.K. Soil microbial biomass: a key soil driver in management of ecosystem functioning // Sci. Total Environ. 2018. V. 634. P. 497–500. https://doi.org/10.1016/j.scitotenv.2018.03.373
Spang A., Hatzenpichler R., Brochier-Armanet C., Rattei T. Distinct gene set in two different lineages of ammonia-oxidizing archaea supports the phylum Thaumarchaeota // Trends in Microbiology. 2010. V. 18(8). P. 331–340. https://doi.org/10.1016/j.tim.2010.06.003
Steen A.D., Crits-Christoph A., Carini P., DeAngelis K.M., Fierer N., Lloyd K.G., Thrash J.C. High proportions of bacteria and archaea across most biomes remain uncultured // The ISME J. 2019. https://doi.org/10.1038/s41396-019-0484-y
Tripathi B.M., Kim H.M., Jung J.Y., Nam S., Ju H.T., Kim M., Lee Y.K. Distinct taxonomic and functional profiles of the microbiome associated with different soil horizons of a moist tussock tundra in Alaska // Frontiers in microbiology, 2019. V. 10. P. 1442. https://doi.org/10.3389/fmicb.2019.01442
Yergeau E., Newsham K.K., Pearce D.A., Kowalchuk G.A. Patterns of bacterial diversity across a range of Antarctic terrestrial habitats // Environ. Microbiol. 2007. V. 9. P. 2670–2682. https://doi.org/10.1111/j.1462-2920.2007.01379.x
Zhang W., Miller P.A., Jansson C., Samuelsson P., Mao J., Smith B. Self-Amplifying Feedbacks Accelerate Greening and Warming of the Arctic // Geophys. Res. Lett. 2018. V. 45(14). P. 7102–7111.
Zhelezova A., Chernov T., Tkhakakhova A., Xenofontova N., Semenov M., Kutovaya O. Prokaryotic community shifts during soil formation on sands in the tundra zone // Plos One. 2019. V. 14(4). P. e0206777. https://doi.org/10.1371/journal.pone.0206777
Дополнительные материалы
- скачать ESM.docx
- Таблица 1. Свойства почв севера Новой Земли [9].