Коллоидный журнал, 2023, T. 85, № 6, стр. 748-761
Изучение криоструктурирования полимерных систем. 65. Характер изменений физико-химических свойств криогелей поливинилового спирта, вызываемых действием водных растворов аминокислот общей формулы H2N–(CH2)n–COOH
О. Ю. Колосова 1, А. С. Рыжова 1, В. П. Чернышев 2, В. И. Лозинский 1, *
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
2 АО “Щелково Агрохим”
141101 Щелково, Московская обл., Россия
* E-mail: loz@ineos.ac.ru
Поступила в редакцию 06.07.2023
После доработки 31.07.2023
Принята к публикации 31.07.2023
- EDN: IEMUPC
- DOI: 10.31857/S0023291223600578
Аннотация
Криогенной обработкой (замораживание при –20°C в течение 12 ч и затем размораживание нагреванием со скоростью 0.03°C/мин) водных растворов поливинилового спирта (ПВС) с концентрацией полимера 100 г/л получены макропористые криогели и исследован характер изменения их физико-химических параметров после уравновешивания образцов с водными растворами аминокислот общей формулы H2N–(CH2)n–COOH (n = 1–5). Показано, что эти аминокислоты, в наибольшей степени глицин (n = 1), в наименьшей – ε-аминокапроновая кислота (n = 5), проявляют космотропное воздействие на свойства криогелей ПВС, вызывая уменьшение их объема, значительное возрастание компрессионного модуля упругости и повышение температуры плавления образцов. Тем не менее высвобождение H2N–(CH2)n–COOH аминокислот из насыщенных их растворами криогелей во внешнее водное окружение происходило без существенных диффузионных затруднений. После исчерпывающего отмывания чистой водой нагруженных аминокислотами криогелей их физико-химические показатели не возвращались полностью к значениям, характерным для образцов до их обработки растворами таких аминокислот вследствие промотируемого космотропными аминокислотами образования дополнительных Н-связанных узлов трехмерной сетки в объеме уже сформированного криогеля.
ВВЕДЕНИЕ
Криогели поливинилового спирта (КГПВС), которые образуются в результате криогенной обработки (замораживание–инкубация в замороженном состоянии–оттаивание) концентрированных водных или ДМСО растворов высокодеацилированных марок данного полимера, относятся к гелевым системам кристаллизационного типа, узлами надмолекулярной полимерной сетки которых являются зоны микрокристалличности, где макромолекулы ПВС ассоциированы друг с другом за счет водородных связей между ОН-группами соседних цепей [1–20]. Эти криогели представляют как научный [5–11, 14–17], так и значительный прикладной интерес в различных областях, особенно в плане их биомедицинского [5, 9, 17, 21–41] и биотехнологического [8–11, 17, 42–49] применения, а также при решении экологических проблем [50–52] и др. Что касается медицинских аспектов, то в настоящее время как очень перспективное направление рассматривается использование КГПВС в качестве нетоксичных биосовместимых носителей для систем доставки лекарстванных средств в виде временных имплантатов [41, 53] или лечебных покрытий на раны [39, 40, 54–56].
Во всех таких случаях необходимо тем или иным путем включать лекарственные агенты в матрицу полимерного криогеля. В принципе, этих путей два: либо ввести соответствующие биологически-активные вещества в исходный раствор ПВС перед его криотропным гелеобразованием (далее эта схема называется вариантом А), либо сначала сформировать КГПВС и уже потом “насытить” его лекарственными агентами, поместив криогель в их раствор (далее эта схема называется вариантом Б).
Выбор конкретного варианта в основном определяется совокупностью целого набора факторов. Так, если лекарство мало растворимо в водных средах, то более подходит применение варианта А, когда в исходный раствор полимера можно внести просто дисперсию частиц необходимого вещества, затем сформировать КГПВС, последующее высвобождение биологически активного действующего начала из которого будет носить пролонгированный характер в результате постепенного растворения лекарства из-за смещения его равновесной концентрации в жидкой фазе при диффузии растворимой фракции вещества из геля. В свою очередь, в случае хорошо растворимых добавок, особенно соединений солевой природы, вводимых в исходный раствор ПВС, часто имеются ограничения в отношении их количества из-за возможности коагуляции полимера вследствие высаливающего действия таких добавок. Тогда предпочтителен вариант Б, поскольку заранее сформированные криогели ПВС обладают достаточной осмотической устойчивостью даже в средах с высокой концентрацией солей [41, 57]. Также желательно использовать подобную схему включения лекарственных агентов в КГПВС, когда биологически-активные добавки не очень стабильны гидролитически, и поэтому лучше насыщать носитель лекарством незадолго до непосредственного медицинского применения. Все эти, а также и менее значимые факторы, обуславливают необходимость изучения влияния водорастворимых веществ различной природы как на процессы криотропного гелеобразования ПВС и физико-химические свойства получающихся криогелей, так и на кинетические особенности высвобождения из них соответствующих добавок, введенных в гелевый носитель приемами либо варианта А, либо варианта Б. При этом наиболее информативным подходом представляется использование в таких исследованиях влияния не каких-то отдельных веществ, а их рядов с систематически варьируемыми характеристиками.
В частности, ранее нами было изучено воздействие на свойства и микроструктуру КГПВС различных концентраций представителей гомологического ряда аминокислот общей формулы H2N–(CH2)n–COOH, вводимых в исходный раствор ПВС перед его криогенной обработкой согласно варианту А [58]. Было найдено, что в ряду: глицин, β-аланин, γ-аминомасляная кислота, δ-аминовалериановая кислота и ε-аминокапроновая кислота наибольшее влияние на повышение упругости и теплостойкости криогелей оказывали добавки глицина, а далее в таком ряду этот эффект ослабевал. В свою очередь, с увеличением от 1 до 5 числа метиленовых звеньев между амино- и карбоксильной группами молекул данных аминокислот возрастает их относительная гидрофобность, что, как оказалось, сказывалось на кинетике высвобождения таких веществ из матрицы КГПВС. Наиболее пролонгированным этот процесс был в случае последнего члена ряда, т.е. ε‑аминокапроновой кислоты, вследствие наиболее выраженного ее гидрофобного взаимодействия с полиметиленовой цепью макромолекул ПВС.
В этой связи представлялось интересным сравнить особенности влияния тех же аминокислот на свойства КГПВС, загружаемого данными водорастворимыми добавками по схеме варианта Б, т.е. путем уравновешивания заранее сформированного криогеля в растворе соответствующей аминокислоты. Выяснение этих особенностей и их возможных отличий от эффектов, наблюдавшихся для варианта А, являлось целью настоящего исследования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе без дополнительной очистки были использованы следующие вещества: поливиниловый спирт с молекулярной массой 86 кДа и степенью дезацетилирования 99-100% (AcrosOrganics, США), глицин (ГЛИ) и β-аланин (β-АЛА) (Reanal, Венгрия), γ-аминомасляная кислота (γ-АМК), δ-аминовалериановая кислота (δ-АВК) и ε-аминокапроновая кислота (ε-АКК) (все Sigma-Aldrich, США), нингидрин (VEB Laborchemie Apolda, бывш. ГДР), этанол ректификат (Ферейн, РФ). Для приготовления водных растворов использовали деионизированную воду.
Водный раствор ПВС с концентрацией полимера 100 г/л готовили согласно известной методике [12, 13]. Этим раствором заполняли разборные дуралюминовые формы (внутренние диаметр 15 мм и высота 10 мм), которые помещали в камеру программируемого ультракриостата FP 45 HP (Julabo, Германия), где образцы замораживали при –20°C, выдерживали в замороженном состоянии 12 ч и далее оттаивали нагреванием со скоростью 0.03°C/мин, задаваемой микропроцессором криостата.
Для насыщения сформированных таким образом криогелей ПВС каждой из аминокислот соответствующий цилиндрический образец КГПВС погружали в 10 мл водного раствора конкретной аминокислоты нужной концентрации, где выдерживали в плотно закрытых флаконах 48 ч при комнатной температуре. Содержание аминокислоты в ее исходном растворе задавалось таким образом, чтобы при достижении равновесия насыщения концентрация аминокислоты в общем объеме системы “криогель + жидкая фаза” была либо 0.1, либо 0.2, либо 0.3 моль/л.
Оценку объема образцов криогелей осуществляли измеpением их диаметра и высоты с помощью штангенциркуля с последующим вычислением объема соответствующего цилиндра.
Значения компрессионного модуля Юнга (Е) для изучаемых КГПВС определяли с помощью автоматического анализатора текстуры TA-Plus (Lloyd Instruments Ltd., Великобритания) в режиме одноосного сжатия по описанной ранее методике [41, 58].
Температуру плавления криогелей (fusion temperature – Tf) измеряли аналогично процедуре, изложенной в работе [41]. Для этого цилиндрический образец КГПВС помещали в пластиковую пробирку, далее на верхней поверхности криогеля с помощью скальпеля делали неглубокий надрез, куда вставляли шарик из нержавеющей стали диаметром 3.5 мм и массой 0.275 ± 0.005 г. Пробирку плотно закрывали и погружали в водяную баню, снабженную мешалкой. Баню нагревали со скоростью примерно 0.4 град/мин. Температура, при которой шарик, проходя через слой плавящегося геля, падал на дно пробирки, принималась за Tf образца.
Измерения величин Е и Tf проводили не менее, чем в трех независимых экспериментах; полученные результаты усредняли с помощью программы Excel 2010.
Динамику высвобождения конкретной аминокислоты из криогеля ПВС после его насыщения такой водорастворимой добавкой изучали следующим образом. Соответствующий цилиндрический КГПВС погружали в 10 мл деионизированной воды, где выдерживали при комнатной температуре необходимое время с периодическим отбором проб по 0.1 мл для измерения концентрации аминокислоты, а убыль жидкости компенсировали чистой водой. Отобранную порцию анализируемого раствора смешивали с 0.1 мл этанольного раствора нингидрина (3 мг/мл) и нагревали реакционную массу при 70°C в течение 10 мин. После охлаждения полученного окрашенного раствора до комнатной температуры его смешивали с 2.8 мл воды и с помощью UV-VIS спектрофотометра T70 (PG Instruments, Великобритания) регистрировали спектр оптического поглощения полученного раствора. Концентрацию соответствующей аминокислоты определяли по предварительно построенному калибровочному графику.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Формирование криогелей ПВС, их насыщение растворами аминокислот и последующее удаление водорастворимой добавки
Использованные в данном исследовании образцы КГПВС были приготовлены в виде цилиндров диаметром 15 мм и высотой 10 мм, исходя из водных растворов с концентрацией полимера 100 г/л. Режимы проведения криотропного гелеобразования были аналогичны условиям процесса, ранее применявшимся нами в работе [58], где такие же аминокислоты вводились в гелевую матрицу по схеме варианта А, а характеристики сформированных в результате образцов сравнивались с криогелем без добавок. Теперь же мы сначала получали все КГПВС только состава вода-ПВС (рис. 1а) и лишь затем по схеме варианта Б (рис. 1б) их “напитывали” раствором одной из аминокислот (рис. 1в).
Рис. 1.
Принципиальная схема экспериментов по насыщению цилиндрических образов криогелей ПВС (1) водными растворами H2N–(CH2)n–COOH аминокислот (2) и последующего удаления таких водорастворимых добавок: (а) исходный КГПВС; (б) криогель сразу после погружения в раствор аминокислоты; (в) система по достижении равновесия насыщения; (г) криогель после промывки чистой водой (3).
При таком способе насыщении криогелей продолжительность инкубации образцов КГПВС в соответствующих растворах аминокислот во всех случаях была одинаковой – 48 ч (см. Экспериментальную часть). Такое время процесса было определено в предварительных опытах, показавших, что еще до истечения указанного периода концентрация любой из пяти аминокислот в свободной жидкости уже переставала снижаться, т.е. достигалось равновесие насыщения.
В свою очередь, чтобы установить, обратимы или нет изменения характеристик насыщенных аминокислотами криогелей, если затем удалить такую водорастворимую добавку из полимерной фазы, соответствующие образцы КГПВС были исчерпывающе промыты многократной сменой воды (рис. 1г) до отрицательной нингидриновой реакции в пробе промывной жидкости.
Результаты измерений физико-химических свойств криогелей ПВС, как насыщенных различным количеством каждой из пяти аминокислот гомологического ряда H2N–(CH2)n–COOH, так и отмытых от указанных добавок, рассматриваются ниже.
Влияние растворов аминокислот на объем, упругость и теплостойкость образцов КГПВС
Известно [9, 41, 44, 57–60], что осмотические характеристики криогелей ПВС, в частности, степень их набухания, чувствительны к присутствию определенных растворимых веществ в жидкости, куда погружен образец КГПВС. При этом влияние электролитов при повышении ионной силы раствора обусловлено либо высаливающими, либо всаливающими эффектами, приводящими, соответственно, либо к “отбуханию” (de-swelling) надмолекулярной физической сетки криогеля ПВС, либо к ее дополнительному набуханию (up-swelling) [57, 59]. Кроме того, возрастание степени набухания трехмерной сетки КГПВС вызывают растворенные вещества (в том числе и незаряженные), обладающие хаотропными свойствами, противодействующими водородному связыванию, а отбухание криогелей ПВС индуцируется антихаотропными веществами (еще называемыми космотропами), способствующими образованию Н-связей [41, 60, 61].
Проведенные в данной работе исследования показали, что инкубация образцов КГПВС в водных растворах всех пяти применявшихся нами аминокислот гомологического ряда H2N–(CH2)n–COOH в той или иной степени приводила к уменьшению объема этих криогелей. Данный эффект иллюстрируется диаграммами рис. 2 как выраженное в процентах отношение объемов цилиндрических криогелей – насыщенного конкретной аминокислотой (Vi) и исходного (V0) образцов.
Рис. 2.
Относительное изменение объемов цилиндрических образцов криогелей ПВС в результате их насыщения водными растворами аминокислот гомологического ряда H2N–(CH2)n–COOH при достижении равновесных концентраций: 0 (а), 0.1 (б), 0.2 (в) и 0.3 (г) моль/л.
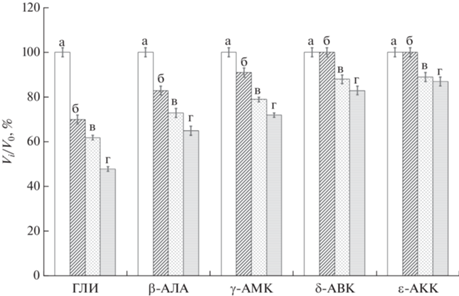
Эти результаты свидетельствуют, что повышение концентрации каждой из использованных нами аминокислот в насыщающих растворах вызывало систематическое снижение степени набухания полимерной сетки соответствующих криогелей ПВС. При этом такое действие указанных аминокислот в основном было обусловлено их космотропными свойствами, нежели высаливающим влиянием в качестве электролитов, поскольку эффекты высаливания становятся заметными в отношении КГПВС при более высоких концентрациях различных неорганических и органических солей (как правило, ≥0.5 моль/л) [57, 62]. Наиболее существенное космотропное воздействие на осмотические свойства исследованных в данной работе КГПВС оказывали растворы глицина, в среде которых происходило самое значительное сокращение объема гелевых образцов. В частности, в случае достижения 0.3-молярной равновесной концентрации ГЛИ объем криогеля сокращался почти до 43% от исходной величины. В свою очередь, по мере увеличения от 1 до 5 числа метиленовых звеньев между NH2- и COOH-группами в молекулах аминокислот ряда H2N–(CH2)n–COOH их космотропный эффект проявлялся в заметно меньшей степени. Иными словами, с возрастанием длины олигометиленовой цепи и, соответственно, с повышением относительной гидрофобности, т.е., как следствие, со снижением гидратируемости таких молекул [58], ослабевала их конкуренция с ОН-группами ПВС за водородное связывание с водой.
В целом, уменьшение геометрических размеров (объема) КГПВС в результате их насыщения H2N–(CH2)n–COOH аминокислотами должно было приводить к возрастанию удельной концентрации полимера в получающихся образцах криогелей, а, значит, и к соответствующему изменению их физико-механических показателей, поскольку, как хорошо известно [6–13], чем значительнее концентрация ПВС, тем выше модуль упругости нековалентных криогелей на его основе. Кроме того, действие промотрирующих водородное связывание космотропных агентов должно было индуцировать образование дополнительных межмолекулярных Н-связей, т.е. повышать количество физических узлов трехмерной полимерной сетки этих криогелей, тем самым также способствуя возрастанию их жесткости.
И действительно, изменения компрессионного модуля Юнга образцов КГПВС, насыщенных разным количеством H2N–(CH2)n–COOH аминокислот, выявили существенное повышение упругости таких гелевых препаратов по сравнению с криогелями ПВС до их обработки растворами этих аминокислот. На рис. 3 этот эффект показан в виде процентного отношения значений модулей Юнга для насыщенного конкретной аминокислотой (Еi) и исходного (Е0) образцов КГПВС.
Рис. 3.
Относительное изменение компрессионного модуля упругости цилиндрических образцов криогелей ПВС в результате их насыщения водными растворами аминокислот гомологического ряда H2N–(CH2)n–COOH при достижении равновесных концентраций: 0 (а), 0.1 (б), 0.2 (в) и 0.3 (г) моль/л.

В наибольшей степени подобный эффект проявлялся в случае насыщения образцов КГПВС растворами глицина, в наименьшей степени – растворами ε-аминокапроновой кислоты. Так, в случае 0.3-молярной равновесной концентрации ГЛИ модуль упругости криогеля достигал 167 ± 2 кПа против Е = 9.1 ± 0.5 кПа для КГПВС без добавок, т.е. процентное отношение Ei/E0 составило 1835%, а в случае 0.3-молярной равновесной концентрации ε-АКК это соотношение было почти в 2.4 раза меньше (766%) Таким образом, тенденции сокращения объема криогелей, вызываемого воздействием H2N–(CH2)n–COOH аминокислот (рис. 2), вполне коррелировали с возрастанием значений их модуля Юнга (рис. 3). Интересно, что когда те же аминокислоты вводились в раствор ПВС до его криогенной обработки по схеме варианта А, то заметное повышение жесткости получаемых криогелей, содержащих такие аминокислоты, наблюдалось при существенно более значительных концентрациях этих космотропных добавок. В частности, при 0.3 М концентрации ГЛИ модуль упругости соответствующих КГПВС практически не отличался от значений Е для образцов без добавок, а при 1.0 М содержании этой аминокислот эффект возрастания модуля упругости составил порядка 330%. В случае же добавок ε-АКК в концентрации 0.3 моль/л значения Е даже снижались примерно вдвое по сравнению с криогелем без добавок и лишь при 3.0-молярном содержании данной аминокислоты модуль упругости криогеля возрастал примерно на 200% [58]. Отсюда следует, что когда надмолекулярная сетка гелевой фазы (стенки макропор) криогеля ПВС уже сформирована, т.е. подвижность цепей полимера и их сегментов существенно ограничена, особенно в областях, близких к узлам сетки, то действие космотропных агентов в случае насыщения ими криогеля по схеме варианта Б в большей степени способствует замыканию новых водородных связей между сближенными ОН-группами по сравнению с промотированием межмолекулярного водородного связывания ПВС при введении космотропов в исходный раствор полимера по схеме варианта А.
Подтверждением высказанному предположению могут служить данные о существенном повышении теплостойкости образцов КГПВС после их насыщения растворами H2N–(CH2)n–COOH аминокислот (рис. 4).
Рис. 4.
Температуры плавления образцов криогелей ПВС после их насыщения водными растворами аминокислот гомологического ряда H2N–(CH2)n–COOH при достижении равновесных концентраций: 0 (а), 0.1 (б), 0.2 (в) и 0.3 (г) моль/л.
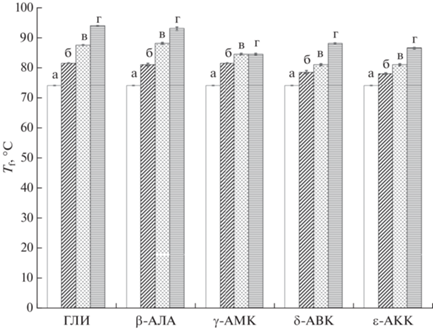
Поскольку температура плавления (Tf) физических гидрогелей, включая и криогели ПВС, является показателем количества межцепных водородных связей (чем больше таких связей, тем при более высокой температуре гель плавится [63, 64]), то приведенные на рис. 4 результаты измерения значений Tf как раз и свидетельствуют в пользу обсуждаемого механизма. В частности, повышение теплостойкости криогелей, насыщенных использованными в работе водорастворимыми добавками, происходило симбатно с ростом концентрации любой из этих пяти аминокислот. При этом самый существенный рост значений температуры плавления соответствующих КГПВС наблюдался для ГЛИ-содержащих образцов, абсолютная же величина эффекта снижалась в ряду: β-АЛА, γ-АМК, δ-АВК, ε-АКК. Если криогели без добавок плавились при 74.2 ± 0.1°C, то в случае 0.1-молярной равновесной концентрации ГЛИ значение Tf уже составляло 81.5 ± 0.3°C, при 0.2-молярной равновесной концентрации этой аминокислоты повышалось до 87.5 ± 0.1°C, а образцы КГПВС, содержавшие глицин в концентрации 0.3 моль/л плавились уже только при 94.0 ± 0.2°C. Для криогелей, насыщенных “последней” из аминокислот использованного в работе ряда, т.е. ε-АКК, температуры плавления образцов с аналогичным глицину содержанием добавки были, соответственно, 78.5 ± 0.2, 80.1 ± 0.1 и 86.4 ± 0.2°C.
Таким образом, на качественном уровне характер зависимостей теплостойкости насыщенных H2N–(CH2)n–COOH аминокислотами криогелей (рис. 4) от типа и концентрации водорастворимой добавки был таким же, что и для значений модуля упругости (рис. 3) аналогичных образцов, тем самым свидетельствуя об индуцируемом этими аминокислотами дополнительном водородном связывании цепей полимера в гелевой фазе макропористого КГПВС, до этого сформированного криогенной обработкой исходного полимерного раствора без каких-либо посторонних добавок.
Динамика высвобождения H2N–(CH2)n–COOH аминокислот из насыщенных их растворами криогелей ПВС
Известно, что некоторые аминокислоты гомологического ряда H2N–(CH2)n–COOH проявляют биологическую активность и поэтому используются в составе как лекарственных, так и косметических препаратов [65, 66]. А поскольку показано, что криогели ПВС являются высокоэффективными носителями фармакологически важных веществ [65, 66], то в настоящей работе мы также изучили особенности высвобождения соответствующих аминокислот из насыщенных их растворами образцов КГПВС (см. Экспериментальную часть). В частности, на рис. 5 в качестве примера приведены кривые, отображающие кинетику такого процесса для криогелей, предварительно насыщенных этими аминокислотами до равновесной концентрации 0.3 моль/л. При этом полученные экспериментальные данные были обработаны в координатах известного уравнения Вейбулла [67]:
где Mt/M∞ – доля растворенного вещества, выделившаяся из полимерного носителя за время t, а значения констант “a” и “b” были получены с использованием программного обеспечения ORIGIN PRO путем загрузки уравнения (1) и экспериментальных величин в эту программу. В данном уравнении константа “b” отражает влияние структуры гелевой матрицы на высвобождение диффузанта, и, согласно [68], значения параметра “b” выше примерно 0.7 свидетельствуют о механизме фактически свободной диффузии растворенного вещества из объема носителя, в нашем случае, высвобождения любой из использованных в работе H2N–(CH2)n–COOH аминокислот из макропористой матрицы криогеля ПВС.Рис. 5.
Экспоненциальные кривые в координатах уравнения Вейбулла кинетических профилей высвобождения в воду аминокислот из насыщенных их растворами цилиндрических образцов КГПВС (равновесная концентрация насыщения для всех аминокислот – 0.3 моль/л).
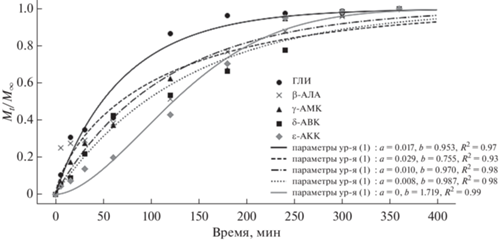
В свою очередь, изучение кинетики высвобождения из КГПВС таких же аминокислот, введенных в исходные растворы полимера перед их криогенной обработкой для формирования криогелей по схеме варианта А, выявило значимое снижение значений параметра “b” с удлинением олигометиленового мостика между амино- и карбокси-группами в молекулах таких водорастворимых добавок [58]. В этом исследовании было показано, что данный эффект обусловлен снижением гидрофильности соответствующих представителей ряда этих аминокислот и, как следствие, усилением их гидрофобного взаимодействия с полиметиленовой цепью макромолекул полимера уже в ходе криотропного гелеобразования ПВС. В итоге, δ-АВК и особенно ε-АКК высвобождались из криогелевого носителя значительно медленнее, чем ГЛИ. Таким образом, из сопоставления ранее полученных данных для содержащих такие аминокислоты криогелей ПВС, сформированных по схеме варианта А [58], с результатами высвобождения тех же аминокислот из нагруженных ими криогелей, приготовленных по схеме варианта Б, можно сделать следующие выводы.
Во-первых, когда криотропное гелеобразование ПВС по схеме варианта А осуществляется в присутствии низкомолекулярных электролитов, то ионная сила незамерзшей жидкой микрофазы (остающиеся жидкими области макроскопически замороженного образца [9, 17, 69]) благодаря эффекту криоконцентрирования существенно выше, чем в исходном растворе до его замораживания или же в растворах тех же аминокислот, использованных для насыщения криогелей ПВС по схеме варианта Б. Поэтому в среде незамерзшей жидкой микрофазы, где собственно и происходит формирование надмолекулярной сетки КГПВС [9, 11, 17], под действием данных электролитов промотируются процессы высаливания полимера и влияния космотропных эффектов H2N–(CH2)n–COOH аминокислот на взаимодействия ПВС-ПВС [58].
Во-вторых, при использовании схемы варианта А процессы криоконцентрирования и ПВС, и аминокислот типа δ-АВК или ε-АКК с четырех- и пятиуглеродным алифатическим мостиком, приводят к усилению обсуждавшихся выше гидрофобных взаимодействий карбоцепного каркаса полимера с такими аминокислотами, что, напротив, крайне слабо проявляется при пропитывании их растворами заранее сформированного криогеля по схеме варианта Б. Влияние данных особенностей вариантов А и Б, а также, скорее всего, и других, пока еще не установленных факторов, как раз и проявляется в различиях кинетики высвобождения этих аминокислот из соответствующих носителей на основе криогеля ПВС.
Изменения объема, упругости и теплостойкости образцов КГПВС после вымывания из них до этого введенных в полимерную матрицу H2N–(CH2)n–COOH аминокислот
На крайней правой пиктограмме (г) рис. 1 схематически показано, что после удаления соответствующей H2N–(CH2)n–COOH аминокислоты из насыщенного ее раствором КГПВС объем криогеля увеличивался по сравнению с объемом “нагруженного” аминокислотой образца, т.е. осмотическое сжатие надмолекулярной сетки криогеля под действием низкомолекулярного электролита не было необратимым. Поэтому представлялось важным количественно охарактеризовать изменения свойств соответствующих криогелей ПВС, вызываемые их промыванием водой до отрицательной нингидриновой реакции в пробе промывной жидкости (см. Экспериментальную часть).
Примеры полученных в этих опытах данных в отношении объема, компрессионного модуля упругости и температуры плавления препаратов КГПВС, промытых таким образом от 0.3-молярного содержания H2N–(CH2)n–COOH аминокислот, приведены в виде диаграмм на рис. 6–8 в тех же координатах и масштабах, что и диаграммы на рис. 2–4 для криогелей после насыщения их растворами аналогичных аминокислот. Кроме того, на рис. 6, 7 даны характеристики криогелей (б), полученных аналогично образцам (а) без добавок аминокислот, а затем многократно промытых водой. При расчетах относительных значений объема и компрессионного модуля (рис. 6 и 7) за 100% принимались, как и в случае диаграмм на рис. 2 и 3, данные для криогелей до их насыщения аминокислотами.
Рис. 6.
Относительное изменение объемов цилиндрических образцов криогелей ПВС: (а) свежеполученный КГПВС; (б) криогель без добавок после обработки водой в том же режиме, что и образец, сначала насыщенный раствором аминокислоты, а затем отмытый от ее добавок; (в) криогель, сначала насыщенный раствором аминокислоты до ее равновесной концентрации 0.3 моль/л и далее отмытый водой.
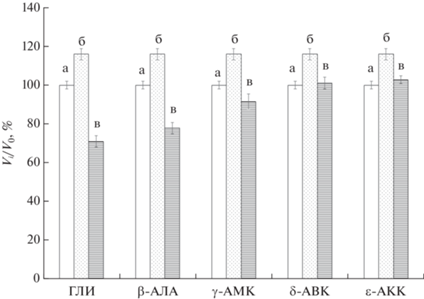
Рис. 7.
Относительное изменение компрессионного модуля упругости образцов криогелей ПВС: (а) свежеполученный КГПВС; (б) криогель без добавок после обработки водой в том же режиме, что и образец, сначала насыщенный раствором аминокислоты, а затем отмытый от ее добавок; (в) криогель, сначала насыщенный раствором аминокислоты до ее равновесной концентрации 0.3 моль/л и далее отмытый водой.

Рис. 8.
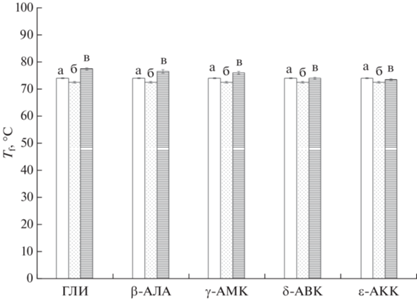
Температура плавления образцов криогелей ПВС: (а) свежеполученный КГПВС; (б) криогель без добавок после обработки водой в том же режиме, что и образец, сначала насыщенный раствором аминокислоты, а затем отмытый от ее добавок; (в) криогель, сначала насыщенный раствором аминокислоты до ее равновесной концентрации 0.3 моль/л и далее отмытый водой.
Сравнение показателей препаратов (а) и (б) показывает, что просто водная обработка приводила к некоторому дополнительному (примерно на 17%) набуханию криогелей ПВС (рис. 6), и это также известно из литературных данных [57]. В то же время, в случае КГПВС, сначала насыщенных водными растворами ГЛИ, β-АЛА и γ-АМК, а затем многократно промытых водой (образцы (в)), их объем в существенной мере отличался от этого параметра как для свежеполученных образцов (а), так и после их промывки водой (б). Отсюда следует, что космотропное действие растворов этих аминокислот, особенно глицина, приводило к замыканию дополнительных достаточно устойчивых Н-связей в уже сформированном криогеле. В случае же КГПВС, насыщенных и затем отмытых от менее космотропных δ-АВК и δ-АКК, остаточного уменьшения объема гелевых образцов практически не наблюдалось.
Более заметными оказались относительные изменения физико-механических свойств обсуждаемых здесь криогелей, т.е. препаратов, схематически показанных на крайней правой пиктограмме (г) рис. 1. Данные рис. 7 наглядно свидетельствуют о существенном влиянии на значения модуля упругости тех Н-связанных узлов надмолекулярной сетки КГПВС, что образовались de novo после обработки криогелей растворами космотропных H2N–(CH2)n–COOH аминокислот и далее отмытых от них. Если модуль упругости немного дополнительно набухших вследствие промывки только водой образцов (б) (рис. 6) снизился примерно на 40% по сравнению с исходными криогелями (а), то значения Е для КГПВС группы (в), обработанных использовавшимися в этой работе аминокислотами, превышали модуль упругости исходных криогелей на величину от ~900% (ГЛИ) до ~550% (δ-АКК) (рис. 7). Эти показатели были ниже, чем у соответствующих образцов непосредственно после их насыщения растворами космотропных аминокислот (рис. 3), что наглядно свидетельствует о появлении дополнительных и, по-видимому, об увеличении размера уже имеющихся узлов пространственной сетки криогелей ПВС в результате воздействия на них растворимых агентов, промотирующих водородное связывание. Причем часть таких “вторичных” межмолекулярных Н-связей, скорее всего, некооперативного характера, диссоциирует в ходе отмывания аминокислоты, а какая-то часть остается, не позволяя образцам восстанавливать первоначальный объем (рис. 6) и обеспечивая более высокую их жесткость по сравнению с исходными или обработанными только водой криогелями (рис. 7).
Что же касается теплостойкости криогелей ПВС, сначала обработанных растворами H2N–(CH2)n–COOH аминокислот, а затем отмытых водой от этих космотропных агентов, то температуры плавления таких криогелей были на 3–6°C выше по сравнению со значением Tf свежеполученного КГПВС (рис. 8), что также указывает на большее удельное (в расчете на единицу массы полимера) количество термодиссоциируемых узлов в образцах, контактировавших с растворами космотропов. Однако, пока что неясным остается феномен некоторого (около 3°C) повышения теплостойкости криогелей (в), промытых просто водой (рис. 8). Возможно, что это связано с так называемым “старением” полимерной сетки физического геля вследствие постепенного совершенствования структуры узлов трехмерной сетки, т.е. микрокристаллитов ПВС [9–11, 64, 70, 71], для разрушения которых при плавлении необходимо затратить больше энергии. Выяснение этих вопросов требует отдельного исследования, не входившего в задачи именно данной работы.
ЗАКЛЮЧЕНИЕ
Макропористые физические криогели на основе поливинилового спирта, которые образуются в результате криогенной обработки его концентрированных растворов, представляют значительный научный и прикладной интерес, особенно в плане их биомедицинского применения, например, в качестве искусственных хрящей или систем доставки лекарств. В последнем случае важно знать, как различные посторонние добавки, присутствие которых требуется по медицинским показаниям, способны влиять на физико-химические свойства соответствующих криогелей, и, с другой стороны, как полимерная матрица может влиять на процессы высвобождения лекарств. В проведенном исследовании криогели поливинилового спирта были получены замораживанием водных растворов данного полимера, их выдерживанием в замороженном состоянии и последующим оттаиванием, а далее инкубировались в растворах одной из аминокислот общей формулы H2N–(CH2)n–COOH (n = 1–5), обладающих космотропным действием в отношении процессов образования водородных связей. Установлено, что в результате такой обработки осмотические, физико-механические и теплофизические характеристики криогелей заметно изменялись, а именно, объем гелевых образцов уменьшался, а их модуль упругости и теплостойкость (температура плавления) значительно возрастали. Интенсивность указанных изменений зависела как от природы соответствующей аминокислоты, так и от ее концентрации в криогеле по достижении равновесия насыщения. В наибольшей степени такие эффекты наблюдались при действии растворов глицина (n = 1), в наименьшей – в случае растворов ε-аминокапроновой кислоты (n = 5). При этом подобные изменения не сильно отражались на эффективности высвобождения H2N–(CH2)n–COOH аминокислот из криогелей, насыщенных соответствующими растворами, поскольку собственно высвобождение этих аминокислот во внешнее водное окружение происходило без диффузионных затруднений. Также показано, что если исчерпывающе отмыть чистой водой нагруженные аминокислотами криогели, то их физико-химические показатели не возвращаются полностью к значениям, характерным для образцов до их обработки растворами таких аминокислот. Эти результаты, по-видимому, свидетельствуют о промотируемом космотропными аминокислотами образовании дополнительных достаточно стабильных Н-связанных узлов трехмерной сетки в объеме уже сформированного криогеля.
Список литературы
Кухарчик М.М., Барамбойм Н.К. Изменения свойств водных растворов поливинилового спирта при криолитическом воздействии // Высокомолекул. соед. 1972. Т. 14. Сер. Б. С. 843–846.
Peppas N.A. Turbidimetric studies of aqueous poly(vinyl alcohol) solutions // Makromol. Chem. Physics. 1975. V. 176. № 11. P. 3433–3440. https://doi.org/10.1002/macp.1975.021761125
Watase M., Nishinari K., Nambu M. Rheological properties of an anomalous poly(vinyl alcohol) gel // Polym. Comm. 1983. V. 24. P. 52–54.
Рогожин С.В., Лозинский В.И., Вайнерман Е.С., Домотенко Л.В., Мамцис А.М., Иванова С.А., Штильман М.И., Коршак В.В. Нековалентное криоструктурирование в полимерных системах // Докл. АН СССР. 1984. Т. 278. № 1. С. 129–133.
Nambu M. Rubber-like poly(vinyl alcohol) gel // Kobunshi Ronbunshu 1990. V. 47. № 9. P. 695–703. https://doi.org/10.1295/koron.47.695
Lozinsky V.I., Vainerman E.S., Domotenko L.V., Mamtsis A.M., Titova E.F., Belavtseva E.M., Rogozhin S.V. Study of cryostructurization of polymer systems. VII. Structure formation under freezing of poly(vinyl alcohol) aqueous solutions // Coll. Polym. Sci. 1986. V. 264. P. 19–24. https://doi.org/10.1007/BF01410304
Peppas N.A., Stauffer S.R. Reinforced uncrosslinked poly(vinyl alcohol) gels produced by cyclic freezing-thawing processes: A short review // J. Control. Release. 1991. V. 16. № 3. P. 305–310. https://doi.org/10.1016/0168-3659(91)90007-Z
Mori Y., Tokura H., Yoshikawa M. Properties of hydrogels synthesized by freezing and thawing aqueous poly(vinyl alcohol) solutions and their applications // J. Mater. Sci. 1997. V. 32. P. 491–496. https://doi.org/10.1023/A:1018586307534
Лозинский В.И. Криотропное гелеобразование растворов поливинилового спирта // Успехи химии. 1998. Т. 67. № 7. С. 641–655. https://doi.org/10.1070/RC1998V067N07ABEH000399
Hassan C.M., Peppas N.A. Structure and applications of poly(vinyl alcohol) hydrogels produced by conventional crosslinking or by freezing/thawing methods // Adv. Polym. Sci. 2000. V. 153. P. 37–65. https://doi.org/10.1007/3-540-46414-X_2
Лозинский В.И. Криогели на основе природных и синтетических полимеров: получение, свойства и области применения // Успехи химии 2002. Т. 71. № 6. С. 559–585. https://doi.org/10.1070/RC2002V071N06ABEH000720
Лозинский В.И., Дамшкалн Л.Г., Шаскольский Б.Л., Бабушкина Т.А., Курочкин И.Н., Курочкин И.И. Изучение криоструктурирования полимерных систем. 27. Физико-химические свойства криогелей поливинилового спирта и особенности их макропористой морфологии // Коллоидн. журн. 2007. Т. 69. № 6. С. 798–816. https://doi.org/10.1134/S1061933X07060117
Лозинский В.И., Дамшкалн Л.Г., Курочкин И.Н., Курочкин И.И. Изучение крио-структурирования полимерных систем. 28. Физико-химические свойства и морфология криогелей поливинилового спирта, сформированных многократным замораживанием-оттаиванием // Коллоидн. журн. 2008. Т. 70. № 2. С. 212–222. https://doi.org/10.1134/S1061933X08020117
Gutiérrez M.C., Ferrer M.L., del Monte F. Ice-templated materials: Sophisticated structures exhibiting enhanced functionalities obtained after unidirectional freezing and ice-segregation-induced self-assembly // Chem. Mater. 2008. V. 20. № 3. P. 634–648. https://doi.org/10.1021/cm702028z
Gun’ko V.M., Savina I.N., Mikhalovsky S.V. Cryogels: Morphological, structural and adsorption characterization // Adv. Coll. Interface Sci. 2013. V. 187–188. P. 1–46. https://doi.org/10.1016/j.cis.2012.11.001
Zhang H., Zhang F., Wu J. Physically crosslinked hydrogels from polysaccharides prepared by freeze–thaw technique // React. Func. Polym. 2013. V. 73. № 7. P. 923–928. https://doi.org/10.1016/j.reactfunctpolym.2012.12.014
Lozinsky V.I., Okay O. Basic principles of cryotropic gelation // Adv. Polym. Sci. 2014. V. 263. P. 49–101. https://doi.org/10.1007/978-3-319-05846-7_2
Lozinsky V.I. Cryostructuring of polymeric systems. 55. Retrospective view on the more than 40-years studies performed in the A.N.Nesmeyanov Institute of Organoelement Compounds with respect of the cryostructuring processes in polymeric systems // Gels. 2020. V. 6. № 3. P. 29. https://doi.org/10.3390/gels6030029
Adelnia H., Ensandoost R., Moonshi S.S., Gavgani J.N., Vasafi E.I., Ta H.T. Freeze/thawed polyvinyl alcohol hydrogels: Present, past and future // Eur. Polym. J. 2022. V. 164. P. 110974. https://doi.org/10.1016/j.eurpolymj.2021.110974
Manzhai V.N., Fufaeva M.S., Kashlach E.S. Relaxation of mechanical stress in poly(vinyl alcohol) cryogels of different compositions // Chinese Journal of Polymer Science. 2023. T. 41. № 3. C. 442–447. https://doi.org/10.1007/s10118-022-2889-8
Lazzeri L. Progress in bioartificial polymeric materials // Trends Polym. Sci. 1996. V. 4. № 8. P. 249–252.
Chu K.C., Rutt B.K. Poly(vinyl alcohol) cryogel: An ideal phantom material for MR studies of arterial flow and elasticity // Magn. Reson. Med. 1997. V. 37. № 2. P. 314–319. https://doi.org/10.1002/mrm.1910370230
Hoskins P.R. Simulation and validation of arterial ultrasound imagining and blood flow // Ultrasound Med. Biol. 2008. V. 34. № 5. P. 693–717. https://doi.org/10.1016/j.ultrasmedbio.2007.10.017
Ghanbari H., Viatage H., Kidane A.G., Burriesci G., Tavakoli M., Seifalian A.M. Polymeric heart valves: New materials, emerging hopes // Trends Biotechnol. 2009. V. 27. № 6. P. 359–367. https://doi.org/10.1016/j.tibtech.2009.03.002
Alves M.H., Jensen B.E.B., Smith A.A.A., Zelikin A.N. Poly(vinyl alcohol) physical hydrogels: New vista on a long serving biomaterial // Macromol. Biosci. 2011. V. 11. № 10. P. 1293–1313. https://doi.org/10.1002/mabi.201100145
Baker M.I., Walsh S.P., Schwatz Z., Boyan B.D. A review of polyvinyl alcohol and its uses in cartilage and orthopedic applications // J. Biomed. Mater. Res. B. 2012. V. 100. № 5. P. 1451–1457. https://doi.org/10.1002/jmb.b32694
Gajra B., Pandya S.S., Vidyasagar G., Rabari H., Dedania R.R., Rao S. Poly(vinyl alcohol) hydrogel and its pharmaceutical and biomedical applications: A review // Int. J. Pharm. Res. 2012. V. 4. № 2. P. 20–26.
Maiolo A.S., Amado M.N., Gonzalez J.S., Alvarez V.A. Development and characterization of poly (vinyl alcohol) based hydrogels for potential use as an articular cartilage replacement // Mater. Sci. Eng. C. 2012. V. 32. № 6. P. 1490–1495. https://doi.org/10.1016/j.msec.2012.04.030
Iatridis J.C., Nicoll S.B., Michalek A.J., Walter B.A., Gupta M.S. Role of biomechanics in intervertebral disc degeneration and regenerative therapies: What needs repairing in the disc and what are promising biomaterials for its repair? // Spine J. 2013. V. 13. № 3. P. 243–262. https://doi.org/10.1016/j.spinee.2012.12.002
Wan W., Bannerman A.D., Yang L., Mak H. Poly(vinyl alcohol) cryogels for biomedical applications // Adv. Polym. Sci. 2014. V. 263. P. 283–321. https://doi.org/10.1007/978-3-319-05846-7_8
Teixeira L.S.M., Patterson J., Luyten F.P. Skeletal tissue regeneration: Where can hydrogels play a role? // Int. Orthopaedics. 2014. V. 38. P. 1861–1876. https://doi.org/10.1007/s00264-014-2402-2
Beddoes C.M., Whitehouse M.R., Briscoe W.H., Su B. Hydrogels as a replacement material for damaged articular hyaline cartilage // Materials. 2016. V. 9. № 6. P. 443. https://doi.org/10.3390/ma9060443
Kumar A., Han S.S. PVA-based hydrogels for tissue engineering: A review // Int. J. Polym. Mater. Polym. Biomater. 2017. V. 66. № 4. P. 159–182. https://doi.org/10.1080/00914037.2016.1190930
Timofejeva A., D’Este M., Loca D. Calcium phosphate/polyvinyl alcohol composite hydrogels: A review on the freeze-thaw synthesis approach and applications in regenerative medicine // Eur. Polym. J. 2017. V. 95. P. 547–565. https://doi.org/10.1016/j.eurpolymj.2017.08.048
Teodorescu M., Bercea M., Morariu S. Biomaterials of poly(vinyl alcohol) and natural polymers // Polym. Revs. 2018. V. 58. № 2. P. 247–287. https://doi.org/10.1080/15583724.2017.1403928
Memic A., Colombani T., Eggermont L.J., Rezaeeyazdi M., Steingold J., Rogers Z.J., Navare K.J., Mohammed H.S., Bencherif S.A. Latest advances in cryogel technology for biomedical applications // Adv. Therapeutics. 2019. V. 2. № 4. P. 1800114. https://doi.org/10.1002/adtp.201800114
Xiang J., Shen L., Hong Y. Status and future scope of hydrogels in wound healing: Synthesis, materials and evaluation // Eur. Polym. J. 2020. V. 130. P. 109609. https://doi.org/10.1016/j.eurpolymj.2020.109609
Rivera-Hernández G., Antunes-Ricardo M., Martínez-Morales P., Sánchez L. Polyvinyl alcohol based-drug delivery systems for cancer treatment // Internat. J. Pharmaceutics. 2021. V. 600. P. 120478. https://doi.org/10.1016/j.ijpharm.2021.120478
Aderibigbe B.A. Hybrid-based wound dressings: Combination of synthetic and biopolymers // Polymers. 2022. V. 14. № 18. P. 3806. https://doi.org/10.3390/polym14183806
Akin A., Ozmen M.M. Antimicrobial cryogel dressings towards effective wound healing // Progress in Biomaterials. 2022. V. 11. P. 331–346. https://doi.org/10.1007/s40204-022-00202-w
Kolosova O.Yu., Shaikhaliev A.I., Krasnov M.S., Bondar I.M., Sidorskii E.V., Sorokina E.V., Lozinsky V.I. Cryostructuring of polymeric systems. 64. Preparation and properties of poly(vinyl alcohol)-based cryogels loaded with antimicrobial drugs and assessment of the potential of such gel materials to perform as the gel implants for treatment of infected wounds // Gels. 2023. V. 9. № 2. P. 113. https://doi.org/10.3390/gels9020113
Лозинский В.И., Вакула А.С., Зубов А.Л. Применение криогелей поливинилового спирта в биотехнологии. IV. Обзор литературных данных // Биотехнология. 1992. № 4. С. 5–14.
Varfolomeev S.D., Rainina E.I., Lozinsky V.I. Cryoimmobilized enzymes and cells in organic synthesis // Pure Appl. Chem. 1992. V. 64. № 8. P. 1193–1196. https://doi.org/10.1351/pac199264081193
Lozinsky V.I., Plieva F.M. Poly(vinyl alcohol) cryogels employed as matrices for cell immobilization. 3. Overview of recent research and developments // Enzyme Microb. Technol. 1998. V. 23. № 3–4. P. 227–242. https://doi.org/10.1016/S0141-0229(98)00036-2
Lozinsky V.I., Plieva F.M., Galaev I.Y., Mattiasson B. The potential of polymeric cryogels in bioseparation // Bioseparation. 2001. V. 10. P. 163–188. https://doi.org/10.1023/A:1016386902611
Lozinsky V.I., Galaev I.Y., Plieva F.M., Savina I.N., Jungvid H., Mattiasson B. Polymeric cryogels as promising materials of biotechnological interest // Trends Biotechnol. 2003. V. 21. № 10. P. 445–451. https://doi.org/10.1016/j.tibtech.2003.08.002
Plieva F.M., Galaev I.Y., Noppe W., Mattiasson B. Cryogel applications in microbiology // Trends Microbiol. 2008. V. 16. № 11. P. 543–551. https://doi.org/10.1016/j.tim.2008.08.005
Mattiasson B. Cryogels for biotechnological applications // Adv. Polym. Sci. 2014. V. 263. P. 245–281. https://doi.org/10.1007/978-3-319-05846-7_7
Berillo D., Al-Jwaid A., Caplin J. Polymeric materials used for immobilisation of bacteria for the bioremediation of contaminants in water // Polymers. 2021. V. 13. № 7. P. 1073. https://doi.org/10.3390/polym13071073
Алтунина Л.К., Фуфаева М.С., Филатов Д.А., Сваровская Л.И., Рождественский Е.А., Ган-Эрдене T. Влияние криогеля на свойства почвы // Почвоведение. 2014. № 5. С. 563–570. https://doi.org/10.1134/S1064229314010025
Vasiliev N.K., Pronk A.D.C., Shatalina I.N., Janssen F.H.M.E., Houben R.W.G. A review on the development of reinforced ice for use as a building material in cold regions // Cold Reg. Sci. Technol. 2015. V. 115. P. 56–63. https://doi.org/10.1016/j.coldregions.2015.03.006
Xie J., Yan M.-L., Yan J.-B. Experimental study on PVA reinforced salt-water ice under uniaxial compression at arctic low temperatures // Cold Reg. Sci. Technol. 2023. V. 206. P. 103751. https://doi.org/10.1016/j.coldregions.2022.103751
Шайхалиев А.И., Коршаков Е.В., Колосова О.Ю., Краснов М.С., Лозинский В.И. Временный имплантат для пациентов с инфицированными дефектами в челюстно-лицевой области и способ их лечения с использованием такого имплантата // Пат. РФ № 2729929;
Vidovic S., Stojkovska J., Stevanovic M., Balanc B., Vukasinovic-Sekulic M., Marinkovic A., Obradovic B. Effects of poly(vinyl alcohol) blending with Ag/alginate solutions to form nanocomposite fibres for potential use as antibacterial wound dressings // Royal Soc. Open Sci. 2021. V. 9. № 3. P. 211517. https://doi.org/10.1098/rsos.211517
Xiong S., Li R., Ye S., Ni P., Shan J., Yuan T., Liang J., Fan Y., Zhang X. Vanillin enhances the antibacterial and antioxidant properties of polyvinyl alcohol-chitosan hydrogel dressings // Intern. J. Biol. Macromol. 2022. V. 220. P. 109–116. https://doi.org/10.1016/j.ijbiomac.2022.08.052
Ningrum D.R., Halif W., Mardhian D.F., Asri L.A.T.W. In vitro biocompatibility of hydrogel polyvinyl alcohol/Moringa oleifera leaf extract/graphene oxide for wound dressing // Polymers. 2023. V. 15. № 2. P. 468. https://doi.org/10.3390/polym15020468
Lozinsky V.I., Zubov A.L., Titova E.F. Swelling behavior of poly(vinyl alcohol) cryogels employed as matrices for cell immobilization // Enzyme Microb. Technol. 1996. V. 18. № 8. P. 561–569. https://doi.org/10.1016/0141-0229(95)00148-4
Kolosova O.Yu., Karelina P.A., Vasil’ev V.G., Grinberg V.Ya., Kurochkin I.I., Kurochkin I.N., Lozinsky V.I. Cryostructuring of polymeric systems. 58. Influence of the H2N–(CH2)n–COOH-type amino acid additives on formation, properties, microstructure and drug release behavior of poly(vinyl alcohol) cryogels // React. Funct. Polym. 2021. V. 167. P. 105010. https://doi.org/10.1016/j.reactfunctpolym.2021.105010
Patachia S., Valente A.J.M., Baciu C. Effect of non-associated electrolyte solutions on the behaviour of poly(vinyl alcohol)-based hydrogels // Eur. Polym. J. 2007. V. 43. № 2. P. 460–467. https://doi.org/10.1016/j.eurpolymj.2006.11.009
Patachia S., Friedrich C., Florea C., Croitoru C. Study of the PVA hydrogel behaviour in 1-butyl-3-methylimidazolium tetrafluoroborate ionic liquid // Express Polym. Lett. 2011. V. 5. № 2. P. 197–207. https://doi.org/10.3144/expresspolymlett.2011.18
Kolosova O.Yu., Kurochkin I.N., Kurochkin I.I., Lozinsky V.I. Cryostructuring of polymeric systems. 48. Influence of organic non-ionic and ionic chaotropes or kosmotropes on the cryotropic gel-formation of aqueous poly(vinyl alcohol) solutions, as well as on the properties and microstructure of the resultant cryogels // Eur. Polym. J. 2018. V. 102. P. 169–177. https://doi.org/10.1016/j.eurpolymj.2018.03.010
Лозинский В.И., Сахно Н.Г., Дамшкалн Л.Г., Бакеева И.В., Зубов В.П., Курочкин И.Н., Курочкин И.И. Изучение криоструктурирования полимерных систем. 31. Влияние добавок хлоридов щелочных металлов на физико-химические свойства и морфологию криогелей поливинилового спирта // Коллоидн. журн. 2011. Т. 73. № 2. С. 225–234. https://doi.org/10.1134/S1061933X11020086
Eldridge J.E., Ferry J.D. Studies of the cross-linking process in gelatin gels. III. Dependence of melting point on concentration and molecular weight // J. Phys. Chem. 1954. V. 58. № 11. P. 992–995. https://doi.org/10.1021/j150521a013
Nishinari K., Watase M., Tanaka F. Structure of junction zones in poly (vinyl alcohol) gels by rheological and thermal studies // J. Chim. Phys. 1996. V. 93. P. 880–886. https://doi.org/10.1051/jcp/1996930880
Якубке Х.-Д., Ешкайт X. Аминокислоты, пептиды, белки. Пер. с нем. М.: Мир, 1985. 456 с.
Стручкова И.В., Брилкина А.А. Аминокислоты. Нижний Новгород: Изд. НГУ, 2016. 32 с.
Weibull W. A statistical distribution function of wide applicability // J. Appl. Mechanics. 1951. V. 18. P. 293–297.
Papadopoulou V., Kosmidis K., Vlachou M., Macheras P. On the use of the Weibull function for the discernment of drug release mechanisms // Int. J. Pharm. 2006. V. 309. № 1–2. P. 44–50. https://doi.org/10.1016/j.ijpharm.2005.10.044
Сергеев Г.Б., Батюк В.А. Реакции в замороженных многокомпонентных системах // Успехи химии. 1976. Т. 45. № 5. С. 793–826.
Kobayashi M., Ando I., Ishii T., Amiya S. Structural and dynamical studies of poly(vinyl alcohol) gels by high-resolution solid-state 13C NMR spectroscopy // J. Mol. Struct. 1998. V. 440. № 1–3. P. 155–164. https://doi.org/10.1016/S0022-2860(97)00238-X
De Rosa C., Auriemma F., Di Girolamo R. Kinetic analysis of cryotropic gelation of poly(vinyl alcohol)/water solutions by small-angle neutron scattering // Adv. Polym. Sci. 2014. V. 263. P. 159–197. https://doi.org/10.1007/978-3-319-05846-7_4
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал


