Коллоидный журнал, 2019, T. 81, № 3, стр. 344-355
Тензиометрические и реологические свойства функционализированных имидазолиевых ПАВ на границе раздела жидкость–газ
С. Л. Хилько 1, *, А. А. Котенко 1, С. А. Гребенюк 1, О. М. Заречная 1, В. А. Михайлов 1
1 Институт физико-органической химии и углехимии им. Л.М. Литвиненко
283114 Донецк-114, ул. Р. Люксембург, 70, Россия
* E-mail: sv-hilko@yandex.ru
Поступила в редакцию 13.06.2018
После доработки 13.11.2018
Принята к публикации 03.12.2018
Аннотация
Методами кольца Дю Нуи, формы висячей капли и максимального давления в пузырьке исследованы тензиометрические (поверхностное натяжение) и реологические (модуль вязкоупругости и фазовый угол) характеристики растворов дикатионного и монокатионного имидазолиевых оксимов на границе фаз жидкость–газ. Выявлена высокая поверхностная активность и высокие значения модуля вязкоупругости дикатионного оксима (дихлорида 1,3-бис(3'-цетилимидазолий-1'-ил)-2-оксиминопропана). Экспериментальные зависимости динамического поверхностного (межфазного) натяжения и реологических параметров поверхностных слоев имидазолиевых оксимов хорошо описываются в рамках реориентационной модели. Высказаны соображения о возможной причине высоких значений модуля вязкоупругости дикатионного оксима с цетильными заместителями на границе фаз жидкость–газ.
ВВЕДЕНИЕ
В последние десятилетия резко возрос интерес к новому классу димерных поверхностно-активных веществ (“ПАВ-близнецам” или Gemini, бис-ПАВ) [1–7]. Димерные ПАВ представляют собой соединения, которые состоят из двух гидрофильных головных групп и двух гидрофобных хвостов, соединенных мостиком (спейсером), который ковалентно связывает фрагменты дифильных молекул по полярным группам или вблизи этих групп по гидрофобным частям. В последние годы были получены ПАВ “высшего порядка”: трис-ПАВ, тетра-ПАВ [8–10].
Интерес к димерным ПАВ связан с необычными коллоидно-химическими свойствами, отличными от свойств их мономерных аналогов. Так, мицеллобразование в растворах димерных ПАВ может начинаться при концентрациях на порядки ниже, а поверхностное натяжение растворов таких ПАВ в точке критической концентрации мицеллообразования (KKM) меньше, чем для растворов мономерных ПАВ [3, 11]. Димерные ПАВ обладают уникальными структурными особенностями: они способны к образованию агрегатов переменного состава, морфология которых можно регулировать путем изменения молекулярной структуры ПАВ [12, 13]. Эти свойства определяются как типом гидрофильных групп и длиной углеводородных заместителей, так и, в значительной степени, размерами и структурой мостиковых фрагментов [4, 14].
Необычные свойства димерных ПАВ определяют широкие возможности их практического применения. Так, например, их можно использовать для разработки новых материалов с высокой пористостью [3, 15] или с желаемой плотностью поверхностного заряда [16], материалов с высокой солюбилизирующей способностью [17, 18], ингибиторов коррозии [15, 19, 20], стабилизаторов микроэмульсий [21, 22] и наночастиц [15, 23–25]. Особо надо отметить возможность использования димерных ПАВ и их мономерных аналогов в качестве ионных жидкостей [26–28] и мицеллярных сред для проведения химических реакций (в мицеллярном катализе) [29–32]. Также известно о биологических применениях димерных ПАВ в качестве средств доставки лекарственных препаратов [33] и ДНК в клетки организмов [15, 34], а также в качестве антимикробных и противогрибковых агентов [35, 36].
В последние годы одним из актуальных направлений синтеза димерных ПАВ является получение функционализированных производных, когда в состав мостиковых фрагментов вводятся гидроксильные или эфирные группы [37–42]. Изменение молекулярной структуры этих фрагментов при их функционализации способствует увеличению гидрофильности головной группы. Это приводит к изменению степени ее сольватации за счет образования водородных связей между молекулами воды и функциональными группами и возможному изменению конформации мостикового фрагмента. Такая функционализация может способствовать повышению биодеградируемости димерных ПАВ [37, 41], использованию их в качестве эксципиентов в лекарственных препаратах [41], усилению взаимодействий с биомолекулами [42] и другим эффектам.
Функционализация мостикового фрагмента дикатионных ПАВ является важным направлением в мицеллярном катализе. Введение в состав мостикового фрагмента реакционноспособных нуклеофильных групп позволяет создавать соединения, которые являются уникальными энзимоподобными реагентами, совмещающими в водных растворах свойства нуклеофила и мицеллообразователя [43–45]. Так, введение в структуру мостикового фрагмента дикатионного диалкилимидазолия ковалентно связанной оксимной группы (–N=ОН) способствует резкому увеличению реакционной способности мицеллярной среды в реакциях нуклеофильного замещения, например переноса ацильной группы при расщеплении токсичных эфиров кислот фосфора и серы [43, 46, 47]. На скорость реакций могут влиять структурные переходы ПАВ в системе при изменении их концентрации. Поэтому исследование каталитической активности также требует изучения структур, образуемых такими ПАВ (параметров упаковки, морфологии агрегатов и др.).
Целью работы было исследование тензиометрических и реологических характеристик поверхностных слоев монокатионного и дикатионного ПАВ, функционализированных оксимной группой, методами динамической тензиометрии и реометрии. Для описания поверхностного натяжения растворов этих ПАВ и реологии их поверхностных слоев использовали теоретическую модель, которая учитывает переориентацию молекул в поверхностном слое (реориентационная модель).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе исследованы свойства межфазных слоев монокатионного оксима (хлорида 1-(2'-оксиминопропил)-3-цетилимидазолия) и дикатионного оксима (дихлорида 1,3-бис(3'-цетилимидазолий-1'-ил)-2-оксиминопропана) имидазолиевых солей, структура которых приведена на рис. 1. Метод синтеза таких ПАВ и каталитическая активность их мицеллярных сред в нуклеофильных реакциях описаны в работе [43].
Растворы ПАВ готовили в очищенной воде (Milli‑Q), имеющей поверхностное натяжение 72.0 ± 0.2 мН/м, которое оставалось неизменным во временном интервале до 105 с (около 28 ч).
Поверхностное натяжение (γ, мН/м) водных растворов имидазолиевых ПАВ при постоянной (фиксированной) концентрации в зависимости от времени жизни поверхности (t, с) измеряли различными методами. Методом кольца Дю Нуи (тензиометр TE-1, Lauda, Германия) исследовали поверхностное натяжение во временном интервале от 10 до 105 с. Принцип работы прибора описан в [48, 49]. Значения γ рассчитывали с учетом поправочных коэффициентов Харкинса–Джордана [49]. Ошибка при измерениях γ не превышала ±0.1 мН/м.
Для определения динамического и равновесного поверхностного натяжения в широком диапазоне времени жизни межфазной поверхности (от 1 до 105 с) использовали метод формы висячей капли (тензиометр PAT-2P, SINTERFACE Technologies, Германия).
Методом максимального давления в газовом пузырьке (тензиометр ВРА-1S, SINTERFACE Technologies) определяли поверхностное натяжение в узком временнóм диапазоне (примерно от 0.01 до 10.0 с).
Дилатационные реологические характеристики поверхностных слоев растворов имидазолиевые солей изучали с помощью тензиометра PAT-2P в режиме гармонических осцилляций капли после достижения адсорбционного равновесия ((5–7) × 104 с с момента формирования капли). Принцип работы тензиометра PAT-2P (включая дилатационную реометрию) детально описан в работах [50, 51]. При варьировании амплитуды осцилляции площади поверхности капли (ΔA) в диапазоне от 3 до 18% использовали частоту 0.1 Гц, а при варьировании частоты осцилляции от 0.005 до 0.5 Гц использовали амплитуду, равную 6%.
Результаты экспериментов с гармоническими осцилляциями капли анализировали с помощью преобразования Фурье, которое входит в программное обеспечение тензиометра [50, 51]:
где A0 – начальная площадь поверхности капли, f – угловая частота.ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Для описания адсорбции, поверхностного (межфазного) натяжения и реологических характеристик поверхностных слоев ПАВ мы использовали теоретическую модель, которая учитывает переориентацию молекул ПАВ и их сжимаемость в поверхностном слое. Реориентационная модель, предложенная Йоосом [52], предполагает, что молекула ПАВ может занимать в поверхностном слое различную площадь. Согласно принципу Ле Шателье–Брауна эта площадь, помимо геометрии молекул, определяется поверхностным давлением [52]: чем выше давление, тем меньше площадь. При этом переход молекулы из одного состояние в другое (с отличающейся площадью) не требует энергии активации.
Термодинамика этой модели была разработана в [53, 54]. Были сформулированы два варианта теории: 1) с большим числом состояний, характеризующихся разными значениями площади, 2) с двумя состояниями, которым отвечают минимальная (ω1) и максимальная (ω2) площади. Сравнение этих моделей показало [55, 56], что модель двух состояний без учета промежуточных согласуется с данными эксперимента не хуже, чем модель большого числа состояний. Во многих работах сравниваются расчеты по реориентационной модели и по моделям Ленгмюра и Фрумкина. Реориентационная модель лучше согласуется с экспериментальными данными по равновесию и кинетике адсорбции и реологии, чем указанные модели [57]. Реориентационная модель используется для различных ПАВ разными авторами, например, [58–60]. В последнем варианте теории была также учтена сжимаемость поверхностного слоя в состоянии с минимальной площадью [61, 62].
В данной работе представлены только основные уравнения реориентационной модели с учетом сжимаемости поверхностного слоя и потерь ПАВ на адсорбцию при использовании метода формы висячей капли [57].
Уравнение состояния поверхностного слоя имеет вид
(2)
$ - \frac{{\Pi {{{\omega }}_{0}}}}{{RT}} = \ln (1 - \Gamma {\omega }) + \Gamma ({\omega } - {{{\omega }}_{0}}) + a{{(\Gamma {\omega })}^{2}}.$Уравнения изотерм адсорбции в состояниях 1 и 2 записываются как
(3)
$bc = \frac{{{{{\Gamma }}_{{\text{1}}}}{{{\omega }}_{{\text{0}}}}}}{{{{{\left( {{\text{1}} - {\Gamma \omega }} \right)}}^{{{{{{{\omega }}_{{\text{1}}}}} \mathord{\left/ {\vphantom {{{{{\omega }}_{{\text{1}}}}} {{{{\omega }}_{{\text{0}}}}}}} \right. \kern-0em} {{{{\omega }}_{{\text{0}}}}}}}}}}}\exp \left( { - \frac{{{{{\omega }}_{{\text{1}}}}}}{{{{{\omega }}_{{\text{0}}}}}}(2a{\Gamma \omega })} \right),$(4)
$bc = \frac{{{{{\Gamma }}_{{\text{2}}}}{{{\omega }}_{{\text{0}}}}}}{{{{{{\text{(}}{{{{{\omega }}_{{\text{2}}}}} \mathord{\left/ {\vphantom {{{{{\omega }}_{{\text{2}}}}} {{{{\omega }}_{{\text{1}}}}}}} \right. \kern-0em} {{{{\omega }}_{{\text{1}}}}}}{\text{)}}}}^{{\alpha }}}{{{\left( {{\text{1}} - {\Gamma \omega }} \right)}}^{{{{{{{\omega }}_{{\text{2}}}}} \mathord{\left/ {\vphantom {{{{{\omega }}_{{\text{2}}}}} {{{{\omega }}_{{\text{0}}}}}}} \right. \kern-0em} {{{{\omega }}_{{\text{0}}}}}}}}}}}\exp \left( { - \frac{{{{{\omega }}_{{\text{2}}}}}}{{{{{\omega }}_{{\text{0}}}}}}(2a{\Gamma \omega })} \right).$Отношение величин адсорбции в двух состояниях равно:
(5)
$\frac{{{{\Gamma }_{1}}}}{{{{\Gamma }_{2}}}} = \frac{{{{{{\text{(}}{{{{{\omega }}_{{\text{1}}}}} \mathord{\left/ {\vphantom {{{{{\omega }}_{{\text{1}}}}} {{{{\omega }}_{{\text{2}}}}}}} \right. \kern-0em} {{{{\omega }}_{{\text{2}}}}}}{\text{)}}}}^{{\alpha }}}}}{{{{{\left( {{\text{1}} - {\Gamma \omega }} \right)}}^{{{{{\text{(}}{{{\omega }}_{{\text{2}}}} - {{{\omega }}_{{\text{1}}}}{\text{)}}} \mathord{\left/ {\vphantom {{{\text{(}}{{{\omega }}_{{\text{2}}}} - {{{\omega }}_{{\text{1}}}}{\text{)}}} {{{{\omega }}_{{\text{0}}}}}}} \right. \kern-0em} {{{{\omega }}_{{\text{0}}}}}}}}}}}\exp \left( { - \frac{{{\text{(}}{{{\omega }}_{{\text{2}}}} - {{{\omega }}_{{\text{1}}}}{\text{)}}}}{{{{{\omega }}_{{\text{0}}}}}}(2a{\Gamma \omega })} \right).$В уравнениях (2)–(5) Π = (γ0 − γ) – поверхностное давление, γ и γ0 – поверхностное натяжение раствора и растворителя соответственно, R – универсальная газовая постоянная, T – температура, b – константа адсорбционного равновесия, ω = = (ω1Γ1 + ω2Γ2)/Γ – средняя молярная площадь ПАВ, ω1 и ω2, Γ1 и Γ2 – молярные площади и адсорбции в состояниях 1 и 2, θ = ωΓ = ω1Γ1 + ω2Γ2 – степень заполнения монослоя ПАВ, Γ = Γ1 + Γ2 – суммарная адсорбция ПАВ, a – коэффициент межмолекулярного взаимодействия, α – параметр, учитывающий разную поверхностную активность молекул ПАВ в двух адсорбционных состояниях.
С учетом сжимаемости поверхностного слоя ПАВ молярная площадь в состоянии 1 описывается уравнением [61, 62]
где ω0 – молярная площадь при Π = 0, ε – коэффициент двумерного сжатия.В методе формы капли адсорбция ПАВ Γ на площади A, приводит после достижения равновесия к понижению его концентрации в капле (потери ПАВ на адсорбцию). Это обусловлено балансом массы ПАВ (M) в капле: $M = {{c}_{0}}V = cV + \Gamma A.$ Отсюда следует, что равновесная концентрация ПАВ в капле равна: $c = {{c}_{0}} - \left( {{A \mathord{\left/ {\vphantom {A V}} \right. \kern-0em} V}} \right)\Gamma ,$ где c0 – начальная концентрация ПАВ в капле.
Расчеты динамики адсорбции ПАВ были выполнены в предположении диффузионного механизма адсорбции путем решения уравнения Фика в сферических координатах:
где c = c(r, t) – концентрация в капле при времени t на расстоянии r от центра капли, D – коэффициент диффузии.Для сферически симметричной капли справедливы следующие граничные условия:
(8б)
${{\left. {\frac{{d\Gamma \left( t \right)}}{{dt}} = \,\quad - D\frac{{dc\left( {r,t} \right)}}{{dt}}} \right|}_{{r = {{r}_{0}}}}},$Детальное описание расчетов по диффузионной модели (7), (8) и программа расчетов представлены в работе [63].
Для расчета адсорбции на поверхности капли использовали уравнения (4)–(8) для динамических условий. Отметим, что при расчете потока ПАВ из объема капли учитывается уменьшение объемной концентрации. При достижении адсорбционного равновесия это дает равновесную концентрацию ПАВ в капле.
Дилатационный модуль $\left| E \right|$ характеризует вязкоупругие свойства поверхностных слоев ПАВ и учитывает все релаксационные процессы, влияющие на поверхностное натяжение γ. Он определяется как изменение поверхностного натяжения dγ при малом относительном изменении площади капли dA/A [64, 65]:
При сжатии капли поверхностное натяжение уменьшается, а при ее расширении – увеличивается.
Модуль $\left| E \right|$ выражается комплексным числом и включает реальную и мнимую компоненты: $E(i\Omega ) = {{E}_{{\text{r}}}} + i{{E}_{{\text{i}}}}.$ Реальная часть Er (упругость) отражает накопление энергии, а мнимая часть Ei – потери энергии в поверхностном слое вследствие релаксационных процессов (вязкость). Для диффузионного механизма адсорбции эти компоненты даются уравнениями [66, 67]
(10)
$\begin{gathered} {{E}_{{\text{r}}}}\left( \Omega \right) = {{E}_{0}}\frac{{1 + \zeta }}{{1 + 2\zeta + 2{{\zeta }^{2}}}}{\kern 1pt} , \\ {{E}_{{\text{i}}}}\left( \Omega \right) = {{E}_{0}}\frac{{1 + \zeta }}{{1 + 2\zeta + 2{{\zeta }^{2}}}}{\kern 1pt} , \\ \end{gathered} $Из уравнений (10) следуют выражения для модуля вязкоупругости $\left| E \right|$ и фазового угла φ между напряжением (dγ) и деформацией (dA) [66, 67]:
(11)
$\begin{gathered} \left| E \right| = {{E}_{0}}{{(1 + 2\zeta + 2{{\zeta }^{2}})}^{{ - {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},\,\,\,\,\varphi = {\text{arctg}}\left[ {{\zeta \mathord{\left/ {\vphantom {\zeta {{\text{(1}} + \zeta {\text{)}}}}} \right. \kern-0em} {{\text{(1}} + \zeta {\text{)}}}}} \right]. \\ \left| E \right| = \sqrt {E_{{\text{i}}}^{{\text{2}}} + E_{{\text{r}}}^{{\text{2}}}} ,\,\,\,\,\varphi = {\text{arctg}}\left( {{{E}_{{\text{i}}}}{\text{/}}{{E}_{{\text{r}}}}} \right). \\ \end{gathered} $Уравнения (10) и (11) описывают релаксационные процессы на плоской поверхности. Уравнения для капли и пузырька были получены Йоосом [52]. В случае адсорбции ПАВ из объема на поверхность капли уравнение для модуля вязкоупругости имеет следующий вид:
(12)
$E(\Omega ) = {{E}_{0}}{{\left\{ {1 - i\frac{D}{{\Omega {{r}_{0}}}}\frac{{dc}}{{d\Gamma }}\left[ {nR\operatorname{cth} \left( {n{{r}_{0}}} \right) - 1} \right]} \right\}}^{{ - 1}}},$Программа расчетов по уравнениям (11) величин модуля вязкоупругости и фазового угла по экспериментальным данным приведена в работе [55].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
1. Тензиометрические характеристики поверхностных слоев имидазолиевых оксимов
На рис. 2 приведены зависимости динамического поверхностного натяжения растворов дикатионного оксима (метод формы капли) от концентрации. Для концентраций <10 мкмоль/л требуется не менее 105 с для достижения равновесия. Пунктирные кривые на рис. 2 являются результатами расчетов динамического поверхностного натяжения для домицеллярных растворов (CПАВ < ККМ), выполненных по уравнениям (2)–(5) и (7), (8).
Рис. 2.
Зависимость динамического поверхностного натяжения (γ) растворов дикатионного оксима от времени (метод формы капли). Концентрация ПАВ, мкмоль/л (×10–6 моль/л): 1 – 2.0, 2 – 5.0, 3 – 7.0, 4 – 20.0, 5 – 50.0, 6 – 500.0. Пунктирные кривые – расчет γ для домицеллярных растворов.

На рис. 3 приведены зависимости динамического поверхностного натяжения растворов монокатионного оксима имидазолиевой соли от времени. Пунктирные кривые также рассчитаны по уравнениям (2)–(5) и (7), (8).
Рис. 3.
Зависимость динамического поверхностного натяжения (γ) растворов монокатионного оксима от времени (метод формы капли). Концентрация ПАВ, мкмоль/л (×10–6, моль/л): 1 – 2.0, 2 – 5.0, 3 – 50.0, 4 – 500.0. Пунктирные кривые – расчет γ для домицеллярных растворов.

Параметры, рассчитанные по реориентационной модели (уравнения (2)–(5)), представлены в табл. 1. Если сравнить значения параметров для двух исследуемых ПАВ, то, как и следовало ожидать, значения молярных площадей ω1 и ω2, которые может занимать ПАВ в состояниях 1 и 2, выше для дикатионного оксима. Для дикатионного ПАВ в 4 раза выше значение константы адсорбционного равновесия b, а значение параметра α меньше, чем для монокатионного оксима. При этом коэффициент межмолекулярного взаимодействия a для этих двух ПАВ одинаков. Такое поведение, очевидно, связано с различиями в структуре молекул монокатионного и дикатионного ПАВ, с их способностью к адсорбции и ориентации в поверхностном слое.
Таблица 1.
Параметры реориентационной модели
| ПАВ | ω1, 105 м2/моль | ω2, 105 м2/моль | α | a | b, л/моль | ε, м/мН | D, м2/с |
|---|---|---|---|---|---|---|---|
| Дикатионный оксим | 5.3 | 10.6 | 1.4 | 0.8 | 5.4 × 107 | 0.006 | 3 × 10–11 |
| Монокатионный оксим | 4.5 | 9.0 | 2.0 | 0.8 | 1.3 × 107 | 0.007 | 10–10 |
Данные о динамике формирования поверхностных слоев имидазолиевых оксимов были использованы для оценки коэффициентов диффузии этих ПАВ путем сопоставления теории и эксперимента. Значения коэффициентов диффузии D рассчитаны по уравнениям (7), (8) (табл. 1). Для дикатионного оксима D = 3 × 10–11 м2/с, что ниже значений, характерных для диффузионного механизма адсорбции. Это указывает на отличающийся от чисто диффузионного механизм адсорбции дикатионного оксима, при котором скорость установления равновесия между поверхностным и приповерхностным слоями существенно меньше скорости диффузии ПАВ к поверхности. Теория [68] позволяет рассчитать (при использовании недиффузионной и реориентационной моделей) константу скорости адсорбции ПАВ по данным о кинетике и равновесии адсорбции и реологии поверхностных слоев, но мы оставляем это на будущее. Для монокатионного оксима величина D = 10–10 м2/с примерно соответствует диффузионному механизму адсорбции на границе фаз жидкость–газ [69, 70].
Заниженные значения коэффициента диффузии для дикатионного оксима (D = 3 × 10–11 м2/с), очевидно, обусловлены не только его более высокой молекулярной массой, но и наличием более гидрофобного фрагмента в составе молекулы по сравнению с мономерным аналогом. Отметим, что уравнения Ленгмюра или Фрумкина неудовлетворительно описывают динамику, равновесие и реологию растворов оксимов, а также других ПАВ, как показано на примере растворов оксиэтилированных ПАВ [68].
Изотермы равновесного поверхностного натяжения, полученные методами формы капли и кольца Дю Нуи для дикатионного оксима (1, 3) и монокатионного оксима (2, 4) приведены на рис. 4. Кривые 1 и 2 (сплошные линии) на этом рисунке – это зависимости γ = f(CПАВ), рассчитанные по реориентационной модели (2)–(5) с использованием параметров, приведенных в табл. 1, и учетом потерь массы ПАВ на адсорбцию (CПАВ – начальная концентрация ПАВ в капле). Кривые 3 и 4 на рис. 4 (пунктирные линии) получены так же, как и кривые 1 и 2, но являются зависимостями γ от равновесной концентрации ПАВ с учетом потери массы ПАВ на адсорбцию. Экспериментальные результаты, полученные методом кольца Дю Нуи, хорошо согласуются с расчетными кривыми 3 и 4 для метода формы капли.
Рис. 4.
Изотермы γ = f(CПАВ), полученные методами формы капли (1, 2) и кольца Дю Нуи (3, 4) для дикатионного оксима (1, 3) и монокатионного оксима (2, 4). Пояснения в тексте.

Различие результатов, полученных методами формы капли и кольца Дю Нуи, обусловлено неодинаковой геометрией объектов, главным образом, – отношением объема исследуемого раствора к его площади. В методе формы капли это отношение равно 0.5 мм (объем капли V = 17 мм3, площадь ее поверхности S = 33 мм2). В методе кольца Дю Нуи исследуемый объем равен объему слоя раствора ПАВ, в которую погружается кольцо, а площадь раствора ПАВ – это площадь поверхности ванны. Это отношение примерно в 100 раз больше, чем в методе формы капли. Таким образом, можно считать, что потерь ПАВ на адсорбцию в методе кольца Дю Нуи практически нет.
Как следует из данных, приведенных на рис. 4, поверхностная активность исследуемых ПАВ достаточно высока. Рассчитанные по экспериментальным данным значения ККМ равны 1.1 × × 10–6 моль/л для дикатионного оксима и 2.5 × × 10–5 моль/л – для монокатионного оксима.
Для определения изменения поверхностного натяжения растворов имидазолиевых оксимов в области малых времен (от 0.01 с) были получены зависимости γ = f(CПАВ) на границе фаз жидкость–газ методом максимального давления в газовом пузырьке (тензиометр ВРА-1S). Поверхностное натяжение растворов монокатионного оксима, измеренное этим методом, снижается даже в области очень небольших времен (рис. 5a) и близко к значениям γ, измеренным методом формы капли (рис. 3). То есть в диапазоне малых времен методы формы капли и максимального давления в пузырьке дают сопоставимые результаты. В случае дикатионного оксима (рис. 5б) имеет место незначительное снижение поверхностного натяжения в области малых времен, что также согласуется с данными, полученными методом формы капли (рис. 2).
2. Реологические характеристики поверхностных слоев имидазолиевых оксимов
На рис. 6 приведены зависимости модуля вязкоупругости от концентрации оксимов при частоте осцилляций капли 0.1 Гц и их амплитуде 6%. Максимальные значения модуля вязкоупругости для растворов дикатионного оксима примерно в 2 раза больше, чем для монокатионного оксима. Кривые рассчитаны по уравнениям модели (2)–(5) с использованием уравнения (12). Расчетные кривые $\left| E \right|$ = f(CПАВ) имеют небольшой максимум. Появление максимума может быть обусловлено следующим. С ростом концентрации ПАВ модуль вязкоупругости увеличивается благодаря увеличению скачка поверхностного натяжения при осцилляциях. При дальнейшем увеличении концентрации ПАВ эффект изменения поверхностного натяжения при осцилляциях не изменяется или даже уменьшается. Поэтому в последнем случае величина модуля вязкоупругости может иметь небольшой максимум.
Рис. 6.
Зависимости модуля вязкоупругости (Е) от концентрации ПАВ, полученные методом формы капли (частота – 0.1 Гц, амплитуда – 6%): 1 –дикатионный оксим, 2 – монокатионный оксим. Линии – расчет в рамках реориентационной модели адсорбции ПАВ.

Значения модуля вязкоупругости для дикатионного оксима превышают максимальные значения величины $\left| E \right|$ для некоторых мономерных, димерных ПАВ и смесей ПАВ (табл. 2), выбранных в качестве примеров. При этом были использованы литературные данные для частоты 0.1 Гц.
Таблица 2.
Экспериментальные значения максимальных значений модуля вязкоупругости для различных ПАВ на границе фаз жидкость–газ
| Поверхностно-активное вещество | Модуль вязкоупругости, ${{\left| E \right|}_{{\max }}}$, мН/м |
|---|---|
| Дикатионный оксим | 120 |
| Монокатионный оксим | 60 |
| Цетилтриметиламмония бромид | 60 |
| 1,2-Этан-бис(диметилдодециламмония бромид) | 60 [71] |
| C14Н29(ОСН2СН2)8, C12Н25(ОСН2СН2)5, С10Н21(ОСН2СН2)8 | 60, 40, 20 [72, 73] |
| Цетилглицидиловый эфир глицин-бетаина | 40 [74] |
| Альбумин | 70 [75] |
| Смесь желатина с имидазолиевым (Im) димерным ПАВ, [C12Н25–Im–(СН2)4–Im–C12Н25]Br2 | 100 [76] |
В работах [71, 72] установлено, что модуль вязкоупругости зависит от амплитуды осцилляции капли. На примере поверхностных слоев различных белков показано, что если значение модуля вязкоупругости больше 40 мН/м, то параметр $\left| E \right|$ уменьшается при увеличении амплитуды осцилляции в диапазоне от 1 до 18%.
На рис. 7 и 8 приведены зависимости модуля вязкоупругости от амплитуды осцилляции капли с частотой 0.1 Гц для растворов дикатионного и монокатионного оксимов. Как следует из этих рисунков, величина модуля вязкоупругости уменьшается с ростом амплитуды осцилляции, когда величина $\left| E \right|$ превышает 50 мН/м. Однако при низких значениях модуля вязкоупругости, как и в работе [72], величина $\left| E \right|$ практически не изменяется с ростом амплитуды колебаний капли, т.е. при низких значениях модуля вязкоупругости нелинейность отклика (изменения поверхностного натяжения) на деформацию отсутствует. Влияние нелинейности отклика на деформацию поверхностных слоев ПАВ будет рассмотрено в следующих работах.
Рис. 7.
Зависимости модуля вязкоупругости (Е) от амплитуды осцилляции капли (ΔА) (f = 0.1 Гц) для растворов дикатионного оксима с концентрацией ПАВ, мкмоль/л (×10–6 моль/л): 1 – 20.0, 2 – 7.0, 3 – 5.0, 4 – 4.0, 5 – 3.0, 6 – 2.0.
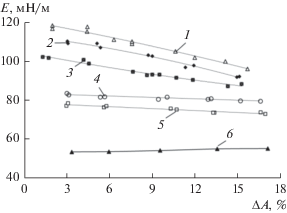
Рис. 8.
Зависимости модуля вязкоупругости (Е) от амплитуды осцилляции площади капли (ΔА) (f = 0.1 Гц) для растворов монокатионного оксима с концентрацией ПАВ, мкмоль/л (×10–6 моль/л): 1 – 50.0, 2 – 20.0, 3 – 5.0, 4 – 2.0, 5 – 1.0, 6 – 0.5.

Такое поведение может быть связано с ориентацией молекул ПАВ в поверхностном слое и степенью их взаимодействия между собой. Так, в работе [73] показано, что молекулы гибкоцепного белка (β-казеина) в большей степени реагируют на поверхностное давление и осцилляции площади, чем молекулы глобулярного белка (β-лактоглобулина), структура поверхностного слоя которых не изменяется при увеличении амплитуды осцилляции капли.
Следует отметить, что выяснение причин снижения величины модуля вязкоупругости поверхностных слоев различных ПАВ с ростом амплитуды осцилляции требует специальных исследований.
Зависимости модуля вязкоупругости от частоты осцилляции площади капли в диапазоне от 0.01 до 1.0 Гц при постоянном значении амплитуды осцилляции (6%) для обоих оксимов приведены на рис. 9. С ростом частоты осцилляции для растворов дикатионного оксима значения модулей вязкоупругости и упругости (реальная компонента) возрастают, а значения фазового угла и модуля вязкости (мнимая компонента) резко падают. Для монокатионного оксима величины $\left| E \right|,$ Еr, Еi и φ возрастают при увеличении частоты осцилляции капли.
Рис. 9.
Зависимости модулей вязкоупругости ($\left| E \right|$), упругости (Еr) и вязкости (Еi) и фазового угла (φ) от частоты осцилляций (f) капель растворов дикатионного оксима (сплошные линии) и монокатионного оксима (пунктирные линии). CПАВ = 10–4 моль/л. Амплитуда осцилляций – 6%.

Как указывалось выше, высокие значения модуля вязкоупругости для дикатионного оксима могут быть связаны со способностью его молекул к образованию прочных поверхностных слоев. Вследствие низкого значения коэффициента диффузии дикатионного оксима величина модуля вязкоупругости близка к величине максимальной (предельной) упругости E0. Физически эта величина соответствует предельно большой частоте осцилляции капли при отсутствии обмена ПАВ между объемом раствора и адсорбционным слоем. При этом количество адсорбированного ПАВ (суммарное на всю площадь капли) остается неизменным при осцилляциях капли. Другой предельный случай – это полное отсутствие вязкоупругости, т.е. ситуация, когда E0 = 0. Физически это возможно при очень медленных осцилляциях и 100%-ном обмене молекулами ПАВ между объемом и поверхностью, т.е. при условии неизменной адсорбции на единицу площади поверхности капли при ее осцилляциях. Величина E0 зависит от параметров изотермы адсорбции. Расчеты по модели (2)–(5) показывают, что величина E0 возрастает при увеличении параметров b, ω1, a и α и уменьшается с ростом ω2. Это значит, что величина модуля вязкоупругости может изменяться в широких пределах в зависимости от действия различных факторов.
В работах [74, 75] показано, что свойства адсорбционных пленок ПАВ определяются не только концентрацией молекул в поверхностном слое, но и их расположением и способностью к ориентации на межфазной поверхности. Так, межмолекулярные взаимодействия гидрофобных разветвленных алкильных заместителей бетаиновых молекул способны усиливаться в поверхностном слое и, тем самым, способствовать росту динамического модуля вязкоупругости [74].
Объяснение высокой поверхностной активности димерных ПАВ‑близнецов заключается в предположении о специфической ориентации гидрофобных и гидрофильных фрагментов, а именно, на межфазной границе молекулы могут “складываться” таким образом, что алкильные “хвосты” оказываются вытянутыми параллельно друг другу, а заряженные фрагменты образуют квазиединую головную группу [76, 77].
В литературе имеются сведения о возможной взаимосвязи между структурой мостиковых фрагментов различных димерных ПАВ, в том числе функционализированных, и свойствами поверхностных слоев этих ПАВ. Структура мостикового фрагмента может влиять на ориентацию как полярной головной группы, так и гидрофобных алкильных групп. Авторами [12, 13] отмечено, что физико-химические свойства димерных ПАВ в значительной степени зависят от размера и структуры мостикового фрагмента. При этом изменение структуры этого фрагмента может приводить к появлению различных внутри- или межмолекулярных взаимодействий, которые оказывают влияние на поведение димерных ПАВ в объеме раствора и на границе фаз. В работе [78] показано, что значительное влияние на свойства адсорбционных пленок оказывает конфигурация мостикового фрагмента в составе димерных ПАВ.
Известно, что в отсутствие растворителя имидазолиевые дикатионы весьма сильно взаимодействуют с противоионами [79], а в растворах – с донорами и акцепторами водородной связи [80]. Солеобразный дихлорид оксима не может существовать в водном растворе в виде свободных ионов. В воде дикатион оксима сольватирован молекулами растворителя, в первую очередь, за счет водородных связей. Склонность имидазолиевых катионов к образованию водородных связей типа C–H…An– хорошо известна [80–82]. В водном растворе ионный агрегат образован, очевидно, гидратированным катионом и гидратированными анионами хлора. В этой рыхлой структуре вклад внутримолекулярных водородных связей становится несущественным, поскольку все потенциальные доноры и акцепторы водородной связи вовлечены во взаимодействие с молекулами воды.
Следует отметить, что влияние структуры мостикового фрагмента на свойства диимидазолиевых ПАВ изучено преимущественно на примере углеводородных полиметиленовых цепочек [79, 83–87], причем основное внимание уделялось термодинамическим и спектральным свойствам самих ПАВ и мицеллообразованию в их растворах. При этом было установлено, что сравнительно небольшие изменения в строении имидазолиевых солей на молекулярном уровне оказывают существенное влияние как на их пространственную организацию в кристалле [88], так и на свойства надмолекулярных агрегатов в растворе [89–91].
Одним из факторов, который способен влиять на свойства имидазолиевых дикатионных ПАВ, может быть замена конформационно подвижного метиленового звена в мостиковом фрагменте, включающего sp3‑гибридизованный атом углерода, на более жесткий фрагмент, содержащий sp2‑гибридизованный атом углерода. К настоящему времени число исследований по влиянию гибридизации атома углерода в составе мостикового фрагмента на строение и свойства дикатионных имидазолиевых солей крайне ограничено [3, 26].
Гидрофильной функциональной группой в исследуемом дикатионном имидазолиевом ПАВ является двузамещенная гидроксимино-группа –(Im+–CH2–C(=NOH)–CH2–Im+)–, где Im+ – имидазолиевый цикл. В составе мостикового фрагмента имеется sp2-гибридизованный атом углерода, который придает определенную жесткость конструкции мостика дикатионного оксима. В работах [92–94] показано, что структура центрального фрагмента дикатионного оксима не подвержена влиянию растворителя (вода, уксусная кислота, диметилсульфоксид, диметилацетамид) и температуры (в интервале 20–80°С), что указывает на устойчивость (консервативность) структуры центрального фрагмента молекулы дикатионного оксима к действию различных факторов.
Можно предположить, что при образовании поверхностного слоя молекулы дикатионного оксима будут способны к более сильным взаимодействиям с участием цетильных групп в силу специфики строения мостикового фрагмента и за счет реориентации (переориентации) молекул, чем молекулы монокатионного оксима. С этим могут быть связаны высокие значения модулей вязкоупругости и упругости растворов дикатионного оксима на границе фаз жидкость–газ, а также особенности влияния амплитуды и частоты осцилляции капли на величину модуля вязкоупругости поверхностных слоев.
ВЫВОДЫ
1. Показана более высокая поверхностная активность дикатионного оксима (дихлорида 1,3-бис(3'-цетилимидазолий-1'-ил)-2-оксиминопропана) по сравнению с монокатионным оксимом (хлоридом 1-(2'-оксиминопропил)-3-цетилимидазолия) на границе фаз жидкость–газ при исследовании динамического и равновесного поверхностного натяжения их водных растворов методами кольца Дю Нуи, формы висячей капли и максимального давления в пузырьке.
2. Выявлена высокая поверхностная вязкоупругость растворов дикатионного оксима. Установлены зависимости модуля вязкоупругости и фазового угла от амплитуды и частоты осцилляций поверхности капли для растворов дикатионного и монокатионного оксимов при использовании метода осциллирующей висячей капли.
3. Доказано, что экспериментальные зависимости динамического поверхностного натяжения и реологических параметров поверхностных слоев имидазолиевых оксимов хорошо описываются с помощью модели, которая учитывает переориентацию молекул в поверхностном слое.
4. Анализ динамики формирования поверхностных слоев имидазолиевых оксимов в рамках реориентационной модели показал, что для дикатионного оксима возможен отличный от диффузионного механизм адсорбции на межфазной границе жидкость–газ, а адсорбция монокатионного оксима протекает по диффузионному механизму.
Список литературы
Menger F.M., Littau C.A. // J. Am. Chem. Soc. 1993. V. 115. P. 10083.
Rosen M.J., Tracy D.J. // J. Surfact. Deterg. 1998. V. 1. P. 547.
Menger F.M., Keiper J. // Angew. Chem. Int. Ed. 2000. V. 39. P. 1906.
Menger F.M., Keiper J.S., Azov V. // Langmuir. 2000. V. 16. P. 2062.
Hait S.K., Moulik S.P. // Current Sci. 2002. V. 82. P. 1101.
Sekhon B.S. // Reson. 2004. V. 9. № 3. P. 42.
Kamal M.S. // J. Surfact. Deterg. 2016. V. 19. P. 23.
Wang M., Wu C., Tang Y., Fan Y., Han Y., Wang Y. // Soft Matter. 2014. V. 10. P. 3432.
Burakova E.A., Saranina I.V., Tikunova N.V., Nazarkina Z.K., Laktionov P.P., Karpinskaya L.A., Ani-kin V.B., Zarubaev V.V., Silnikov V.N. // Bioorganic Med. Chem. 2016. V. 24. P. 6012.
Hegazy M.A., Abd El-Rehim S.S., Badr E.A., Kamel W.M., Youssif A.H. // J. Surfact. Deterg. 2015. V. 18. P. 1033.
Tariq M., Freire M.G., Saramago B., Coutinho J.A.P., Canongia Lopes J.N., Rebelo L.P.N. // Chem. Soc. Rev. 2012. V. 41. P. 829.
Fan Y.-X., Han Y.-C., Wang Y.-L. // Acta Phys.-Chim. Sin. 2016. V. 32. P. 214.
Wang P., Pei S., Wang M., Yan Y., Sun X., Zhang J. // Phys. Chem. Chem. Phys. 2017. V. 19. P. 4462.
Sood R., Alakoskela J.-M., Sood A., Vitovi P., Kinnunen P.K.J. // J. Appl. Sol. Chem. Model. 2012. V. 1. P. 13.
Sharma R., Kamal A., Abdinejad M., Mahajan R.K., Kraatz H.-B. // Adv. Colloid Interface Sci. 2017. V. 248. P. 35.
Gemini Surfactants: Synthesis, Interfacial and Solution-Phase Behavior, and Applications / Ed. by Zana R., Xia J. New-York: Marcel Dekker, 2003.
Patel U., Parekh P., Sastry N.V., Aswal V.K., Bahadur P. // J. Mol. Liq. 2017. V. 225. P. 888.
Choi T.-S., Shimizu Y., Shirai H., Hamada K. // Dyes Pigm. 2000. V. 45. P. 145.
Hegazy M.A., El-Tabei A.S. // J. Surfact. Deterg. 2013. V. 16. P. 221.
Mobin M., Masroor S. // Int. J. Electrochem. Sci. 2012. V. 7. P. 6920.
Moshe M.B., Magdassi S., Cohen Y., Avram L. // J. Colloid Interface Sci. 2004. V. 276. P. 221.
Kunieda H., Kaneko M., Feng J., Tsubone K. // J. Oleo Sci. 2002. V. 51. P. 761.
Guerrero-Martınez A., Perez-Juste J., Carbo-Argibay E., Tardajos G., Liz-Marzan L.M. // Angew. Chem. Int. Ed. 2009. V. 48. P. 9484.
Veronovski N., Andreozzi P., La Mesa C., Sfiligoj-Smole M., Ribitsch V. // Colloid Polym. Sci. 2010. V. 288. P. 387.
Wang Q., Han Y., Wang Y., Qin Y., Guo Z.-X. // J. Phys. Chem. B. 2008. V. 112. P. 7227.
Dong K., Liu X., Dong H., Zhang X., Zhang S. // Chem. Rev. 2017. V. 117. P. 6636.
Canongia Lopes J.N., Padua A.A. // J. Phys. Chem. B. 2006. V. 110. P. 3330.
Hayes R., Warr G.G., Atkin R. // Chem. Rev. 2015. V. 115. P. 6357.
Myers D. Surfactant Science and Technology. Hoboken: Wiley & Sons, 2006.
Zakharova L.Ya., Mirgorodskaya A.B., Zhiltsova E.P., Kudryavtseva L., Konovalova A. // Molecular Encapsulation: Organic Reactions in Constrained Systems / Ed. by Brinker U.H., Mieusset J.-L. New-York: Wiley, 2010. P. 397.
Milton M.D., Garg P. // Appl. Organomet. Chem. 2016. V. 30. P. 727.
Прокопьева Т.М., Капитанов И.В., Белоусова И.А. Шумейко А.Е., Кострикин М.Л., Сердюк А.А., Туровская М.К., Разумова Н.Г. // Журн. орг. химии. 2017. Т. 53. С. 503.
Mirgorodskaya A.B., Zakharova L.Ya., Khairutdinova E.I., Lukashenko S.S., Sinyashin O.G. // Colloids Surf. A. 2016. V. 510. P. 33.
Wettig S.D., Wang C., Verrall R.E., Foldvari M. // Phys. Chem. Chem. Phys. 2007. V. 7. P. 871.
Sheikh Mohmad S., Khanam Ahmad J., Matto Rayees-ul H., Kabir-ud-Din // J. Surfact. Deterg. 2013. V. 16. P. 503.
Fatma N., Panda M., Kabir-ud-Din, Beg M. // J. Mol. Liq. 2016. V. 222. P. 390.
Wettig S.D., Nowak P., Verrall R.E. // Langmuir. 2002. V. 18. P. 5354.
Pei X., Zhang Q., Liu Z., Song B., Li R., Zhao J., Cui Z. // Colloid Polym. Sci. 2016. V. 294. P. 1405.
Bhadani A., Tani M., Endo T., Sakai K., Abe M., Sakai H. // Phys. Chem. Chem. Phys. 2015. V. 17. P. 19 474.
Sunitha S., Reddy P.S., Prasad R.B.N., Kanjilal S. // Eur. J. Lipid Sci. Technol. 2011. V. 113. P. 756.
Akram M., Ansari F., Bhat I.A., Chaturvedi S.K., Khan R.H., Kabir-ud-Din // Colloids Surf. A. 2017. V. 516. P. 245.
Mir M.U.H., Maurya N., Beg I., Khan A.B., Patel R. // Colloids Surf. A. 2016. V. 507. P. 36.
Капитанов И.В., Белоусова И.А., Шумейко А.Е., Кострикин М.Л., Прокопьева Т.М., Попов А.Ф. // Журн. орг. химии. 2013. Т. 49. С. 1308.
Gindri I.M., Siddiqui D.A., Bhardwaj P., Rodriguez L.C., Palmer K.L., Frizzo C.P., Martins M.A.P., Rodrigues D.C. // RSC Adv. 2014. V. 4. P. 62594.
Masri A.N., Mi A.M., Leveque J.M. // Ind. Eng. Manage. 2016. V. 5. P. 197.
Прокопьева Т.М., Капитанов И.В., Белоусова И.А., Шумейко А.Е., Кострикин М.Л., Туровская М.К., Разумова Н.Г., Попов А.Ф. // Журн. орг. химии. 2015. Т. 51. С. 1105.
Садовский Ю.С., Соломойченко Т.Н., Туровская М.К., Капитанов И.В., Пискунова Ж.П., Кострикин М.Л., Прокопьева Т.М., Попов А.Ф. // Теор. эксперим. химия. 2012. Т. 48. С. 112.
Miller R., Makievski A.V., Fainerman V.B. // Surfactants – Chemistry, Interfacial Properties and Application / Ed. by Fainerman V.B., Möbius D., Miller R. Amsterdam: Elsevier, 2001. Studies in Interface Science. V. 13. P. 287.
Русанов А.И., Прохоров В.А. Межфазная тензиометрия. СПб: Химия, 1994.
Loglio G., Pandolfini P., Miller R., Makievski A.V., Ravera F., Ferrari M., Liggieri L. Novel Methods to Study Interfacial Layers. Amsterdam: Elsevier, 2001.
Zholob S.A., Makievski A.V., Miller R., Fainerman V.B. // Adv. Colloid Interface Sci. 2007. V. 322. P. 134.
Joos P. Dynamic Surface Phenomena. Utrecht: VSP, 1999.
Fainerman V.B., Miller R., Wüstneck R., Makievski A.V. // J. Phys. Chem. 1996. V. 100. P. 7669.
Fainerman V.B., Miller R., Wüstneck R. // J. Phys. Chem. 1997. V. 101. P. 6479.
Fainerman V.B., Lylyk S.V., Aksenenko E.V., Makievski A.V., Ravera F., Petkov J.T., Yorke J., Miller R. // Colloids Surf. A. 2009. V. 334. P. 16.
Fainerman V.B., Zholob S.A., Lucassen-Reynders E.H., Miller R. // J. Colloid Interface Sci. 2003. V. 261. P. 180.
Fainerman V.B., Miller R. // Adsorption Isotherms at Liquid Interfaces. Encyclopedia of Surface and Colloid Science / Ed. by Somasundaran P., Hubbard A. London: Taylor & Francis, 2009. V. 1. P. 1.
Lee Y.-C., Liu H.-S., Lin S.-Y. // Colloids Surf. A. 2003. V. 212. P. 123.
Ritacco H.A., Busch J. // Langmuir. 2004. V. 20. P. 3648.
Valenzuela M.A., Garate M.P., Olea A.F. // Colloids Surf. A. 2007. V. 307. P. 28.
Fainerman V.B., Kovalchuk V.I., Aksenenko E.V., Michel M., Leser M.E., Miller R. // J. Phys. Chem. B. 2004. V. 108. P. 13700.
Fainerman V.B., Miller R., Kovalchuk V.I. // Langmuir. 2002. V. 18. P. 7748.
Fainerman V.B., Lylyk S.V., Aksenenko E.V., Liggieri L., Makievski A.V., Petkov J.T., Yorke J., Miller R. // Colloids Surf. A. 2009. V. 334. P. 8.
Ravera F., Liggieri L., Loglio G. // Progress in Colloid and Interface Science. V. I. Interfacial Rheology / Ed. by Miller R., Liggieri L. Boca Raton: Taylor and Francis Group, 2009. P. 137.
Zholob S.A., Kovalchuk V.I., Makievski A.V., Kragel J., Fainerman V.B., Miller R. // Progress in Colloid and Interface Science. V. I. Interfacial Rheology / Ed. by Miller R., Liggieri L. Boca Raton: Taylor and Francis Group, 2009. P.77.
Lucassen J., Van den Tempel M. // Chem. Eng. Sci. 1972. V. 27. P. 1283.
Lucassen J., Hansen R.S. // J. Colloid Interface Sci. 1967. V. 23. P. 319.
Miller R., Aksenenko E.V., Fainerman V.B. // Adv. Colloid Interface Sci. 2017. V. 247. P. 115.
Ward A.F.H., Tordai L. // J. Chem. Phys. 1946. V. 14. P. 543.
Miller R., Fainerman V.B., Aksenenko E.V., Leser M.E., Michel M. // Langmuir. 2004. V. 20. P. 771.
Wan Z., Yang X., Sagis L.M.C. // Langmuir. 2016. V. 32. P. 3679.
Benjamins J. Static and Dynamic Properties of Proteins Adsorbed at Liquid Interfaces // Dissertation, externally prepared. Wageningen: Wageningen University. The Netherlands. 2000. 213 p. http://edepot.wur.nl/.
Fainerman V.B., Kovalchuk V.I., Aksenenko E.V., Zinkovych I.I., Makievski A.V., Nikolenko M.V., Miller R. // Langmuir. 2018. V. 34. P. 6678.
Zhou Z.-H., Ma D.-S., Zhang Q., Wang H.-Z., Zhang L., Luan H.-X., Zhu Y., Zhang L. // Colloids Surf. A. 2018. V. 538. P. 739.
Pei X., Zhang Q., Liu Z., Song B., Li R., Song B., Li R., Zhao J., Cui Z. // Colloid Polym. Sci. 2016. V. 294. P. 1405.
Fuhrhop J.-H., Wang T. // Chem. Rev. 2004. V. 104. P. 2901.
Pal A., Datta S., Aswal V.K., Bhattacharya S. // J. Phys. Chem. B. 2012. V. 116. P. 13239.
Pei X., Zhang Q., Liu Z., Song B., Li R., Zhao J., Cui Z. // Colloid Polym. Sci. 2016. V. 294. P. 1405.
Hennemann B.L., Bender C.R., Salbego P.R.S., Meyer A.R., Belladona A.L., Zanatta N., Bonacorso H.G., Villetti M.A., Martins M.A.P., Frizzo C.P. // J. Mol. Liq. 2018. V. 252. P. 184.
Noujeim N., Leclercq L., Schmitzer A.R. // Curr. Org. Chem. 2010. V. 14. P. 1500.
Dhumal R., Noack K., Kiefer J., Kim H.J. // J. Phys. Chem. A. 2014. V. 118. P. 2547.
Yamada T., Tominari Y., Tanaka S., Mizuno M. // J. Phys. Chem. B. 2017. V. 121. P. 3121.
Anderson J.L., Ding R.F., Ellern A., Armstrong D.W. // J. Am. Chem. Soc. 2005. V. 127. P. 593.
Frizzo C., Gindri I.M., Bender C.R., Marcos A.Z.T., Villetti A., Rodrigues D.C., Machado G., Martins M.A.P. // Colloids Surf. A. 2015. V. 468. P. 285.
Moosavi M., Khashei F., Sharifi A., Mirzaei M. // J. Chem. Thermodyn. 2017. V. 107. P. 1.
Pal A., Datta S., Aswal V.K., Bhattacharya S. // J. Phys. Chem. B. 2012. V. 116. P. 13239.
Ding Y.S., Zha M., Zhang J., Wang S.S. // Colloids Surf. A. 2007. V. 298. P. 201.
Ozawa R., Hayashi S., Saha S., Kobayashi A., Hamaguchi H.-O. // Chem. Lett. 2003. V. 32. P. 948.
Singh T., Kumar A. // J. Phys. Chem. B. 2007. V. 12. P. 7843.
Shi L., Zheng L. // J. Phys. Chem. B. 2012. V. 116. P. 2162.
Frizzo C.P., Bender C.R., Gindri I.M., Villetti M.A., Machado G., Bianchi O., Martins M.A.P. // J. Phys. Chem. C. 2016. V. 120. P. 14402.
Гребенюк С.А., Хилько С.Л., Прокопьева Т.М., Михайлов В.А. // Вестник ДонНУ. Сер. А. 2018. № 1. С. 76.
Гребенюк С.А., Хилько С.Л., Прокопьева Т.М., Михайлов В.А. // Вестник ДонНУ. Сер. А. 2018. № 2. С. 62.
Заречная О.М., Гребенюк С.А., Хилько С.Л., Михайлов В.А. // Сб. статей XXIV Всероссийской конференции “Структура и динамика молекулярных систем” М.: Изд. центр ИФХЭ РАН, 2017. С. 111.
Дополнительные материалы отсутствуют.
Инструменты
Коллоидный журнал





