Химия твердого топлива, 2019, № 5, стр. 20-29
МОЛЕКУЛЯРНОЕ МОДЕЛИРОВАНИЕ КОНКУРИРУЮЩЕЙ АДСОРБЦИИ МЕТАНА И УГЛЕКИСЛОГО ГАЗА В МАТРИЦЕ УГЛЯ В ПРИСУТСТВИИ ВОДЫ
Хань Цзиньсюань 1, *, Лу Яньцзюнь 1, **, Е. Ю. Макарова 1, ***, А. Х. Богомолов 1, ****, Ян Чжаочжун 2, *****
1 ФГБОУ ВО “Московский государственный университет имени М.В. Ломоносова”, Геологический факультет
119991 Москва, Россия
2 Юго-западный нефтяной университет, главная государственная лаборатория геологии
и разработки залежей нефти и газа
610500 Чэнду, Китай
* E-mail: pulinsd@mail.ru
** E-mail: hmsu@mail.ru
*** E-mail: lenamakarova87@yandex.ru
**** E-mail: nvproncl@geol.msu.ru
***** E-mail: yzzycl@vip.sina.com
Поступила в редакцию 15.01.2018
После доработки 25.04.2019
Принята к публикации 03.06.2019
Аннотация
Рассмотрено молекулярное моделирование конкурирующей адсорбции CH4/CO2 в углях в присутствии воды. Показано, что синергетический эффект стенок микропор оказывает значительное влияние на пространственное распределение адсорбатов и молекулы воды могут мешать беспрепятственной диффузии и адсорбции CO2 и CH4 в пустотном пространстве угля. Углекислой газ легче адсорбируется в микропорах, чем метан при конкурирующей адсорбции. Изменение избыточной адсорбируемости связано с разностью плотности между адсорбированной и объемной фазами. По сравнению с плотностью метана, изменение плотности углекислого газа оказывает влияние на тенденцию изменения адсорбируемости при конкурирующей адсорбции этих компонентов.
ВВЕДЕНИЕ
Метан угольных пластов (МУП) − это новый вид нетрадиционных энергетических ресурсов. В компонентном составе МУП наибольшую долю составляет метан (СН4). Газы в угольном пласте находятся преимущественно в сорбированном состоянии, что осложняет разработку метаноугольных месторождений при добыче метана угольных пластов (МУП). Фильтрационно-емкостное свойство метаноугольных отложений хуже традиционных коллекторов (песчаники, известняки и др.). В угле пустотное пространство формируется структурой органического вещества угля и трещинами различного размера и происхождения. При создании модели пустот трещинного типа в углях была принята следующая классификация [1]: микропоры размером менее 2 нм, мезопоры размером 2–50 нм, макропоры размером более 50 нм.
Современные исследования свидетельствуют о том, что углекислый газ (CO2) может увеличить добычу метана угольных пластов при разработке метаноугольных месторождений [2–6]. Углекислый газ, закачанный в угольные пласты, может не только снизить уровень загрязнения окружающей среды, но и содействовать десорбции метана угольных пластов путем его вытеснения из угольной матрицы.
Как правило, большинство угольных пластов насыщены водой в разных формах ее существования: свободной, адсорбированной, поверхностно-адсорбированной, капиллярной, как непосредственно в матрице угля, так и в трещинах и пустотах различной размерности и происхождения [7, 8]. Установлено, что для сухого угля существует параболическая зависимость с минимумом между степенью метаморфизма угля и адсорбируемостью газа, тогда как для влажного угля (без удаления естественной влажности угля) наблюдается линейная зависимость между этими показателями [9]. Чем больше содержание влаги, тем меньше адсорбируемость газа, но при достижении предела содержания влаги адсорбируемость газа становится постоянной [10, 11]. Макромолекула угля обладает кислородными функциональными группами, такими как карбоксильная и гидроксильная, из-за которых молекулы воды сначала адсорбируются на кислородных функциональных группах, а затем – на адсорбированных молекулах воды, в зависимости от водородных связей [12–14], что может существенно влиять на адсорбцию газа.
Исследовали антрациты бассейна Циньшуй, расположенного в Северном Китае. Запасы МУП в бассейне Циньшуй достигают 3.97 трлн м3, что составляет 10% от всех запасов Китая [15]. В настоящее время на юге бассейна разрабатывается метаноугольное месторождение, что подтверждает актуальность проводимых исследований. В южном бассейне Циньшуй в основном залегают антрациты, поэтому в статье обсуждаются созданные модели пустотного пространства трещинного типа в антрацитах с различным размером пустоты (1, 2, 4 и 6 нм) и содержанием влаги (1, 2 и 4%). Моделируются изотермы адсорбции двухкомпонентной смеси метан/углекислый газ (CH4/CO2), и рассматривается влияние размера пустоты, содержания влаги и мольных долей этих компонентов на конкурирующую адсорбцию СН4 и СО2. Выявлены закономерности конкурирующей адсорбции.
Информация о моделировании. Метан угольных пластов адсорбируется преимущественно в микропорах антрацита. Исходя из характеристик химического состава антрацита, были созданы модели пустотного пространства в “угольной матрице” трещинного типа на основе молекулярной модели, предложенной в [16] и оптимизированной, и изучены адсорбционные характеристики МУП в трещинах разной размерности. Принятая модель имеет более высокую ароматизацию и правильное расположение молекул, что близко к молекулярной структуре именно антрацита.
Для молекулярного моделирования было использовано программное обеспечение Materials studio, с помощью которого для получения необходимой модели были выполнены минимизация энергии и оптимизация плотности молекулярной структуры угля посредством метода оптимизации плотности: плотность молекул угля с пространственной структурой будет ближе к антрациту. Оптимизированная модель представлена на рис. 1. Для создания моделей пустот трещинного типа с различным размером раскрытия сначала была получена плоскость расщепления оптимизированной молекулярной модели в соответствии с положением (–2, 0, –1), затем созданы слои с различными размерами пустот и добавлены молекулы воды от массы модели угля. Содержание молекул воды в модели угля выражается как абсолютное содержание влаги и вычисляется по формуле
где β – абсолютное содержание влаги, %; Mm – масса угля, содержащего влагу, г; Md – масса высушенного угля, г.Модели трещинных пустот с содержанием влаги представлены на рис. 2.
Метод GCMC используется для моделирования конкурирующей адсорбции смеси CH4/CO2 в матрице угля в присутствии воды. Молекулярные модели H2O, CO2 и CH4 получены геометрической оптимизацией (структурные параметры приведены в табл. 1). В соответствии с глубиной залегания антрацита и состоянием адсорбции, диапазон адсорбционного давления составляет от 0 до 10 МПа при 303.15 K, но при моделировании введена летучесть, которая используется взамен давления в случае высоких давлений и неидеального газа. Силовое поле играет ключевую роль в молекулярном моделировании. В процессе моделирования выбрано силовое поле “dreiding”, в котором общая энергия E состоит из связанной энергии и несвязанной энергии. Силовое поле “dreiding” представлено следующим образом:
(2)
$\begin{gathered} E = \frac{1}{2}\sum\nolimits_i {{{k}_{b}}} {{({{b}_{i}} - {{b}_{0}})}^{2}} + \frac{1}{2}\sum\nolimits_i {{{k}_{\theta }}} {{({{\theta }_{i}} - {{\theta }_{0}})}^{2}} + \\ + \;\frac{1}{2}\sum\nolimits_i {{{V}_{\varphi }}} \text{[}1 - \cos ({{\varphi }_{i}} - {{\varphi }_{0}})] + \frac{1}{2}{{\sum\nolimits_i {{{k}_{\chi }}({{\chi }_{i}} - {{\chi }_{0}})} }^{2}} + \\ + \;4\sum\limits_{i,j} {{{\varepsilon }_{{ij}}}} \left[ {{{{\left( {\frac{{{{\sigma }_{{ij}}}}}{{{{r}_{{ij}}}}}} \right)}}^{{12}}} - {{{\left( {\frac{{{{\sigma }_{{ij}}}}}{{{{r}_{{ij}}}}}} \right)}}^{6}}} \right] + \sum\limits_{i,j} {\frac{{{{q}_{i}}{{q}_{j}}}}{{D{{r}_{{ij}}}}}} + \\ + \;{{D}_{{hb}}}\left[ {5{{{\left( {\frac{{{{R}_{{hb}}}}}{{{{R}_{{DA}}}}}} \right)}}^{{12}}} - 6{{{\left( {\frac{{{{R}_{{hb}}}}}{{{{R}_{{DA}}}}}} \right)}}^{{10}}}} \right]{{\cos }^{4}}({{\theta }_{{DHA}}}), \\ \end{gathered} $(3)
${{\varepsilon }_{{ij}}} = \sqrt {{{\varepsilon }_{i}}{{\varepsilon }_{j}}} ,\quad {{\sigma }_{{ij}}} = ({{\sigma }_{i}} + {{\sigma }_{j}}){\text{/}}2,$Таблица 1.
Структурные параметры адсорбатов
| Молекула адсорбата | Длина связи, Å | Угол связи, град |
|---|---|---|
| H2O | 0.980 | 104.485 |
| CO2 | 1.152 | 180.000 |
| CH4 | 1.090 | 109.471 |
Как показано в формуле (2), силовое поле “dreiding” включает энергию связи (член 1), энергию угла (член 2), торсионную энергию (член 3) и энергию инверсии (член 4) в связанном потенциале. Несвязанный потенциал состоит из энергии Ван-дер-Ваальса (член 5), кулоновской энергии (член 6) и энергии водородных связей (член 7).
В процессе моделирования адсорбции получены абсолютная и избыточная адсорбируемость. Абсолютная адсорбируемость – это количество вещества адсорбата в поверхностном слое адсорбента. Избыточная – это избыток адсорбата в поверхностном слое, по сравнению с таким же слоем в объемной фазе. Отношение абсолютной адсорбируемости к избыточной показано следующим образом:
где Ne– избыточная адсорбируемость, моль/г; Na – абсолютная адсорбируемость, моль/г; Vp – объем пустоты, cм3; ρ – плотность адсорбата при постоянном давлении и температуре, г/см3; n – мольная масса, г/моль; m – масса адсорбента, г. Коэффициент селективности S характеризует адсорбируемость молекул в конкурирующей адсорбции, и коэффициент селективности ${{S}_{{{\text{C}}{{{\text{H}}}_{4}}/{\text{C}}{{{\text{O}}}_{2}}}}}$ представлен следующим образом:(5)
${{S}_{{{\text{C}}{{{\text{H}}}_{{\text{4}}}}/{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = \left( {\frac{{{{x}_{{{\text{C}}{{{\text{H}}}_{{\text{4}}}}}}}}}{{{{x}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right){\text{/}}\left( {\frac{{{{y}_{{{\text{C}}{{{\text{H}}}_{{\text{4}}}}}}}}}{{{{y}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right),$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Влияние размера пустоты. Адсорбируемость при различных размерах пустот представлена на рис. 3. При уменьшении размера пустот адсорбируемость повышается из-за эффекта заполнения микропор, следовательно, микропоры с большим адсорбционным потенциалом могут привести к значительному повышению адсорбируемости при низкой летучести. Когда размер микропор приближается к апертуре адсорбированной молекулы, потенциалы стен микропор перекрывают друг друга, что приводит к очень высокой энергии адсорбции (рис. 4). Чем меньше размер пустот, тем более сильные потенциалы адсорбции. Это явление заметно в диапазоне 0–1.5 МПа в трещинной пустоте размером 1 нм.
С увеличением размера пустот изменение адсорбируемости при низкой летучести замедляется. В мезопорах капиллярная конденсация может способствовать непрерывной адсорбции в отношении эффекта заполнения микропор. При возрастании летучести адсорбируемость повышается, а избыточная адсорбируемость сначала повышается, а затем снижается, что связано с разностью плотности между адсорбированной и свободной фазами. С возрастанием летучести CH4 и CO2 в свободной фазе постепенно сжимаются, поэтому плотность свободной фазы постепенно приближается к плотности адсорбированной фазы. Когда разностью плотности невозможно пренебречь, избыточная адсорбируемость начинает снижаться. Для выражения этой связи можно использовать уравнение
где ${{\rho }_{f}}$ – плотность свободной фазы, г/см3; ${{\rho }_{a}}$ – плотность адсорбированной фазы, г/см3. Для дальнейшего изучения характеристик конкурирующей адсорбции на рис. 4 представлены значения адсорбата на различных расстояниях от трещинных пустот.В трещинной пустоте размером 1 нм концентрация CH4 и CO2 в центре пустоты указывает на то, что синергетический эффект стенок в микропоре оказывает значительное влияние на пространственное распределение адсорбатов. При увеличении размера пустот синергетический эффект стенок постепенно снижается и пространственное положение адсорбатов смещается от центра пустоты к ее стенкам. В трещинной пустоте размером 6 нм CH4 и CO2 в основном адсорбируются на стенках пустоты. Как показано на рис. 4, количество молекул CO2 всегда превышает количество молекул CH4 в пустоте любого размера. Хотя молярная концентрация CO2 в смеси меньше по сравнению с CH4, участки адсорбции на стенках пустот преимущественно занимают молекулы CO2, следовательно, концентрация не влияет на преимущество адсорбции CO2. Тем не менее, преимущество CO2 в адсорбции теряется с увеличением размера пустоты. Кроме того, коэффициенты селективности также могут выявить преимущество адсорбции в конкурирующей адсорбции. Коэффициенты селективности при различных размерах пустот представлены на рис. 5. Все коэффициенты меньше единицы, следовательно, адсорбируемость CO2 лучше адсорбируемости CH4.
В [17] представлены результаты моделирования изотерм адсорбции смеси газов CH4/CO2 при различных размерах пустот с использованием метода GCMC. Результаты показали, что адсорбция смеси газов в микропорах выше, что соответствует результатам моделирования (рис. 3), полученным в данном исследовании. Микропоры, обладающие большей удельной площадью поверхности и большим адсорбционным потенциалом, могут способствовать адсорбции молекул газа.
Влияние содержания влаги. Микропоры – это основное адсорбционное пространство, в котором содержится МУП, поэтому для адсорбции и диффузии МУП важно изучить возможное заполнение микропористой среды молекулами воды, которая, безусловно, присутствует в рассматриваемой системе. Адсорбция проведена при постоянных температуре и давлении. В случае, когда летучесть газа равна нулю, независимо от того, как изменяется содержание влаги, адсорбируемость газа считается равной нулю. По мере увеличения содержания влаги уменьшаются адсорбируемости CO2 и CH4 (рис. 6). Это связано с тем, что некоторая часть адсорбирующего пространства занята молекулами воды. В [18] показано, что CO2 и CH4 продолжают адсорбироваться на углях с равновесной влажностью, что обусловлено конкуренцией за все доступные центры адсорбции между водой и этими двумя газами. Как показано на рис. 7, α, γ и β являются областями пересечения центров адсорбции CO2–CH4, H2O–CH4 и H2O–CO2 соответственно, а δ – центрами первичной адсорбции воды [18], которые обычно находятся на кислородных функциональных группах углей. Молекулы воды, которые преимущественно адсорбируются на центрах первичной адсорбции δ, затем занимают области пересечения центров адсорбции H2O, CO2 и CH4, непрерывно захватывая центры адсорбции до достижения динамического равновесия, поэтому области пересечения центров адсорбции и их соответствующие пропорции будут меняться с изменением температуры и давления [18]. Исследование этой части было подробно описано в [19].
Рис. 7.
Центры адсорбции H2O, CO2 и CH4 при постоянном давлении и температуре (сфера представляет количество центров адсорбции) [18].

Молекулы воды в основном распределяются в центре трещины размером 1 нм (рис. 8), кроме того, за счет образования водородных связей могут формировать кластеры [14, 19–21], поэтому наличие воды препятствует диффузии CO2 и CH4 в пустоте. Рассчитанные коэффициенты диффузии смеси СН4/СО2 при различном содержании влаги приведены в табл. 2. С увеличением содержания влаги коэффициент диффузии уменьшается. Когда содержание влаги достигает 4%, коэффициент диффузии уменьшается до 3.92 ⋅ 10–9 м2/с.
Таблица 2.
Коэффициенты диффузии смеси СН4/СО2 при различном содержании влаги
| Содержание влаги (%) в трещинной пустоте размером 1 нм | 0 | 1 | 2 | 4 |
|---|---|---|---|---|
| Коэффициент диффузии смеси СН4/СО2 (×10–9 м2/с) | 6.07 | 5.85 | 5.78 | 3.92 |
Была введена радиальная функция распределения (РФР) для дальнейшего изучения влияния воды на пространственное распределение углекислого газа и метана в микропорах. РФР представляет вероятность появления других частиц в пространстве с расстоянием (r) от указанной частицы (см. рис. 9). Когда расстояние между H2O и CO2 составляет 0.37 нм, значение РФР максимально – 1.57, что указывает на то, что вероятность наличия молекулы CO2 максимальна на расстоянии 0.37 нм от молекулы воды. Максимальное значение РФР H2O–CH4 меньше максимального значения РФР H2O–CO2 на расстоянии 0.41 нм, что говорит о том, что максимальная локальная плотность CH4 меньше максимальной локальной плотности CO2, а относительно H2O–CH4 взаимодействие между H2O и CO2 сильнее из-за большей поляризуемости молекул CO2. Значение РФР CO2–CH4 достигает своего максимума при расстоянии 0.44 нм, а при расстоянии между CO2 и CH4 менее 0.19 нм значение РФР равно нулю, т.е. предельное расстояние между CO2 и CH4 составляет 0.19 нм. Когда расстояние между CO2 и CH4 превышает 0.9 нм, значение РФР колеблется около единицы, указывая на то, что локальная плотность двухкомпонентного соединения близка к средней плотности системы.
Рис. 9.
Радиальные функции распределения двухкомпонентной смеси CH4/CO2 в микропоре с содержанием влаги 1%.
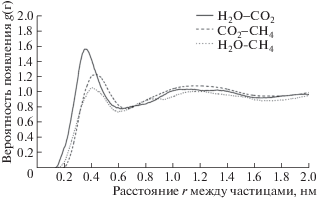
Для проверки выводов проведенного моделирования обратимся к данным экспериментальных исследований. В [22] измеряли адсорбируемость смеси газов CH4/CO2 к адсорбции на антраците при различном содержании влаги. Опытные данные показывают, что наличие влаги может значительно снизить адсорбируемость газа и при увеличении содержания влаги можно наблюдать еще большее снижение адсорбируемости. Результаты эксперимента соответствуют результатам моделирования (рис. 6). Молекулы воды сначала занимают центры адсорбции с кислородными функциональными группами, а затем адсорбируют друг друга для образования кластеров, зависящих от водородных связей [14, 19–21]. Это явление будет препятствовать адсорбции газа.
Влияние молекулярных соотношений. На рис. 10 показана адсорбируемость в микропорах и мезопорах при разной мольной доле рассматриваемых газов. В пустотном пространстве трещинного типа размером 1 нм абсолютная адсорбируемость сначала увеличивается довольно резко, а затем медленно растет параллельно с увеличением летучести. Абсолютная адсорбируемость обратно пропорциональна мольной доле. Избыточная адсорбируемость приближается к абсолютной адсорбируемости при низкой летучести, указывая на то, что в микропорах на начальном этапе адсорбции преобладает адсорбированная фаза изучаемых газов. С увеличением летучести избыточная адсорбируемость сначала не меняется, а потом начинает снижаться, и при летучести 6.2 МПа избыточная адсорбируемость прямо пропорциональна мольной доле, что говорит о том, что высокая летучесть может предотвратить вытеснение молекул метана (CH4) молекулами углекислого газа (CO2). В случае с пустотой шириной 6 нм при возрастании летучести абсолютная адсорбируемость постепенно повышается ввиду отсутствия воздействия заполнения микропор и абсолютная адсорбируемость немного возрастает с увеличением мольной доли CO2. Тенденция изменения избыточной адсорбируемости в трещинах шириной 6 нм схожа с изменением в условиях трещин 1 нм, но адсорбируемость в широких трещинах (6 нм) значительно изменяется при летучести более 5.3 МПа. По сравнению с адсорбцией в мезопоре микропора более благоприятна для CO2 при конкурирующей адсорбции.
Как сказано ранее, уменьшение избыточной адсорбируемости связано с разностью плотностей между адсорбированной фазой и объемной фазой. Для отбрасывания вмешательства большого адсорбционного потенциала в микропорах и дальнейшего выявления влияния плотности адсорбата на адсорбируемость на рис. 11 показаны кривые изменения плотности в трещинной пустоте размером 6 нм. При снижении мольной доли CO2 плотность CH4 в адсорбированной фазе постепенно приближается к плотности в объемной фазе, указывая на то, что адсорбированная фаза постепенно объединяется с объемной фазой. При увеличении мольной доли CO2 разница в плотности CO2 между адсорбированной и объемной фазами постепенно уменьшается, и по сравнению с плотностью CH4 изменение плотности CO2 может значительно повлиять на адсорбируемость при конкурирующей адсорбции.
Все коэффициенты селективности при различных мольных долях меньше единицы (рис. 12), что говорит о том, что при конкурирующей адсорбции преобладают молекулы CO2. На рис. 10,б показано, что, когда летучесть достигает примерно 7 МПа, избыточная адсорбируемость приближается к нулю при соотношении мольной доли CH4/CO2 = 2/3. Это связано с тем, что, согласно уравнению (6) и рис. 11,б, адсорбированная фаза и объемная фаза в этот момент не могут быть разделены.
В [23] приведены изотермы адсорбции смеси газов CH4/CO2 при различной их концентрации. При концентрации углекислого газа в пределах 0–70% избыточная адсорбируемость двухкомпонентной смеси возрастает, что похоже на результаты моделирования, которое было проведено в рамках этого исследования в трещинах шириной 6 нм при летучести 0–4 МПа (рис. 10,б). Однако опытные данные (рис. 2 из [23]) и результаты моделирования отличаются в том случае, когда летучесть превышает 4 МПа. Возможно, что при моделировании летучесть имеет принятое значение. Летучесть – это эффективное давление, которое меньше экспериментального. Кроме того, в моделировании интервал изменения летучести соответствует интервалу изменения давления 0–10 МПа, который шире экспериментального интервала давления 0.5–5 МПа. Изотермы избыточной адсорбции могут меняться из-за влияния разницы плотности между адсорбированной фазой и объемной фазой, когда давление более 5 МПа.
ВЫВОДЫ
Синергетический эффект стенок микропор оказывает значительное влияние на пространственное распределение адсорбатов. При увеличении размера пустот синергетический эффект стенок постепенно снижается и пространственное положение адсорбатов смещается от центра пустоты к ее стенкам.
Молекулы воды в микропорах могут мешать беспрепятственной диффузии и адсорбции CO2 и CH4 в пустотном пространстве угля. Взаимодействие между H2O и CO2 относительно H2O–CH4 сильнее из-за большей поляризуемости молекул CO2. По сравнению с адсорбцией в мезопоре, микропора более благоприятна для CO2 при конкурирующей адсорбции.
Уменьшение избыточной адсорбируемости связано с разностью плотности между адсорбированной фазой и объемной фазой. По сравнению с плотностью CH4 изменение плотности CO2 может оказать значительное влияние на адсорбируемость при конкурирующей адсорбции. В целом, CO2 обладает большей адсорбируемостью, чем CH4.
Список литературы
Jinteng J.Y., Shichuan D.X., Anbu Y.F. Chemical Industry Press: Beijing, 2010. 15 c.
Kutchko B.G., Goodman A.L., Rosenbaum E., Natesakhawat S., Wagner K. // Fuel. 2013. V. 107. № 2. P. 777.
Perera M.S.A., Ranjith P.G., Choi S.K., Airey D. // Fuel. 2012. V. 94. № 1. P. 596.
Qu H.Y., Liu J.S., Chen Z.W., Wang J.G., Pan Z.J., Connell L., Elsworth D. // Int. J. Green. Gas. Con. 2012. V. 9. P. 281.
Shukla R., Ranjith P., Haque A., Choi X. // Fuel. 2010. V. 89. № 10. P. 2651.
Massarotto P., Golding S.D., Bae J.S., Iyer R., Rudolph V. // Int. J. Coal. Geol. 2010. V. 82. № 3–4. P. 269.
Han J.X., Yang Z.Z., Li X.G., Zhang J. // Chem. Tech. Fuels. Oil. 2015. V. 51. № 2. P. 207.
Chen D., Pan Z.J., Liu J.S., Connell L.D. // Int. J. Coal. Geol. 2013. V. 109–110. № 2. P. 45.
Ozdemir E., Schroeder K. // Energ. Fuel. 2009. V. 23. № 5. P. 2821.
Walker P.L., Jr., Mahajan O.P. // Energ. Fuel. 1993. V. 7. № 4. P. 559.
Charrière D., Behra P. // J. Colloid. Interf. Sci. 2010. V. 344. № 2. P. 460.
Given P.H., Marzec A., Barton W.A., Lynch L.J., Gerstein B.C. // Fuel. 1986. V. 65. № 2. P. 155.
Suárez N., Laredo E., Nava R. // Fuel. 1993. V. 72. № 1. P. 13.
Salame I.I., Bandosz T.J. // Langmuir. 1999. V. 15. № 2. P. 587.
Zhao Q.B., Tian W.G. // Natural Gas Industry. 2008. V. 28. № 3. P. 16.
Yu J.S. Coal Chemistry. Metallurgical Industry Press: Beijing, 2000. 162 c.
Aljamaan H., Ismail M.Al., Kovscek A.R. // J. Nat. Gas. Sci. Eng. 2017. V. 48. P. 119.
Busch A., Gensterblum Y. // Int. J. Coal. Geol. 2011. V. 87. № 2. P. 49.
Han J.X., Bogomolov A.Kh., Makarova E.Yu., Yang Z.Z., Lu Y.J., Li X.G. // Energ. Fuel. 2017. V. 31. № 12. P. 13528.
Salame I.I., Bandosz T.J. // J. Colloid. Interf. Sci. 1999. V. 210. № 2. P. 367.
Ohba T., Kanoh H., Kaneko K. // J. Phys. Chem. B. 2004. V. 108. № 39. P. 14964.
Merkel A., Gensterblum Y., Krooss B.M., Amann A. // Int. J. Coal. Geol. 2015. V. 150–151. P. 181.
Lafortune S., Adelise F., Bentivegna G., Didier C., Farret R., Gombert P., Lagny C., Pokryszka Z., Canto Toimil N. // Energy Procedia. 2014. V. 63. P. 5870.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива












