Биология внутренних вод, 2023, № 6, стр. 821-831
Влияние альгицида на основе метаболитов-аллелохемиков водных растений на прорастание семян и развитие проростков трех видов гелофитов
А. Г. Лапиров a, *, Е. А. Беляков a, b, О. А. Лебедева a, Е. А. Курашов a, c, Ю. В. Крылова a, c
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл, Россия
b Череповецкий государственный университет
Череповец, Вологодская обл., Россия
c Институт озероведения Российской академии наук, Санкт-Петербургский федеральный исследовательский центр
Санкт-Петербург, Россия
* E-mail: a_lapir@ibiw.ru
Поступила в редакцию 23.01.2023
После доработки 14.02.2023
Принята к публикации 19.05.2023
- EDN: KAAUVM
- DOI: 10.31857/S0320965223060207
Аннотация
Впервые изучено влияние запатентованного спиртового раствора альгицида на основе галловой, тетрадекановой, гептановой и октановой органических кислот на прорастание семян и развитие проростков трех видов гелофитов: Sparganium emersum, S. glomeratum и Schoenoplectus lacustris. Выявлены значительные различия во влиянии различных концентраций альгицида (0.1, 1.0 и 10.0 мг/л) на прорастание семян и начальные этапы развития проростков трех видов гелофитов. Отмечена стимуляция прорастания семян Sparganium emersum в концентрации 10.0 мг/л и ингибирование этого процесса у S. glomeratum в концентрациях в 1.0 и 0.1 мг/л. Значимого действия альгицида на прорастание семян Schoenoplectus lacustris не обнаружено. По степени увеличения устойчивости морфологических показателей растений к действию различных концентраций альгицида проростки трех видов гелофитов образуют следующий ряд: S. lacustris > S. glomeratum > S. emersum.
ВВЕДЕНИЕ
Растения обладают способностью синтезировать различные органические молекулы, обладающие уникальной структурой углеродного скелета, имеющие низкую молекулярную массу и участвующие в специфических взаимодействиях растений с окружающей средой (Pagare et al., 2015). Растения вод (макрофиты) формируют одни из наиболее продуктивных сообществ, которые благодаря метаболической активности способны оказывать большое влияние на окружающую среду (Takao et al., 2011). В связи с этим важная роль отводится аллелопатическим взаимодействиям, которые осуществляются с помощью специфических соединений – аллелохемиков. К ним относятся многие летучие низкомолекулярные органические соединения (ЛНОС), синтезируемые и выделяемые в среду макрофитами (Nakai et al., 2005; Zhou et al., 2006; Fink, 2007; Курашов и др., 2014). К аллелохемикам относятся галловая – С7Н6О5 (Gallic acid), тетрадекановая – С14Н28О2 (Tetradecanoic acid), гептановая – С7Н14О2 (Heptanoic acid) и октановая С8Н16О2 (Octanoic acid) кислоты (Nakai et al., 2005; Zhou et al., 2006; Курашов и др., 2014; Kurashov et al., 2021), которые вошли в состав запатентованного спиртового раствора альгицида (Курашов и др., 2019), используемого нами в этой работе. Четыре органических кислоты (галловая, тетрадекановая, гептановая и октановая) в составе спиртового раствора альгицида находятся в концентрациях – по 70 г/л (по 25% действующего соединения) каждой, остальное – этиловый спирт (1 л) (Курашов и др., 2019).
Анализ прорастания семян и роста растений является основным инструментом, применяемым для определения аллелопатического влияния аллелохемиков в контролируемых лабораторных условиях (Lovett, Ryuntyu, 1992 – цит. по Chiapusio et al., 1997; Reigosa, Pazos-Malvido, 2007; Takao et al., 2011). Работ, касающихся непосредственного влияния того или иного конкретного аллелохемика (входящего в состав изучаемого нами альгицида) на прорастание семян, крайне мало. Египетские ученые (Zeid et al., 2019) изучали влияние некоторых антиоксидантных соединений (в том числе и галловой кислоты) на прорастание семян Vigna unguiculata (L.) Walp. Ранее эту же кислоту использовали индийские ученые (Muzaffar et al., 2012), исследуя действие ряда фенольных соединений (катехола, галловой и пирогалловой кислот) на прорастание семян и рост проростков Cucumis sativus L. Они установили (Muzaffar et al., 2012), что фенольные соединения – одни из наиболее распространенных молекул среди вторичных метаболитов, имеющих большое значение в обмене веществ у растений. Действие 21 вторичного метаболита растений (в том числе и галловой кислоты) на прорастание семян и рост корней Arabidopsis thaliana (L.) Heynh. было исследовано испанскими учеными (Reigosa, Pazos-Malvido, 2007). В 90-х годах XX в. южноафриканские ученые использовали октановую кислоту для изучения ее влияния на прорастание семян Arachis hypogaea L. (Whitehead, Nelson, 1992), Cyclopia subternata Vogel и Cyclopia intermedia E. Mey (Sutcliffe, Whitehead, 1995) и салата Гранд Рапидс (Jiiger et al., 1996). Исследований, связанных с действием комплекса органических кислот (в спиртовом растворе), входящих в состав изучаемого нами альгицида, на прорастание семян растений вод, нами не обнаружено.
Цель работы – выявить концентрации альгицида, влияющие на прорастание семян и развитие проростков широко распространенных в водоемах гелофитов Sparganium emersum Rehm., S. glomeratum (Laest. ex Beurl.) Neuman и Schoenoplectus lacustris (L.) Palla.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследованные нами виды относятся к экологической группе гелофитов. Ежеголовник всплывший (Sparganium emersum) и ежеголовник скученный (S. glomeratum) – вегетативно подвижные явнополицентрические длиннокорневищные малолетники вегетативного происхождения, поликарпики с кистевидной корневой системой. Это близкие в таксономическом плане виды, отличающиеся по экологическим особенностям местообитания. Так, Sparganium emersum встречается в широком спектре водных объектов – от олиготрофных до дистрофных (предпочитает мезо- и эвтрофные воды), S. glomeratum, наоборот, ограничен в типе водного объекта, произрастая в олиго-мезотрофных и мезотрофных водах. Камыш озерный (Schoenoplectus lacustris) – вегетативно слабо-подвижный явнополицентрический короткокорневищный многолетник вегетативного происхождения, поликарпик с диффузной корневой системой и побегами двух типов: плагиотропным, находящимся в толще грунта или на его поверхности (корневище) и моноциклическими ортотропными полурозеточными монокарпическими надземными побегами (стрелками) (Савиных и др., 2015). Растет по берегам мезо- и эвтрофных водоемов (Дубына и др., 1993). У всех изучаемых видов вегетативное размножение превалирует над семенным, в природных условиях проростки встречаются крайне редко, несмотря на значительное число формирующихся семян (Sparganium emersum – 182 ± 47, S. glomeratum – 134 ± 30 – семян на один монокарпический побег, Schoenoplectus lacustris – от 86 ± 14 до 122 ± 41 семян на одно растение) (Беляков, Лапиров, 2019). Sparganium emersum и Schoenoplectus lacustris считаются обыкновенными (широко распространенными) видами по всему региону Волжского бассейна, в то время как Sparganium glomeratum, наоборот, довольно редок. Исследуемые виды встречаются на мелководьях и берегах рек, озер и водохранилищ, в болотах, канавах, ручьях, прудах (Лисицына и др., 2009).
Зрелые семена всех гелофитов собраны на различных водных объектах Ярославской обл.: cемена Sparganium emersum – Пошехонский р-н, устье р. Маткома, рядом с местом впадения в Рыбинское водохранилище, в окрестностях д. Малафеево, 58.683580 с.ш., 38.503158 в.д., 14.09.2016 г.; Sparganium glomeratum – Пошехонский р-н, северо-восточнее д. Голодяйка, колеи с водой по лесной дороге (глубина 30–40 см) на Талицкое болото, 58.746140 с.ш., 38.752736 в.д., 15.09.2018 г., Schoenoplectus lacustris – Некоузский р-н, окрестности пос. Борок, р. Сунога, 58.060436 с.ш., 38.226895 в.д., 16.08.2020 г. Учитывая, что отобранные виды растений должны легко и равномерно прорастать и относительно быстро расти (Dayan et al., 2000), в экспериментах нами использованы только семена, прошедшие с момента сбора и до постановки на прорастание холодную влажную стратификацию в холодильнике (температура +2.5…+3°С). Семена камыша были поставлены на прорастание 16.04.2021 г., двух видов ежеголовников – 23.06.2021 г.
Семена проращивали в контролируемых лабораторных условиях в люминостате (освещенность 3400–3500 лк, фотопериод 9/15, температура 28–29°С) в чашках Петри (по 30 семян на каждую чашку) в растворе альгицида (по 10 мл на каждую чашку) разной концентрации (0.1, 1.0 и 10.0 мг/л). Данные концентрации использованы нами, исходя из их испытаний по влиянию альгицида на численность цианобактерий и зеленых водорослей, проведенных в рамках патентования данного препарата (Курашов и др., 2019). Для создания необходимых концентраций альгицида (0.1, 1.0 и 10 мг/л) в экспериментальные чашки Петри, с рабочим объемом 10 мл, было добавлено 0.014, 0.14 и 1.4 мкл альгицида соответственно. Для этого был приготовлен рабочий раствор альгицида в водопроводной воде из расчета 143 мкл альгицида на 100 мл воды. Затем, для создания указанных концентраций альгицида, при помощи хроматографического шприца в чашки Петри добавляли по 10, 100 и 1000 мкл приготовленного рабочего раствора. В рабочем растворе 98%-ный этиловый спирт, входящий в состав альгицида, был разбавлен в ~700 раз. Как показали предварительные экспериментальные работы с альгицидом (Kurashov et al., 2021), сам спирт при таком большом разведении не оказывает никакого воздействия на биологические объекты. В качестве контроля использовали отстоявшуюся водопроводную воду, не содержащую аллелохимических веществ. Опыты проводили в пяти повторностях в течение 20 сут.
Семена проращивали с учетом “Международных правил определения качества семян” (1969). Определяли следующие основные показатели прорастания (Shipley, Parent, 1991): лаг-время (L) – время, (сут) между началом эксперимента и началом прорастания; конечное прорастание (Gfin или G) – процент проросших семян в конце эксперимента, соответствующее в отечественной литературе термину “лабораторная всхожесть” (Николаева и др., 1999); энергия прорастания (E) – процент проросших семян в течение 7 сут; период прорастания (P) – число суток, в течение которых семена прорастают. Дополнительно применяли индекс толерантности или относительного роста корня (tolerance index – TI (Iqbal, Rahmati, 1992)), названный позднее “относительный рост корня” (relative root growth – RRG (Fuentes et al., 2004)), индекс фитотоксичности (PP (Chou, Lin, 1976)), индекс относительной всхожести семян или скорости прорастания семян (relative seed germination – RSG (Fuentes et al., 2004) или seed germination rate – GR (Wang et al., 2022)) и индекс всхожести (germination index – GI (Fuentes et al., 2004)) по формулам (1)–(4) соответственно:
(1)
${\text{RRG\;}}\left( {{\text{TI}}} \right){\text{\% }} = \frac{{L{\text{e}}}}{{L{\text{c}}}} \times 100,$(2)
${\text{PP\% }} = \frac{{L{\text{max}}.{\text{\;c}} - L{\text{max}}.\,\,{\text{e}}}}{{L{\text{max}}.{\text{\;c}}}} \times 100{\text{\;,}}$(3)
${\text{RSG\;}}\left( {{\text{GR}}} \right){\text{\;\% }} = \frac{{N{\text{e}}}}{{N{\text{c}}}} \times 100,$В конце эксперимента проростки (по 15 проростков каждого вида, отобранных случайным образом из различных концентраций альгицида и контроля), помещали в пластиковые контейнеры и фиксировали их 76%-ным этиловым спиртом для дальнейшего морфологического анализа. У проростков подсчитывали количество придаточных корней и ассимилирующих листьев, измеряли длину главного корня и максимальную длину придаточных корней, длину и диаметр гипокотиля, базального участка главного побега и семядолей, а также максимальную длину и ширину ассимилирующих листьев. Полученные результаты представлены как среднее значение ± стандартное отклонение (M ± SD). Сравнения нескольких групп по количественным показателям, распределенным ненормально, проводили с помощью H-критерия Краскела–Уоллиса. Для множественных апостериорных сравнений использовали критерий Манна–Уитни с корректирующей поправкой Бонферрони. Различия считали статистически значимыми при p ≤ 0.05. Расчeты выполняли в пакете PAST (Paleontological Statistics Software Package, Норвегия, 1999–2019, v. 3.19 (Hammer et al., 2001).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Прорастание семян. Анализ основных показателей прорастания семян трех видов гелофитов (табл. 1) показал, что по двум из них – лаг-времени и периоду прорастания достоверных различий между контролем и опытными растворами альгицида не обнаружено ни у одного из видов растений. Подобная картина, но для всех основных показателей прорастания, отмечена для семян Schoenoplectus lacustris (табл. 1).
Таблица 1.
Основные показатели прорастания семян Sparganium emersum, S. glomeratum и Schoenoplectus lacustris при разной концентрации альгицида
| Показа-тель | S. emersum | S. glomeratum | Sch. lacustris | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Контроль | мг/л | Контроль | мг/л | Контроль | мг/л | |||||||
| 0.1 | 1.0 | 10.0 | 0.1 | 1.0 | 10.0 | 0.1 | 1.0 | 10.0 | ||||
| L, сут. | 3.0 ± 0.0 | 3.0 ± 0.0 | 3.0 ± 0.0 | 4.2 ± 1.6 | 3.2 ± 0.4 | 3.6 ± 1.3 | 4.2 ± 1.6 | 3.6 ± 1.3 | 6.0 ± 0.7 | 5.6 ± 0.5 | 6.0 ± 1.0 | 6.0 ± 0.7 |
| Gfin, % | 44.7 ± 3.0a | 47.3 ± 8.3 | 44.7 ± 6.5c | 54.7 ± 2.8d | 54.7 ± 1.8a | 42.7 ± 8.6b | 51.3 ± 5.1 | 46.7 ± 7.1d | 18.7 ± 8.0 | 16.7 ± 7.8 | 16.7 ± 6.7 | 15.3 ± 6.5 |
| E, % | 40.7 ± 4.9 | 43.3 ± 10.5 | 40.7 ± 7.2 | 50.7 ± 2.8 | 38.7 ± 3.0a | 30.7 ± 6.4b | 36.7 ± 4.1 | 32.0 ± 8.7 | 8.0 ± 3.8 | 8.7 ± 3.8 | 11.3 ± 6.5 | 10.0 ± 5.8 |
| P, сут. | 9.2 ± 4.4 | 6.8 ± 3.9 | 7.2 ± 3.3 | 5.8 ± 2.2 | 9.2 ± 1.9 | 9.6 ± 4.6 | 9.0 ± 2.8 | 9.0 ± 1.7 | 6.4 ± 1.9 | 6.4 ± 3.0 | 4.8 ± 2.6 | 5.2 ± 1.6 |
Примечание. Здесь и в табл. 2 даны средние значения ± стандартное отклонение (M ± SD). Показатели прорастания: L – лаг-время, Gfin – конечное прорастание, E – энергия прорастания, P – период прорастания. Различия статистически значимы между выборками: конечное прорастание – Sparganium emersum – a–d, c–d, Sparganium glomeratum – a–b, a–d; энергия прорастания – Sparganium glomeratum – a–b. Остальные различия недостоверны. n = 30.
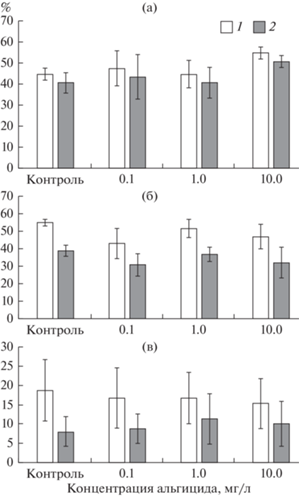
У Sparganium emersum при самой высокой концентрации альгицида (10.0 мг/л) величина конечного прорастания была значимо выше (в 1.2 раза), чем в контроле и концентрации альгицида 1.0 мг/л (H(5) = 7.616, p = 0.0425). Это различается с данными, полученными для S. glomeratum, у которого при самой низкой (0.1 мг/л) и самой высокой концентрациях альгицида (10.0 мг/л), значения конечного прорастания были достоверно ниже (в 1.2–1.3 раза), чем в контроле (H(5) = 7.866, p = = 0.04184), а величина энергии прорастания в контроле превышала таковую при концентрации альгицида 0.1 мг/л (H(5) = 7.866, p = 0.04184 (табл. 1, рис. 1).
Рис. 1.
Изменение важнейших показателей прорастания (ось y) – конечного прорастания (Gfin) и энергии прорастания (E, %) при действии различных концентраций альгицида на семена Sparganium emersum (a), S. glomeratum (б) и Schoenoplectus lacustris (в). 1 – Gfin, 2 – Е.
Морфологические показатели проростков. У проростков Sparganium emersum при действии всех испытуемых концентраций альгицида ни один из морфологических показателей не имел достоверных отличий от контрольных значений (табл. 2).
Таблица 2.
Изменение морфометрических показателей проростков Sparganium emersum, S. glomeratum и Schoenoplectus lacustris при действии различных концентраций альгицида (мг/л)
| Показатель | S. emersum | S. glomeratum | Sch. lacustris | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Контрольa | мг/л | Контрольa | мг/л | Контрольa | мг/л | |||||||
| 0.1b | 1.0c | 10.0d | 0.1b | 1.0c | 10.0d | 0.1b | 1.0c | 10.0d | ||||
| Lгл, см | 2.0 5± 0.55 | 1.63 ± 0.49 | 1.84 ± 0.68 | 1.91 ± 0.41 | 2.13 ± 0.29 | 2.19 ± 0.78 | 2.69 ± 0.53 | 2.47 ± 0.45 | 2.33 ± 0.58 | 2.05 ± 0.56 | 3.00 ± 0.35 | 2.33 ± 0.48 |
| Lприд, см | 1.45 ± 0.48 | 1.66 ± 0.59 | 1.60 ± 0.56 | 1.58 ± 0.63 | 0.98 ± 0.31 | 1.41 ± 0.58 | 1.37 ± 0.34 | 0.74 ± 0.36 | 2.16 ± 0.50 | 1.72 ± 0.56 | 2.87 ± 0.4 | 2.39 ± 0.63 |
| Nприд, экз. | 1.80 ± 0.41 | 2.00 ± 0.65 | 1.93 ± 0.26 | 1.67 ± 0.72 | 1.33 ± 0.49 | 1.47 ± 0.52 | 1.47 ± 0.52 | 1.53 ± 0.52 | 3.13 ± 0.60 | 2.60 ± 0.83 | 2.60 ± 0.83 | 3.00 ± 0.53 |
| Lгип, см | 0.04 ± 0.00 | 0.04 ± 0.01 | 0.04 ± 0.01 | 0.04 ± 0.01 | 0.03 ± 0.01 | 0.03 ± 0.01 | 0.03 ± 0.01 | 0.04 ± 0.01 | 0.03 ± 0.00 | 0.02 ± 0.00 | 0.02 ± 0.00 | 0.02 ± 0.00 |
| Dгип, см | 0.04 ± 0.01 | 0.05 ± 0.01 | 0.05 ± 0.01 | 0.05 ± 0.01 | 0.04 ± 0.01 | 0.04 ± 0.00 | 0.04 ± 0.00 | 0.04 ± 0.01 | 0.04 ± 0.01 | 0.03 ± 0.00 | 0.03 ± 0.00 | 0.03 ± 0.00 |
| Lсем, см | 0.39 ± 0.03 | 0.39 ± 0.04 | 0.39 ± 0.03 | 0.39 ± 0.04 | 0.34 ± 0.06 | 0.37 ± 0.04 | 0.37 ± 0.04 | 0.36 ± 0.05 | 0.20 ± 0.01 | 0.19 ± 0.02 | 0.19 ± 0.04 | 0.20 ± 0.01 |
| Dсем, см | 0.03 ± 0.00 | 0.03 ± 0.00 | 0.03 ± 0.00 | 0.03 ± 0.00 | 0.03 ± 0.00 | 0.03 ± 0.00 | 0.03 ± 0.00 | 0.03 ± 0.00 | – | – | – | – |
| Nассим, экз. | 2.93 ± 0.26 | 2.93 ± 0.26 | 3.00 ± 0.00 | 3.00 ± 0.00 | 2.87 ± 0.35 | 2.67 ± 0.49 | 2.67 ± 0.49 | 2.53 ± 0.52 | 3.40 ±0.48 | 3.20 ± 0.32 | 3.67 ± 0.44 | 3.53 ± 0.50 |
| Lассим, см | 1.80 ± 0.30 | 1.77 ± 0.27 | 1.85 ± 0.30 | 1.93 ± 0.42 | 2.82 ± 0.42 | 3.47 ± 0.52 | 3.11 ± 0.49 | 2.91 ± 0.56 | 2.13 ± 0.20 | 1.82 ± 0.18 | 2.18 ± 0.19 | 2.05 ± 0.28 |
| Hассим, см | 0.07 ± 0.01 | 0.07 ± 0.00 | 0.07 ± 0.01 | 0.07 ± 0.01 | 0.06 ± 0.01 | 0.07 ± 0.01 | 0.07 ± 0.01 | 0.07 ± 0.01 | 0.04 ± 0.00 | 0.04 ± 0.00 | 0.05 ± 0.00 | 0.04 ± 0.00 |
| Lбаз, см | 0.05 ± 0.01 | 0.04 ± 0.01 | 0.05 ± 0.01 | 0.04 ± 0.01 | 0.04 ± 0.01 | 0.04 ± 0.01 | 0.04 ± 0.01 | 0.04 ± 0.01 | 0.04 ± 0.00 | 0.04 ± 0.01 | 0.05 ± 0.01 | 0.06 ± 0.01 |
| Dбаз, см | 0.06 ± 0.01 | 0.06 ± 0.01 | 0.06 ± 0.01 | 0.06 ± 0.01 | 0.05 ± 0.01 | 0.05 ± 0.01 | 0.04 ± 0.01 | 0.05 ± 0.01 | 0.05 ± 0.00 | 0.04 ± 0.01 | 0.06 ± 0.01 | 0.05 ± 0.01 |
Примечание. Lгл – длина главного корня; Lприд, Nприд – длина и число придаточных корней соответственно; Lгип, Dгип – длина и диаметр гипокотиля соответственно; Lсем, Dсем – длина и диаметр семядоли соответственно; Nассим, Lассим, Hассим – число корней, длина и ширина ассимилирующих листьев соответственно; Lбаз, Dбаз – длина и диаметр базального участка розеточного побега; “–” – данные отсутствуют; у Sparganium emersum статистически значимыe различия между одноименными показателями в строках отсутствуют. У Sparganium glomeratum различия в одноименных строках статистически значимы при p < 0.05 между выборками: Lгл – a–c, максимальная Lприд – a–c, b–d, c–d; максимальная Lассим – a–b, остальные различия недостоверны. У Schoenoplectus lacustris различия в одноименных строках статистически значимы при p < 0.05 между выборками: Lгл – a–c, b–c, c–d; максимальная Lприд – a–c, b–c; Lгип – a–b, a–c, a–d; Dгип – a–b, b–c; максимальная Lассим – a–b, b–c, Lбаз – a–c, a–d, b–c, b–d; Dбаз – a–b, b–c, b–d, c–d; остальные различия недостоверны. n = 15.
У S. glomeratum действие различных концентраций альгицида сказалось на линейном росте основных органов проростка – главного корня, придаточных корней и ассимилирующих листьев (табл. 2). Так, значимых отличий от контрольных величин главный и придаточные корни достигали в концентрации альгицида 1.0 мг/л (H(15) = = 8.968, p = 0.02911 и H(15) = 21.12, p = 0.00009005 соответственно). При этом, максимальная длина придаточных корней в самой низкой концентрации альгицида была значимо выше, чем при увеличении последней в 10 и 100 раз, а максимальная длина ассимилирующих листьев проростков в концентрации 0.1 мг/л превышала контрольные значения этого показателя в 1.2 раза (H(15) = = 12.76, p = 0.005044).
У Schoenoplectus lacustris действие альгицида не отразилось на числе придаточных корней и ассимилирующих листьев, длине семядоли и ширине ассимилирующих листьев проростков. По остальным показателям выявлены значимые отличия как от контрольных значений, так и между испытуемыми концентрациями альгицида (табл. 2). При действии раствора альгицида концентрацией 1 мг/л длина главного корня проростков достоверно превышала таковые в контроле и во всех остальных концентрациях альгицида (H(15) = 15.4, p = = 0.001472) (табл. 2). Близкая ситуация наблюдалась и с максимальными размерами придаточных корней. В растворе альгицида 1.0 мг/л их величина была значимо выше, чем в контроле и концентрации 0.1 мг/л (H(15) = 16.75, p = 0.0007717). Длина гипокотиля в контроле в 1.5 раза превышала таковую у опытных образцов растений при всех концентрациях альгицида (H(15) = 12.65, p = = 0.02327). Максимальная длина ассимилирующих листьев у растений в контроле была значимо выше, чем в концентрации альгицида 0.1 мг/л. С повышением концентрации альгицида в 10 раз, размер ассимилирующих листьев проростков увеличился в 1.5 раза по сравнению с действием предыдущей концентрации препарата (H(15) = 14.32, p = 0.002224). Длина базального участка главного побега превышала контрольные значения в концентрациях 1.0 и 10.0 мг/л, и в этих же концентрациях была выше, чем в самой низкой концентрации альгицида (H(15) = 31.97, p = = 0.0000002188). Диаметр базальной части побега, в контроле превышал таковой при концентрации препарата 0.1 мг/л, а при 1.0 мг/л был больше, чем при 10.0 мг/л (H(15) = 23.95, p = 0.00001174 (табл. 2)).
Показатели прорастания семян и роста проростков. Получены показатели прорастания семян и роста проростков (RRG, RSG, GI и PP (табл. 3)). Максимальные величины индексов толерантности RRG (TI) и всхожести (GI) были у Sparganium glomeratum и Schoenoplectus lacustris при концентрации альгицида 1.0 мг/л, у Sparganium emersum – при концентрации в 10 раз больше. Индекс относительной всхожести семян (RSG) достигал максимальных значений при самой высокой концентрации альгицида (10 мг/л) у S. emersum и у Schoenoplectus lacustris, у Sparganium glomeratum – при концентрации 1.0 мг/л. Самые высокие отрицательные значения индекса фитотоксичности (PP) обнаружены у Schoenoplectus lacustris при концентрации альгицида 1.0 мг/л, положительные значения – у Sparganium emersum при самой низкой концентрации альгицида 0.1 мг/л. У S. glomeratum выявлены только отрицательные значения этого индекса во всех испытуемых концентрациях, достигавшие максимума при 1.0 мг/л (табл. 3).
Таблица 3.
Изменение показателей прорастания семян и роста главного корня проростков Sparganium emersum, S. glomeratum и Schoenoplectus lacustris при действии различных концентраций альгицида (мг/л)
| Индекс, % | Sparganium emersum | Sparganium glomeratum | Schoenoplectus lacustris | ||||||
|---|---|---|---|---|---|---|---|---|---|
| мг/л | мг/л | мг/л | |||||||
| 0.1 | 1.0 | 10.0 | 0.1 | 1.0 | 10.0 | 0.1 | 1.0 | 10.0 | |
| RSG | 106.92 ± 24.99 | 100.33 ± 15.74 | 121.52 ±12.92 | 77.87 ± 14.44 | 93.97 ± 9.54 | 85.37 ± 12.75 | 107.02 ± 75.82 | 108.10 ± 64.72 | 110.36 ± 94.78 |
| RRG | 79.64 | 89.90 | 93.49 | 102.82 | 126.13 | 116.12 | 88.00 | 128.63 | 100.00 |
| GI | 85.16 | 90.20 | 113.60 | 80.06 | 118.53 | 99.13 | 94.18 | 139.04 | 110.36 |
| PP | 15.70 ± 30.28 | 3.98 ± 43.73 | –2.89 ± 42.05 | –6.74 ± 43.19 | –27.39 ± 26.41 | –17.49 ± 23.46 | 2.75 ± 43.52 | –43.50 ± 54.20 | –12.94 ± 56.89 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Альгициды на основе органических кислот (метаболитов водных растений) применяются для обработки искусственных водных экосистем – аквариумов, бассейнов для аквакультуры, с целью избирательного подавления цветения, вызываемого цианобактериями и зелеными водорослями, и для поддержания развития экосистемы (Курашов и др., 2019). Анализ данных, полученных Е.А. Курашовым с соавт. (2019) при исследовании альгидида такого типа показал снижение численности цианобактерий (Synechocystis aquatilis Sauvageau, 1892) под влиянием альгицида при всех исследованных концентрациях (0.1, 1.0 и 10.0 мг/л). Наибольшее воздействие отмечено при концентрации альгицида 10.0 мг/л, где разница с контролем на 13-е сутки была в 13.6 раза. При концентрации альгицида в 10 раз меньше (1.0 мг/л) численность цианобактерий в те же сроки эксперимента была ниже, чем в контроле в 4.7 раза (Курашов и др., 2019). По этой причине данный альгицид нового поколения и ему подобные найдут, в ближайшем будущем, свое применение для контроля “цветения” вызываемого цианобактериями во внутренних водоемах. В связи с этим, важно оценить, как данный альгицид будет влиять на других гидробионтов, в том числе на водные макрофиты.
Для высших растений анализ прорастания семян и роста растений – главный инструмент, способный обнаружить потенциальные аллелопатические эффекты в контролируемых лабораторных условиях (Reigosa, Pazos-Malvido, 2007). Рассмотрим всхожесть – главный и ключевой показатель качества семян (Zhang et al., 2016). По данным проведенных экспериментов (табл. 1), самая высокая концентрация альгицида стимулировала конечное прорастание (всхожесть) семян Sparganium emersum (по сравнению с контролем). Однако у S. glomeratum отмечено ингибирование процесса прорастания (по сравнению с контролем) при действии самой низкой и самой высокой концентраций альгицида. В отличие от этого, у Schoenoplectus lacustris ни одна из опытных концентраций не оказала значимого влияния на основные параметры конечного прорастания семян (табл. 1). Возможно, подобный результат связан с видовой специфичностью растений, которая нашла отражение в их различной устойчивости к аллелохимическим веществам, содержащимся в спиртовом растворе альгицида. Кроме того, выявленные различия в прорастании семян испытуемых видов гелофитов могут быть связаны не только с концентрацией альгицида и длительностью нахождения семян в его растворе, но и со структурой семенной оболочки. Эти же причины, на наш взгляд, лежат в основе того, что все испытуемые концентрации альгицида почти не повлияли на второй важнейший параметр – энергию прорастания семян – ни у Sparganium emersum, ни у Schoenoplectus lacustris. Снижение величины этого показателя отмечено лишь у S. glomeratum при самой низкой концентрации альгицида.
В середине 80-х годов XX века J.D. Bewley and M. Black (1985 – цит. по Chiapusio et al., 1997) предложили использовать более одного индекса для точного описания процесса прорастания, cчитая, что количественная оценка этого процесса не должна ограничиваться одним параметром, например, максимальным процентом всхожести (всхожестью) или скоростью прорастания. Во многих исследованиях использовали различные индексы, чтобы показать влияние аллелопатии на прорастание (Chiapusio et al., 1997). С этой целью в нашей работе сделана попытка применить ряд индексов: TI или RRG, RSG или GR, GI и PP. Их (за исключением индекса PP) применяли при оценке фитотоксичности компоста и его пригодности в качестве удобрения для почвы или среды для выращивания (Barral, Paradelo, 2011; Selim et al., 2012; Wang et al., 2022). Наш выбор этих индексов связан с тем, что компост, как и используемый нами альгицид – органическое соединение, содержащее в своем составе низкомолекулярные органические кислоты, влияющие на прорастание семян, рост и удлинение корней (Mazumder et al., 2020). Именно эти показатели используют для определения фитотоксичности компоста (Zucconi et al., 1981 – цит. по: Mazumder et al., 2020), которая также может быть связана с формированием веществ временного характера (короткоцепочечных органических жирных кислот, фенолов), образующихся на ранних стадиях компостирования (Barral, Paradelo, 2011). При этом, под фитотоксичностью понимается задержка прорастания, ингибирование роста растений или любой другой неблагоприятный эффект, вызванный специфическими веществами (фитотоксинами) или неадекватными условиями роста (Baumgarten, Spiegel, 2004 – цит. по Barral, Paradelo, 2011).
Индексы RSG, RRG и GI представляют разные процессы во время прорастания (появление главного корня – это процесс прорастания семени, а удлинение главного корня – это процесс роста) и их чувствительность к стрессу окружающей среды также различна (Wang et al., 2022). GI – объединенный показатель, включающий в себя RSG и RRG и считающийся более полной оценкой фитотоксичности компоста (El Fels et al., 2016). В нашем случае (табл. 3) эти три индекса лишь подтвердили данные, полученные при прорастании семян (табл. 1) и развитии главного корня проростков трех испытуемых видов гелофитов (табл. 2). Так, у S. emersum самые высокие индексы (табл. 3) получены при концентрации альгицида 10.0 мг/л, что указывает на его стимулирующее действие – повышение всхожести семян и увеличение длины главного корня с 1.63 до 1.91 см. У других двух видов максимальные значения всех трех индексов отмечены в концентрации альгицида 1.0 мг/л, при которой наблюдали наиболее высокие величины (среди всех испытуемых концентраций) всхожести семян и длины главного корня проростков. Необходимо иметь в виду, что результаты, полученные с использованием GI, следует интерпретировать с осторожностью, поскольку они зависят от типа используемых семян и характера органического вещества (Bernal et al., 1998; Tiquia and Tam, 1998; Brewer and Sullivan, 2003, цит. по: Selim et al., 2012).
Отдельно следует рассмотреть PP (табл. 3), который связан с размерами главного корня проростков (фактически, с эффективностью его развития) изучаемых видов. Этот индекс достаточно четко показал низкую степень фитотоксичности альгицида для данного органа проростков. Так, у Sparganium emersum отмечено очень слабое ингибирование роста главного корня в концентрациях 0.1 и 1.0 мг/л и очень слабая стимуляция его развития при 10.0 мг/л (по сравнению с предыдущими концентрациями). Полное отсутствие тормозящего действия альгицида выявлено для главного корня S. glomeratum, а у Schoenoplectus lacustris – слабое ингибирование его ростовых процессов в концентрации 0.1 мг/л, с последующей их стимуляцией при повышении концентрации. По нашему мнению, PP – крайне важный показатель, поскольку именно главный корень первым “сталкивается” с анализируемой средой (в нашем случае, с различными концентрациями спиртового раствора альгицида) при прорастании семени. Его рост напрямую связан с поглощением питательных веществ и, как следствие, дальнейшим развитием надземной и подземной сфер проростков.
Замечено (Reigosa, Pazos-Malvido, 2007), что морфология проростков, выращенных в присутствии фитотоксина, также может дать важную информацию. У Sparganium emersum ни один из морфологических показателей проростков не показал значимых различий от контрольных значений (табл. 2), у S. glomeratum влияние альгицида сказалось лишь на размерах главного и придаточных корней, а также ассимилирующих листьев (табл. 2), а у Schoenoplectus lacustris – на семи из двенадцати тестируемых показателей (табл. 2). Таким образом, по степени увеличения устойчивости морфологических показателей растений к действию различных концентраций альгицида проростки трех видов гелофитов образуют следующий ряд: S. lacustris > Sparganium glomeratum > S. emersum.
Наши результаты подтвердили гипотезу французских и испанских исследователей (Chiapusio et al., 1997), что не все индексы могут подходить для точного описания аллелохимических эффектов на процесс прорастания. В нашем случае показатели лаг-время и период прорастания оказались неэффективны с точки зрения оценки процесса прорастания семян двух видов Sparganium и Schoenoplectus lacustris под влиянием различных концентраций альгицида.
Рассматривая полученные нами результаты, следует отметить, что “… Хотя аллелопатия включает и положительные (стимулирующие) взаимодействия, в большинстве исследований описывается ингибирующая активность аллелопатически активных соединений…” (Gross, 2003, p. 313). Аллелопатическое ингибирование (торможение, подавление) – сложный процесс, который может включать взаимодействие различных классов химических веществ (фенольных соединений, флавоноидов, терпеноидов, алкалоидов, стероидов, углеводов и аминокислот), а также смеси различных соединений, иногда оказывающих более выраженный аллелопатический эффект, чем отдельные соединения (James et al., 2013 – цит. по: Bhadha et al., 2014). Например, флавоноиды и жирные кислоты (присутствующие в вытяжках) оказывают отрицательное влияние на всхожесть, поскольку могут действовать на различные клеточные процессы, включающие нарушение проницаемости мембран и фотосинтез (Bhadha et al., 2014).
Обработка семян огурца фенольными соединениями (катехолом, галловой (входящей в состав изучаемого нами альгицида) или пирогалловой кислотой) значительно снижали процент всхожести, рост корней и гипокотилей проростков. Из различных использованных концентраций этих соединений 10–3 М вызывала максимальное торможение. Среди используемых фенолов пирогалловая кислота оказывала наиболее сильный ингибирующий эффект (Muzaffar et al., 2012). При изучении фитотоксического действия 21 вторичного метаболита растений (включая галловую кислоту) на прорастание семян и рост корней Arabidopsis thaliana (L.) Heynh было показано (Reigosa, Pazos-Malvido, 2007), что 11 из 21 молекулы значительно ингибируют всхожесть семян. При этом, галловая кислота тормозила прорастание семян этого вида в концентрациях 500 и 750 мкМ и была отмечена среди наиболее сильных ингибиторов роста корня (Reigosa, Pazos-Malvido, 2007). Наибольший эффект был получен при замачивании семян Vigna unguiculata (L.) Walp. в растворах галловой кислоты с концентрацией 150 ppm, однако на длину еe проростков положительно влияло повышение концентрации этого соединения до 250 ppm, а затем значения постепенно снижались (по сравнению с контролем) при более высоких концентрациях. Длина почки и первичного корня 4-дневных проростков V. unguiculata были значительно увеличены (по сравнению с контролем) в ответ на действие галловой кислоты концентрацией до 200 ppm (Zeid et al., 2019). В целом, фенольные кислоты сильнее влияют на рост проростков, чем на процесс прорастания (Reigosa et al., 1999 – цит. по Reigosa, Pazos-Malvido, 2007). При изучении влияния водного экстракта дыма растительного происхождения, октановой кислоты (входящей в состав изучаемого нами альгицида) и этилена на прорастание светочувствительных семян салата Гранд Рапидс показано, что октановая кислота в сочетании с этиленом обеспечивали более высокий уровень прорастания, чем при использовании одного этилена, но только при самой высокой концентрации октановой кислоты (1 мМ) (Jiiger et al., 1996). Одночасовая импульсная обработка 10 мкМ октановой кислотой приводила к выраженной стимуляции прорастания у Cyclopia intermedia E. Mey. почти до такого же уровня, как и у C. subternata Vogel, однако непрерывная обработка ингибировала прорастание у обоих видов. Аналогичные результаты получены с семенами других видов растений (Berrie et al., 1975; Stewart and Berrie, 1979; Whitehead and Nelson, 1992 – все цит. по: Sutcliffe, Whitehead, 1995). Кроме того, непрерывное применение 100 мкМ октановой кислоты приводило к ингибированию прорастания семян Arachis hypogaea L., а обработка этой кислотой в концентрации от 1 до 100 мкМ – к стимуляции прорастания за счет повышения чувствительности ткани семени к этилену (Whitehead and Nelson, 1992).
В отечественных и зарубежных источниках не была обнаруженa информация о влиянии на прорастание семян и развитие проростков водных и прибрежно-водных растений как отдельных органических кислот (аллелохемиков водных растений), так и их комплекса, входящего в состав использованного в работе запатентованного альгицида. Поэтому анализ полученных результатов показывает необходимость дальнейшего продолжения исследований в этом направлении. Однако следует учитывать, что в случае использования рассматриваемого альгицида, основанного на метаболитах-аллелохемиках водных макрофитов, для борьбы с цианобактериальным “цветением” данный препарат, возможно, будет одновременно стимулировать естественное развитие определенных видов макрофитов в водоеме, тем самым увеличивая способность водной экосистемы противостоять и уменьшать развитие фитопланктона, включая цианобактерий.
Одна из основных проблем состоит в том, что нам неизвестны клеточные и молекулярные механизмы реакции растений (водорослей и цианобактерий) на аллелохемики. Эта реакция при разных концентрациях аллелохемиков может меняться – при одних концентрациях наблюдаться ингибирующий эффект, при других – стимулирующий (Kurashov et al., 2020).
Наши данные и проведенный литературный анализ показали, что, по-видимому, отклик семян и проростков трех видов гелофитов на действие альгицида зависит от видовой принадлежности и экотипа растений, стадии онтогенетического развития, концентрации альгицида и времени экспозиции.
Выводы. Исследовано влияние альгицида на основе органических кислот (вторичных метаболитов водных растений в концентрациях 0.1–10.0 мг/л) на прорастание семян и развитие проростков трех видов гелофитов. Альгицид стимулирует прорастание семян Sparganium emersum в концентрации 10.0 мг/л, приводя к повышению всхожести в 1.2 раза по сравнению с контролем. У S. glomeratum ингибирование процесса прорастания происходит в концентрации альгицида 0.1 и 10.0 мг/л, вызывая снижение всхожести по сравнению с контролем в 1.2–1.3 раза. У Schoenoplectus lacustris значимый эффект альгицида на процесс прорастания семян не обнаружен. При действии альгицида у Sparganium emersum ни один из морфологических показателей проростков не показал достоверных отличий от контрольных значений, у S. glomeratum его влияние сказалось лишь на размерах главного и придаточных корней, а также ассимилирующих листьев, у Schoenoplectus lacustris – на семи из двенадцати тестируемых показателях. По степени увеличения устойчивости морфологических показателей растений к действию различных концентраций альгицида проростки трех видов гелофитов образуют следующий ряд: S. lacustris > Sparganium glomeratum > S. emersum.
Список литературы
Беляков Е.А., Лапиров А.Г. 2019. Семенная продуктивность и особенности плавучести генеративных диаспор некоторых европейских видов рода Sparganium L. // Биология внутр. вод. № 4–2. С. 36. https://doi.org/10.1134/S0320965219060044
Дубына Д.В., Стойко С.М., Сытник К.М. и др. 1993. Макрофиты – индикаторы изменений природной среды. Киев: Наукова думка.
Курашов Е.А., Крылова Ю.В., Батаева Ю.В. и др. 2019. Альгицид для подавления развития цианобактерий из зеленых водорослей на основе метаболитов – аллелохемиков водных растений. Патент РФ № 2019104959 (RU 2 709 308 C1).
Курашов Е.А., Крылова Ю.В., Митрукова Г.Г., Чернова А.М. 2014. Летучие низкомолекулярные метаболиты водных макрофитов, произрастающих на территории России, и их роль в гидроэкосистемах // Сиб. экол. журн. Т. 21. № 4. С. 573.
Лисицына Л.И., Папченков В.Г., Артеменко В.И. 2009. Флора водоемов Волжского бассейна. Определитель сосудистых растений. М.: Тов-во науч. изд. КМК.
Международные правила определения качества семян. 1969. М.: Колос.
Николаева М.Г., Лянгузова И.В., Поздова Л.М. 1999. Биология семян. СПб.: НИИ химии СПбГУ.
Савиных Н.П., Шабалкина С.В., Лелекова Е.В. 2015. Биоморфологические адаптации гелофитов // Сиб. экол. журн. Т. 22. № 5. С. 671. https://doi.org/10.15372/SEJ20150502
Barral M.T., Paradelo R. 2011. A Review on the use of phytotoxicity as a compost quality indicator // Dynamic Soil, Dynamic Plant. V. 5. Iss. 2. P. 36.
Bhadha J.H., Lang T.A., Alvarez O.M. et al. 2014. Allelopathic effects of Pistia stratiotes and Lyngbya wollei Farlow ex Gomont on seed germination and root growth // Sustain. Agr. Res. V. 3. № 4. P. 121. https://doi.org/10.5539/sar.v3n4p121
Chiapusio G., Sánchez A.M., Reigosa M.J. et al. 1997. Do germination indices adequately reflect allelochemical effects on the germination process? J. Chem. Ecol. V. 23. № 2. P. 2445.
Chou C.H., Lin H.J. 1976. Autointoxication mechanism of mechanism of Oriza sativa L. Phytotoxic effects of decomposing rice residues in soil // J. Chem. Ecol. V. 2. № 3. P. 353. https://doi.org/10.1007/BF00988282
Dayan F.E., Romagni J.G., Duke S.O. 2000. Investigating the Mode of Action of Natural Phytotoxins // J. Chem. Ecol. V. 26. № 9. P. 2079. https://doi.org/10.1023/A:1005512331061
El Fels L., Hafidi M., Ouhdouch Y. 2016. Artemia salina as a new index for assessment of acute cytotoxicity during co-composting of sewage sludge and lignocellulose waste // Waste Manage. V. 50. P. 194. https://doi.org/10.1016/j.wasman.2016.02.002
Fink P. 2007. Ecological functions of volatile organic compounds in aquatic systems// Mar. Freshwater Behav. Physiol. V. 40. № 3. P.155. https://doi.org/10.1080/10236240701602218
Fuentes A., Lloréns M., Sáez J. et al. F. 2004. Phytotoxicity and heavy metals speciation of stabilised sewage sludges // J. Hazard. Mater. V. A108. № 3. P. 161. https://doi.org/10.1016/j.jhazmat.2004.02.014
Gross E.M. 2003. Allelopathy of Aquatic Autotrophs // CRC Crit. Rev. Plant. Sci. V. 22. № 3–4. P. 313. https://doi.org/10.1080/713610859
Hammer Ø., Harper D.A.T., Ryan P.D. 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis // Palaeontol. Electron. V. 4. № 1. P. 1.
Iqbal M.Z., Rahmati K. 1992. Tolerance of Albizia lebeck to Cu and Fe application // Ekológia (CSFR). V. 11. № 4. P. 427.
Jäger A.K., Strydom A., van Stade J. 1996. The effect of ethylene, octanoic acid and a plant-derived smoke extract on the germination of light-sensitive lettuce seeds // Plant Growth Regul. V. 19. P. 197. https://doi.org/10.1007/BF00037791
Kurashov E., Kapustina L., Krylova J., Mitrukova G. 2020. The Use of fluorescence microscopy to assess the suppression of the development of cyanobacteria under the influence of allelochemicals of aquatic macrophytes // Fluorescence methods for investigation of living cells and microorganisms. London: IntechOpen. P. 83. https://doi.org/10.5772/intechopen.92800
Kurashov E., Krylova J., Protopopova E. 2021. The Use of Allelochemicals of Aquatic Macrophytes to Suppress the Development of Cyanobacterial “Blooms” // Plankton Communities. London: IntechOpen. https://doi.org/10.5772/intechopen.95609
Mazumder P., Khwairakpam M., Kalamdhad A.S. 2020. Bio-inherent attributes of water hyacinth procured from contaminated water body-effect of its compost on seed germination and radicle growth // J. Environ. Man. V. 257. art. № 109990. https://doi.org/10.1016/j.jenvman.2019.109990
Muzaffar S., Ali B., Wani N. A. 2012. Effect of catechol, gallic acid and pyrogallic acid on the germination, seedling growth and the level of endogenous phenolics in cucumber (Cucumis sativus L.) // Int. J. Life Sci. Pharm. Res. V. 1 № 3. P. 50.
Nakai S., Yamada S., Hosomi M. 2005. Anti-cyanobacterial fatty acids released from Myriophyllum spicatum // Hydrobiologia. V. 543. P. 71. https://doi.org/10.1007/s10750-004-6822-7
Pagare S., Bhatia M., Tripathi N. et al. 2015. Secondary Metabolites of Plants and their Role: Overview // Curr. Trends Biotechnol. Pharm. V. 9. № 3. P. 293.
Reigosa M.J., Pazos-Malvido E. 2007. Phytotoxic effects of 21 plant secondary metabolites on Arabidopsis thaliana germination and root growth // J. Chem. Ecol. V. 33. P. 1456. https://doi.org/10.1007/s10886-007-9318-x
Selim Sh.M., Zayed Mona S., Atta H.M. 2012. Evaluation of phytotoxicity of compost during composting process // Nat. Sci. Sleep. V. 10. № 2. P. 69.
Shipley B., Parent M. 1991. Germination responses of 64 wetland species in relation to seed size, minimum time to reproduction and seedling relative growth rate // Funct. Ecol. V. 5. № 1. P. 111. https://doi.org/10.2307/2389561
Sutcliffe M.A., Whitehead C.S. 1995. Role of ethylene and short-chain saturated fatty acids in the smoke-stimulated germination of Cyclopia seed // J. Plant Physiol. V. 145. P. 271.
Takao L.K., Ribeiro J.P.N., Lima M.I.S. 2011. Potencial alelopático de macrófitas aquáticas de um estuário cego // Acta Bot. Bras. V. 25. № 2. P. 324. https://doi.org/10.1590/S0102-33062011000200008
Wang G., Yang Y., Kong Y. et al. 2022. Key factors affecting seed germination in phytotoxicity tests during sheep manure composting with carbon additives // J. Hazard. Mater. V. 421. Art. no. 126809. https://doi.org/10.1016/j.jhazmat.2021.126809
Whitehead C.S., Nelson R.M. 1992. Ethylene sensitivity in germinating peanut seeds: The effect of short-chain saturated fatty acids // J. Plant Physiol. V. 139. P. 479.
Zeid I.M., Gharib Z.F.A.E., Ghazi S.M., Ahmed E.Z. 2019. Promotive effect of ascorbic acid, gallic acid, selenium and nano-selenium on seed germination, seedling growth and some hydrolytic enzymes activity of Cowpea (Vigna unguiculata) Seedling // J. Plant Physiol. Pathol. V. 7. Iss. 1. P. 1000193. https://doi.org/10.4172/2329-955X.1000193
Zhang L., Jia Y., Zhang X. et al. 2016. Wheat straw: an inefficient substrate for rapid natural lignocellulosic composting // Bioresour. Technol. V. 209. P. 402. https://doi.org/10.1016/j.biortech.2016.03.004
Zhou S., Nakai S., Hosomi M. et al. 2006. Allelopathic growth inhibition of cyanobacteria by reed // Allelopathy J. V. 18. № 2. P. 277.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


