Журнал аналитической химии, 2023, T. 78, № 11, стр. 963-979
Нанообъекты для люминесцентного определения фторхинолонов
С. Н. Штыков a, *, Т. Д. Смирнова a, Т. Ю. Русанова a
a Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского,
Институт химии
410012 Саратов, ул. Астраханская, 83, Россия
* E-mail: shtykovsn@mail.ru
Поступила в редакцию 02.07.2023
После доработки 05.07.2023
Принята к публикации 05.07.2023
- EDN: NVLNOD
- DOI: 10.31857/S0044450223110154
Аннотация
Фторхинолоны являются наиболее успешными антибиотиками, которые также проявляют противовирусное, противоопухолевое действие. Широкое применение фторхинолонов в медицине, фармацевтике, ветеринарии, кормах для животных, птицы, рыбы требует постоянного совершенствования методов их определения в разнообразных объектах. Одним из перспективных и высокочувствительных методов определения фторхинолонов является сенсибилизированная флуоресценция, основанная на резонансном переносе энергии электронного возбуждения (RET) при образовании хелатов с ионами тербия и европия. В обзоре проанализировано применение двух типов нанообъектов: жидких мицеллярных наносистем и квантовых точек на основе наночастиц серебра, золота, полупроводников, углеродных, магнитных и других наноматериалов для увеличения эффективности переноса энергии и чувствительности определения фторхинолонов в различных объектах. Рассмотрена терминология, применяемая при индуктивно-резонансном и обменно-резонансном механизмах переноса энергии, показана принципиальная разница в особенностях RET между жидкими и твердыми типами нанообъектов. Табулированы линейные динамические диапазоны определяемых концентраций, пределы обнаружения и примеры практического применения сенсибилизированной флуоресценции для определения фторхинолонов в реальных объектах с применением наночастиц и мицеллярных наносистем.
Фторхинолоны используют в качестве антибиотиков уже более четырех десятилетий [1]. Это один из самых успешных маркетинговых проектов за всю историю антибактериальной терапии. Общепринятой научной классификации фторхинолонов нет. Исторически их разделяют по поколениям, а также по количеству атомов фтора в молекуле (монофторхинолоны, дифторхинолоны и трифторхинолоны). Выделяют четыре поколения препаратов этого ряда, однако третье и четвертое значительных отличий в антибактериальном плане не имеют. Наибольшее клиническое значение имеет их противомикробная активность к грамотрицательной флоре, включая штаммы, устойчивые к пенициллинам, цефалоспоринам и аминогликозидам, что дало возможность использовать эту группу для лечения тяжелых нозокомиальных (внутрибольничных) инфекций. Фторхинолоны третьего и четвертого поколений (спарфлоксацин, клинафлоксацин, гатифлоксацин и др.) активны также к грамположительным коккам [2]. По еще одной классификации фторхинолоны делят на три группы по предпочтительному ингибированию топоизомеразы IV, ДНК-гиразы или обоих ферментов [1].
Исследования последних лет позволили выявить новые свойства фторхинолонов, в частности противовирусные, противоопухолевые, включая противораковое действие [1, 3]. В то же время неудачная маркетинговая политика фармкомпаний провоцирует длительный и дозозависимый механизм развития резистентности микроорганизмов к фторхинолонам, уменьшающий их эффективность [4, 5]. Широкое и не всегда оправданное использование антибиотиков в пищевой промышленности, сельском хозяйстве, ветеринарии, медицине, проблемы фармакокинетики и фармакодинамики фторхинолонов в организме человека, животных и птиц, выращиваемых на фермах, присутствие в объектах окружающей среды служат основой постоянного совершенствования методов их определения в указанных областях. Опубликованы несколько обзоров определения фторхинолонов, из которых видно, что наиболее часто для этой цели используют методы высокоэффективной жидкостной хроматографии с фотометрическим, флуориметрическим или масс-селективным детектированием [6–8]. Такие методы требуют привлечения дорогостоящего оборудования и квалифицированных специалистов.
Наряду с хроматографическим методом для определения фторхинолонов достаточно широко применяют различные варианты флуоресцентного анализа. Одной из привлекательных фундаментальных особенностей этого метода является существование нескольких подходов к увеличению квантового выхода флуорофоров, улучшению чувствительности и селективности определения аналитов, в том числе фторхинолонов. Эти подходы базируются на использовании флуоресценции с разрешением во времени, синхронной спектрофлуориметрии и различных вариантов сенсибилизированной флуоресценции, основанной на переносе энергии в возбужденном состоянии (RET) [9–14]. Сенсибилизированная флуоресценция фторхинолонов, как правило, основана на образовании хелатов антибиотиков с ионами лантанидов и сочетается с проведением аналитической реакции в/на поверхности жидких и твердых нанообъектов [11, 15, 16]. Простота методик анализа, доступность аппаратуры и высокая чувствительность флуориметрического метода анализа служат основой постоянного интереса к его применению для определения антибиотиков.
Жидкие нанообъекты, такие как мицеллы или микроэмульсии на основе поверхностно-активных веществ (ПАВ), выполняют роль нанореакторов, в которых солюбилизируется антибиотик или его хелат с ионом металла. Солюбилизация в объеме нанофазы улучшает растворимость флуорофоров, их комплексов с металлами, изменяет их гидратацию, гидрофобные, комплексообразующие свойства, увеличивает “жесткость” структуры флуоресцирующего центра, улучшает эффективность переноса энергии возбуждения и в итоге повышает чувствительность определения антибиотиков [15, 16].
Влияние на флуоресценцию твердых нанообъектов, в первую очередь различных наночастиц (НЧ) благородных металлов и квантовых точек (КТ), связано с эффектами сорбции и локального поверхностного плазмонного резонанса (ЛППР), а также переноса энергии в результате перекрывания спектров поглощения (флуоресценции) наночастиц и хелатов лантанидов с антибиотиками [11, 16]. Среди металлических НЧ наиболее часто используют наночастицы серебра и золота (AgНЧ и AuНЧ), поскольку их полосы плазмонного резонанса расположены в видимой области спектра и перекрываются с полосами поглощения и испускания самих фторхинолонов и их комплексов с лантанидами. Высокие значения коэффициентов молярного светопоглощения, уникальные поверхностные сорбционные свойства, легко варьируемые оптические характеристики способствуют широкому использованию твердых нанообъектов в химическом анализе. Можно предположить, что совместное применение в аналитической системе ПАВ и наночастиц может открыть новые возможности в повышении чувствительности и селективности флуориметрического определения антибиотиков и представляет интерес для аналитической практики при определении биологически активных веществ.
Цель настоящей работы состояла в анализе публикаций за последние 10 лет, посвященных способам и новым подходам к повышению чувствительности и избирательности люминесцентного определения фторхинолонов с использованием жидких и твердых нанообъектов, в основном с переносом энергии в возбужденном состоянии.
ЭФФЕКТЫ ПЕРЕНОСА ЭНЕРГИИ В СИСТЕМЕ НАНООБЪЕКТ–ФТОРХИНОЛОН
Безызлучательный перенос энергии электронного возбуждения является фундаментальным физическим явлением, играющим важную роль в природных процессах, особенно в фотосинтезе, а также в оптоэлектронике, биохимии, координационной химии переходных металлов и лантанидов, в люминесцентном анализе, в том числе при определении антибиотиков [11]. RET – оптический процесс, при котором избыточная энергия возбужденной молекулы, обычно называемой донором, передается молекуле-акцептору (рис. 1). Перенос энергии предполагает наличие донора (D), поглощающего свет, и акцептора (A), принимающего поглощенную и преобразованную энергию донора для последующего ее излучения. Схема процесса передачи энергии имеет простой вид D* + A → D + A*, где звездочка означает молекулу в возбужденном состоянии. Вариант излучения, возникающего в результате синглет-синглетных переходов при переносе энергии, называют сенсибилизированной флуоресценцией, а в случае триплет-триплетных или триплет-синглетных сенсибилизированной фосфоресценцией.
Рис. 1.
Схема процессов (а) обычной флуоресценции с излучением кванта света меньшей энергии, (б) ап-конверсии с излучением кванта большей энергии, (в) сенсибилизированной флуоресценции хелата европия с лигандом.
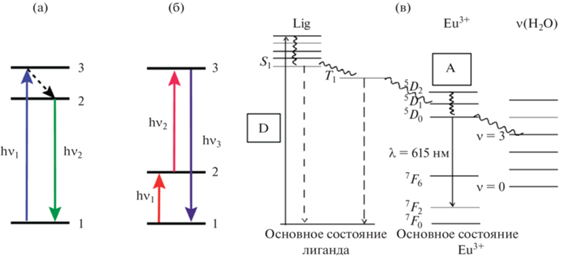
Показано, что поглощение света и последующий перенос энергии электрона в возбужденном состоянии, сопровождаемый батохромным сдвигом спектра излучения акцептора по отношению к донору, может происходить в следующих случаях [11]:
– при динамическом столкновении ионов и молекул D и А в растворе;
– внутри одной молекулы, имеющей два реакционных центра (D и А) с разными условиями поглощения и излучения света;
– внутри хелата металла, образованного, например, ионом лантанида (А) и антибиотика (D);
– между растворенными молекулами (ионами) и наночастицами.
Кроме того, в случае двухфотонного поглощения света, наоборот, может происходить перенос с излучением акцептором света большей энергии (повышением частоты), чем поглощенная донором – так называемый процесс ап-конверсии [17] (рис. 1).
Для переноса энергии донор и акцептор должны оказаться на расстоянии нескольких нанометров, поэтому в гомогенном растворе перенос возможен только при достаточно больших концентрациях (10–3–10–2 М) обоих компонентов. Для химического анализа такая ситуация не представляет интереса. Использование жидких и твердых нанообъектов в люминесцентном анализе радикально изменило ситуацию. Применение нанообъектов обоих видов привело к локальному концентрированию и сближению донора и акцептора энергии возбуждения в/на нанообъекте, росту вероятности переноса и снижению предела обнаружения аналита на несколько порядков.
Для определения фторхинолонов используют как жидкие, в основном мицеллярные наносистемы, так и разные по природе твердые наночастицы [11]. Следует подчеркнуть принципиальную разницу в особенностях резонансного переноса энергии (RET) между этими двумя типами нанообъектов. Так, мицеллы, микроэмульсии, циклодекстрины и другие наносистемы выполняют в растворе роль нанореакторов, концентрирующих и сближающих в ограниченном пространстве нанообъекта молекулы D и A за счет эффекта их совместной солюбилизации. Таким образом, сами мицеллы в переносе энергии не участвуют. Другая их роль состоит в изменении микрополярности, микрокислотности и микровязкости микроокружения донорно-акцепторной (D–А) пары, изолировании еe от влияния тушителей, гидратных молекул воды и реализации индуктивно-резонансного или обменно-резонансного типа флуоресцентного (фeрстеровского) RET (FRET).
Условием безызлучательного переноса энергии при FRET является частичное перекрывание спектра излучения донора со спектром поглощения акцептора, которые участвуют в диполь-дипольном взаимодействии или образовании аддукта. При этом расстояние между донором и акцептором обычно не должно превышать 10 нм [11], и это условие легко реализуется в мицеллах ПАВ, размер которых гораздо меньше 10 нм. Условием для перекрывания спектров донора и акцептора является наличие у них частично одинакового или близкого набора энергетических уровней. Этот факт является потенциальной возможностью улучшения селективности определений люминесцентным методом.
Другим видом переноса энергии в мицеллах является лантанидный резонансный перенос (LRET), который по своей природе является обменно-резонансным внутримолекулярным переносом энергии возбуждения от молекулы лиганда-донора, например антибиотика, к комплексообразующему иону лантанида [11]. Ионом лантанида при определении фторхинолонов, как правило, является тербий, а для тетрациклинов – европий, что связано с взаимным расположением триплетных уровней данных антибиотиков и излучательного уровня лантанида (см. рис. 1в). В обоих случаях донор имеет бóльшую энергию излучения, а акцептор меньшую, т.е. спектр излучения донора расположен гипсохромно по отношения к спектру поглощения акцептора [12, 13]. Потеря энергии вызвана быстрой колебательной релаксацией молекулы донора в возбужденном состоянии и выражается в величине стоксова сдвига, который для LRET составляет сотни нанометров. Кроме увеличения интенсивности флуоресценции за счет эффекта сенсибилизации, в анализе применяют и еe тушение аналитом, вызванное переносом энергии [18].
При взаимодействии антибиотиков с твердыми наночастицами существует гораздо большее число сценариев переноса энергии, поскольку появляется возможность участия в переносе энергии самих наночастиц, которые могут быть как донорами, так и акцепторами энергии возбуждения (рис. 2). Следует отметить, что устоявшейся терминологии в обозначении переноса энергии с участием наночастиц не существует. Одни авторы используют термин “флуоресценция, усиленная поверхностью” (SEF) [19–23], другие “флуоресценция, усиленная металлом“ (MEF) [9, 24–31], третьи “плазмон-усиленная флуоресценция“ (PEF) [32–34], “плазмон-связанная флуоресценция” (PCF) [35, 36], “плазмон-контролируемая флуоресценция” [37], “металл-связанная флуоресценция” (MCF) [38] или cпектроскопия локализованного поверхностного плазмонного резонанса (LSPR), а также “перенос энергии, индуцированный плазмоном” (PIRET) [39].
При формировании термина авторы фактически для одной и той же системы D–A принимают во внимание разные факторы, вызывающие изменение интенсивности сигнала флуоресценции. Одни отмечают участие в переносе энергии наночастицы металла (MEF, MCF), другие – влияние эффекта электромагнитного поля, создаваемого поверхностью наночастицы (SEF), третьи – участие плазмонных электронов наночастицы (PEF, PCF). Во всех перечисленных видах, кроме PIRET, пару D–A составляют наночастица металла и органический флуорофор или хелат металла с лигандом. Диполь-дипольное взаимодействие при резонансной передаче FRET приводит к некогерентной передаче энергии донора к акцептору и характеризуется батохромным смещением максимума спектра сенсибилизированной флуоресценции.
В случае PIRET перенос энергии возбуждения происходит между наночастицами металла и полупроводниковой КТ [39]. Наночастица металла поглощает свет и в результате диполь-дипольного взаимодействия передает энергию плазмонов от металла к полупроводнику, в котором генерируются пары электрон–дырка ниже и вблизи края зоны полупроводника. Плазмоны имеют большой дипольный момент и коллективные колебания их электронов когерентны, что создает возможность сильного гипсохромного смещения спектра флуоресценции. PIRET отличается от классического FRET отсутствием стоксова сдвига, нелокальными эффектами поглощения и сильной зависимостью от скорости расфазировки плазмона и дипольного момента. PIRET может безызлучательно передавать энергию возбуждения через изолирующий слой, что предотвращает межфазные рекомбинационные потери заряда и расфазировку плазмона от переноса горячих электронов [39].
Перечисленные виды переноса энергии электронного возбуждения, его механизмы и особенности в системах с участием наночастиц рассмотрены в ряде обзоров [29, 31, 40–42]. Показано, что в переносе энергии может принимать участие много разных по природе наночастиц, таких как наночастицы серебра, золота, кремния, полупроводниковые КТ, углеродные и магнитные наночастицы (МНЧ).
В случае локализованных поверхностных плазмонов свет взаимодействует с наночастицами, размер которых намного меньше длины волны падающего света. Это приводит к появлению плазмона (облака возбужденных электронов), который локально колеблется вокруг наночастицы с частотой, известной как ЛППР [43]. Эффективность и результат переноса энергии зависит от расстояния в паре донор–акцептор [44, 45]. Если оно менее 5 нм и спектр флуоресценции флуорофора перекрывается со спектром плазмона наночастицы, то обычно наблюдается тушение флуоресценции. Если это расстояние превышает 5 нм, то влияние FRET быстро становится незначительным, так как его эффективность падает как 1/r6 (где r – расстояние между плазмоном и флуорофором). В этом случае перенос энергии определяется эффектом Парселла, который уменьшается в зависимости от 1/r3. Этот эффект выражается в увеличении скорости спонтанного излучения флуоресцентной молекулы под влиянием сильного локального поля – так называемых “горячих точек”, генерируемых находящимися рядом плазмонными наноструктурами. Эффект Парселла может быть максимальным, если полоса ЛППР перекрывается с полосой испускания флуоресценции. При расстоянии между органической молекулой и наночастицей от 5 до 90 нм возможно как усиление, так и тушение излучения флуорофора [29]. Если это расстояние превышает 90 нм, то перенос отсутствует, и интенсивность флуоресценции флуорофора практически не изменяется.
Характер изменений флуоресценции органической молекулы зависит от ее оптических характеристик. В случае перекрывания спектров поглощения флуорофора и ЛППР возможно небольшое усиление излучения флуорофора, возрастание квантового выхода в результате MEF или SEF и изменение времени жизни флуорофора [44, 46–49].
Степень воздействия наночастиц на оптические свойства флуорофора связана также с размером и формой наночастиц, ориентацией дипольных моментов, квантовым выходом флуорофора, природой растворителя. Эффекты усиления флуоресценции органической молекулы вблизи структуры наночастиц металла использовали при создании высокочувствительных химических и биосенсорных систем [9, 19, 23, 25, 29, 50–57].
Выделяют несколько важнейших факторов, определяющих возрастание интенсивности флуоресценции флуорофора в присутствии наночастиц благородных металлов [29]. Одним из главных факторов является эффект усиления локального электромагнитного поля, генерируемого вблизи металлических наночастиц [58, 59]. Наночастицы взаимодействуют с падающим светом и создают концентрированные электрические поля с локализованными колебаниями плотности заряда – возникает ЛППР, который изменяет оптические свойства флуорофоров, находящихся вблизи поверхности частицы. В результате интенсивность флуоресценции органических молекул, эффективно взаимодействующих с электромагнитным полем свободных электронов металла, значительно возрастает. В условиях резонансного возбуждения форма и размер наночастиц играют в формировании флуоресценции органических молекул важнейшую роль, так как острые углы и края металлических наноструктур максимально усиливают электрическое поле [33, 60]. В этом случае наноструктуры металла являются антенной локализованного электрического поля и оказывают эффективное воздействие на флуорофор вблизи поверхности наночастиц.
Другим фактором, определяющим увеличение интенсивности флуоресценции молекулы, является эффект плазмонного воздействия наночастиц металлов, связанный с безызлучательным переносом энергии ППР на флуорофор [61]. Механизм резонансного переноса энергии возбуждения (FRET) реализуется, если наночастица и флуорофор находятся на оптимальном расстоянии [46]. Эффективность процесса зависит не только от силы электрического поля, но и от степени перекрывания спектра ЛППР наночастиц и спектра поглощения флуорофора [47, 59]. Экспериментальные и теоретические исследования показали, что скорости возбуждения и испускания флуорофора увеличиваются, когда спектры поглощения наночастиц перекрываются со спектрами поглощения флуорофора [27, 48].
Следующий немаловажный фактор увеличения эффективности излучательного процесса связан с возрастанием скорости излучательного и безызлучательного процессов и числа циклов возбуждение‒испускание [49, 59, 62], сопровождающихся уменьшением времени жизни флуоресценции, повышением еe квантового выхода и интенсивности флуоресценции флуорофора.
Различают резонансное и нерезонансное возбуждение флуорофора в присутствии наночастиц. В результате одновременного поглощения энергии возбуждения наночастицей и органической молекулой происходит резонансное фотовозбуждение флуорофора и усиление его флуоресценции, если расстояние между флуорофором и наночастицей металла находится в интервале 5‒90 нм. При нерезонансном возбуждении энергия органической молекулы передается наночастице металла, которая впоследствии может флуоресцировать [63], а интенсивность флуоресценции флуорофора в результате переноса энергии возбуждения на наночастицу металла уменьшается.
ОПРЕДЕЛЕНИЕ ФТОРХИНОЛОНОВ С УЧАСТИЕМ НАНОЧАСТИЦ
Основным эффектом, используемым при флуоресцентном определении фторхинолонов, является перенос энергии в системе наночастица–флуорофор, т.е. сенсибилизированной флуоресценции [11, 16]. Публикации, в которых рассмотрены методы определения фторхинолонов с участием НЧ, обобщены в табл. 1. Из таблицы следует, что для определения фторхинолонов предложены флуоресцентные методы с использованием наночастиц серебра [9, 64–66], золота [67], квантовых точек на основе полупроводниковых материалов, например ZnS [68, 69], CdTe [70, 71], MoS2 [72] и др. [73]. Кроме полупроводниковых КТ, для определения фторхинолонов применяют углеродные КТ [54, 74, 75] и другие углеродные наноматериалы, например графен [75, 76] или углеродные нанотрубки (УНТ) совместно с полупроводниковыми КТ [71]. В ряде случаев для отделения фторхинолонов, сорбированных наночастицами, используют магнитные наночастицы магнетита вместе с другими НЧ [68, 76, 77], а также МНЧ другого состава в сочетании с хемилюминесцентным определением [78].
Таблица 1.
Флуориметрическое определение фторхинолонов с помощью нанообъектов
| Наночастица, стабилизатор/модификатор | Фторхинолон | Линейный диапазон (ПрО) | Объект анализа | Эффект | Литература |
|---|---|---|---|---|---|
| Ag НЧ | ЦФ | ЦФ 25–1000 мкг/л (90 нг/л) | Фармпрепараты | Увеличение | [9] |
| ЭФ | ЭФ 0.005–0.160 мкг/л (5 нг/л) | ||||
| ЛФ | ЛФ 10–800 мкг/л (6 нг/л) | ||||
| Ag НЧ, цитрат-ион и β-ЦД | ЭФ | ЭФ 5–300 мкг/л | Фармпрепараты | Увеличение | [64] |
| ЛФ | ЛФ 50–500 мкг/л | ||||
| НФ | НФ 10–405 мкг/л | ||||
| Ag НЧ | ЛеФ | 4.16 × 10–17–3.59 × 10–15 M (7.19 × 10–18 M) | Моча, плазма | Увеличение | [65] |
| МоФ | 4.98 × 10–17–2.49 × 10–15 M (8.47 × 10–18 M) | ||||
| Ag НЧ, модификация ЛФ | Hg2+, Fe3+ | Hg2+ (6.86 × 10-8M), Fe3+ (2.52 × 10–9M) | – | Тушение | [66] |
| Au НЧ модификация аптамером ОФ + РБ | ОФ | 20–300 нМ (4.61 нМ) (1.66 мкг/л) в молоке |
Вода, молоко, пищевые продукты | Увеличение | [67] |
| НЧ Fe3O4 + КТ Mn-ZnS+ АПТЭС + ТЭОС | НФ | 1–90 мкг/л (0.80 мкг/л) | Рыба, молоко | Увеличение | [68] |
| КТ ZnS + Tb3+ и ПЭГ | НФ | 2.0 × 10–9–8.0 × 10–7 М (0.5 × 10–10 М) | Моча, фармпрепараты | Увеличение | [69] |
| CdTe/CDs@ SiO2 | ЦФ | 0–60 нМ (0.0127 нМ) | Моча | Увеличение, тушение | [70] |
| УНТ и КТ CdTe, с MIP ЦФ | ЦФ | 0.10–1.0 мкг/л; 1.0 –100 мкг/л (0.066 мкг/л) | Мышечная ткань, молоко | Тушение | [71] |
| КТ MoS2 c ТЦ | ЛеФ | 10 мкМ–1 мМ (10 мкМ) | Вода, сточные воды, молоко | Увеличение | [72] |
| QDs-FM@ALP-SA | НФ | 0.013–12.48 нг/мл; 0.042–39.86 нг/мл | Молоко | Увеличение | [73] |
| НЧ графена, и GO + Gd3+ | ЭФ | 0.976–62.5 нг/мл (0.47 нг/мл) | Сухое молоко | Тушение | [54] |
| КТ GO c MIP | ОФ | 0.10–25 мкг/л (0.066 мкг/л) | Молоко | Тушение | [74] |
| PGr-GQDs-MIP-Fe3O4 @SiO2 в полимере | ЛеФ | 0.10–25 мкг/л (0.03 мкг/л) | Молоко | Тушение | [75] |
| Маннитол+ Fe3O4+ GQDs + бор | СпФ ОрФ |
1.5 × 10–9–13 × 10–7 М (5.0 × 10–10 М) 1.2 × 10–9–1.1 × 10–7 М (4.0 × 10–10 М) |
Молоко, природная вода | Увеличение | [76] |
| НЧ Fe3O4 на NaYF4: Yb3+, Er3+, покрытые МАК с MIP | 5ФХ | ЭФ 1.03–280 нМ | Рыба, объекты окружающей среды и сельского хозяйства |
Тушение | [77] |
| ФлК 1.69–220 нМ | |||||
| ЛеФ 6.92–280 нМ | |||||
| ЦФ 7.54–300 нМ | |||||
| ЭС 3.90–250 нМ | |||||
| Zr-Fe-C НЧ Fe3O4, х/л системы Ce4+–${\text{SO}}_{3}^{{2 - }}$–Tb3+ | Сумма ФХ | ФлК 5 × 10–9–1 × 10–6 М (2 × 10–9 М) | Молоко | Увеличение | [78] |
| NaGdF4: Yb, Tm@NaYF4 + аптамер | ЭФ | 0.1–1000 нг/мл (0.034 нг/мл) | Рыба и креветки | Увеличение | [79] |
| Si НЧ + ионы Eu3+ | ЦФ | 0.211–132 мкМ (89 нМ) | Пищевые продукты | Увеличение | [80] |
| MIPs@SiO2-FITC | ЦФ | 4.04–250 нМ | Вода | Увеличение | [81] |
| НЧ AgBr + Ti3C2 MXene | ЭФ | 1.0 × 10–12–1.0 × 10–6 М (5.97 × 10–13 М) | – | Увеличение | [82] |
| Tb3+–ФХ–ДНК | НФ, ЦФ | 40–700 нг/мл (12.56 нг/мл) | Фармпрепараты | Увеличение | [83] |
| Eu3+(ДБМ)3Фен в полистироле с MIP ЦФ | ЦФ | 0.5–100 мкг/л (92 нг/л) | Рыба | Увеличение | [84] |
| НЧ метакриловой кислоты | ЦФ | (3.21 мкг/л) | Вода | Увеличение | [85] |
| Полимер метакриловой кислоты | ЦФ | 1.5–150.9 мкМ | Природная вода | Увеличение | [86] |
| Нанолисты тербий-координирующий полимер | Сумма ФХ | 0.04–5.0 мкМ (0.01 мкМ) | Молоко | Увеличение | [87] |
| Фотонный кристалл | ЦФ | 2–512 мкг/л (0.76 мкг/л) | Природная вода | Тушение | [88] |
Примечание: CDs – углеродные КТ, GO – графен оксид, GQDs – графеновые КТ, FITC – флуоресцеин изотиацианат, MIP – молекулярно-импринтированный полимер, PGr – пористый графит, ЛФ – ломефлоксацин, ЛеФ – левофлоксацин, МАК – метакриловая кислота, МоФ – моксифлоксацин, НФ – норфлоксацин, ОФ – офлоксацин, ОрФ – орбифлоксацин, ПрО – предел обнаружения, РБ – родамин Б, СпФ – спарфлоксацин, ТЦ – тетрациклин, ФлК – флероксацин, ФХ – фторхинолон, ЦФ – ципрофлоксацин, ЭФ – энрофлоксацин, ЭС – эноксацин.
Интересный подход к определению фторхинолонов, основанный на явлении ап-конверсии, т.е. возбуждении одного компонента системы в длинноволновой области, а излучении другого компонента в коротковолновой части спектра, предложен в нескольких работах [77, 79]. Такие НЧ иногда покрывают полимерами с молекулярными отпечатками определяемых фторхинолонов. Список наночастиц для флуоресцентного определения фторхинолонов включает наночастицы кремния [80], диоксида кремния [81], сочетание НЧ AgBr и Ti3C2 типа MXene [82], использование ДНК для увеличения сигнала флуоресценции [83].
Большое число работ посвящено определению фторхинолонов, комплексы которых включены в различные наноразмерные полимерные наночастицы, например полистирола [84], метакриловой кислоты [85], метакриловой кислоты и 2-гидроксиэтилметакрилата [86], нанолисты тербий-координирующего полимера [87], которые контактируют с наночастицами металлов или КТ. Новым направлением в определении фторхинолонов является использование фотонных кристаллов [88].
Анализ данных табл. 1 позволяет сделать вывод о том, что предлагаемые различные виды наночастиц позволяют определять фторхинолоны в интервалах концентраций, отличающихся на несколько порядков. Описано определение на уровне аттомолей с НЧ Ag [65], наномолей с квантовыми точками [69, 70, 73, 76, 77, 81] и микромолей [80, 86–88]. Однако делать окончательные выводы относительно того, какие нанообъекты лучше, достаточно сложно. Так, с одной стороны, чувствительность определения в флуориметрии зависит от мощности источника возбуждения, используемого в приборе, а с другой, нужно принимать во внимание и селективность определения антибиотика.
Рассмотрим полученные результаты более детально. Усиленная металлом флуоресценция фторхинолонов впервые наблюдалась в водных растворах в присутствии наночастиц серебра и нашла применение для определения антибиотиков этой группы [9, 64]. Авторы [9, 64] предлагают синтезировать наночастицы серебра в водной среде, а в качестве стабилизатора использовать β-циклодекстрин. Установлено, что с увеличением концентрации наночастиц в растворе флуоресценция энрофлоксацина, ломефлоксацина и норфлоксацина сначала возрастает, а затем уменьшается. Спектр флуоресценции фторхинолонов значительно перекрывается со спектром ЛППР наночастиц серебра (400 нм), что способствует увеличению интенсивности флуоресценции всех трeх антибиотиков и использовано для определения фторхинолонов в лекарственных препаратах. Наночастицы благородных металлов наряду с собственной флуоресценцией фторхинолонов, усиливают также сенсибилизированную флуоресценцию комплексов антибиотиков преимущественно с ионами тербия [8, 56, 89].
Идея создания флуоресцентного биосенсора для определения офлоксацина в пробах воды и молока реализована с помощью немаркированного офлоксацин-специфического аптамера, Au НЧ и родамина Б [67]. Au НЧ покрывают аптамером офлоксацина, который тушит эмиссию флуорофора родамина В в чувствительном слое биосенсора. Офлоксацин, взаимодействуя с аптамером, вызывает его удаление с поверхности Au НЧ, высвобождение молекул родамина Б и рост его флуоресценции.
Альтернативное использование фторхинолона предложено в работе [66], в которой левофлоксацин выступает в качестве модификатора поверхности наночастиц серебра аналитической системы. Разработанный хемосенсор позволяет определять ионы Hg2+ и Fe3+ в растворах на уровне 10–9–10–8 М.
Предложены сенсоры на фторхинолоны, основанные на сенсибилизированной флуоресценции ионов европия и тербия [84, 87]. Сочетание полимеров с молекулярным отпечатком (MIP) ципрофлоксацина и комплексов европия(III) с трис(дибензоилметан)(1,10-фенантролином), внедренных в полистироловые микрочастицы, используется для определения этого фторхинолона в пробах рыбы [84]. Ципрофлоксацин захватывается MIP и тушит сенсибилизированную флуоресценцию смешанолигандного хелата европия, что обеспечивает его специфическое обнаружение и высокочувствительное определение. Наноматериалы из координационных полимеров, содержащих аденозинмонофосфат и ионы Tb3+, предложены в качестве сенсорной платформы датчика для скрининга общего содержания фторхинолонов в молоке [87].
Для обнаружения ципрофлоксацина в воде с использованием ЛППР предложен оригинальный наносенсор, содержащий наночастицы золота и полимера с молекулярным отпечатком, который синтезирован миниэмульсионной полимеризацией метакриловой кислоты [85]. Другой подход к использованию наночастиц полимера метакриловой кислоты с молекулярными отпечатками размером 160 нм для определения ципрофлоксацина основан на их ковалентной прививке на кантилевер [86]. Сенсор позволяет определять ципрофлоксацин в водном растворе в интервале 1.5–151 мкМ с пределом обнаружения на уровне 0.8 мкмоль.
Эффект антенны использован для определения ципрофлоксацина с помощью флуоресцентных кремниевых наночастиц в присутствии ионов Eu3+. Введение ципрофлоксацина заметно усиливало интенсивность сенсибилизированной флуоресценция иона Eu3+ при 590 и 619 нм [80].
Существует несколько вариантов использования квантовых точек для люминесцентного определения фторхинолонов: на основе полимеров с молекулярным отпечатком [83, 90, 91], с помощью аптамеров [54, 82, 90] или иммуносенсоров [73, 90]. Квантовые точки могут выступать в качестве флуоресцентных меток, доноров энергии, носителей-матриц, мишеней, чувствительных к красителям в блоках распознавания сенсорных систем [90]. Квантовые точки, модифицированные полимерами с молекулярными отпечатками, позволяют достигать не только низких пределов обнаружения, но и уникальной избирательности определения антибиотиков. Сочетание аптамеров с квантовыми точками способствует высокой аффинности связывания, легкости модификации и долговременной стабильности аналитической системы. Сочетание в методике наночастиц и полимера с MIP значительно расширяет возможности химического определения, распознавания антибиотиков ряда фторхинолонов, осуществления мониторинга в сложных объектах анализа [90].
Для флуориметрического определения тетрациклина и левофлоксацина предложены КТ нового типа на основе дисульфида молибдена [72]. В присутствии тетрациклина наблюдается динамическое тушение люминесценции этих КТ. Добавки в анализируемый раствор левофлоксацина приводят к образованию нового, более устойчивого комплекса с фотоиндуцированным процессом переноса электрона, сопровождаемым увеличением интенсивности флуоресценции. Предложенный сенсор использован для анализа проб воды, сточных вод и молока.
Квантовые точки на основе сульфида цинка, легированные ионами Tb3+ и полиэтиленгликолем, увеличивают интенсивность флуоресценции в присутствии норфлоксацина [69]. Образующийся комплекс с переносом энергии на наночастицы характеризуется высокой интенсивностью флуоресценции. Сорбционная активность поверхности наночастиц КТ способствует концентрированию аналита и снижению предела обнаружения до десятых долей наномоля при определении норфлоксацина в моче и фармпрепаратах.
Углеродные наноматериалы для определения фторхинолонов применяли в виде УНТ [71], графена и оксида графена [54, 74]. Чаще всего их сочетали с полупроводниковыми КТ, например CdTe [71], добавками соли Gd3+ [54], молекулярно-импринтированными полимерами на определяемый фторхинолон [74] или наночастицами магнетита и диоксида кремния [75]. Включение КТ гидроксиапатита и графена в высокоселективный полимер позволило получить нанозонд для определения норфлоксацина [92]. Гидроксиапатит способствует адсорбции норфлоксацина на чувствительном слое, графеновые КТ повышают чувствительность аналитического сигнала, а полимер с молекулярным отпечатком обеспечивает селективность определения антибиотика в курином мясе и молоке [92]. Нанокомпозитный оптосенсорный зонд на основе пористого углерода и графеновых КТ, встроенных в селективный полимер, предложен для обнаружения следов офлоксацина в молоке [74].
Технологию иммуноанализа применяют для обнаружения токсикантов в различных объектах уже более трех десятилетий. Ограничения метода связаны с генерацией антител против низкомолекулярных мишеней, не вызывающих иммунный ответ, низкой стабильностью антител в условиях окружающей среды. В качестве альтернативы предлагают использовать аптамеры как более устойчивые аналитические инструменты для обнаружения широкого спектра аналитов, в том числе и антибиотиков. Благодаря высокой специфичности в распознавании мишеней аптамеры считаются надeжными элементами молекулярного распознавания. В обзорах [54, 93–95] обсуждаются последние достижения в области аптасенсоров для обнаружения различных загрязнителей и антибиотиков в том числе.
Аптасенсор для определения энрофлоксацина в образцах сухого молока основан на измерении флуоресценции, возникающей в результате резонансного переноса энергии возбуждения от наночастиц NaYF4:Yb/Er/Gd@NaYF4 к оксиду графена [54]. Высокая эффективность адсорбции аналита в чувствительном слое обеспечивается включением наночастиц в полимер, нековалентным взаимодействием аналита и образованием водородных связей. Легирование поверхности наночастиц ионами Gd3+ способствует смещению сигнала флуоресценции в ИК-область и нивелированию аутофлуоресценции матрицы. Этот прием позволил понизить предел обнаружения в 13 раз по сравнению с коммерческим ферментным набором для иммуноферментного определения энрофлоксацина. Другой аптамер для определения энрофлоксацина при анализе рыб и креветок реагирует на конформационные изменения в чувствительном слое, возникающие в присутствии аналита и способствует увеличению интенсивности флуоресценции [79]. Нетоксичные и эффективные люминофоры ближнего инфракрасного диапазона используют для определения энрофлоксацина аптасенсором с настройкой длины волны [82].
Магнитодисперсионная твердофазная экстракция (МТФЭ) с помощью сорбентов, управляемых действием внешнего магнитного поля, позволяет избежать стадий центрифугирования и фильтрования растворов, открывает новые возможности экспресс-определения фторхинолонов [10]. МТФЭ фторхинолонов с последующим люминесцентным определением общего содержания антибиотиков представлена в работах [68, 76, 77]. Для флуориметрического определения спарфлоксацина и орбифлоксацина предлагают использовать разные наночастицы для двух целей: отделения аналита, сорбированного на наночастицах магнетита, действием постоянного магнита, и его последующего флуориметрического определения в молоке и природной воде с применением углеродных КТ, легированных бором [76]. Наногибридный магнитно-флуоресцентный зонд для определения левофлоксацина состоит из пористого графена, наночастиц магнетита и графеновых КТ, включенных в селективный полимер с молекулярным отпечатком. Высокая селективность, обеспеченная применением MIP, позволила определять левофлоксацин в присутствии ципрофлоксацина, ломефлоксацина, марбофлоксацина и сарафлоксацина [75]. Описан автоматизированный метод хемилюминесцентного скрининга общего содержания фторхинолонов в образцах молока с использованием микротвердофазной экстракции в проточной системе с магнитными наночастицами Zr–Fe–C [78].
Послойная сборка флуоресцентного зонда на основе молекулярно-импринтированного полимера, апконверсионных наночастиц NaYF4 и наночастиц Fe3O4 описана в работе [77]. Сорбционные свойств полимера изучали на примере энрофлоксацина. Широкий диапазон спектральных и магнитных свойств сенсора, а также возможность молекулярного распознавания и определения целого ряда производных фторхинолонов (энрофлоксацина, флероксацина, левофлоксацина, ципрофлоксацина и эноксацина) позволяет его использовать в анализе сложных биологических объектов, например тканей рыб [77].
ОПРЕДЕЛЕНИЕ ФТОРХИНОЛОНОВ В ПРИСУТСТВИИ МИЦЕЛЛ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ
Наиболее активно влияние мицелл ПАВ на перенос энергии электронного возбуждения и сенсибилизированную флуоресценцию комплексов лантанидов с фторхинолонами изучали в конце 90-х годов прошлого века и первое десятилетие текущего [96]. В последние десять лет число исследований, посвященных использованию организованных сред на основе мицелл ПАВ для определения фторхинолонов, уменьшилось. Основные публикации, в которых имеются методики определения некоторых фторхинолонов в объектах с использованием ПАВ, приведены в табл. 2. Из таблицы следует, что в большинстве случаев используют мицеллы анионных ПАВ (АПАВ), чаще додецилсульфата натрия или додецилбензолсульфоната натрия. Специфика влияния АПАВ может быть связана со способностью отрицательно заряженных мицелл концентрировать катионы лантанидов на их поверхности за счет электростатических взаимодействий, в то время как солюбилизация лигандов фторхинолонов в мицеллах обусловлена главным образом гидрофобным взаимодействием углеводородного скелета их молекул с углеводородным радикалом ионов АПАВ [11, 13, 108]. Существенный рост интенсивности флуоресценции большинства фторхинолонов достигается при образовании хелатов Tb3+, реже Eu3+, что связано с особенностями взаимного расположения триплетного уровня фторхинолона и излучательного уровня иона лантанида [11, 13, 111].
Таблица 2.
Флуориметрическое определение фторхинолонов в присутствии мицелл поверхностно-активных веществ
| Ион металла, мицеллы ПАВ | Фторхинолон | Линейный диапазон (ПрО) | Объект анализа | рН | Литература |
|---|---|---|---|---|---|
| Tb3+, Фен, ДДС | Флю | 1 × 10–8 – 1 × 10–3 М (6.2 × 10–9 М) | Мясо курицы | 7.5 | [12] |
| Eu 3+, Фен, ДДБС | ЦФ, ЭФ | 4.0 × 10–7–1.0 × 10–4 М (2.3 × 10–7 М) | Фармпрепараты, плазма | 9.0 | [13] |
| Tb3+ , ЛС | ЦФ, ЭФ | 10–50 мкг/кг (2 мкг/л) | Мясо курицы и форели | – | [97] |
| ДДС-Na | МоФ | 30–300 нг/мл (10 нг/мл) | Фармпрепараты | 4.0 | [98] |
| Tb3+, ДДС | ЛеФ | 8–600 нг/мл | Фармпрепараты, моча, плазма | 6.0 | [99] |
| Tb3+ , ДДС | ТФ | 20–450 нг/мл | Плазма | 6.0 | [100] |
| ДДС | ГФ | 0.020–0.450 мкг/мл | Моча, плазма | 3.5 | [101] |
| Eu 3+, Gd3+, ДДБС | ОФ* | 5.0 × 10–10 ∼ 2.0 × 10–7 М (1.46 × 10–10 М), Eu3+ |
Искусственные руды | 7.8 | [102] |
| Tb3+ , ДДБС | ГФ | 5.0 × 10–10–5.0 × 10–8 М (6.0 × 10–11 М) |
Фармпрепараты, моча, плазма | 7.0 | [103] |
| ДДС, PONPE-7.5 | ОФ | 0.1–150 (0.04 нг/мл) | Фармпрепараты, моча, плазма | 4.0 | [104] |
| ГФ | 0.1–250 (0.06 нг/мл) | ||||
| ДДС, ВЭЖХ с флуор. детектором | ОК**, ДФ, ЦФ, ЭФ | 0.01– 0.5 мг/кг | Говядина, свинина | 3.0 | [105] |
| Ce3+, ЦТАБ | ЛеФ | <5.0 × 10–5 М | Вода | – | [106] |
| Y3+, ДДС | ЛеФ | 1 × 10-8–2 × 10–5 М | Вода | 8.0 | [107] |
| Tb3+, Фен, ДДБС | НФ | 1 × 10-8–2 × 10–5 М (3.1 × 10–9 М) | Фармпрепарат | 8.0 | [108] |
| Tb3+, ДМДФФен, МЭ н-октан/вода/н-пентанол/ДДС | Флю | 1.0 × 10-8–1.0 × 10–3 (4.2 × 10–9 М) | Мясо курицы | 7.5 | [109] |
| Tb3+-Фен-ДДС | НК** | 4.0 × 10–8–7.9 × 10–5 (1.0 × 10–8 М) | – | 7.5 | [110] |
| Y3+, ДДС | ЛеФ | 1 × 10–9–1 × 10–6 М (3.0 × 10–10 М) |
Природная вода, фармпрепарат | 6.0 | [113] |
* Приведены данные по определению европия, но эта же система использована нами для определения ОФ. ** НК и ОК не содержат в молекуле атома фтора, но относятся к той же группе антибиотиков на основе 4-хинолон-3-карбоновой кислоты. Примечание: ГФ – гатифлоксацин; ДДБС – додецилбензолсульфонат натрия; ДДС – додецилсульфат натрия; ДМДФФен – 2,9-диметил-4,7-дифенил-1,10-фенантролин; ДФ – данофлоксацин; ЛС – лаурилсульфат натрия; МЭ – микроэмульсия; НК – налидиксовая кислота; ОК – оксолиниевая кислота; Фен – фенантролин; Флю – флюмеквин; ТФ – тровафлоксацин; ЦТАБ – цетилтриметиламмония бромид.
В присутствии АПАВ, кроме увеличения сенсибилизированной флуоресценции бинарных хелатов лантанидов, происходит также расширение плато их комплексообразования, что связано с изменением протолитических свойств флавоноидов [11, 15]. Рост интенсивности флуоресценции в мицеллярных средах может быть вызван несколькими причинами: солюбилизацией и частичной дегидратацией координационно-ненасыщенных комплексов в менее полярном микроокружении мицеллы, также удалением молекул воды из координационной сферы иона лантанида в результате возможного вхождения аниона ПАВ как самостоятельного лиганда в координационную сферу лантанида.
Обобщение имеющихся результатов позволяет сделать вывод о том, что дополнительный рост интенсивности сенсибилизированной флуоресценции европия и тербия с фторхинолонами определяют три фактора: использование второго лиганда; использование второго лантанида, чаще Gd3+; проведение реакции в мицеллярном растворе или введение в раствор глобулярных биополимеров типа альбумина, формирующих более “жесткую” структуру флуоресцирующего центра. Совместное использование указанных факторов позволяет в итоге увеличить интенсивность сенсибилизированной флуоресценции почти на два порядка и снизить предел обнаружения фторхинолонов на 2–3 порядка.
В случае высокой гидрофобности второго лиганда и всего смешанолигандного комплекса вместо мицеллярного раствора ПАВ предложено использовать микроэмульсии, обладающие большей солюбилизирующей способностью и солюбилизационной емкостью [11, 13, 109]. Результатом действия второго лиганда может быть также тушение флуоресценции хелата, имеющее аналитическое значение. Причиной является образование более прочного и менее флуоресцирующего комплекса, т.е. тушение протекает по статическому механизму.
Одновременное использование второго лиганда и солюбилизации в мицеллах ПАВ дополнительно уменьшает число координированных лантанидом молекул воды, которые являются причиной безызлучательной дезактивации энергии возбужденного состояния иона металла. На указанные характеристики влияют также липофильность, основность лиганда и кислотность среды, время жизни возбужденных состояний, соотношение скоростей безызлучательных и излучательных процессов в водной и мицеллярной средах [11, 12].
Показано, что при использовании вторых лигандов, содержащих хромофорные группы, увеличение интенсивности флуоресценции связано не только с замещением остаточных молекул воды, но и дополнительным лиганд-лигандным или лиганд-металльным внутримолекулярным переносом энергии возбуждения, т.е. усилением эффекта антенны, что характерно также для хелатов лантанидов с тетрациклинами в мицеллах неионных ПАВ [13, 111]. Результатом совместного действия второго иона лантанида и второго лиганда может быть образование гидрофобных гетеронаночастиц, в которых реализуются межмолекулярный и внутримолекулярный механизмы переноса энергии возбуждения от комплексов второго лантанида к комплексу европия [112].
Выявлен дифференцирующий эффект природы организованных сред на интенсивность собственной и сенсибилизированной флуоресценции бинарных и смешанолигандных хелатов европия и тербия с различными фторхинолонами, обусловленный их солюбилизацией мицеллами ПАВ. Например, мицеллы анионных ПАВ увеличивают флуоресценцию хелатов тербия с фенантролином и лигандами одного и того же класса фторхинолонов – норфлоксацином и флюмеквином, а мицеллы неионных тушат ее, в то время как катионные ПАВ действуют разнонаправленно [12, 110]. Мицеллы анионных ПАВ тушат флуоресценцию хелатов Eu3+-ДЦ-Фен и Tb3+-ОК-Фен, а мицеллы катионных – наоборот, увеличивают ее. Мицеллы неионных ПАВ значительно увеличивают флуоресценцию Eu3+-ДЦ-Фен и не изменяют – хелата европия с ЭФ, НК и ОК [110]. Особенностями солюбилизации можно объяснить и влияние мицелл на хелат тербия с налидиксовой кислотой и Фен, флуоресценция которого тушится мицеллами только катионных ПАВ, в отличие от хелата другого хинолона – оксолиновой кислоты [110]. Показано, что усиление флуоресценции связано с солюбилизацией хелатов в мицеллы, а тушение – с их разрушением за счет конкурентного взаимодействия ионов мицелл с ионом металла или лигандом или отсутствием солюбилизации хелата в мицелле. Таким образом, варьируя концентрацию и природу ПАВ можно усиливать или ослаблять эффективность переноса энергии и регулировать синергетические и антагонистические эффекты в системе лантанид–фторхинолон–второй лиганд–ПАВ.
Новый подход, состоящий в одновременном применении для реализации переноса энергии серебряных наночастиц и мицелл ДДС, предложен в работе [113] для флуориметрического определения левофлоксацина и офлоксацина. В такой системе хелаты Y3+–Леф–ДДС и Y3+–ОФ–ДДС локализуются на наночастицах серебра, покрытых слоем анионного ПАВ, и имеют гидрофобное окружение. В перенос энергии включаются не только компоненты хелата, но и наночастицы серебра. Показано, что модификация поверхности наночастиц серебра мицеллами анионного ПАВ позволяет расширить диапазон определяемых концентраций офлоксацина и левофлоксацина до трех порядков величины и понизить предел обнаружения на два порядка. Практическое применение переноса энергии в мицеллах ПАВ для определения фторхинолонов в конкретных объектах иллюстрирует табл. 2.
* * *
Анализ публикаций позволил выявить устойчивую тенденцию к применению нанообъектов для определения фторхинолонов методом сенсибилизированной флуоресценции, основанной на переносе энергии электронного возбуждения при образовании хелатов с ионами тербия и европия. Сенсибилизированную флуоресценцию применяют также в сенсорах, ДНК-зондах, проточной цитофлуориметрии, гомогенном и гетерогенном иммунном анализе, а также при сочетании определения с предварительным хроматографическим разделением или отделением фторхинолонов. Ранее проблему повышения чувствительности определения аналитов-лигандов, в том числе фторхинолонов, решали переходом от однороднолигандных хелатов к смешанолигандным (эффект антенны), использованием биомакромолекул или варьированием реакционной среды. В 21 веке появилась новая тенденция, основанная на использовании жидких мицеллярных наносистем (организованных сред), а в последнее время и наночастиц (в основном квантовых точек) благородных металлов, полупроводников, углеродных соединений. Преимущество наночастиц и наносистем по сравнению с гомогенными средами состоит в эффектах локального сближения и концентрирования компонентов иона лантанида и лигандов. Это сокращает расстояние между донором и акцептором энергии возбуждения, повышает эффективность ее переноса и позволяет понизить пределы обнаружения фторхинолонов на 1–5 порядков.
Сравнивая два вида нанообъектов – твердые наночастицы и жидкие мицеллярные наносистемы, следует отметить, что последние более надежны на практике, поскольку ПАВ коммерчески доступны, а мицеллообразование в воде является хорошо воспроизводимым процессом. Использование мицеллярных систем должно обеспечить хорошую воспроизводимость результатов определения и пределы обнаружения на уровне 10–10–10–8 М, что значительно ниже ПДК фторхинолонов. Получение наночастиц в каждой отдельной лаборатории пока проводится по индивидуальной методике, зависит от природы применяемых реагентов, температуры, скорости проведения синтеза, времени роста наночастиц, используемого стабилизатора поверхности. В связи с такой многофакторностью результаты у разных исследователей могут сильно различаться. Дальнейшее развитие коммерческого синтеза наночастиц, методов их характеризации и стандартизации в будущем, возможно, позволит решить эту проблему.
Работа выполнена при финансовой поддержке РНФ, проект № 21-13-00267.
Список литературы
Чарушин В.Н., Носова Э.В., Липунова Г.Н., Чупахин О.Н. Фторхинолоны: синтез и применение. М.: ФИЗМАТЛИТ, 2014. 320 с.
Zhang G.-F., Zhang S., Pan B., Liu X., Feng L.-S. 4-Quinolone derivatives and their activities against Gram positive pathogens // Eur. J. Med. Chem. 2018. V. 143. P. 710. https://doi.org/10.1016/j.ejmech.2017.11.082
Yadav V., Talwar P. Repositioning of fluoroquinolones from antibiotic to anti-cancer agents: An underestimated truth // Biomed. Pharmacotherapy. 2019. V. 111. P. 934. https://doi.org/10.1016/j.biopha.2018.12.119
Pham T.D.M., Ziora Z., Blaskovich M. Quinolone antibiotics // Med. Chem. Commun. 2019. V. 10. P. 1719. https://doi.org/10.1039/C9MD00120D
Aldred K.J., Kerns R.J., Osheroff N. Mechanism of quinolone action and resistance // Biochemistry. 2014. V. 53. № 10. P. 1565. https://doi.org/10.1021/bi5000564
Andreu V., Blasco C., Pico Y. Analytical strategies to determine quinolone residues in food and the environment // Trends Anal. Chem. 2007. V. 26. № 6. P. 534. https://doi.org/10.1016/j.trac.2007.01.010
Czyrski A. Analytical methods for determining third and fourth generation fluoroquinolones: A Review // Chromatographia. 2017. V. 80. P. 181. https://doi.org/10.1007/s10337-016-3224-8
Maciuca A-M., Munteanu A-C., Uivarosi V. Quinolone complexes with lanthanide ions: An insight into their analytical applications and biological activity // Molecules. 2020. V. 25. № 6. Article 1347. https://doi.org/10.3390/molecules25061347
Yin S.N., Yao T., Wu T.H., Zhang Y., Wang P. Novel metal nanoparticle-enhanced fluorescence for determination of trace amounts of fluoroquinolone in aqueous solutions // Talanta. 2017. V. 174. P. 14. https://doi.org/10.1016/j.talanta.2017.05.053
Егунова О.Р., Решетникова И.С., Казимирова К.О., Штыков С.Н. Магнитная твердофазная экстракция и флуориметрическое определение некоторых фторхинолонов // Журн. аналит. химии. 2020. Т. 75. № 1. С. 31. https://doi.org/10.1134/S1061934820010062
Smirnova T.D., Shtykov S.N., Zhelobitskaya E.A. Energy transfer in liquid and solid nanoobjects: Application in luminescent analysis // Phys. Sci. Rev. 2019. V. 4. № 3. Article 20189981. https://doi.org/10.1515/psr-2018-9981
Смирнова Т.Д., Штыков С.Н., Неврюева Н.В., Жемеричкин Д.А., Паращенко И.И. Флуориметрическое определение флюмеквина с помощью сенсибилизированной флуоресценции тербия в организованных средах // Хим.-фарм. журн. 2010. Т. 44. № 11. С. 13. https://doi.org/10.1007/s11094-011-0535-910.1007/s11094-011-0535-9 (Smirnova T.D., Shtykov S.N., Nev-ryueva N.V., Zhemerichkin D.A., Parashchenko I.I. Fluorimetric assay of flumequine using sensitized terbium fluorescence in organized media // Pharm. Chem. J. 2011. V. 44. P. 635. )https://doi.org/10.30906/0023-1134-2010-44-11-49-52
Штыков С.Н., Смирнова Т.Д., Былинкин Ю.Г., Калашникова Н.В., Жемеричкин Д.А. Определение ципрофлоксацина и энрофлоксацина методом сенсибилизированной флуоресценции европия в присутствии второго лиганда и мицелл анионных ПАВ // Журн. аналит. химии. 2007. Т. 62. № 2. С. 153. https://doi.org/10.1134/S1061934807020062 (Shtykov S.N., Smirnova T.D., Bylinkin Yu.G., Kalashnikova N.V., Zhemerichkin D.A. Determination of ciprofloxacin and enrofloxacin by the sensitized fluorescence of europium in the presence of the second ligand and micelles of anionic surfactants // J. Anal. Chem. 2007. V. 62. P. 136.)
Yao T., Wang H., Si X., Yin S., Wu T., Wang P. Determination of trace fluoroquinolones in water solutions and in medicinal preparations by conventional and synchronous fluorescence spectrometry // Open Chem. 2018. V. 16. P. 1122. https://doi.org/10.1515/chem-2018-0125
Штыков С.Н. Химический анализ в нанореакторах: основные понятия и применение // Журн. аналит. химии. 2002. № 10. С. 1018. https://doi.org/10.1023/A:1020410605772 (Shtykov S.N. Chemical analysis in nanoreactors: Main concepts and applications // J. Anal. Chem. 2002. V. 57. P. 859.)
Nanoanalytics: Nanoobjects and Nanotechnologies in Analytical Chemistry / Ed. Shtykov, S. Berlin: De Gruyter. Germany, 2018. 446 p. https://www.degruyter.com/document/doi/10.1515/9783110542011/html
Borse Sh., Rafique R., Murthy Z.V.P., Park T.J., Kailasa S.K. Applications of upconversion nanoparticles in analytical and biomedical sciences: A review // Analyst. 2022. V. 147. № 14. P. 3155. https://doi.org/10.1039/D1AN02170B
Штыков С.Н., Смирнова Т.Д., Былинкин Ю.Г. Определение аденозинтрифосфорной кислоты по тушению флуоресценции дикетонатного хелата Eu(III) в мицеллах Бридж-35 // Журн. аналит. химии. 2004. Т. 59. № 5. С. 495. (Shtykov S.N., Smirnova T.D., Bylinkin Yu.G. Determination of adenosine triphosphoric acid by its effect on the quenching of the fluorescence of europium(III) diketonate in micelles of Brij-35 // J. Anal. Chem. 2004. V. 59. № 5. 2004. P. 438. )
Sultangaziyev A., Bukasov R. Review: Applications of surface-enhanced fluorescence (SEF) spectroscopy in bio-detection and biosensing // Sens. Bio-Sens. Res. 2020. V. 30. Article 100382. https://doi.org/10.1016/j.sbsr.2020.100382
Lakowicz J.R., Geddes C.D., Gryczynski I., Malicka J., Gryczynski Z., Aslan K., Lukomska J., Matveeva E., Zhang J., Badugu R., Huang J. Advances in surface-enhanced fluorescence // J. Fluoresc. 2004. V. 14. № 4. P. 425. https://doi.org/10.1023/B:JOFL.0000031824.48401.5c
Dasary S.S.R., Rai U.S., Yu H., Anjaneyulu Y., Dubey M., Ray P.C. Gold nanoparticle based surface enhanced fluorescence for detection of organophosphorus agents // Chem. Phys. Lett. 2008. V. 460. № 1. P. 187. https://doi.org/10.1016/j.cplett.2008.05.082
Pauling L., Peixoto F., Santos J.F.L., Andrade G.F.S. Surface enhanced fluorescence immuno-biosensor based on gold nanorods // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2023. V. 284. № 5. Article 121753. https://doi.org/10.1016/j.saa.2022.121753
Lee I-Y.S., Suzuki H., Ito K., Yasuda Y. Surface-enhanced fluorescence and reverse saturable absorption on silver nanoparticles // J. Phys. Chem. B. 2004. V. 108. № 50. P. 19368. https://doi.org/10.1021/jp0471554
Geddes C.D., Lakowicz J.R. Metal enhanced fluorescence // J. Fluoresc. 2002. V. 12. № 2. P. 121. https://doi.org/10.1023/A:1016875709579
Geddes C.D., Cao H., Gryczynski I., Gryczynski Z., Fang J.Y., Lakowicz J.R. Metal-enhanced fluorescence (MEF) due to silver colloids on a planar surface: Potential applications of indocyanine green to in vivo imaging // J. Phys. Chem. A. 2003. V. 107. P. 3443. https://doi.org/10.1021/jp022040q
Lakowicz J.R. Radiative decay engineering 5: Metal-enhanced fluorescence and plasmon emission // Anal. Biochem. 2005. V. 337. № 2. P. 171. https://doi.org/10.1016/j.ab.2004.11.026
Aslan K., Lakowicz J.R., Szmacinski H., Geddes C.D. Metal-enhanced fluorescence solution-based sensing platform // J. Fluoresc. 2004. V. 14. № 6. P. 677.
Geddes C.D. Metal-enhanced fluorescence // Phys. Chem. Chem. Phys. 2013. V. 15. Article 19537. https://doi.org/10.1039/C3CP90129G
Jeong Y., Kook Y-M., Lee K., Koh W.-G. Metal enhanced fluorescence (MEF) for biosensors: General approaches and a review of recent developments // Biosens. Bioelectron. 2018. V. 111. P. 102. https://doi.org/10.1016/j.bios.2018.04.007
Dragan A.I., Mali B., Geddes C.D. Wavelength-dependent metal-enhanced fluorescence using synchronous spectral analysis // Chem. Phys. Lett. 2013. V. 556. P. 168. https://doi.org/10.1016/j.cplett.2012.11.035
Ranjan R., Esimbekova E.N., Kirillova M.A., Kratasyuk V.A. Metal-enhanced luminescence: Current trend and future perspectives – A review // Anal. Chim. Acta. 2017. V. 971. P. 1. https://doi.org/10.1016/j.aca.2017.03.051
Fu Y., Zhang J., Lakowicz J.R. Plasmon-enhanced fluorescence from single fluorophores end-linked to gold nanorods // J. Am. Chem. Soc. 2010. V. 132. P. 5540. https://doi.org/10.1021/ja9096237
Zhu Z., Yuan P., Li S., Garai M., Hong M., Xu Q.-H. Plasmon-enhanced fluorescence in coupled nanostructures and applications in DNA detection // ACS Appl. Bio Mater. 2018. V. 1. P. 118. https://doi.org/10.1021/acsabm.8b00032
Emerson N.T., Yang H. Reproducibly measuring plasmon-enhanced fluorescence in bulk solution across a 20-fold range of optical densities // Anal. Chem. 2021. V. 93. № 22. P. 8045. https://doi.org/10.1021/acs.analchem.1c01210
Ding W., Hsu L.-Y., Schatz G.C. Plasmon-coupled resonance energy transfer: A real-time electrodynamics approach // J. Chem. Phys. 2017. V. 146. № 6. Article 064109. https://doi.org/10.1063/1.4975815
Hsu L.-Y., Wendu D.W., George C., Schatz G.C. Plasmon-coupled resonance energy transfer // J. Phys. Chem. Lett. 2017. V. 8. № 10. P. 2357. https://doi.org/10.1021/acs.jpclett.7b00526
Zhao L., Ming T., Shao L., Chen H., Wang J. Plasmon-controlled Förster resonance energy transfer // J. Phys. Chem. C 2012. V. 116. P. 8287. https://doi.org/10.1021/jp300916a
Kim K.-S., Yoo S.I., Sohn B.-H. Metal-coupled fluorescence resonance energy transfer in layer-by-layer assemblies for dual modality fluorescence enhancement // Macromol. Chem. Phys. 2018. V. 219. № 13. Article 1800115. https://doi.org/10.1002/macp.201800115
Li J., Cushing S.K., Meng F., Senty T.R., Bristow A.D., Wu N. Plasmon-induced resonance energy transfer for solar energy conversion // Nature Photonics. 2015. V. 9. P. 601. https://doi.org/10.1038/nphoton.2015.142
Teunissen A.J.P., Peґrez-Medina C., Meijerink A., Mulder W.J.M. Investigating supramolecular systems using Förster resonance energy transfer // Chem. Soc. Rev. 2018. V. 47. P. 7027. https://doi.org/10.1039/c8cs00278a
He Z., Li F., Zuo P., Tian H. Principles and applications of resonance energy transfer involving noble metallic nanoparticles // Materials. 2023. V. 16. № 8. Article 3083. https://doi.org/10.3390/ma16083083
Metal-enhanced fluorescence / Ed. Geddes C.D. New Jersey: John Wiley & Sons. Inc., 2010. 625 p.
Kelly K.L., Coronado E., Zhao L., Schatz G.C. The optical properties of metal nanoparticles: The influence of size, shape, and dielectric environment // J. Phys. Chem. B. 2003. V. 107. P. 668. https://doi.org/10.1021/jp026731y
Park J.-E., Kim J., Nam J.-M. Emerging plasmonic nanostructures for controlling and enhancing photoluminescence // Chem. Sci. 2017. V. 8. P. 4696. https://doi.org/10.1039/C7SC01441D
Willets K.A., Van Duyne R.P. Localized surface plasmon resonance spectroscopy and sensing // Annu. Rev. Phys. Chem. 2007. V. 58. P. 267. https://doi.org/10.1146/annurev.physchem.58. 032806.104607
Govorov A., Martínez P-L.H., Demir H.V. Understanding and modeling Förster-type resonance energy transfer (FRET) // Nanosci. Nanotechnol. 2016. P. 53. https://doi.org/10.1007/978-981-287-378-1
Stranik O., Nooney R., McDonagh C., MacCraith B.D. Optimization of nanoparticle size for plasmonic enhancement of fluorescence // Plasmonics. 2007. V. 2. № 1. P. 15. https://doi.org/10.1007/s11468-006-9020-9
Tam F., Goodrich G.P., Johnson B.R., Halas N.J. Plasmonic enhancement of molecular fluorescence // Nano Lett. 2007. V. 7. № 2. P. 496. https://doi.org/10.1021/nl062901x
Zhang Y., Aslan K., Previte M., Geddes C.D. Metal-enhanced fluorescence: Surface plasmons can radiate a fluorophore’s structured emission // Appl. Phys. Lett. 2007. V. 90. № 5. Article 053107. https://doi.org/10.1063/1.2435661
Selivanova N., Galyametdinov Y. Terbium(III) as a fluorescent probe for molecular detection of ascorbic acid // Chemosensors. 2021. V. 9. № 6. Article 134. https://doi.org/10.3390/chemosensors9060134
Dong H., Sun L.-D., Yan C.-H. Energy transfer in lanthanide upconversion studies for extended optical applications // Chem. Soc. Rev. 2015. V. 44. P. 1608. https://doi.org/10.1039/C4CS00188E
Zhang H., Chen Z-H., Liu X., Zhang F. A mini-review on recent progress of new sensitizers for luminescence of lanthanide doped nanomaterials // Nano Res. 2020. V. 13. № 7. P. 1795. https://doi.org/10.1007/s12274-020-2661-8
Jouybana A., Rahimpoura E. Optical sensors based on silver nanoparticles for determination of pharmaceuticals: An overview of advances in the last decade // Talanta. 2020. V. 217. Article 121071. https://doi.org/10.1016/j.talanta.2020.121071
Zhang Y., Duan B., Bao Q., Yang T., Wei T. Wang J., Mao Ch., Zhang C., Yang M. Aptamer-modified sensitive nanobiosensors for the specific detection of antibiotics // J. Mater. Chem. B. 2020. V. 80. P. 8607. https://doi.org/10.1039/D0TB01441A
Camarca A., Varriale A., Capo A., Pennacchio A., Calabrese A., Giannattasio C., Almuzara C.M., D’Auria S., Staiano M. Emergent biosensing technologies based on fluorescence spectroscopy and surface plasmon resonance // Sensors. 2021. V. 21. № 3. Article 906. https://doi.org/10.3390/s21030906
Kaczmarek M. Lanthanide-sensitized luminescence and chemiluminescence in the systems containing most often used medicines; a review // J. Lumin. 2020. V. 222. Article 117174. https://doi.org/10.1016/j.jlumin.2020.117174
Gaviria-Arroyave M.I., Cano J.B., Peñuela, Gustavo A. Nanomaterial-based fluorescent biosensors for monitoring environmental pollutants: A critical review // Talanta Open. 2020. V. 2. Article 100006. https://doi.org/10.1016/j.talo.2020.100006
Li H., Wu X. Silver nanoparticles-enhanced rare earth co-luminescence effect of Tb(III)–Y(III)–dopamine system // Talanta. 2015. V. 138. P. 203. https://doi.org/10.1016/j.talanta.2015.02.023
Lakowicz J.R., Ray K., Chowdhury M., Szmacinski H., Fu Y. Zhang J., Nowaczyk K. Plasmon-controlled fluorescence: a new paradigm in fluorescence spectroscopy // Analyst. 2008. V. 133. P. 1308. https://doi.org/10.1039/B802918K
Zenin V.A., Andryieuski A., Malureanu R., Radko I.P., Volkov V.S., Gramotnev D.K., Lavrinenko A.V., Bozhevolnyi S.I. Boosting local field enhancement by on-chip nanofocusing and impedance-matched plasmonic antennas // Nano Lett. 2015. V. 15. № 12. P. 8148. https://doi.org/10.1021/acs.nanolett.5b03593
Aslan K., Gryczynski I., Malicka J., Matveeva E., Lakowicz J.R., Geddes C.D. Metal-enhanced fluorescence: An emerging tool in biotechnology // Curr. Opin. Biotechnol. 2005. V. 16. P. 55. https://doi.org/10.1016/j.copbio.2005.01.001
Wu M., Lakowicz J.R., Geddes C.D. Enhanced lanthanide luminescence using silver nanostructures: Opportunities for a new class of probes with exceptional spectral characteristics // J. Fluoresc. 2005. V. 15. P. 53. https://doi.org/10.1007/s10895-005-0213-y
Торопов Н.А., Камалиева А.Н., Набиуллина Р.Д. Резонансное и нерезонансное взаимодействие полупроводниковых нанокристаллов с локализованными плазмонами // Научно-технический вестник информационных технологий, механики и оптики. 2019. Т. 19. № 2. С. 189. https://doi.org/10.17586/2226-1494-2019-19-2-189-195
Wang H., Si X., Wu T., Wang P. Silver nanoparticles enhanced fluorescence for sensitive determination of fluoroquinolones in water solutions // Open Chem. 2019. V. 17. P. 884. https://doi.org/10.1515/chem-2019-0094
Kamruzzaman M., Alam A-M., Lee S.H., Suh Y.S., Kim Y.H., Kim G.M., Kim S.H. Method for determination of fluoroquinolones based on the plasmonic interaction between their fluorescent terbium complexes and silver nanoparticles // Microchim. Acta. 2011. V. 174. P. 353. https://doi.org/10.1007/s00604-011-0633-0
Roy S.M., Roy D.R. Levofloxacin capped Ag-nanoparicles: A new highly selective sensor for cations under joint experimental and DFT investigation // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2017. V. 179. P. 178. https://doi.org/10.1016/j.saa.2017.02.030
Yan Z., Yi H., Wang L., Zhou X., Yan R., Zhang D., Wang S., Su L., Zhou Sh. Fluorescent aptasensor for ofloxacin detection based on the aggregation of gold nanoparticles and its effect on quenching the fluorescence of Rhodamine B // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2019. V. 221. № 5. Article 117203. https://doi.org/10.1016/j.saa.2019.117203
Chen S., Su X., Yuan C., Ji C.Q., Qiao Y., Li Y., He L., Zou L., Ao X., Liu A., Liu Sh., Yang Y. A magnetic phosphorescence molecularly imprinted polymers probe based on manganese-doped ZnS quantum dots for rapid detection of trace norfloxacin residual in food // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2021. V. 253. Article 119577. https://doi.org/10.1016/j.saa.2021.119577
Kaur B., Kumar R., Chand S., Singh K., Malik A.K. Determination of norfloxacin in urine and pharmaceutical samples using terbium doped zinc sulphide nanomaterials-sensitized fluorescence method // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2019. V. 214. P. 261. https://doi.org/10.1016/j.saa.2019.02.015
Liu X., Wang T., Lu Y., Wang W., Zhou Z. Constructing carbon dots and CdTe quantum dots multi-functional composites for ultrasensitive sensing and rapid degrading ciprofloxacin // Sens. Actuators B: Chem. 2019. V. 289. P. 242. https://doi.org/10.1016/j.snb.2019.03.094
Yuphintharakun N., Nurerk P., Chullasat K., Kanatharana P., Davis F., Sooksawat D., Bunkoed O. A nanocomposite optosensor containing carboxylic functionalized multiwall carbon nanotubes and quantum dots incorporated into a molecularly imprinted polymer for highly selective and sensitive detection of ciprofloxacin // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2018. V. 201. P. 382. https://doi.org/10.1016/j.saa.2018.05.034
Sri S., Singh U., Kumar R., Lakshmi G.B.V.S., Solanki P.R. Ignition of photoluminescent intensity of quenched MoS2 quantum dots tetracycline mixture by levofloxacin via photoinduced electron transfer // JCIS Open. 2021. V. 3. Article 100021. https://doi.org/10.1016/j.jciso.2021.100021
Liu X., Xu Z, Han Z., Fan L., Liu S., Yang H., Chen Z., Sun T., Ning B. A highly sensitive and dual-readout immunoassay for norfloxacin in milk based on QDs-FM@ALP-SA and click chemistry // Talanta. 2021. V. 234. № 1. Article 122703. https://doi.org/10.1016/j.talanta.2021.122703
Suanchan K., Chansud N., Sanguanprang S., Bunkoed O. A nanocomposite optosensing probe based on hierarchical porous carbon and graphene quantum dots incorporated in selective polymer for the detection of trace ofloxacin // Colloids Surf. A: Physicochem. Eng. Asp. 2021. V. 628. Article 127376. https://doi.org/10.1016/j.colsurfa.2021.127376
Chansud N., Longnapa N., Bunkoed O. A nanohybrid magnetic sensing probe for levofloxacin determination integrates porous graphene, selective polymer and graphene quantum dots // J. Pharm. Biomed. Anal. 2021. V. 205. Article 114316. https://doi.org/10.1016/j.jpba.2021.114316
Ali H.R., Hassan A.I., Hassan Y.F., El-Wekil M.M. Mannitol capped magnetic dispersive micro-solid-phase extraction of polar drugs sparfloxacin and orbifloxacin from milk and water samples followed by selective fluorescence sensing using boron-doped carbon quantum dots // J. Environ. Chem. Eng. 2021. V. 9. № 2. Article 105078. https://doi.org/10.1016/j.jece.2021.105078
Tang Y., Liu H., Gao J. Liu X., Gao X., Lu X., Fang G., Wang J., Li J. Upconversion particle@Fe3O4@molecularly imprinted polymer with controllable shell thickness as high-performance fluorescent probe for sensing quinolones // Talanta. 2018. V. 181. P. 95. https://doi.org/10.1016/j.talanta.2018.01.006
Vakh C., Pochivalov A., Koronkiewicz S., Kalinowski S., Postnov V., Bulatov A. A chemiluminescence method for screening of fluoroquinolones in milk samples based on a multi-pumping flow system // Food Chem. 2019. V. 270. № 1. P. 10. https://doi.org/10.1016/j.foodchem.2018.07.073
Ding X., Ahmad W., Zareef M., Rong Y., Zhang Y., Wu J., Ouyang Q., Chen Q. MIL-101(Cr)-induced nano-optical sensor for ultra-sensitive detection of enrofloxacin in aquatic products using a fluorescence turn-on mechanism via upconversion nanoparticles // Sens. Actuators B: Chem. 2022. V. 365. Article 131915. https://doi.org/10.1016/j.snb.2022.131915
Yuan X., Lv W., Wang B., Yan C., Ma Q. Zheng B., Du J., Xiao D. Silicon nanoparticles-based ratiometric fluorescence platform: Real-time visual sensing to ciprofloxacin and Cu2+ // Spectrochim. Acta A: Mol. Biomol. Spectrosc. 2021. V. 253. Article 119599. https://doi.org/10.1016/j.saa.2021.119599
Wu C., Cheng R., Wang J., Wang Y., Jing X., Chen R., Lin Sun, Yan Y. Fluorescent molecularly imprinted nanoparticles for selective and rapid detection of ciprofloxacin in aquaculture water // J. Sep. Sci. 2018. V. 41. № 19. P. 3782. https://doi.org/10.1002/jssc.201800418
Jiang D., Wei M., Dub X., Qin M., Shan X., Wang W., Chen Z. Ultrasensitive near-infrared aptasensor for enrofloxacin detection based on wavelength tunable AgBr nanocrystals electrochemiluminescence emission triggered by O-terminated Ti3C2 MXene // Biosens. Bioelectron. 2022. V. 200. Article 113917. https://doi.org/10.1016/j.bios.2021.113917
Rizk M., Habi I.H.I., Mohamed D., Mowak S., El-Eryan Th. Lanthanide-DNA probe for spectrofluorimetric determination of some 6-fluoroquinolones in eye-ear pharmaceutical preparations // Microchem. J. 2019. V. 150. Article 104138. https://doi.org/10.1016/j.microc.2019.104138
Li Z., Cui Z., Tang Y., Liu X., Zhang X., Liu B., Wang X., Draz M.Sh., Gao X. Fluorometric determination of ciprofloxacin using molecularly imprinted polymer and polystyrene microparticles doped with europium(III)(DBM)3phen // Microchim. Acta. 2019. V. 186. P. 334. https://doi.org/10.1007/s00604-019-3448-z
Sari E., Üzek R., Duman M., Denizli A. Detection of ciprofloxacin through surface plasmon resonance nanosensor with specific recognition sites // J. Biomater. Sci. Polym. 2018. V. 29. № 11. P. 1302. https://doi.org/10.1080/09205063.2018.1457417
Okan M., Sari E., Duman M. Molecularly imprinted polymer based micromechanical cantilever sensor system for the selective determination of ciprofloxacin // Biosens. Bioelectron. 2017. V. 88. P. 258. https://doi.org/10.1016/j.bios.2016.08.047
Xu X., Feng L., Li J., Yuan P., Feng J., Wei L., Chen X. Rapid screening detection of fluoroquinolone residues in milk based on turn-on fluorescence of terbium coordination polymer nanosheets // Chin. Chem. Lett. 2019. V. 30. № 3. P. 549. https://doi.org/10.1016/j.cclet.2018.11.026
Song Y., Bai J., Zhang R. He H., Li Ch., Wang J., Li Sh., Yuan Peng Y., Ning B., Wang M., Gao Zh. Michael-addition-mediated photonic crystals allow pretreatment-free and label-free sensoring of ciprofloxacin in fish farming water // Anal. Chem. 2017. V. 90. № 2. P. 1388. https://pubs.acs.org/doi/abs/10.1021/acs.analchem.7b04655
Mohamadian E., Shayanfar A., Khoubnasabjafari M., Jouyban-Gharamaleki V., Ghaffaryf S., Jouyban A. An overview on terbium sensitized based-optical sensors/nanosensors for determination of pharmaceuticals // Appl. Spectrosc. 2022. V. 57. P. 39. https://doi.org/10.1080/05704928.2020.1843174
Ding R., Chen Y., Wang O., Wu Z., Zhang X., Li B., Lin L. Recent advances in quantum dots-based biosensors for antibiotics detection // J. Pharm. Anal. 2022. V. 12. № 3. P. 355. https://doi.org/10.1016/j.jpha.2021.08.002
Liu Q., Zhang H., Jiang H., Yang P., Luo L., Niu Q., You T. Photoactivities regulating of inorganic semiconductors and their applications in photoelectrochemical sensors for antibiotics analysis: A systematic review // Biosens. Bioelectron. 2022. V. 216. Article 114634. https://doi.org/10.1016/j.bios.2022.114634
Bunkoed O., Donkhampa P., Nurerk P. A nanocomposite optosensor of hydroxyapatite and graphene quantum dots embedded within highly specific polymer for norfloxacin detection // Microchem. J. 2020. V. 158. Article 105127. https://doi.org/10.1016/j.microc.2020.105127
Mehlhorn A., Rahimi P., Joseph Y. Aptamer-based biosensors for antibiotic detection: A review // Biosensors. 2018. V. 8. № 2. Article 54. https://doi.org/10.3390/bios8020054
Zhou Y., Mahapatra C., Chen H., Peng X., Ramakrishna S., Nanda H.S. Recent developments in fluorescent aptasensors for detection of antibiotics // Curr. Opin. Biomed. Eng. 2020. V. 13. P. 16. https://doi.org/10.1016/j.cobme.2019.08.003
Hong J., Su M., Zhao K., Zhou Y., Wang J., Zhou S-F., Lin X. A minireview for recent development of nanomaterial-based detection of antibiotics // Biosensors. 2023. V. 13. № 3. Article 327. https://doi.org/10.3390/bios13030327
Егорова А.В., Скрипинец Ю.В., Александрова Д.И., Антонович В.П. Сенсибилизированная люминесценция ионов лантанидов и ее применение в биоанализе (обзор) // Методы и объекты химического анализа. 2010. Т. 5. № 4. С. 180.
Hernandez-Arteseros J.A., Compano R., Ferrer R., Prat M.D. Application principal component regression to luminescence data for the screening of ciprofloxacin and enrofloxacin in animal tissues // Analyst. 2000. V. 125. P. 1155. https://doi.org/10.1039/A910275M
Ocana J.A., Barragan F.J., Callejon M. Spectrofluorimetric determination of moxifloxacin in tablets, human urine and serum // Analyst. 2000. V. 125. № 12. P. 2322. https://doi.org/10.1039/B005991I
Ocaña J.A., Callejón M., Barragán F.J. Terbium-sensitized luminescence determination of levofloxacin in tablets and human urine and serum // Analyst. 2000. V. 125. № 10. P. 1851. https://doi.org/10.1039/b004252h
Ocaña J.A., Callejón M., Barragán F.J. Determination of trovafloxacin in human serum by time resolved terbium-sensitised luminescence // Eur. J. Pharm. Sci. 2001. V. 13. № 3. P. 297. https://doi.org/10.1016/S0928-0987(01)00116-6
Ocaña J.A., Barragán F.J., Callejón M. Spectrofluorimetric and micelle-enhanced spectrofluorimetric determination of gatifloxacin in human urine and serum // J. Pharm. Biomed. Anal. 2005. V. 23. 37. № 2. P. 327. https://doi.org/10.1016/j.jpba.2004.10.027
Wang F., Huang W., Hou Y., Xu Z. The Co-luminescence Effect of Eu–Gd–Ofloxacin–SDBS system and its analytical application // J. Fluoresc. 2007. V. 17. P. 105. https://doi.org/10.1007/s10895-006-0136-2
Guo Ch., Wang L., Hou Zh., Jiang W., Sang L. Micelle-enhanced and terbium-sensitized spectrofluorimetric determination of gatifloxacin and its interaction mechanism // Spectrochim. Acta A. 2009. V. 72. № 3. P. 766. https://doi.org/10.1016/j.saa.2008.10.063
Wu H., Zhao G.-Y., Du L.-M. Determination of ofloxacin and gatifloxacin by mixed micelle-mediated cloud point extraction-fluorimetry combined methodology // Spectrochim. Acta A. 2010. V. 75. P. 1624. https://doi.org/10.1016/j.saa.2010.02.031
Terrado-Campos D., Tayeb-Cherif K., Peris-Vicente J., Carda-Broch S., Esteve-Romero J. Determination of oxolinic acid, danofloxacin, ciprofloxacin, and enrofloxacin in porcine and bovine meat by micellar liquid chromatography with fluorescence detection // Food Chem. 2017. V. 221. P. 1277. https://doi.org/10.1016/j.foodchem.2016.11.029
Wang L., Liu J., Wang Z., Wang Y. Fluorescence resonance energy transfer between cerium ion(III) and levofloxacin in micellar solution and its analytical application to the determination of levofloxacin // Spectrosc. Lett. 2019. V. 52. № 6. P. 313. https://doi.org/10.1080/00387010.2019.1629961
Данилина Т.Г., Смирнова Т.Д., Брышкина А.Д., Левина Н.А., Неврюева Н.В. Влияние мицелл поверхностно-активных веществ на флуоресцентные свойства комплекса иттрия с левофлоксацином // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2019. Т. 19. № 4. С. 372. https://doi.org/10.18500/1816-9775-2019-19-4-372-378
Штыков С.Н., Смирнова Т.Д., Калашникова Н.В., Жемеричкин Д.А. Флуориметрический метод определения норфлоксацина, основанный на явлении переноса энергии // Изв. вузов. Химия и хим. технол. 2006. Т. 49. № 7. С. 27.
Штыков С.Н., Смирнова Т.Д., Неврюева Н.В., Богомолова И.В. Комплексы с переносом энергии в организованных средах для определения флюмеквина в биологических объектах // Изв. вузов. Химия и хим. технол. 2010. Т. 53. № 11. С. 24.
Смирнова Т.Д., Неврюева Н.В. Флуориметрическое определение оксолиновой и налидиксовой кислот с использованием мицеллярных растворов ПАВ // Заводск. лаборатория. Диагностика материалов. 2010. № 12. С. 17.
Смирнова Т.Д., Штыков С.Н., Кочубей В.И., Хрячкова Е.И. Перенос энергии возбуждения в хелате европия с доксициклином в присутствии второго лиганда в мицеллярных растворах неионогенных ПАВ // Оптика и спектроскопия. 2011. Т. 110. № 1. С. 65. https://doi.org/10.1134/S0030400X1101019X (Smirnova T.D., Shtykov S.N., Kochubei V.I., Khryachkova E.S. Excitation energy transfer in europium chelate with doxycycline in the presence of a second ligand in micellar solutions of nonionic surfactants // Optiсs Spectrosс. 2011. V. 110. № 1. P. 60.)
Штыков С.Н., Смирнова Т.Д., Молчанова Ю.В. Синергетические эффекты в системе европий-теноилтрифторацетон-фенантролин в мицеллах блоксополимеров ПАВ и их аналитическое значение // Журн. аналит. химии. 2001. Т. 56. № 10 С. 1052. https://doi.org/10.1023/A:1012305310980 (Shtykov S.N., Smirnova T.D., Molchanova Yu.V. Synergistic effects in the europium(III)–thenoyltrifluoroacetone–1,10-phenanthroline system in micelles of block copolymers of nonionic surfactants and their analytical applications // J. Anal. Chem. 2001. V. 56. № 10. P. 920.)
Смирнова Т.Д., Данилина Т.Г., Русанова Т.Ю., Симбирева Н.А. Влияние серебряных наночастиц на флуоресцентные свойства левофлоксацина в присутствии ионов иттрия(III) в водных и мицеллярных средах поверхностно-активных веществ // Журн. аналит. химии. 2021. Т. 76. № 1. С. 67. https://doi.org/10.31657/s004445022101014x (Smirnova T.D., Danilina T.G., Rusanova T.Yu., Simbireva N.A. Effect of silver nanoparticles on the fluorescence properties of levofloxacin in the presence of yttrium(III) ions in aqueous and micellar surfactant media // J. Anal. Chem. 2021. V. 76. № 1. P. 89.)
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии



