Журнал аналитической химии, 2020, T. 75, № 7, стр. 579-596
Методы определения селективных модуляторов андрогенных рецепторов
А. З. Темердашев a, Е. В. Дмитриева a, *
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
* E-mail: catherine_dmitrieva@outlook.com
Поступила в редакцию 04.07.2019
После доработки 09.09.2019
Принята к публикации 22.01.2020
Аннотация
Описана история появления и развития селективных модуляторов андрогенных рецепторов (САРМ). Рассмотрены основные классы САРМ и различные подходы к их определению. Показана перспективность использования методов хромато-масс-спектрометрии для надежного определения следовых количеств САРМ в различных объектах. Рассмотрены известные способы их пробоподготовки и определения в биологических объектах, проведено сравнение метаболических путей превращения наиболее изученного селективного модулятора андрогенных рецепторов (андарина) с использованием клеточных культур (in vitro), а также in vivo на лабораторных животных и людях.
Андрогенный рецептор – член надсемейства ядерных рецепторов, активируемый лигандами (андрогенами) [1, 2]. Главным циркулирующим андрогеном в организме человека является тестостерон, который в некоторых тканях может быть превращен в более биологически активную форму дигидротестостерон под действием фермента 5α-редуктазы [3–5]. Андрогены необходимы для развития и поддержания вторичных половых признаков у мужчин. Кроме того, они играют важную роль в нерепродуктивных тканях, таких как мышечная и костная, не только у мужчин, но и у женщин [4, 6, 7]. В случае нарушения уровней экспрессии андрогенов возникает необходимость в восполнении их недостатка. Однако серьезные побочные эффекты при проведении терапии тестостероном [8], которые связывают с его метаболитами 5α-дигидротестостероном и эстрадиолом, образующимся по реакции ароматизации [9, 10], привели к поиску селективных лигандов андрогенных рецепторов, способных активировать андрогенный рецептор в определенных тканях, например в мышцах и костях, и обладающих уменьшенной активностью либо ее полным отсутствием в других, в частности, в органах малого таза, сердце и печени, т.е. являющихся смешанными агонистами/антагонистами [11, 12]. Помимо тканеселективности, считается, что идеальные андрогены должны обладать высокой специфичностью к андрогенному рецептору, пероральной биодоступностью и удовлетворительными фармакокинетическими профилями [13].
Первые исследования в 40-х [14] – начале 50-х гг. прошлого века были посвящены структурной модификации эндогенных стероидов и привели к появлению различных синтетических стероидов. По причине низкой пероральной биодоступности тестостерона и дигидротестостерона большинство ранних исследований было посвящено либо ее увеличению, либо улучшению тканеселективности андрогенов. Тем не менее, многие из экзогенных стероидов обладают высокой гепатотоксичностью и кросс-реакциями с другими стероидными рецепторами помимо андрогенного рецептора [6].
Преодолеть данные ограничения позволили синтетические нестероидные лиганды, являющиеся более гибкими при проведении структурной модификации. Первые соединения, описанные в 1970-х, являются антагонистами андрогенных рецепторов и все еще используются при лечении рака предстательной железы, но они не обладают удовлетворительной тканеселективностью. Интерес к развитию нестероидных андрогенов возродился в 1980–1990-х гг. после успешного применения селективных модуляторов эстрогенных рецепторов для восполнения дефицита эстрогенов у женщин [6].
В 1998 г. двумя независимыми исследовательскими группами из университета Теннесси и фармацевтической компании Ligand Pharmaceuticals были представлены первые нестероидные андрогены, получившие название селективных модуляторов андрогенных рецепторов (САРМ) по аналогии с селективными модуляторами эстрогенных рецепторов. Группой ученых из университета Теннесси под руководством Джеймса Далтона на основе уже известных структур антагонистов андрогенных рецепторов бикалутамида и флутамида был описан класс САРМ – производных арилпропионамида [15], а исследователями из Ligand Pharmaceuticals представлен класс производных хинолина [9, 16, 17] (схема 1 ).
Схема 1 . Структурные формулы антагонистов андрогенных рецепторов: (а) – бикалутамид, (б) – флутамид.
С момента открытия первых представителей описано более десятка классов САРМ, которые можно разделить на стероидные и нестероидные (табл. 1).
Таблица 1.
Классификация некоторых представителей селективных модуляторов андрогенных рецепторов
| Класс | Тривиальное название представителя класса | Элементный состав | Структурная формула представителя класса | Литера-тура |
|---|---|---|---|---|
| Производные арилпропионамида | S-1 | C17H14F4N2O5 |  |
[18] |
| S-4 (GTx-007, андарин) |
C19H18F3N3O6 |  |
[19] | |
| S-9 | C17H14ClF3N2O5 |  |
[20] | |
| S-22 (GTx-024, MK-2866, остарин) |
C19H14F3N3O3 |  |
[21] | |
| S-23 | C18H13ClF4N2O3 |  |
[22] | |
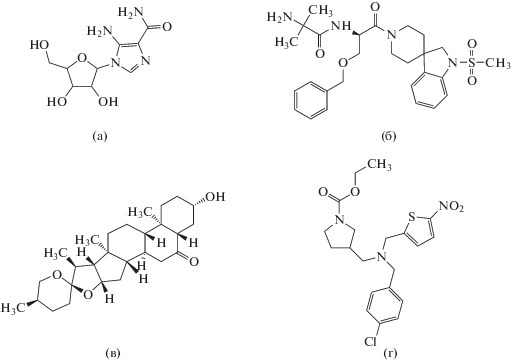
| Производные хинолина | LGD-2226 | C14H9F9N2O |  |
[23] |
| LGD-2941 | C17H16F6N2O2 | 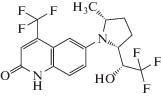 |
[24] | |
| LGD-3303 | C16H14ClF3N2O |  |
[24] | |
| LG-121071 | C15H15F3N2O |  |
[25] | |
| PF-06260414 | C14H14N4O2S |  |
[26] | |
| Производные тетрагидрохинолина | S-40503 | C15H23N3O3 |  |
[24] |
| S-49288 | C25H26N4O |  |
[27] | |
| S-101479 | C26H24F2N4O3 |  |
[27] | |
| Производные гидантоина | BMS-564929 | C14H12ClN3O3 |  |
[28] |
| Производные диарилгидантоина | DT-200 (GLPG0492) |
C19H14F3N3O3 |  |
[29] |
| Производные пирролидинабензонитрила | LGD-4033 (VK-5211, лигандрол) |
C14H12F6N2O |  |
[30] |
| Производные тропанола | AC-262536 (сармастол) |
C18H18N2O |  |
[24] |
| ACP-105 | C16H19ClN2O |  |
[24] | |
| Производные фенилпиразолкарбоксамида | JNJ-28330835 | C14H10F6N4O |  |
[31] |
| Производные фенилоксадиазола | RAD-140 (радарин) |
C20H16ClN5O2 | 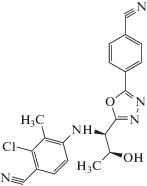 |
[32] |
| Производные бензоимидазола | JNJ-37654032 | C11H7Cl2F3N2O |  |
[33] |
| Производные индола | RAD-35010 | C13H11ClF3NO |  |
[34] |
| LY-2452473 | C23H23N3O2 |  |
[35] | |
| GSK2881078 | C14H13F3N2O2S |  |
[36] | |
| Производные пиридинилметанамида | 2-FPA | C17H19FN2O |  |
[24] |
| Производные фенилметанамида | MK-3984 | C17H12F7NO2 |  |
[37] |
| Производные тиофена | NEP28 | C10H10BrF3N2S |  |
[38] |
| Стероидные | YK-11 (миостоп) |
C25H34O6 |  |
[39] |
| MK-0773 | C27H34FN5O2 |  |
[40] |
Несмотря на значительное количество описанных классов САРМ, поиск новых соединений продолжается и в настоящее время. Помимо заместительной гормональной терапии рассматривается возможность применения САРМ для лечения ряда других заболеваний, включая остеопороз [41], заболеваний, связанных с потерей мышечной массы [42, 43], болезни Альцгеймера [38], доброкачественной гиперплазии предстательной железы [44], а также в качестве мужских контрацептивов [22, 45].
По причине анаболического действия и сниженных побочных эффектов возможность злоупотребления этими препаратами профессиональными спортсменами весьма высока, что послужило причиной их запрета Всемирным антидопинговым агентством (ВАДА) в 2008 г. [46].
Несмотря на то, что в настоящее время многие САРМ находятся на разных стадиях клинических испытаний, уже несколько лет их приобретение возможно через интернет, поэтому существует необходимость разработки методик их контроля. Кроме того, учитывая популярность САРМ на черном рынке, на сегодняшний день под их видом реализуются препараты, относящиеся к другим классам. В частности, лаксогенин относится к фитостероидам [47, 48], ибутаморен (MK-677) – непептидный секретагог гормона роста [49], реверол (SR-9009) является Rev-Erbα агонистом [50], а эндогенный AICAR (акадезин) – агонистом аденозинмонофосфат активируемой протеинкиназы [51, 52] (схема 2 ). Следует отметить, что, несмотря на отличающиеся от САРМ механизмы действия, употребление данных препаратов приводит к близким эффектам на организм, поэтому некоторые из них также включены в перечень запрещенных ВАДА к употреблению препаратов.
Определение селективных модуляторов андрогенных рецепторов. В настоящее время одними из наиболее широко используемых методов определения ксенобиотиков являются газовая и жидкостная хроматография в сочетании с масс-спектрометрическим детектированием. Несмотря на наличие в газовой хромато-масс-спектрометрии с электронной ионизацией библиотек масс-спектров, позволяющих проводить первичную идентификацию аналитов в случаях, когда спектры исследуемых соединений имеются в библиотеке, данный метод не лишен недостатков. Его нельзя применять для определения макромолекул, полярных и труднолетучих молекул без проведения реакций дериватизации, которая позволяет повысить летучесть соединений, но существенно увеличивает продолжительность анализа [53, 54].
Метод жидкостной хромато-масс-спектрометрии без перевода аналитов в газовую фазу, сочетающий высокие чувствительность и селективность определения веществ, во многих случаях занимает значительно меньше времени и, следовательно, пригоден для определения макромолекул, а также термически лабильных веществ.
Схема 2 . Структурные формулы соединений, реализуемых под видом селективных модуляторов андрогенных рецепторов: (а) – AICAR, (б) – ибутаморен, (в) – лаксогенин, (г) – реверол.
Основными биологическими матрицами, применяемыми для определения запрещенных препаратов в допинг-контроле, являются кровь и моча. Хотя образцы крови обычно лучше отражают фармакокинетику препаратов, моча предпочтительнее при скрининге различных ксенобиотиков, поскольку она обеспечивает более широкое “окно” для их обнаружения [55]. Cодержание нативных аналитов и их метаболитов, как правило, выше в моче [56]. Кроме того, процедура ее получения является неинвазивной и не сопряжена со стрессом.
В качестве альтернативных биологических матриц для определения некоторых селективных модуляторов андрогенных рецепторов используют также волосы [57] и выдыхаемый воздух человека [58].
Метаболизм ксенобиотиков. При разработке методик определения ксенобиотиков в биологических жидкостях человека одним из главных вопросов становится форма, в которой определяют аналит, будь то соединение в неизменной форме или его метаболиты. Ответ на данный вопрос можно получить на основе анализа сведений о биотрансформации соединения в организме человека. Этот процесс обычно состоит из двух стадий: реакции функционализации (первая стадия) и реакции конъюгации (вторая стадия) [59]. Кроме того, иногда выделяют третью стадию метаболизма, под которой понимают дельнейшую модификацию и экскрецию препарата из организма человека [60, 61].
Реакции первой стадии заключаются во введении новых или изменении уже присутствующих в молекуле функциональных групп; к ним относятся гидролиз, восстановление, окисление. К реакциям второй стадии относятся реакции образовании ковалентной связи между метаболитом первой стадии (или родительской молекулой) и эндогенными молекулами, такие как глюкуронидация, сульфонирование, ацетилирование, метилирование, конъюгация с глютатионом или аминокислотами. Полученные сильнополярные конъюгаты обычно неактивны и быстро выводятся из организма.
Метаболические превращения веществ являются по своей природе ферментативными. Наиболее важной группой метаболизирующих ферментов являются цитохромы P450 (CYP450), вовлеченные в первую стадию метаболизма (процесс окисления) большого числа ксенобиотиков [60, 62, 63]. Среди ферментов, катализирующих реакции второй стадии метаболизма, наиболее значимыми являются некоторые изоформы УДФ-глюкуронилтрансферазы, приводящие к образованию глюкуронидов [64].
Поскольку по этическим причинам проведение контролируемых исследований для установления метаболизма новых препаратов с привлечением людей in vivo исключено, на ранних стадиях изучения метаболизма препаратов применяют относительно простые системы in vitro. Наиболее часто используемыми моделями in vitro являются рекомбинантные ферменты, субклеточные фракции (фракции микросом, цитозоля, S-9) и клеточные органеллы (гепатоциты, фрагменты печени) [65–67]. Исследования in vitro позволяют оценить такие важные аспекты метаболизма, как токсичность и кросс-реакции с другими соединениями [68]. Однако данные системы обычно имеют ограниченную ценность – они показывают только один или несколько аспектов метаболизма, не отражая полной картины [69, 70]. По этой причине пути метаболизма устанавливают также in vivo на лабораторных животных. В настоящее время первичные клинические испытания проводят в основном на крысах, поскольку они являются сравнительно дешевыми и не требуют большого количества тестируемого соединения. Исследования на крысах позволяют оценить такие возможные проблемы, как низкое всасывание или высокий клиренс, приводящие к неудовлетворительной фармакокинетике [70]. Метаболические пути, установленные на лабораторных животных, являются отправной точкой для установления метаболитов у людей. Тем не менее, метаболиты и токсические действия у животных и людей часто различаются [71]. Например, для производного арилпропионамида андарина всесторонне изучены метаболиты с использованием моделей in vitro и in vivo на животных и людях, а также с использованием штамма Cunninghamella elegans (C. elegans) (схема. 3, табл. 2). При сравнении метаболитов, найденных у человека, с остальными моделями видны значимые различия в результатах. Очевидно, что в случае несовпадения результатов in vitro и in vivo превалирует результат, полученный in v-ivo у человека.
Таблица 2.
Наличие метаболитов андарина (S-4), идентифицированных у человека с использованием различных моделей in vitro и in vivo
| Метаболит, найденный в моче человека | Процесс биотрансформации | C. elegans [75] | in vitro микросомы печени |
in vivo моча |
||||
|---|---|---|---|---|---|---|---|---|
| лошади [76] | быка [77] | человека [78] | крысы [79] | собаки [79] | лошади [80] | |||
| S-4 | Нативное соединение | + | + | + | + | + | + | + |
| M1 | Восстановление нитрогруппы, дезацетилирование и сульфонирование | – | – | – | – | – | – | – |
| M2 | Дезацетилирование и глюкуронидация | – | – | – | – | – | – | – |
| M3 | Дезацетилирование, моногидроксилирование и глюкуронидация | – | – | – | – | – | – | – |
| M4 | Отщепление B-кольца и глюкуронидация | – | – | – | – | – | – | – |
| M5 | Отщепление B-кольца | + | + | + | + | – | – | + |
| M6 | Дигидроксилирование и глюкуронидация | – | – | – | – | – | – | – |
| M7 | Моногидроксилирование и глюкуронидация | – | – | – | – | – | – | – |
| M8 | Моногидроксилирование и глюкуронидация | – | + | – | + | – | – | – |
| M9 | Глюкуронидация | – | + | – | + | – | – | – |
| M10 | Дезацетилирование и сульфонирование | – | – | – | – | – | – | – |
Схема 3 . Идентифицированные метаболиты андарина (S-4) в моче человека (по данным [72] (а), [73] (б), [74] (в)).
Одновременное развитие знаний о метаболизме ксенобиотиков и вычислительной мощности компьютеров за последние десятилетия привело к разработке и внедрению моделей in silico не только для обработки и интерпретации данных о метаболитах, но для и предсказания подверженных метаболизму сайтов в молекуле (MetaboLynx, METEOR, MetaSite) [59]. Однако многие исследователи считают, что это всего лишь один из множества инструментов для установления путей метаболизма ксенобиотиков, и он не должен использоваться как “черный ящик”, но может быть полезен при совмещении эмпирических подходов вместе с знаниями исследователя [81].
Определение селективных модуляторов андрогенных рецепторов в нативном виде. Наиболее простыми способами пробоподготовки при определении аналита в нативном виде являются разбавление пробы и осаждение белков. Однозначным их преимуществом является отсутствие потерь аналита, но подобная пробоподготовка приводит к получению “грязных” проб [56]. Такие процедуры обычно используют при скрининговом анализе для качественной идентификации. В случае проведения количественной оценки содержания аналита в нативном виде необходимо учитывать матричные эффекты, способные как усиливать, так и уменьшать эффективность ионизации аналита [82–86]. Для этого рекомендуется использовать внутренний стандарт [87, 88]. Кроме того, существенным ограничением данных способов подготовки проб к анализу является отсутствие стадии концентрирования, что приводит к потере чувствительности определения аналитов.
Для очистки проб от матричных компонентов и концентрирования аналитов в нативном виде также используют твердофазную экстракцию (ТФЭ). Для концентрирования САРМ описано использование полимерных сорбентов (сополимеры стирола/дивинилбензола и N-винилпирролидона/дивинилбензола) и сорбентов с неполярными привитыми фазами (С8, С18) (табл. 3). Кроме того, известен способ определения САРМ в моче с использованием жидкость–жидкостной экстракции трет-бутилметиловым эфиром в щелочной среде [92].
Таблица 3.
Определение селективных модуляторов андрогенных рецепторов в нативном виде методом высокоэффективной жидкостной хроматографии–масс-спектрометрии
| Аналит | Матрица | Пробо-подготовка | Колонка | Подвижная фаза | Тип масс-спектрометри-ческого детектора | Предел обнаружения, нг/мл | Лите-ратура |
|---|---|---|---|---|---|---|---|
| S-4 | Моча человека | Разбавление образца | Nucleodur C18 Pyramid (2 × 50 мм, 3 мкм) |
5 мМ ацетатный буфер, содержащий 0.1%-ную ледяную уксусную кислоту/ацетонитрил | Тройной квадрупольный/линейная ионная ловушка | 1 | [89] |
| S-4, S-22, метаболит S-22, S-23, S-24 | Моча человека | Разбавление образца | Nucleoshell RP18plus (2 × 50 мм, 2.7 мкм) |
5 мМ ацетатный буфер, содержащий 0.1%-ную уксусную кислоту/ацетонитрил | Орбитальная ловушка | <0.1 | [90] |
| S-4 | Моча человека | Разбавление образца | Phenomenex Kinetex C18 (2.1 × 100 мм, 1.7 мкм) |
0.1%-ная муравьиная кислота в воде/0.1%-ная муравьиная кислота в метаноле | Тройной квадрупольный | 0.5 | [91] |
| S-1, S-4, S-22 | Лошадиная моча | Разбавление образца | Aquity UPLC BEH C18 (2.1 × 100 мм, 1.7 мкм) |
0.1%-ная муравьиная кислота в воде/метанол | Квадруполь- времяпролетный | – | [80] |
| AC-262536, S-1, S-4, S-6, S-9, S-22, S-23, BMS-564929, GLPG0492, LGD-2226, LGD-4033, LY-2452473, PF-06260414, RAD-140 | Моча человека, лошади, собаки, быка, мыши | ЖЖЭ* | Luna Omega Polar C18 (2.1 × 100 мм, 1.6 мкм) |
0.1%-ная уксусная кислота в воде/0.1%-ная уксусная кислота в метаноле | Тройной квадрупольный | 1–5 | [92] |
| Производные арил-пропионамида | Моча человека | ТФЭ (PAD-1) | Macherey-Nagel C-18 Isis (4 × 70 мм) |
5 мМ ацетатный буферный раствор, содержащий 0.1%-ную уксусную кислоту/ацетонитрил | Тройной квадрупольный | 1 | [11] |
| S-22, S-23 и их метаболиты | Лошадиная моча | ТФЭ (PAD-1) | XTerra RP18 Isis (2.1 × 150 мм, 3.5 мкм) |
5 мМ ацетатный буфер, содержащий 0.1% уксусную кислоту/метанол | Ионная ловушка | – | [93] |
| Производные бензоимидазола и гидантоина | Моча человека | ТФЭ (PAD-1) | Macherey-Nagel Pyramid (4 × 70 мм, 5 мкм) |
5 мМ ацетатный буферный раствор, содержащий 0.1%-ную уксусную кислоту/ацетонитрил : метанол (1 : 1, по объему) | Ионная ловушка | 1 | [94] |
| S-1, S-4, S-22 | Лошадиная моча | ТФЭ (C18; HLB) | Aquity UPLC BEH C18 (2.1 × 100 мм, 1.7 мкм) |
0.1%-ная муравьиная кислота в воде/метанол | Квадруполь-времяпролетный | – | [80] |
| S-40503 | Плазма человека | Осаждение белков | Macherey-Nagel Sphinx (4 × 70 мм, 5 мкм) |
5 мМ ацетатный буфер, содержащий 0.1%-ную уксусную кислоту/метанол | Ионная ловушка | 8.3 | [95] |
| S-1, S-4, S-22 и их метаболиты | Лошадиная плазма | Осаждение белков | Aquity UPLC BEH C18 (2.1 × 100 мм, 1.7 мкм) |
0.1%-ная муравьиная кислота в воде/метанол | Квадруполь-времяпролетный | – | [96] |
| S-1 | Плазма крыс | Осаждение белков | Waters Nova-pak C18 (3.9 × 150 мм, 4 мкм) |
Вода/ацетонитрил | Ионная ловушка | <0.3 | [97] |
| S-1, S-4, S-9, S-24 | Плазма человека | Осаждение белков | Hypersil gold C18 (2.1 × 50 мм, 1.7 мкм) |
0.2%-ная муравьиная кислота в воде/ацетонитрил | Орбитальная ловушка | 10 | [98] |
| S-4 | Лошадиная плазма | ТФЭ (C8/SCX) | SunFire C18 (2.1 × 100 мм, 3.5 мкм) |
0.1%-ная муравьиная кислота в воде/0.1%-ная муравьиная кислота в метаноле | Орбитальная ловушка | – | [99] |
Как видно из табл. 3, в некоторых случаях с применением описанных процедур помимо нативных соединений возможно определение и некоторых мажорных метаболитов. Применение данных подходов возможно лишь для ограниченного числа соединений, поэтому для оценки содержания остальных аналитов в организме человека требуется разработка методик определения метаболитов.
Определение метаболитов селективных модуляторов андрогенных рецепторов. Основными методами идентификации и установления структур метаболитов являются газовая и жидкостная хромато-масс-спектрометрия, которые позволяют не только установить молекулярную массу целевого соединения, но и его структуру, исходя из данных о его фрагментации. Вместе с тем сопоставление молекулярной массы родительского соединения и метаболита может указать на путь метаболизма, поскольку метаболические процессы обычно приводят к характерным изменениям молекулярных масс [63]. Некоторые из подобных изменений масс и соответствующих им процессов представлены в табл. 4.
Таблица 4.
| Биотрансформация | Изменения в молекулярной формуле | Изменение массы, Да |
|---|---|---|
| Реакции первой стадии | ||
| Потеря нитрогруппы | −NO2 + H | −44.9851 |
| Декарбоксилирование | −CO2 | −43.9898 |
| Восстановление нитрогруппы | +H2 − O2 | −29.9742 |
| Дезэтилирование | −C2H4 | −28.0312 |
| Дезметилирование | −CH2 | −14.0157 |
| Дегидрирование (окисление) | −H2 | −2.0157 |
| Гидрирование (восстановление) | +H2 | +2.0157 |
| Метилирование | +CH2 | +14.0157 |
| Гидроксилирование | +O | +15.9949 |
| Гидратация | +H2O | +18.0106 |
| Реакции второй стадии | ||
| Сульфонирование | +SO3 | +79.9568 |
| Глюкуронидация | +C6H8O6 | +176.0321 |
При проведении газового хромато-масс-спектрометрического анализа используют как источники электронной ионизации, дающие информативные с точки зрения установления структуры спектры, так и источники химической ионизации в качестве подтверждающего метода, необходимого для получения интенсивного пика молекулярного иона. Существенным недостатком данного метода является необходимость проведения экстракции и дериватизации метаболитов, что существенно усложняет пробоподготовку и увеличивает общую продолжительность анализа [63]. Можно заключить, что для определения метаболитов САРМ наиболее перспективен метод жидкостной хромато-масс-спектрометрии.
При определении структуры с применением источников ионизации при атмосферном давлении (мягкая ионизация) в основном образуется пик молекулярного иона, протонированного или депротонированного [88], который является малоинформативным. Для получения фрагментарных ионов используют высокоэнергетическую соударительную диссоциацию с применением тройных квадрупольных, либо квадруполь-времяпролетных масс-спектрометров или ионных ловушек. Для большинства САРМ подробно описана фрагментация в масс-спектрометре [11, 39, 103–106]. Для изучения некоторых процессов биотрансформации с учетом изменения молекулярных масс удобно использовать тандемное масс-спектрометрическое детектирование в режиме регистрации нейтральной потери (neutral loss). Например, для метаболитов второй стадии величина нейтральной потери 176 Да соответствует отрыву глюкуронового остатка, а 80 Да – сульфогруппы.
В качестве пробоподготовки при определении САРМ в моче человека традиционно используют процедуру ферментативного гидролиза с последующей жидкость−жидкостной экстракцией (ЖЖЭ) и определением аналитов методом жидкостной хромато-масс-спектрометрии (табл. 5). На первой стадии проводят инкубацию мочи с ферментом [109] при оптимальных для данного фермента pH и температуре [110]. В настоящее время наиболее часто применяют фермент β‑глюкуронидазу E. coli, приводящую к гидролизу глюкуронидов. Затем экстрагируют деконъюгаты метаболитов диэтиловым или метил-трет-бутиловым эфиром в щелочной среде с последующим упариванием органического слоя и повторным растворением в подходящем растворителе, например, в подвижной фазе. В качестве альтернативы ЖЖЭ описано использование твердофазной экстракции для извлечения аналитов из мочи после ферментативного гидролиза [80].
Таблица 5.
Определение метаболитов селективных модуляторов андрогенных рецепторов методом высокоэффективной жидкостной хроматографии−масс-спектрометрии
| Аналит | Матрица | Пробоподготовка | Колонка | Подвижная фаза | Детектор | Предел обнаружения, нг/мл | Литература |
|---|---|---|---|---|---|---|---|
| LGD-4033 и метаболиты | Моча человека | Ферментативный гидролиз, ЖЖЭ | Restek Raptor Biphenyl (2 × 100 мм, 2.7 мкм) |
25 мМ формиат аммония, содержащий 0.1%-ную муравьиную кислоту/ацетонитрил | Тройной квадрупольный | – | [107] |
| S-4 и метаболиты | Моча человека | Ферментативный гидролиз, ЖЖЭ | Phenomenex Synergi MAX (2 × 50 мм, 5 мкм) |
– | Тройной квадрупольный/линейная ионная ловушка | 0.1 | [74] |
| S-4 и метаболиты | Моча человека | Ферментативный гидролиз, ЖЖЭ | Aquity UPLC BEH C18 (2.1 × 100 мм, 1.7 мкм) |
0.1%-ная муравьиная кислота в воде/0.1%-ная муравьиная кислота в метаноле | Квадруполь-времяпролетный | – | [73] |
| Производные тетрагидрохинолина | Моча человека | Ферментативный гидролиз, ЖЖЭ | Zorbax XDB-C8 (4.6 × 150 мм, 5 мкм) |
5 мМ ацетат аммония, содержащий 0.1%-ную уксусную кислоту/ацетонитрил: метанол (1 : 1, по объему) | Ионная ловушка | 0.2−0.6 | [108] |
| Производные хинолина | Моча человека | Ферментативный гидролиз, ЖЖЭ | Macherey-Nagel Sphinx (4.0 × 70 мм, 5 мкм) |
5 мМ ацетат аммония, содержащий 0.1%-ную уксусную кислоту/ацетонитрил | Ионная ловушка | 0.05−1 | [104] |
| S-1, S-4, S-22 и метаболиты | Лошадиная моча | Ферментативный гидролиз, ТФЭ (HLB) | Aquity UPLC BEH C18 (2.1 × 100 мм, 1.7 мкм) |
0.1%-ную муравьиная кислота в воде/метанол | Квадруполь-времяпролетный | – | [80] |
Процедура газового хромато-масс-спектрометрического определения триметилсилильных производных нативных соединений и их метаболитов применена для производных хинолина [111, 112], гидантоина [113] и арилпропионамида [72]. Она аналогична ранее описанной процедуре с применением метода ВЭЖХ−МС, но с дериватизацией после упаривания органического слоя для увеличения летучести соединения [114]. Недостатками данной процедуры являются длительность и сложность пробоподготовки. Тем не менее, ее можно использовать в качестве подтверждающей при определении некоторых САРМ.
* * *
Таким образом, стремительное развитие селективных модуляторов андрогенных рецепторов требует разработки методик одновременного определения широкого круга соединений, особенно в биологических жидкостях. В этом случае первоочередной задачей становится поиск метаболитов, что позволит увеличить “окно” для определения данных соединений в биологических жидкостях по сравнению с нативными молекулами. Для этих целей наиболее эффективным является использование методов хромато-масс-спектрометрии.
Исследования проводили при финансовой поддержке РФФИ, проект № 18-33-20009 мол_а_вед, с участием специалистов ЦКП “Эколого-аналитический центр” Кубанского государственного университета, уникальный идентификатор центра RFMEFI59317Х0008.
Список литературы
Gao W., Bohl C.E., Dalton J.T. Chemistry and structural biology of androgen receptor // Chem. Rev. 2005. V. 105. № 9. P. 3352.
Nagata N., Miyakawa M., Amano S., Furuya K., Yamamoto N., Inoguchi K. Design and synthesis of tricyclic tetrahydroquinolines as a new series of nonsteroidal selective androgen receptor modulators (SARMs) // Bioorg. Med. Chem. Lett. 2011. V. 21. № 6. P. 1744.
Davey R.A., Grossmann M. Androgen receptor structure, function and biology: from bench to bedside // Clin. Biochem. Rev. 2016. V. 37. № 1. P. 3.
McEwan I.J. Androgen receptor modulators: a marriage of chemistry and biology // Future Med. Chem. 2013. V. 5. № 10. P. 1109.
Chang C., Saltzman A., Yeh S., Young W., Keller E., Lee H.J., Wang C., Mizokami A. Androgen receptor: an overview // Crit. Rev. Eukaryot. Gene. Expr. 1995. V. 5. № 2. P. 97.
Gao W., Dalton J.T. Expanding the therapeutic use of androgens via selective androgen receptor modulators (SARMs) // Drug Discov. Today. 2007. V. 12. № 5–6. P. 241.
Palvimo J.J. The androgen receptor // Mol. Cell Endocrinol. 2012. V. 352. № 1–2. P. 1.
Narayanan R., Coss C.C., Dalton J.T. Development of selective androgen receptor modulators (SARMs) // Mol. Cell Endocrinol. 2018. V. 465. P. 134.
Hamann L.G., Mani N.S., Davis R.L., Wang X.N., Marschke K.B., Jones T.K. Discovery of a potent, orally active, nonsteroidal androgen receptor agonist: 4-ethyl-1,2,3,4-tetrahydro-6- (trifluoromethyl)-8-pyridono[5,6-g]-quinoline (LG121071) // J. Med. Chem. 1999. V. 42. № 2. P. 210.
Bhasin S., Calof O.M., Storer T.W., Lee M.L., Mazer N.A., Jasuja R., Montori V.M., Gao W., Dalton J.T. Drug insight: testosterone and selective androgen receptor modulators as anabolic therapies for chronic illness and aging // Nat. Clin. Pract. Endocrinol. Metab. 2006. V. 2. № 3. P. 146.
Thevis M., Kamber M., Schänzer W. Screening for metabolically stable aryl-propionamide-derived selective androgen receptor modulators for doping control purposes // Rapid Commun. Mass Spectrom. 2006. V. 20. № 5. P. 870.
Choi S.M., Lee B.M. Comparative safety evaluation of selective androgen receptor modulators and anabolic androgenic steroids // Expert Opin. Drug Saf. 2015. V. 14. № 11. P. 1773.
Clarke B.L., Khosla S. New selective estrogen and androgen receptor modulators // Curr. Opin. Rheumatol. 2009. V. 21. № 4. P. 374.
Bhasin S., Jasuja R. Selective androgen receptor modulators as function promoting therapies // Curr. Opin. Clin. Nutr. Metab. Care. 2009. V. 12. № 3. P. 232.
Dalton J.T., Mukherjee A., Zhu Z., Kirkovsky L., Miller D.D. Discovery of nonsteroidal androgens // Biochem. Biophys. Res. Commun. 1998. V. 244. № 1. P. 1.
Edwards J.P., West S.J., Pooley C.L., Marschke K.B., Farmer L.J., Jones T.K. New nonsteroidal androgen receptor modulators based on 4-(trifluoromethyl)-2(1H)-pyrrolidino[3,2-g]quinolinone // Bioorg. Med. Chem. Lett. 1998. V. 8. № 7. P. 745.
Negro-Vilar A. Selective androgen receptor modulators (SARMs): a novel approach to androgen therapy for the new millennium // J. Clin. Endocrinol. Metab. 1999. V. 84. № 10. P. 3459.
Kim J., Wu D., Hwang D.J., Miller D.D., Dalton J.T. The para substituent of S-3-(phenoxy)-2-hydroxy-2-methyl-N-(4-nitro-3-trifluoromethyl-phenyl)-propionamides is a major structural determinant of in vivo disposition and activity of selective androgen receptor modulators // J. Pharmacol. Exp. Ther. 2005. V. 315. № 1. P. 230.
Kearbey J.D., Wu D., Gao W., Miller D.D., Dalton J.T. Pharmacokinetics of S-3-(4-acetylamino-phenoxy)-2-hydroxy-2-methyl-N-(4-nitro-3-trifluoromethyl-phenyl)-propionamide in rats, a non-steroidal selective androgen receptor modulator // Xenobiotica. 2004. V. 34. № 3. P. 273.
Marhefka C.A., Gao W., Chung K., Kim J., He Y., Yin D., Bohl C., Dalton J.T., Miller D.D. Design, synthesis, and biological characterization of metabolically stable selective androgen receptor modulators // J. Med. Chem. 2004. V. 47. № 4. P. 993.
Kim J., Wang R., Veverka K.A., Dalton J.T. Absorption, distribution, metabolism and excretion of the novel SARM GTx-024 [(S)-N-(4-cyano-3-(trifluoromethyl)phenyl)-3-(4-cyanophenoxy)-2-hydroxy-2-methylpropanamide] in rats // Xenobiotica. 2013. V. 43. № 11. P. 993.
Jones A., Chen J., Hwang D.J., Miller D.D., Dalton J.T. Preclinical characterization of a (S)-N-(4-cyano-3-trifluoromethyl-phenyl)-3-(3-fluoro, 4-chlorophenoxy)-2-hydroxy-2-methyl-propanamide: a selective androgen receptor modulator for hormonal male contraception // Endocrinology. 2009. V. 150. № 1. P. 385.
Miner J.N., Chang W., Chapman M.S., Finn P.D., Hong M.H., López F.J., Marschke K.B., Rosen J., Schrader W., Turner R., van Oeveren A., Viveros H., Zhi L., Negro-Vilar A. An orally active selective androgen receptor modulator is efficacious on bone, muscle, and sex function with reduced impact on prostate // Endocrinology. 2007. V. 148. № 1. P. 363.
Zhang X., Sui Z. Deciphering the selective androgen receptor modulators paradigm // Expert Opin. Drug Discov. 2013. V. 8. № 2. P. 191.
Knoop A., Krug O., Vincenti M., Schänzer W., Thevis M. In vitro metabolism studies on the selective androgen receptor modulator (SARM) LG121071 and its implementation into human doping controls using liquid chromatography-mass spectrometry // Eur. J. Mass Spectrom. 2015. V. 21. № 1. P. 27.
Bhattacharya I., Tarabar S., Liang Y., Pradhan V., Owens J., Oemar B. Safety, pharmacokinetic, and pharmacodynamic evaluation after single and multiple ascending doses of a novel selective androgen receptor modulator in healthy subjects // Clin. Ther. 2016. V. 38. № 6. P. 1401.
Furuya K., Yamamoto N., Ohyabu Y., Morikyu T., Ishige H., Albers M., Endo Y. Mechanism of the tissue-specific action of the selective androgen receptor modulator S-101 479 // Biol. Pharm. Bull. 2013. V. 36. № 3. P. 442.
Zhang X., Allan G.F., Sbriscia T., Linton O., Lundeen S.G., Sui Z. Synthesis and SAR of novel hydantoin derivatives as selective androgen receptor modulators // Bioorg. Med. Chem. Lett. 2006. V. 16. № 22. P. 5763.
Nique F., Hebbe S., Triballeau N., Peixoto C., Lefrançois J.M., Jary H., Alvey L., Manioc M., Housseman C., Klaassen H., Van Beeck K., Guédin D., Namour F., Minet D., Van der Aar E., Feyen J., Fletcher S., Blanqué R., Robin-Jagerschmidt C., Deprez P. Identification of a 4-(hydroxymethyl)diarylhydantoin as a selective androgen receptor modulator // J. Med. Chem. 2012. V. 55. № 19. P. 8236.
Krug O., Thomas A., Walpurgis K., Piper T., Sigmund G., Schänzer W., Laussmann T., Thevis M. Identification of black market products and potential doping agents in Germany 2010-2013 // Eur. J. Clin. Pharmacol. 2014. V. 70. № 11. P. 1303.
Allan G.F., Tannenbaum P., Sbriscia T., Linton O., Lai M.T., Haynes-Johnson D., Bhattacharjee S., Zhang X., Sui Z., Lundeen S.G. A selective androgen receptor modulator with minimal prostate hypertrophic activity enhances lean body mass in male rats and stimulates sexual behavior in female rats // Endocrine. 2007. V. 32. № 1. P. 41.
Miller C.P., Shomali M., Lyttle C.R., O’Dea L.S., Herendeen H., Gallacher K., Paquin D., Compton D.R., Sahoo B., Kerrigan S.A., Burge M.S., Nickels M., Green J.L., Katzenellenbogen J.A., Tchesnokov A., Hattersley G. Design, synthesis, and preclinical characterization of the selective androgen receptor modulator (SARM) RAD140 // ACS Med. Chem. Lett. 2010. V. 2. № 2. P. 124.
Allan G., Sbriscia T., Linton O., Lai M.T., Haynes-Johnson D., Bhattacharjee S., Ng R., Sui Z., Lundeen S. A selective androgen receptor modulator with minimal prostate hypertrophic activity restores lean body mass in aged orchidectomized male rats // J. Steroid. Biochem. Mol. Biol. 2008. V. 110. № 3–5. P. 207.
Miller C.P., Bhaket P., Muthukaman N., Lyttle C.R., Shomali M., Gallacher K., Slocum C., Hattersley G. Synthesis of potent, substituted carbazoles as selective androgen receptor modulators (SARMs) // Bioorg. Med. Chem. Lett. 2010. V. 20. № 24. P. 7516.
Yi P., Rehmel J.F., Cassidy K., Hadden C., Campanale K., Patel N., Johnson J. Disposition and metabolism of LY2452473, a selective androgen receptor modulator, in humans // Drug Metab. Dispos. 2012. V. 40. № 12. P. 2354.
Aikawa K., Asano M., Ono K., Habuka N., Yano J., Wilson K., Fujita H., Kandori H., Hara T., Morimoto M., Santou T., Yamaoka M., Nakayama M., Hasuoka A. Synthesis and biological evaluation of novel selective androgen receptor modulators (SARMs). Part III: Discovery of 4-(5-oxopyrrolidine-1-yl)benzonitrile derivative 2f as a clinical candidate // Bioorg. Med. Chem. 2017. V. 25. № 13. P. 3330.
Dalton J.T., Taylor R.P., Mohler M.L., Steiner M.S. Selective androgen receptor modulators for the prevention and treatment of muscle wasting associated with cancer // Curr. Opin. Support. Palliat. Care. 2013. V. 7. № 4. P. 345.
Akita K., Harada K., Ichihara J., Takata N., Takahashi Y., Saito K. A novel selective androgen receptor modulator, NEP28, is efficacious in muscle and brain without serious side effects on prostate // Eur. J. Pharmacol. 2013. V. 720. № 1–3. P. 107.
Thevis M., Schänzer W. Detection of SARMs in doping control analysis // Mol. Cell Endocrinol. 2018. V. 464. P. 34.
Schmidt A., Kimmel D.B., Bai C., Scafonas A., Rutledge S., Vogel R.L., McElwee-Witmer S., Chen F., Nantermet P.V., Kasparcova V., Leu C.T., Zhang H.Z., Duggan M.E., Gentile M.A., Hodor P., Pennypacker B., Masarachia P., Opas E.E., Adamski S.A., Cusick T.E., Wang J., Mitchell H.J., Kim Y., Prueksaritanont T., Perkins J.J., Meissner R.S., Hartman G.D., Freedman L.P., Harada S., Ray W.J. Discovery of the selective androgen receptor modulator MK-0773 using a rational development strategy based on differential transcriptional requirements for androgenic anabolism versus reproductive physiology // J. Biol. Chem. 2010. V. 285. № 22. P. 17 054.
Cilotti A., Falchetti A. Male osteoporosis and androgenic therapy: from testosterone to SARMs // Clin. Cases Miner. Bone Metab. 2009. V. 6. № 3. P. 229.
Saeed A., Vaught G.M., Gavardinas K., Matthews D., Green J.E., Losada P.G., Bullock H.A., Calvert N.A., Patel N.J., Sweetana S.A., Krishnan V., Henck J.W., Luz J.G., Wang Y., Jadhav P. 2-Chloro-4-[[(1R,2R)-2-hydroxy-2-methyl-cyclopentyl]amino]-3-methyl-benzonitrile: A transdermal selective androgen receptor modulator (SARM) for muscle atrophy // J. Med. Chem. 2016. V. 59. № 2. P. 750.
Papanicolaou D.A., Ather S.N., Zhu H., Zhou Y., Lutkiewicz J., Scott B.B., Chandler J. A phase IIA randomized, placebo-controlled clinical trial to study the efficacy and safety of the selective androgen receptor modulator (SARM), MK-0773 in female participants with sarcopenia // J. Nutr. Health Aging. 2013. V. 17. № 6. P. 533.
Nejishima H., Yamamoto N., Suzuki M., Furuya K., Nagata N., Yamada S. Anti-androgenic effects of S-40542, a novel non-steroidal selective androgen receptor modulator (SARM) for the treatment of benign prostatic hyperplasia // Prostate. 2012. V. 72. № 14. P. 1580.
Chen J., Hwang D.J., Bohl C.E., Miller D.D., Dalton J.T. A selective androgen receptor modulator for hormonal male contraception // J. Pharmacol. Exp. Ther. 2005. V. 312. № 2. P. 546.
World Anti-Doping Agency. The World Anti-Doping Code. The 2008 Prohibited List. International Standard. https://www.wada-ama.org/sites/default/files/ resources/files/WADA_Prohibited_List_2008_EN.pdf, (2008) (28.06.2019).
Iglesias-Arteaga M.A., Símuta-Lopez E.M., Xochihua-Moreno S., Viñas-Bravo O., Smith S.M., Reyes S.M., Sandoval-Ramírez J. A convenient procedure for the synthesis of 3β-hydroxy-6-oxo-5α-steroids. Application to the synthesis of Laxogenin // J. Braz. Chem. Soc. 2005. V. 16. P. 381.
Bajguz A., Tretyn A. The chemical characteristic and distribution of brassinosteroids in plants // Phytochemistry. 2003. V. 62. № 7. P. 1027.
Constanzer M.L., Chavez-Eng C.M., Matuszewski B.K. Determination of a novel growth hormone secretagogue (MK-677) in human plasma at picogram levels by liquid chromatography with atmospheric pressure chemical ionization tandem mass spectrometry // J. Chromatogr. B Biomed. Sci. Appl. 1997. V. 693. № 1. P. 131.
Geldof L., Deventer K., Roels K., Tudela E., Van Eeno P. In vitro metabolic studies of Rev-Erb agonists SR9009 and SR9011 // Int. J. Mol. Sci. 2016. V. 17. № 10. pii: E1676.
Shah A.K., Gupta A., Dey C.S. AICAR induced AMPK activation potentiates neuronal insulin signaling and glucose uptake // Arch. Biochem. Biophys. 2011. V. 509. № 2. P. 142.
Guo F., Liu S.Q., Gao X.H., Zhang L.Y. AICAR induces AMPK-independent programmed necrosis in prostate cancer cells // Biochem. Biophys. Res. Commun. 2016. V. 474. № 2. P. 277.
Wu A.H., Gerona R., Armenian P., French D., Petrie M., Lynch K.L. Role of liquid chromatography-high-resolution mass spectrometry (LC-HR/MS) in clinical toxicology // Clin. Toxicol. 2012. V. 50. № 8. P. 733.
Kamel A., Prakash C. High performance liquid chromatography/atmospheric pressure ionization/tandem mass spectrometry (HPLC/API/MS/MS) in drug metabolism and toxicology // Curr. Drug Metab. 2006. V. 7. № 8. P. 837.
Gosetti F., Mazzucco E., Gennaro M.C., Marengo E. Ultra high performance liquid chromatography tandem mass spectrometry determination and profiling of prohibited steroids in human biological matrices. A review // J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2013. V. 927. P. 22.
Viette V., Fathi M., Rudaz S., Hochstrasser D., Veuthey J.L. Current role of liquid chromatography coupled to mass spectrometry in clinical toxicology screening methods // Clin. Chem. Lab. Med. 2011. V. 49. № 7. P. 1091.
Kintz P., Ameline A., Gheddar L., Raul J.S. LGD-4033, S-4 and MK-2866 – Testing for SARMs in hair: About 2 doping cases // Toxicol. Anal. Clin. 2019. V. 31. № 1. P. 56.
Thevis M., Krug O., Geyer H., Schänzer W. Expanding analytical options in sports drug testing: Mass spectrometric detection of prohibited substances in exhaled breath // Rapid Commun. Mass Spectrom. 2017. V. 31. № 15. P. 1290.
Kostiainen R., Kotiaho T., Kuuranne T., Auriola S. Liquid chromatography/atmospheric pressure ionization-mass spectrometry in drug metabolism studies // J. Mass Spectrom. 2003. V. 38. № 4. P. 357.
Fasinu P., Bouic P.J., Rosenkranz B. Liver-based in vitro technologies for drug biotransformation studies – A review // Curr. Drug Metab. 2012.V. 13. № 2. P. 215.
Xu C., Li C.Y., Kong A.N. Induction of phase I, II and III drug metabolism/transport by xenobiotics // Arch. Pharm. Res. 2005. V. 28. № 3. P. 249.
Yengi L.G., Leung L., Kao J. The evolving role of drug metabolism in drug discovery and development // Pharm. Res. 2007. V. 24. № 5. P. 842.
Peters F.T., Meyer M.R. In vitro approaches to studying the metabolism of new psychoactive compounds // Drug Test. Anal. 2011. V. 3. № 7-8. P. 483.
Taavitsainen P., Honkakoski P., Juvonen R., Pelkonen O., Raunio H. Role of xenobiotic metabolism in drug discovery and development // Biotechnology. V. 12.
Jia L., Liu X. The conduct of drug metabolism studies considered good practice(II): In vitro experiments // Curr. Drug Metab. 2007. V. 8. № 8. P. 822.
Ekins S., Ring B.J., Grace J., McRobie-Belle D.J., Wrighton S.A. Present and future in vitro approaches for drug metabolism // J. Pharmacol. Toxicol. Methods. 2000.V. 44. № 1. P. 313.
Wrighton S.A., Ring B.J., VandenBranden M. The use of in vitro metabolism techniques in the planning and interpretation of drug safety studies // Toxicol. Pathol. 1995. V. 23. № 2. P. 199.
Gómez-Lechón M.J., Castell J.V., Donato M.T. An update on metabolism studies using human hepatocytes in primary culture // Expert Opin. Drug Metab. Toxicol. 2008. V. 4. № 7. P. 837.
Pelkonen O., Raunio H. In vitro screening of drug metabolism during drug development: can we trust the predictions? // Expert Opin. Drug Metab. Toxicol. 2005. V. 1. № 1. P. 49.
Zhang D., Luo G., Ding X., Lu C. Preclinical experimental models of drug metabolism and disposition in drug discovery and development // Acta Pharm. Sin. B. 2012. V. 2. № 6. P. 549.
Olson H., Betton G., Robinson D., Thomas K., Monro A., Kolaja G., Lilly P., Sanders J., Sipes G., Bracken W., Dorato M., Van Deun K., Smith P., Berger B., Heller A. Concordance of the toxicity of pharmaceuticals in humans and in animals // Regul. Toxicol. Pharmacol. 2000. V. 32. № 1. P. 56.
Thevis M., Thomas A., Fusshöller G., Beuck S., Geyer H., Schänzer W. Mass spectrometric characterization of urinary metabolites of the selective androgen receptor modulator andarine (S-4) for routine doping control purposes // Rapid Commun Mass Spectrom. 2010. V. 24. № 15. P. 2245.
Grata E., Perrenoud L., Saugy M., Baume N. SARM-S4 and metabolites detection in sports drug testing: A case report // Forensic Sci. Int. 2011. V. 213. № 1–3. P. 104.
Starcevic B., Ahrens B.D., Butch A.W. Detection of the selective androgen receptor modulator S-4 (Andarine) in a doping control sample // Drug Test. Anal. 2013. V. 5. № 5. P. 377.
Rydevik A., Thevis M., Krug O., Bondesson U., Hedeland M. The fungus Cunninghamella elegans can produce human and equine metabolites of selective androgen receptor modulators (SARMs) // Xenobiotica. 2013. V. 43. № 5. P. 409.
Krug O., Thomas A., Beuck S., Schenk I., Machnik M., Schänzer W., Bondesson U., Hedeland M., Thevis M. Characterization of in vitro synthesized equine metabolites of the selective androgen receptor modulators S24 and S4 // J. Equine Vet. Sci. 2012. V. 32. № 9. P. 562.
de Rijke E., Essers M.L., Rijk J.C., Thevis M., Bovee T.F., van Ginkel L.A., Sterk S.S. Selective androgen receptor modulators: In vitro and in vivo metabolism and analysis // Food Addit. Contam. Part A. Chem. Anal. Control Expo. Risk Assess. 2013. V. 30. № 9. P. 1517.
Kuuranne T., Leinonen A., Schänzer W., Kamber M., Kostiainen R., Thevis M. Aryl-propionamide-derived selective androgen receptor modulators: liquid chromatography-tandem mass spectrometry characterization of the in vitro synthesized metabolites for doping control purposes // Drug Metab. Dispos. 2008. V. 36. № 3. P. 571.
Perera M.A., Yin D., Wu D., Chan K.K., Miller D.D., Dalton J. In vivo metabolism and final disposition of a novel nonsteroidal androgen in rats and dogs // Drug Metab. Dispos. 2006. V. 34. № 10. P. 1713.
Hansson A., Knych H., Stanley S., Thevis M., Bondesson U., Hedeland M. Characterization of equine urinary metabolites of selective androgen receptor modulators (SARMs) S1, S4 and S22 for doping control purposes // Drug Test. Anal. 2015. V. 7. № 8. P. 673.
Prakash C., Shaffer C.L., Nedderman A. Analytical strategies for identifying drug metabolites // Mass Spectrom. Rev. 2007. V. 26. № 3. P. 340.
Trufelli H., Palma P., Famiglini G., Cappiello A. An overview of matrix effects in liquid chromatography-mass spectrometry // Mass Spectrom. Rev. 2011. V. 30. № 3. P. 491.
Srinivas N.R. Dodging matrix effects in liquid chromatography tandem mass spectrometric assays–compilation of key learnings and perspectives // Biomed. Chromatogr. 2009. V. 23. № 5. P. 451.
Taylor P.J. Matrix effects: the Achilles heel of quantitative high-performance liquid chromatography-electrospray-tandem mass spectrometry // Clin. Biochem. 2005. V. 38. № 4. P. 328.
Van Eeckhaut A., Lanckmans K., Sarre S., Smolders I., Michotte Y. Validation of bioanalytical LC-MS/MS assays: Evaluation of matrix effects // J. Chromatogr. B. Anal. Technol. Biomed. Life Sci. 2009. V. 877. № 23. P. 2198.
Matuszewski B.K., Constanzer M.L., Chavez-Eng C.M. Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS // Anal. Chem. 2003. V. 75. № 13. P. 3019.
Niu Z., Zhang W., Yu C., Zhang J., Wen Y. Recent advances in biological sample preparation methods coupled with chromatography, spectrometry and electrochemistry analysis techniques // Trends Anal. Chem. 2018. V. 102. P. 123.
Ma S., Chowdhury S.K., Alton K.B. Application of mass spectrometry for metabolite identification // Curr. Drug Metab. 2006. V. 7. № 5. P. 503.
Guddat S., Solymos E., Orlovius A., Thomas A., Sigmund G., Geyer H., Thevis M., Schänzer W. High-throughput screening for various classes of doping agents using a new 'dilute-and-shoot' liquid chromatography-tandem mass spectrometry multi-target approach // Drug Test. Anal. 2011. V. 3. № 11–12. P. 836.
Görgens C., Guddat S., Thomas A., Wachsmuth P., Orlovius A.K., Sigmund G., Thevis M., Schänzer W. Simplifying and expanding analytical capabilities for various classes of doping agents by means of direct urine injection high performance liquid chromatography high resolution/high accuracy mass spectrometry // J. Pharm. Biomed. Anal. 2016. V. 131. P. 482.
Дмитриева Е., Темердашев А., Азарян А., Гашимова Э. Определение андарина (S-4), селективного модулятора андрогенных рецепторов, и ибутаморена (МК-677), непептидного секретагога гормона роста, в моче ультравысокоэффективной жидкостной хроматографией с тандемным масс-спектрометрическим детектированием // Журн. аналит. химии. 2018. Т. 73. № 7. P. 523.
Ventura E., Gadaj A., Monteith G., Ripoche A., Healy J., Botrè F., Sterk S.S., Buckley T., Mooney M.H. Development and validation of a semi-quantitative ultra-high performance liquid chromatography-tandem mass spectrometry method for screening of selective androgen receptor modulators in urine // J. Chromatogr. A. 2019. V. 1600. P. 183.
Thevis M., Gerace E., Thomas A., Beuck S., Geyer H., Schlörer N., Kearbey J.D., Dalton J.T., Schänzer W. Characterization of in vitro generated metabolites of the selective androgen receptor modulators S-22 and S-23 and in vivo comparison to post-administration canine urine specimens // Drug Test. Anal. 2010. V. 2. № 11–12. P. 589.
Thevis M., Kohler M., Thomas A., Maurer J., Schlörer N., Kamber M., Schänzer W. Determination of benzimidazole- and bicyclic hydantoin-derived selective androgen receptor antagonists and agonists in human urine using LC-MS/MS // Anal. Bioanal. Chem. 2008. V. 391. № 1. P. 251.
Thevis M., Beuck S., Thomas A., Kortner B., Kohler M., Rodchenkov G., Schänzer W. Doping control analysis of emerging drugs in human plasma – identification of GW501516, S-107, JTV-519, and S-40503 // Rapid Commun. Mass Spectrom. 2009. V. 23. № 8. P. 1139.
Hansson A., Knych H., Stanley S., Thevis M., Bondesson U., Hedeland M. Investigation of the selective androgen receptor modulators S1, S4 and S22 and their metabolites in equine plasma using high-resolution mass spectrometry // Rapid Commun. Mass Spectrom. 2016. V. 30. № 7. P. 833.
Wu D., Wu Z., Yang J., Nair V.A., Miller D.D., Dalton J.T. Pharmacokinetics and metabolism of a selective androgen receptor modulator in rats: implication of molecular properties and intensive metabolic profile to investigate ideal pharmacokinetic characteristics of a propanamide in preclinical study // Drug Metab. Dispos. 2006. V. 34. № 3. P. 483.
Thomas A., Guddat S., Kohler M., Krug O., Schänzer W., Petrou M., Thevis M. Comprehensive plasma-screening for known and unknown substances in doping controls // Rapid Commun. Mass Spectrom. 2010. V. 24. № 8. P. 1124.
Cawley A.T., Smart C., Greer C., Liu Lau M., Keledjian J. Detection of the selective androgen receptor modulator andarine (S-4) in a routine equine blood doping control sample // Drug Test. Anal. 2016. V. 8. № 2. P. 257.
Tolonen A., Turpeinen M., Pelkonen O. Liquid chromatography-mass spectrometry in in vitro drug metabolite screening // Drug Discov. Today. 2009. V. 14. № 3–4. P. 120.
Zhu M., Ma L., Zhang D., Ray K., Zhao W., Humphreys W.G., Skiles G., Sanders M., Zhang H. Detection and characterization of metabolites in biological matrices using mass defect filtering of liquid chromatography/high resolution mass spectrometry data // Drug Metab. Dispos. 2006. V. 34. № 10. P. 1722.
Anari M.R., Sanchez R.I., Bakhtiar R., Franklin R.B., Baillie T.A. Integration of knowledge-based metabolic predictions with liquid chromatography data-dependent tandem mass spectrometry for drug metabolism studies: application to studies on the biotransformation of indinavir // Anal. Chem. 2004. V. 76. № 3. P. 823.
Thevis M., Kohler M., Maurer J., Schlörer N., Kamber M., Schänzer W. Screening for 2-quinolinone-derived selective androgen receptor agonists in doping control analysis // Rapid Commun. Mass Spectrom. 2007. V. 21. № 21. P. 3477.
Thevis M., Piper T., Dib J., Lagojda A., Kühne D., Packschies L., Geyer H., Schänzer W. Mass spectrometric characterization of the selective androgen receptor modulator (SARM) YK-11 for doping control purposes // Rapid Commun. Mass Spectrom. 2017. V. 31. № 14. P. 1175.
Thevis M., Kohler M., Schlörer N., Kamber M., Kühn A., Linscheid M.W., Schänzer W. Mass spectrometry of hydantoin-derived selective androgen receptor modulators // J. Mass Spectrom. 2008. V. 43. № 5. P. 639.
Thevis M., Schänzer W. Mass spectrometry of selective androgen receptor modulators // J. Mass Spectrom. 2008. V. 43. № 7. P. 865.
Cox H.D., Eichner D. Detection of LGD-4033 and its metabolites in athlete urine samples // Drug Test. Anal. 2017. V. 9. № 1. P. 127.
Thevis M., Kohler M., Thomas A., Schlörer N., Schänzer W. Doping control analysis of tricyclic tetrahydroquinoline-derived selective androgen receptor modulators using liquid chromatography/electrospray ionization tandem mass spectrometry // Rapid Commun. Mass Spectrom. 2008. V. 22. № 16. P. 2471.
Gomes R.L., Meredith W., Snape C.E., Sephton M.A. Analysis of conjugated steroid androgens: deconjugation, derivatisation and associated issues // J. Pharm. Biomed. Anal. 2009. V. 49. № 5. P. 1133.
Ferchaud V., Courcoux P., Le Bizec B., Monteau F., André F. Enzymatic hydrolysis of conjugated steroid metabolites: search for optimum conditions using response surface methodology // Analyst. 2000. V. 125. № 12. P. 2255.
Luosujärvi L., Haapala M., Thevis M., Saarela V., Franssila S., Ketola R.A., Kostiainen R., Kotiaho T. Analysis of selective androgen receptor modulators by gas chromatography-microchip atmospheric pressure photoionization-mass spectrometry // J. Am. Soc. Mass Spectrom. 2010. V. 21. № 2. P. 310.
Gerace E., Salomone A., Fasano F., Costa R., Boschi D., Di Stilo A., Vincenti M. Validation of a GC/MS method for the detection of two quinolinone-derived selective androgen receptor modulators in doping control analysis // Anal. Bioanal. Chem. 2011. V. 400. № 1. P. 137.
Thevis M., Kohler M., Schlörer N., Fusshöller G., Schänzer W. Screening for two selective androgen receptor modulators using gas chromatography-mass spectrometry in doping control analysis // Eur. J. Mass Spectrom. 2008. V. 14. № 3. P. 153.
Mareck U., Geyer H., Opfermann G., Thevis M., Schänzer W. Factors influencing the steroid profile in doping control analysis // J. Mass Spectrom. 2008. V. 43. № 7. P. 877.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии