Журнал аналитической химии, 2020, T. 75, № 12, стр. 1108-1118
Вольтамперометрический сенсор на основе композита 3,4,9,10-перилентетракарбоновой кислоты для распознавания и определения энантиомеров тирозина
Ю. А. Яркаева a, *, Д. И. Дубровский a, Р. А. Зильберг a, В. Н. Майстренко a, В. М. Корнилов b
a Башкирский государственный университет, химический факультет
450076 Уфа, ул. Заки Валиди, 32, Россия
b Башкирский государственный педагогический университет им. М. Акмуллы, Институт физики,
математики, цифровых и нанотехнологий
450076 Уфа, ул. Октябрьской революции, 3-а, Россия
* E-mail: julijajarkaeva05@gmail.com
Поступила в редакцию 12.03.2020
После доработки 25.04.2020
Принята к публикации 07.05.2020
Аннотация
Разработан энантиоселективный вольтамперометрический сенсор на основе стеклоуглеродного электрода, модифицированного композитом полиэлектролитного комплекса хитозана, графитированной термической сажи Carboblack C и 3,4,9,10-перилентетракарбоновой кислоты, для распознавания и определения энантиомеров тирозина. Энантиоселективность сенсора обусловлена образованием самоорганизующихся хиральных нанокластеров 3,4,9,10-перилентетракарбоновой кислоты. Изучены электрохимические и аналитические характеристики сенсора. Предложенный сенсор использован для распознавания и определения L- и D-энантиомеров тирозина в образцах мочи и плазмы крови человека, а также в смеси. Для повышения вероятности распознавания энантиомеров тирозина при их определении в смеси применен хемометрический метод проекции на латентные структуры. Показано, что предложенный сенсор позволяет с высокой вероятностью определять соотношение L- и D-энантиомеров тирозина в смеси с относительной погрешностью менее 8%.
L-энантиомер тирозина – 2-амино-3-(4-гидроксифенил)пропионовая кислота (L-Тир) – является ароматической альфа-аминокислотой, которая образуется в организме человека и играет важную роль в синтезе нейротрансмиттеров и липидном обмене, регулирует аппетит, нормализует работу надпочечников, гипофиза, щитовидной железы и др. [1]. Для распознавания и определения энантиомеров тирозина применяют различные методы. В последнее время из-за простоты использования, экспрессности, низкой стоимости и высокой чувствительности возрос интерес к вольтамперометрическим сенсорам на основе стеклоуглеродных (СУЭ), металлических (Au, Pt и др.) и угольно-пастовых электродов, модифицированных хиральными селекторами [2–5]. В частности, для распознавания энантиомеров аминокислот, в том числе тирозина, используют сенсоры на основе циклодекстринов [6–10] и краун-эфиров [11], полисахаридов [12], белков [13, 14], полимеров с молекулярными отпечатками [15–19], высокоупорядоченных самоорганизующихся систем [20–24], а также хиральных супрамолекулярных структур, образующихся из ахиральных молекул при внешнем воздействии [25–29].
Существует большое число неорганических и органических соединений, способных образовывать хиральные нанокластеры и супрамолекулярные структуры за счет образования межмолекулярных связей с другими молекулами [20–22]. Потенциальной возможностью образовывать при внешнем воздействии (интенсивное перемешивание) хиральные нанокластеры обладает 3,4,9,10-перилентетракарбоновая кислота (ПТКК), которую получают из ее диангидрида. В отличие от диангидрида, подвижные карбоксильные группы в молекулах ПТКК имеют пространственную симметрию 2D [30], что способствует образованию при самосборке молекул ПТКК хиральных нанокластеров [31]. В литературе имеются данные о хиральных вольтамперометрических сенсорах на основе нанокомпозитов ПТKК [32–36], в том числе на основе хитозана и его производных [34, 36].
Важной задачей является распознавание и определение энантиомеров Тир в их смеси. Для этого необходимо, чтобы пики окисления на вольтамперограммах энантиомеров существенно отличались между собой как по потенциалам, так и по величинам максимальных токов. Однако во многих случаях, особенно при анализе реальных объектов, между ними наблюдаются небольшие различия, что недостаточно для достоверного распознавания энантиомеров Тир и приводит к ошибкам при их определении в смеси. В большинстве публикаций, в которых изучены возможности вольтамперометрических хиральных сенсоров для определения энантиомеров Тир или их соотношения в смеси, приведены данные для модельных растворов, и лишь в некоторых из них изучены реальные объекты (обычно моча и плазма крови человека) [9–12, 37–40]. По-видимому, это обусловлено как недостаточной селективностью предложенных сенсоров, так и влиянием мешающих компонентов, присутствующих в реальных образцах. Известно, что использование хемометрических методов обработки экспериментальных данных позволяет компенсировать недостаточную селективность вольтамперометрических сенсоров и с высокой вероятностью определять соотношение энантиомеров в смеси [41, 42].
C использованием методов циклической и дифференциально-импульсной вольтамперометрии (ДИВ), электрохимической импедансной спектроскопии в работе изучены электрохимические и аналитические характеристики вольтамперометрического сенсора на основе ПТКК, иммобилизованной на поверхности СУЭ в виде композита полиэлектролитного комплекса (ПЭК) хитозана и N-сукцинилхитозана, содержащего графитированную термическую сажу (ГС) Carboblack C с осажденными на ней хиральными нанокластерами ПТКК. Проведено определение энантиомеров тирозина в модельных растворах, в моче и плазме крови человека. Показано, что использование хемометрических методов обработки данных позволяет с высокой достоверностью определять соотношение энантиомеров Тир в смеси. Пленки ПЭК стабильны в водных растворах [43, 44], их свойства и морфология поверхности практически не изменяются в течение периода эксплуатации сенсора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование и реагенты. Для электрохимических измерений использовали потенциостат-гальваностат Autolab PGSTAT 204 (Metrohm Autolab Ins., Нидерладны) с модулем импеданса FRA32M (Metrohm Autolab Ins., Нидерладны) c программным обеспечением NOVA. Измерения проводили в стандартной трехэлектродной ячейке емк. 20 мл, состоящей из модифицированного стеклоуглеродного электрода диаметром 3 мм, вспомогательного электрода, выполненного в виде платиновой пластинки, и хлоридсеребряного электрода сравнения. Для полирования поверхности СУЭ использовали деагломерированную суспензию оксида алюминия (0.3 мкм) и полировальную ткань Spec-Cloth (Allied High Tech Products Inc., США). Значения pH растворов измеряли с помощью pH-метра Seven Compact pH/Ion S220 (Mettler-Toledo AG, Швейцария). Для перемешивания растворов при получении ПТКК и приготовлении ПЭК хитозана использовали магнитную мешалку MR Hei-Tec (Heidolph, Германия). Морфологические характеристики поверхности СУЭ, модифицированной ПЭК и ПЭ-К-ГС-ПТКК, изучали методом атомно-силовой микроскопии (АСМ) с использованием микроскопа CMM-2000T (Протон-МИЭТ, Москва, Россия). При пробоподготовке образцов мочи и плазмы крови человека использовали центрифугу CM-6MT (ELMI, Латвия).
В качестве исследуемых веществ использовали D- и L-тирозин ч. д. а. (Sigma-Aldrich, США). Фоновым электролитом служил 0.1 M фосфатный буферный раствор, содержащий Na2HPO4 и NaH2PO4 (pH 6.86). Стандартные растворы D- и L-Тир (0.001 М) получали растворением точных навесок реагентов в 50 мл 0.1 M фосфатного буферного раствора. Растворы более низких концентраций получали разбавлением исходных 0.001 М растворов Тир. Раствор [Fe(CN)6]3–/4– (5 мМ) готовили на фоне 0.1 М KCl и использовали в качестве стандартного при электрохимических измерениях.
Для модифицирования СУЭ использовали композит ПЭК хитозана с молекулярной массой 30 кДа и степенью деацетилирования 75% с натриевой солью N-сукцинилхитозана с молекулярной массой 200 кДа и степенью деацетилирования 82%, содержащий графитированную термическую сажу Carboblack C (Restek, США) с удельной поверхностью 10 м2/г и размером частиц 0.18–0.25 мм, на которые осаждали ПТКК. Для синтеза ПТКК использовали ее диангидрид (Sigma-Aldrich, США).
Образцы мочи получали с письменного согласия донора, плазма крови предоставлена Уфимской Республиканской станцией переливания крови. Все эксперименты проводили в соответствии с действующим законодательством. Образцы мочи и плазмы крови объемом 2.5 мл центрифугировали в течение 10 мин и разбавляли в 10 раз фосфатным буферным раствором с рН 6.86. В полученные растворы добавляли известные количества D- и L-Тир для получения растворов с концентрациями 0.1, 0.3, 0.7 мМ. Для приготовления растворов использовали сверхчистую деионизованную воду с удельной проводимостью 0.1 мкСм/см.
Модифицирование стеклоуглеродного электрода. Полиэлектролитный комплекс хитозана получали введением по каплям с интервалом 2 мин при интенсивном перемешивании (500 об/мин) и 25°С в 0.005%-ный водный раствор натриевой соли N-сукцинилхитозана (полианион) водного 0.005%-ного раствора гидрохлорида хитозана (поликатион). При добавлении к раствору N-сукцинилхитозана гидрохлорида хитозана происходило фазовое разделение, сопровождающееся появлением опалесценции. Область существования устойчивой суспензии ПЭК хитозана ограничивается мольным соотношением 1 : 10, выше которого в процессе смешения компонентов наблюдается выпадение осадка.
Для получения ПТКК 0.5 г ее диангидрида растворяли в 60 мл 1 М раствора KOH и кипятили полученный раствор в течение 12 ч в колбе с обратным холодильником. После охлаждения в него вносили 5 г стеклянных шариков диаметром 2 мм и медленно при перемешивании со скоростью 1300 об/мин в течение 3 ч добавляли концентрированную соляную кислоту до pH 1. Суспензию ПТКК отделяли от стеклянных шариков декантацией и центрифугировали. Коричнево-красный осадок ПТКК промывали деионизованной водой и высушивали под вакуумом при комнатной температуре. Далее к суспензии ПТКК в 100 мл воды добавляли порошок Carboblack C в соотношении 10 : 1 и перемешивали полученную смесь в течение 2 ч со скоростью 200 об/мин. Модифицированные ПТКК частицы Carboblack C отфильтровывали и сушили под вакуумом в течение 12 ч до постоянной массы.
Стеклоуглеродный электрод модифицировали нанесением 10 мкл смеси ПЭК хитозана с модифицированными ПТКК частицами Carboblack C (в соотношении 100 : 1) с последующим высушиванием электродной поверхности под ИК-лампой в течение 10 мин и охлаждением пленки модификатора при комнатной температуре. После серии измерений поверхность СУЭ очищали механически и полировали с помощью деагломерированной суспензии оксида алюминия (0.3 мкм) с последующим промыванием деионизованной водой и высушиванием на воздухе при комнатной температуре. Затем СУЭ вновь модифицировали.
Методика эксперимента. Дифференциально-импульсные вольтамперограммы регистрировали в диапазоне потенциалов от 0.5 до 1.0 В с амплитудой 50 мВ, интервалом времени 0.25 с, временем модуляции 0.025 с и скоростью развертки 20 мВ/с. Спектры электрохимического импеданса регистрировали в диапазоне частот от 500 кГц до 0.1 Гц с амплитудой 10 мВ. Циклические вольтамперограммы регистрировали в диапазоне потенциалов от 0.5 до 1.3 В со скоростью развертки потенциала 0.1 В/с. Массив данных для каждого образца состоял из 5 параллельных измерений. Перед каждым измерением поверхность электрода стабилизировали установлением соответствующего потенциала в открытой цепи (функция Open circuit potential в программном обеспечении NOVA). Для хемометрической обработки данных использовали программное обеспечение The Unscrambler (САМО, Норвегия). Все измерения проводились при 25 ± 0.1°С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для изучения электрохимических свойств предложенного сенсора использовали стандартную редокс-систему на основе ферроцианидов калия. На рис. 1а представлены циклические вольтамперограммы 5 мМ раствора $\left[ {{\text{Fe}}({\text{CN}})_{{\text{6}}}^{{{{{\text{3}} - } \mathord{\left/ {\vphantom {{{\text{3}} - } {{\text{4}} - }}} \right. \kern-0em} {{\text{4}} - }}}}} \right]$ на различных электродах, которые характерны для типичного обратимого окислительно-восстановительного процесса. Видно, что каждый компонент композитного модификатора СУЭ по-разному влияет на высоту редокс-пиков ферроцианидов. Наименьшие пики на циклической вольтамперограмме (ЦВА) наблюдаются для электрода, модифицированного только ПЭК хитозана. При введении модифицированных ПТКК частиц графитированной сажи Carboblack C в ПЭК хитозана максимальные токи пиков возрастают, что обусловлено, по-видимому, увеличением площади эффективной поверхности электрода.
Рис. 1.
(а) Циклические вольтамперограммы 5.0 мМ раствора редокс-пары [Fe(CN)6]3−/4− (1 : 1) на различных электродах (1 – СУЭ, 2 – СУЭ/ПЭК-ГС-ПТТК, 3 – СУЭ/ПЭК-ГС, 4 – СУЭ/ПЭК) на фоне 0.1 М KCl при скорости развертки потенциала 0.1 В/с. (б) Диаграммы Найквиста для различных электродов (1 – СУЭ, 2 – СУЭ/ПЭК-ГС, 3 – СУЭ/ ПЭК-ГС-ПТТК, 4 – СУЭ/ПЭК) в 0.1 М растворе KCl, содержащем 5.0 мМ [Fe(CN)6]4–/3–.

Площадь эффективной поверхности электрода рассчитывали с использованием уравнения Рэндлса–Шевчика [45]:
Ip = (2.69 × 105)n2/3AD1/2cv1/2,
где Ip – высота тока пика, A; n – число переносимых электронов; A – эффективная площадь поверхности электрода, см2; D – коэффициент диффузии, см2/с (для K4[Fe(CN)6] в 0.1 М растворе KCl n = 1, D = 7.6 × 10–6 см2/с); c – концентрация K4[Fe(CN)6], моль/мл; v – скорость развертки потенциала, В/с. Для СУЭ, модифицированного только ПЭК хитозана, площадь эффективной поверхности составила 2.22 мм2, добавление немодифицированной ГС и модифицированной ПТКК приводит к ее увеличению до 3.75 и 4.26 мм2 соответственно, тогда как для “голого” СУЭ площадь эффективной поверхности составляет 5.54 мм2.
Для подтверждения полученных закономерностей использовали также электрохимическую импедансную спектроскопию (рис. 1б). Спектры импеданса имеют стандартный вид и описываются эквивалентной схемой Рэндлса. Анализ диаграмм Найквиста свидетельствует о том, что данные импеданса и ЦВА хорошо согласуются между собой. Наибольшее сопротивление имеет сенсор, модифицированный только ПЭК (Ret = 770.6 Ом). При добавлении к ПЭК хитозана немодифицированной ГС перенос электрона облегчается (Ret = = 412.2 Ом), а при введении ГС, модифицированной ПТКК, значение Ret приближается к величине, характерной для “голого” СУЭ (Ret = 247.1 Ом и Ret = 141.5 Ом соответственно).
Таким образом, сенсор, модифицированный композитом ПЭК-ГС-ПТКК, имеет достаточно высокую проводимость и с успехом может использоваться в электрохимических датчиках при определении электроактивных органических соединений, в том числе аминокислот.
Для характеристики поверхности модифицированных СУЭ использовали также АСМ. На рис. 2 приведены AСM-изображения поверхности СУЭ, модифицированного ПЭК хитозана и композитом ПЭК-ГС-ПТКК. В отсутствие ГС-ПТКК поверхность электрода гладкая с редкими включениями в полимерной пленке. При нанесении на поверхность СУЭ композита ПЭК-ГС-ПТКК она становится неровной и зернистой с диаметром отдельных зерен порядка 300–400 нм и высотой около 100–150 нм. Видно, что модификатор равномерно распределен по поверхности электрода.
Рис. 2.
АСМ-изображения поверхности стеклоуглеродного электрода, модифицированной ПЭК (а) и ПЭК-ГС-ПТКК (б).

Как известно, тирозин окисляется на СУЭ в диапазоне от 0.5 до 1.0 В [46–48], преимущественно в кислых и нейтральных средах. В связи с тем, что используемый в качестве подложки композит ПЭК хитозана наиболее устойчив в нейтральной среде, измерения проводили в фосфатном буферном растворе с pH 6.86.
Для установления природы наблюдаемых токов изучена зависимость lg ip = lg v + const в диапазоне от 10 до 200 мВ/с, где v – скорость развертки потенциала электрода (рис. 3). По величине тангенса угла наклона данной зависимости (критерий Семерано) можно определить природу лимитирующей стадии электродного процесса. Для предложенного электрода тангенс угла (рис. 3, вставка) близок к 0.5, что свидетельствует о диффузионном характере электродного процесса.
Рис. 3.
Циклические вольтамперограммы 0.6 мМ раствора тирозина в фосфатном буферном растворе с pH 6.86 на стеклоуглеродном электроде, модифицированном ПЭК-ГС-ПТТК, при разной скорости развертки потенциала. Вставка: график зависимости lg ip от lgv.

На рис. 4 представлены ДИВ окисления энантиомеров Тир на изученных электродах. Видно, что в случае СУЭ, модифицированного только ПЭК хитозана (СУЭ/ПЭК), между вольтамперограммами энантиомеров Тир наблюдаются небольшие различия в высоте максимальных токов пиков окисления (IpL/IpD = 1.12) и форме вольтамперограмм (кривые 4), т.е такой электрод не является энантиоселективным для энантиомеров Тир. При введении в ПЭК хитозана немодифицированной ГС (кривые 3) наблюдается рост максимальных токов пиков окисления энантиомеров Тир за счет увеличения площади эффективной поверхности электрода, как и в случае $\left[ {{\text{Fe}}({\text{CN}})_{{\text{6}}}^{{{{{\text{3}} - } \mathord{\left/ {\vphantom {{{\text{3}} - } {{\text{4}} - }}} \right. \kern-0em} {{\text{4}} - }}}}} \right].$
Рис. 4.
Дифференциально-импульсные вольтамперограммы 0.6 мМ растворов энантиомеров тирозина в фосфатном буферном растворе с pH 6.86 на СУЭ (1), СУЭ/ПЭК-ГС-ПТТК (2), СУЭ/ПЭК-ГС (3), СУЭ/ПЭК (4); скорость развертки потенциала 20 мВ/с.

Введение в ПЭК хитозана модифицированных ПТКК частиц ГС (кривые 2) позволяет различить вольтамперограммы энантиомеров как по величине максимальных токов пиков, так и по потенциалам пиков окисления. В данном случае энантиоселективность сенсора обусловлена введением в ПЭК хитозана хиральных нанокластеров ПТКК, осаждающихся на поверхности ГС и являющихся для энантиомеров Тир хиральным селектором. Ранее аналогичный эффект был обнаружен для сенсора на основе угольно-пастового электрода, модифицированного хиральными нанокластерами ПТКК, при распознавании и определении энантиомеров варфарина [31]. Для молекул ПТКК этот эффект обусловлен 2D пространственной симметрией карбоксильных групп при их самоорганизации в нанокластеры. Различия в Ip (IpL/IpD = 1.24) и Ep (30 мВ) для L- и D-Тир свидетельствуют о том, что свободные энергии взаимодействия энантимеров Тир с нанокластерами ПТКК отличаются друг от друга, что отражается на максимальных токах и потенциалах пиков окисления энантиомеров Тир. При этом Ip энантиомеров линейно возрастают с увеличением их концентрации в диапазоне от 6.25 до 1000 мкМ; чувствительность (a в уравнении регрессии) для D-Тир больше, чем для L-Тир. Пределы обнаружения (табл. 1) оценивали по 3σ-критерию.
Таблица 1.
Аналитические характеристики методики определения D- и L-энантиомеров тирозина на стеклоуглеродном электроде, модифицированном ПЭК-ГС-ПТТК, в фосфатном буферном растворе с pH 6.86 (n = 5, P = 0.95)
| Аналит | Линейный диапазон, М | Уравнение регрессии ip (мкА) = aс (мМ) + b |
R2 | Предел обнаружения, М | |
|---|---|---|---|---|---|
| a ± Δa | b ± Δb | ||||
| L-Тир | 6.25 × 10–6–0.001 | 5.6 ± 0.2 | 0.57 ± 0.01 | 0.998 | 2.39 × 10–6 |
| D-Тир | 6.25 × 10–6–0.001 | 6.4 ± 0.2 | 0.66 ± 0.02 | 0.997 | 2.03 × 10–6 |
Правильность определения энантиомеров Тир с помощью предложенного сенсора, в том числе в моче и плазме крови человека, оценивали методом введено–найдено. Из табл. 2 видно, что сенсор позволяет с высокой точностью определять содержание тирозина в модельных растворах в широком диапазоне концентраций. Относительное стандартное отклонение во всех случаях не превышало 5.4%, что свидетельствует об удовлетворительной сходимости результатов измерений. Относительное стандартное отклонение при определении энантиомеров Тир в моче колеблется в пределах 2.6–7.1%, а в плазме крови – в пределах 3.3–7.3%. Менее стабильные показатели в плазме крови, по-видимому, связаны с ее сложным составом по сравнению с мочой. Плазма представляет собой сложную смесь белков, аминокислот, углеводов, жиров, солей, гормонов, ферментов и антител. Несмотря на это, их влияние на вольтамперометрическое определение Тир незначительно и выражается лишь в небольшом увеличении стандартного отклонения. При определении Тир в моче в диапазоне потенциалов 0.3–0.6 В наблюдался небольшой пик окисления мочевой кислоты, но, так как данный пик находится вне диапазона потенциалов определения Тир, он не влияет на определение Тир.
Таблица 2.
Результаты (мкМ) вольтамперометрического определения энантиомеров тирозина на стеклоуглеродном электроде, модифицированном ПЭК-ГС-ПТТК, в чистых растворах, в моче и плазме крови человека (pH 6.86, скорость развертки потенциала 20 мВ/с, n = 5, P = 0.95)
| Образец | Введено | Найдено | sr, % | |||
|---|---|---|---|---|---|---|
| D-Тир | L-Тир | D-Тир | L-Тир | D-Тир | L-Тир | |
| Чистый раствор | 700 | 700 | 691 ± 15 | 690 ± 20 | 1.8 | 2.3 |
| 300 | 300 | 291 ± 11 | 289 ± 14 | 3.1 | 3.9 | |
| 100 | 100 | 96 ± 8 | 95 ± 7 | 5.4 | 5.1 | |
| Моча | 700 | 700 | 688 ± 22 | 690 ± 30 | 2.6 | 3.2 |
| 300 | 300 | 290 ± 21 | 294 ± 15 | 4.5 | 4.1 | |
| 100 | 100 | 96 ± 8 | 95 ± 8 | 7.1 | 6.7 | |
| Плазма крови | 700 | 700 | 679 ± 28 | 682 ± 40 | 3.3 | 4.2 |
| 300 | 300 | 289 ± 14 | 286 ± 20 | 5.0 | 5.5 | |
| 100 | 100 | 93 ± 7 | 93 ± 8 | 5.9 | 7.3 | |
Предложенный сенсор позволяет устанавливать присутствие энантиомеров Тир как в рацемической смеси, так и в смеси с преобладанием одного из энантиомеров. На рис. 5а приведены дифференциально-импульсные вольтамперограммы 0.6 мМ растворов Тир с различным содержанием L-Тир (0, 20, 40, 60, 80, 100 мас. %), из которого видно, что с увеличением содержания L-Тир и соответственно с уменьшением содержания D-Тир максимальный ток пика окисления энантиомеров Тир уменьшается, а потенциал пика смещается в сторону более положительных значений. На рис. 5б приведены зависимости максимальных токов и потенциалов пиков окисления энантиомеров Тир от содержания L-Тир в 0.6 мМ растворах их смеси на СУЭ/ПЭК-ГС-ПТТК, что свидетельствует о возможности применения предложенного сенсора для установления состава смесей с различным соотношением D- и L-Тир. Однако погрешность таких измерений достаточно велика из-за малых различий между максимальными токами и потенциалами пиков окисления D- и L-Тир.
Рис. 5.
(а) Дифференциально-импульсные вольтамперограммы 0.6 мМ смесей энантиомеров тирозина с разным содержанием L-тирозина на СУЭ/ПЭК-ГС-ПТТК. (б) Зависимость потенциала и максимального тока пика от содержания L-тирозина в 0.6 мМ растворе смеси энантиомеров. Содержание L-тирозина, мас. %: 0, 20, 40, 60, 80, 100; v = 20 мВ/с.

Следует отметить, что аналогичная проблема наблюдается для многих вольтамперометрических сенсоров, описанных в литературе (табл. 3). Большинство из них, как правило, характеризуются небольшими различиями потенциалов пиков окисления/восстановления энантиомеров Тир. Применение хемометрических методов обработки экспериментальных данных во многом позволяет решить эту проблему [31, 41, 42]. В частности, метод проекции на латентные структуры (ПЛС) является инструментом хемометрики, с помощью которого можно осуществить многомерную градуировку экспериментальных данных [51, 52]. В отличие от классического метода введено–найдено, где используются единичные значения токов Ip или потенциалов пиков Ep, в многомерном анализе рассматривается матрица данных для всей вольтамперограммы. В нашем случае это матрица размерностью 42 × 100, состоящая из 100 столбцов, равных количеству значений мгновенных токов при различных потенциалах на вольтамперограммах, и 42 строк, равных количеству вольтамперограмм, полученных для модельных смесей известного состава (7 параллельных измерений для каждого из 6 растворов с различным соотношением энантиомеров Тир). Все полученные данные были разделены на два набора – обучающий (для построения градуировки), и проверочный, по результатам анализа которого судят о применимости метода для распознавания и определения энантиомеров Тир. Основная и наиболее трудоемкая задача при построении ПЛС-модели – формирование обучающего набора. Необходимо выбрать такое число смесей с различным соотношением энантиомеров Тир, которое позволяет анализировать реальные объекты с погрешностью, не превышающей заданное значение.
Таблица 3.
Сравнение сенсора на основе стеклоуглеродного электрода, модифицированного комплексом ПЭК-ГС-ПТТК, с описанными в литературе сенсорами для определения энантиомеров тирозина в их смеси
| Сенсор | Аналит | ΔEp, мВ | IpL/IpD | Литература |
|---|---|---|---|---|
| GCE/(CNT + ILC)/CW (СУЭ, модифицированный многослойными углеродными нанотрубками, ионным жидким кристаллом и 18-краун-6) | Тир | 30 | 3.09 | [11] |
| GCE/SS-CS (СУЭ, модифицированный крахмалом и хитозаном) | Тир | 12 | 1.38 | [12] |
| ГПЭ/ЦК (графитовый пастовый электрод, модифицированный циануровой кислотой) | Тир | 50 | 1.79 | [40] |
| MGCE/L-Cys-Au/Fe3O4 (СУЭ, модифицированный наночастицами Fe3O4/Au и L-цистеином) | Тир | 84 | 1.85 | [49] |
| GCE/L-CCNT-3/L-Cys (СУЭ, модифицированный хиральными углеродными нанотрубками и L-цистеиновой кислотой) | Тир | 24 | 2.29 | [50] |
| СУЭ/ПЭК-ГС-ПТКК | Тир | 30 | 1.24 | Данная работа |
Из рис. 6а видно, что на графике счетов ПЛС-модели точки, соответствующие вольтамперограммам растворов смесей с различным соотношением энантиомеров Тир, образуют кластеры, расположенные в соответствии с изменением соотношения L- и D-Тир вдоль первой главной компоненты (ГК1). Судя по значению объясненной дисперсии, ГК1 описывает большую часть полученных экспериментальных данных. Для оценки работоспособности ПЛС-модели провели ее перекрестную проверку (cross-validation) [51], при которой использовали стандартные образцы из имеющегося градуировочного набора. Часть этих образцов служила для построения ПЛС-модели, а другая часть – для ее проверки. Результатом проверки является сравнение предсказанных и заданных значений соотношений L- и D-энантиомеров Тир, представленное в виде соответствующего графика (рис. 6б). В этом случае среднеквадратичная погрешность прогнозирования (RMSEP – root mean square error of prediction) имела значение 0.0408, свидетельствующее о том, что предложенная ПЛС-модель является адекватной и может использоваться для распознавания и определения энантиомеров Тир в смеси.
Рис. 6.
(а) График счетов ПЛС-моделирования вольтамперограмм растворов смесей с различным соотношением L- и D-тирозина, полученных на СУЭ/ПЭК-ГС-ПТКК (содержание L-тирозина в смеси энантиомеров тирозина, мас. доля: 1 – 0, 2 – 0.2, 3 – 0.4, 4 – 0.6, 5 – 0.8, 6 – 1); (б) график сравнения предсказанных и заданных значений соотношений L- и D-энантиомеров тирозина (Y – содержание L-тирозина в смеси энантиомеров тирозина, мас. доля).
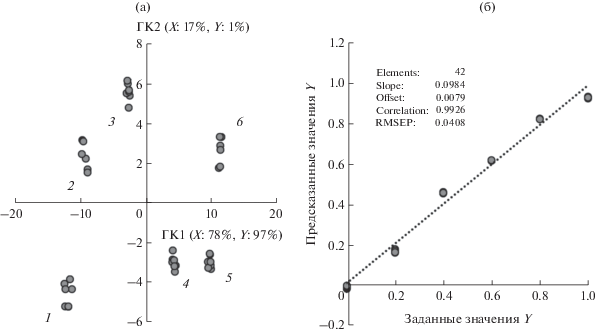
Вторым этапом хемометрической обработки полученных данных является прогнозирование с помощью полученной ПЛС-модели состава тестовых образцов, в качестве которых использовали растворы смесей энантиомеров Тир, приготовленные независимо от градуировочного набора. Для повышения достоверности распознавания в качестве тестовых образцов использовали растворы с промежуточными соотношениями энантиомеров Тир. Представленные в табл. 4 результаты свидетельствуют о том, что во всех случаях содержание энантиомеров L-Тир в смеси установлено правильно с относительной погрешностью, не превышающей 8%.
Таблица 4.
Результаты прогнозирования содержания L-тирозина (мас. доля) в смеси энантиомеров с использованием ПЛС-модели
| Заданное содержание L-Тир в смеси энантиомеров Тир, мас. доля | Прогнозируемое содержание L-Тир в смеси энантиомеров Тир, мас. доля | Относительная погрешность, % |
|---|---|---|
| 0 | 0.01 ± 0.02 | 1.0 |
| 0.01 ± 0.02 | 1.0 | |
| 0.04 ± 0.04 | 4.0 | |
| 0.2 | 0.18 ± 0.02 | 10.0 |
| 0.18 ± 0.03 | 10.0 | |
| 0.20 ± 0.02 | 0.0 | |
| 0.3 | 0.28 ± 0.03 | 6.7 |
| 0.29 ± 0.03 | 3.3 | |
| 0.29 ± 0.03 | 3.3 | |
| 0.4 | 0.42 ± 0.03 | 5.0 |
| 0.42 ± 0.03 | 5.0 | |
| 0.41 ± 0.03 | 2.5 | |
| 0.5 | 0.53 ± 0.03 | 6.0 |
| 0.53 ± 0.03 | 6.0 | |
| 0.53 ± 0.03 | 6.0 | |
| 0.6 | 0.62 ± 0.05 | 3.3 |
| 0.62 ± 0.06 | 3.3 | |
| 0.62 ± 0.05 | 3.3 | |
| 0.7 | 0.69 ± 0.04 | 1.4 |
| 0.69 ± 0.04 | 1.4 | |
| 0.69 ± 0.04 | 1.4 | |
| 0.8 | 0.82 ± 0.02 | 2.5 |
| 0.82 ± 0.02 | 2.5 | |
| 0.82 ± 0.02 | 2.5 | |
| 1 | 0.94 ± 0.06 | 6.0 |
| 0.97 ± 0.06 | 3.0 | |
| 0.95 ± 0.06 | 5.0 |
* * *
Таким образом, для селективного распознавания и определения энантиомеров тирозина предложен хиральный вольтамперометрический сенсор на основе стеклоуглеродного электрода, модифицированного композитом полиэлектролитного комплекса хитозана и графитированной сажи с осажденными на ней хиральными нанокластерами 3,4,9,10-перилентетракарбоновой кислоты, который является эффективной платформой для энантиоселективного распознавания и определения энантиомеров тирозина в плазме крови и моче человека. Применение хемометрического метода ПЛС при использовании предложенного сенсора позволяет достоверно определять соотношение энантиомеров тирозина в смеси.
Работа выполнена при поддержке РНФ: грант № 19-73-10079.
Список литературы
Fernstrom J.D., Fernstrom. Tyrosine, phenylalanine, and catecholamine synthesis and function in the brain // J. Nutr. 2007. V. 137. № 6. P. 1539S.
Zhu G., Kingsford O.J., Yi Y., Wong K.-Y. Review – recent advances in electrochemical chiral recognition // J. Electrochem. Soc. 2019. V. 166. P. H205.
Zor E., Bingol H., Ersoz M. Chiral sensors // Trends Anal. Chem. 2019. V. 121. Article 115 662.
Srivastava A.K., Upadhyay S.S., Rawool C.R., Punde N.S., Rajpurohit A.S. Voltammetric techniques for the analysis of drugs using nanomaterials based chemically modified electrodes // Curr. Anal. Chem., 2019. V. 15. P. 249.
Майстренко В.Н., Сидельников А.В., Зильберг Р.А. Энантиоселективные вольтамперометрические сенсоры: новые решения // Журн. аналит. химии. 2018. Т. 73. № 1. С. 3. (Maistrenko V.N., Sidel’nikov A.V., Zil’berg R.A. Enantioselective voltammetric sensors: New solutions // J. Analyt. Chem. 2018. V. 73. № 1. P. 1.)
Lenik J. Cyclodextrins based electrochemical sensors for biomedical and pharmaceutical analysis // Curr. Med. Chem. 2017. V. 24. P. 2359.
Niu X., Mo Z., Yang X., Sun M., Zhao P., Li Z., Ouyang M., Liu Z., Gao H., Guo R., Liu N. Advances in the use of functional composites of β-cyclodextrin in electrochemical sensors // Microchim. Acta. 2018. V. 185. P. 328.
Wang S.-Y., Li L., Xiao Y., Wan Y. Recent advances in cyclodextrins-based chiral-recognizing platforms // Trends Anal. Chem. 2019 V. 121. Article 115 691.
Quintana C., Suarez S., Hernandez L. Nanostructures on gold electrodes for the development of an L-tyrosine electrochemical sensor based on host–guest supramolecular interactions // Sens. Actuators B. 2010. V. 149. P. 129.
Dong S.Q., Bi Q., Qiao C.D., Sun Y.M., Zhang X., Lu X.Q., Zhao L. Electrochemical sensor for discrimination tyrosine enantiomers using graphene quantum dots and beta-cyclodextrins composites // Talanta. 2017. V. 173. P. 94.
Atta N.F., Galal A., Ahmed Y.M. Highly conductive crown ether/ionic liquid crystal-carbon nanotubes composite based electrochemical sensor for chiral recognition of tyrosine enantiomers // J. Electrochem. Soc. 2019. V. 166. P. B623.
Zou J., Yu J.G. Chiral recognition of tyrosine enantiomers on a novel bis-aminosaccharides composite modified glassy carbon electrode // Anal. Chim. Acta. 2019. V. 1088. P. 35.
Bao L., Dai J., Yang L., Ma J., Tao Y., Deng L., Kong Y. Electrochemical recognition of tyrosine enantiomers based on chiral ligand exchange with sodium alginate as the chiral selector // J. Electrochem. Soc. 2015. V. 162. P. H486.
Wang L., Gong W., Wang F., Yu Z., Chen Z. Efficient bienzyme nanocomposite film for chiral recognition of L-tryptophan, L-phenylalanine and L-tyrosine // Anal. Methods. 2016. V. 8. P. 3481.
Tiwari M.P., Prasad A. Molecularly imprinted polymer based enantioselective sensing devices: a review // Anal. Chim. Acta. 2015. V. 853. P. 1.
Canfarotta F., Rapini R., Piletsky S. Recent advances in electrochemical sensors based on chiral and nanosized imprinted polymers // Curr. Opin. Electrochem. 2018. V. 7. P. 146.
Radi A.-E., Wahdan T., El-Basiony A. Electrochemical sensors based on molecularly imprinted polymers for pharmaceuticals analysis // Curr. Anal. Chem. 2019. V. 15. P. 219.
Liang H.-J., Ling T.-R., Rick J.F., Chou T.-C. Molecularly imprinted electrochemical sensor able to enantroselectivly recognize D and L-tyrosine // Anal. Chim. Acta. 2005. V. 542. P. 83.
Zhao Q., Yang J., Zhang J., Wu D., Tao Y., Kong Y. Single-template molecularly imprinted chiral sensor for simultaneous recognition of alanine and tyrosine enantiomers // Anal. Chem. 2019. V. 91. P. 12546.
Hembury G.A., Borovkov V.V., Inoue Y. Chirality-sensing supramolecular systems // Chem. Rev. 2008. V. 108. P. 1.
Liu M.H., Zhang L., Wang T.Y. Supramolecular chirality in self-assembled systems // Chem. Rev. 2015. V. 115. P. 7304.
Mandler D. Chiral self-assembled monolayers in electrochemistry // Curr. Opin. Electrochem. 2018. V. 7. P. 42.
Tao Y., Gu X., Yang B., Deng L., Bao L., Kong Y., Chu F., Qin Y. Electrochemical enantioselective recognition in a highly ordered self-assembly framework // Anal. Chem. 2017. V. 89. P. 1900.
Tao Y., Chu F., Gu X., Kong Y., Lv Y., Deng L. A novel electrochemical chiral sensor for tyrosine isomers based on a coordination-driven self-assembly // Sens. Actuators B. 2018. V. 255. P. 255.
Viedma C. Chiral symmetry breaking during crystallization: complete chiral purity induced by nonlinear autocatalysis and recycling // Phys. Rev. Lett. 2005. V. 94. Article 065504.
Wang Y., Xu J., Wang Y.W., Chen H.Y. Emerging chirality in nanoscience // Chem. Soc. Rev. 2013. V. 42. P. 2930.
Wang Y., Zhou D., Li H., Li R., Zhong Y., Sun X., Sun. Hydrogen-bonded supercoil self-assembly from achiral molecular components with light-driven supramolecular chirality // J. Mater. Chem. C. 2014. V. 2. P. 6402.
Purcell-Milton F., McKenna R., Brennan L.J., Cullen C.P., Guillemeney L., Tepliakov N.V., Baimuratov A.S., Rukhlenko I.D., Perova T.S., Duesberg G.S., Baranov A.V., Fedorov A.V., Gun’ko Y.K. Induction of chirality in two-dimensional nanomaterials: chiral 2D MoS2 nanostructures // ASC Nano. 2018. V. 12. P. 954.
Gus’kov V.Y., Sukhareva D.A., Gainullina Y.Y., Hamitov E.M., Galkin Y.G., Maistrenko V.N. Chiral recognition capabilities of melamine and cyanuric acid supramolecular structures // Supramol. Chem. 2018. V. 30. P. 940.
Plass K.E., Grzesiak A.L., Matzger A.J. Molecular packing and symmetry of two-dimensional crystals // Acc. Chem. Res. 2007. V. 40. P. 287.
Zilberg R.A., Maistrenko V.N., Zagitova L.R., Guskov V.Y., Dubrovsky D.I. Chiral voltammetric sensor for warfarin enantiomers based on carbon black paste electrode modified by 3,4,9,10-perylenetetracarboxylic acid // J. Electroanal. Chem. 2020. V. 861. Article 113986.
Guo D., Ran P., Chen C., Chen Y., Xuan C., Fu Y. Study on chiral nanocomposite for recognition of DOPA enantiomers via square wave voltammetry // J. Electrochem. Soc. 2015. V. 162. P. B354.
Niu X., Mo Z., Gao H., Wang R., Li Z., Meng S., Guo R. Highly selective tryptophan enantiomers electrochemical chiral sensor based on poly-lysine and functionalized multi-walled carbon nanotubes // J. Solid State Electrochem. 2018. V. 22. P. 973.
Mo Z., Niu X., Gao H., Li Z., Meng S., Guo R. Electrochemical recognition for tryptophan enantiomers based on 3,4,9,10-perylenetetracarboxylic acid–chitosan composite film // J. Solid State Electrochem. 2018. V. 22. P. 2405.
Niu X., Yang X., Mo Z., Guo R., Liu N., Zhao P., Liu Z. Perylene-functionalized graphene sheets modified with β-cyclodextrin for the voltammetric discrimination of phenylalanine enantiomers // Bioelectrochemistry. 2019. V. 129. P. 189.
Yang X., Niu X., Mo Z., Guo R., Liu N., Zhao P., Liu Z. Perylene-functionalized graphene sheets modified with chitosan for voltammetric discrimination of tryptophan enantiomers // Microchim. Acta. 2019. V. 186. P. 333.
Nie R., Bo X., Wang H., Zeng L., Guo L. Chiral electrochemical sensing for tyrosine enantiomers on glassy carbon electrode modified with cysteic acid // Electrochem. Commun. 2013. V. 27. P. 112.
Pang T.T., Zhang X.Y., Xue Y.B. Determination of tyrosine using p-sulfonated calix[n] arene modified electrode // J. Incl. Phen. Macrocycl. Chem. 2017. V. 87. P. 275.
Chen L., Liu S., Chang F., Xie X., Zhu Z. A gold nanoparticles-enhanced carbon nanotubes electrochemical chiral sensor // Electroanalysis. 2017. V. 29. P. 955.
Зильберг Р.А., Майстренко В.Н., Кабирова Л.Р., Гуськов В.Ю., Хамитов Э.М., Дубровский Д.И. Хиральный вольтамперометрический сенсор на основе модифицированного циануровой кислотой пастового электрода для распознавания и определения энантиомеров тирозина // Журн. аналит. химии. 2020. Т. 75. С. 80. (Zil’berg R.A., Maistrenko V.N., Kabirova L.R., Gus’kov V.Yu., Khamitov E.M., Dubrovskii D.I. A chiral voltammetric sensor based on a paste electrode modified by cyanuric acid for the recognition and determination of tyrosine enantiomers // J. Analyt. Chem. 2020. V. 75. P. 101.)
Zilberg R.A., Maistrenko V.N., Kabirova L.R., Dubrovsky D.I. Selective voltammetric sensors based on composites of chitosan polyelectrolyte complexes with cyclodextrins for recognition and determination of atenolol enantiomers // Anal. Methods. 2018. V. 10. P. 1886.
Zilberg R.A., Sidelnikov A.V., Maistrenko V.N., Yarkaeva Y.A., Khamitov E.M., Kornilov V.M., Maksutova E.I. A voltammetric sensory system for recognition of propranolol enantiomers based on glassy carbon electrodes modified by polyarylenephthalide composites of melamine and cyanuric acid // Electroanalysis. 2018. V. 30. P. 619.
Krayukhina M.A., Samoilova N.A., Yamskov I.A. Polyelectrolyte complexes of chitosan: formation, properties and applications // Russ. Chem. Rev. 2008. V. 77. P. 854.
Racine L., Texier I., Auzely-Velty R. Chitosan-based hydrogels: recent design concepts to tailor properties and functions // Polym. Int. 2017. V. 66. P. 981.
Bard A.J., Faulkner L.R. Electrochemical Methods. Fundamentals and Applications. New York: Wiley, 2004. 833 p.
Ghoreishi S.M., Behpour M., Jafari N., Golestaneh M. Electrochemical determination of tyrosine in the presence of dopamine and uric acid at the surface of gold nanoparticles modified carbon paste electrode // J. Chin. Chem. Soc. 2012. V. 59. P. 1015.
D’Souza O.J., Mascarenhas R.J., Satpati A.K., Namboothiri I.N.N., Detriche S., Mekhalif Z., Delhalle J. A multi-walled carbon nanotube/poly-2,6-dichlorophenolindophenol film modified carbon paste electrode for the amperometric determination of L-tyrosine // RSC Adv. 2015. V. 5. P. 91472.
Karami Z., Sheikhshoaie I. rGO/ZnO nanocomposite modified carbon paste electrode as sensor for tyrosine analysis // Anal. Bioanal. Electrochem. 2017. V. 9. P. 834.
Shi X., Wang Y., Peng C., Zhang Z., Chen J., Zhou X., Jiang H. Enantiorecognition of tyrosine based on a novel magnetic electrochemical chiral sensor // Electrochim. Acta. 2017. V. 241. P. 386.
Guo Y., Yao R., Wang Z., Zhang Y., Cui M., Zhao Q., Wang H. Novel potential type electrochemical chiral recognition biosensor for amino acid // J. Solid State Electrochem. 2018. V. 22. P. 41.
Brereton R.G. Chemometrics: Data Analysis for the Laboratory and Chemical Plant. Chichester, UK: Wiley, 2003.
Pomerantsev A.L. Chemometrics in Excel. New York: Wiley, 2014.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


