Химия твердого топлива, 2019, № 5, стр. 12-19
ИНТЕНСИФИКАЦИЯ ПРОЦЕССА ОКИСЛЕНИЯ БУРОГО И КАМЕННОГО УГЛЕЙ АКТИВИРУЮЩЕЙ ДОБАВКОЙ Fe(NO3)2
К. Б. Ларионов 1, *, И. В. Мишаков 2, **, К. В. Слюсарский 1, ***, В. Е. Губин 1, ****, А. А. Ведягин 2, *****
1 Томский политехнический университет
634050 Томск, Россия
2 ФГБУН Институт катализа имени Г.К. Борескова СО РАН
630090 Новосибирск, Россия
* E-mail: laryk070@gmail.com
** E-mail: mishakov@catalysis.ru
*** E-mail: slyuskonst@gmail.com
**** E-mail: gubin@tpu.ru
***** E-mail: vedyagin@catalysis.ru
Поступила в редакцию 14.03.2019
После доработки 28.03.2019
Принята к публикации 03.06.2019
Аннотация
Исследован процесс окисления бурого и каменного углей, модифицированных активирующей добавкой Fe(NO3)2 (5 мас. %). Нанесение нитрата железа осуществлялось методом пропитки по влагоемкости с предварительным растворением Fe(NO3)2 в водно-спиртовом растворе, с объемным соотношением C2H5OH : H2O = 50 : 50. Реакционная способность образцов была изучена методом термогравиметрического анализа в режиме окисления при скорости нагрева 2.5°С/мин в интервале температур 25–600°С при атмосферном давлении. Установлено, что использование активирующей добавки способствовало снижению начальной температуры интенсивного окисления (Δti = 77°C) и смещению процесса в низкотемпературную область в целом. Методом масс-спектрометрии выполнен качественный анализ газофазных продуктов окисления углей, и установлено, что снижение начальной температуры выхода летучих соединений сопряжено с разложением нитрата железа. По методу Coats–Redfern, вычислены значения энергии активации процесса окисления в присутствии нитрата железа. Максимальное снижение Ea (с 74.0 до 64.4 кДж/моль) наблюдалось для модифицированного образца каменного угля. Обсужден возможный механизм действия нитрата железа, приводящий к активации процесса окисления исследуемых углей.
ВВЕДЕНИЕ
Одним из современных технических решений в области интенсификации процесса горения энергетических углей является его каталитическое сжигание в топливосжигающих аппаратах [1, 2]. Особенность данной технологии заключается в интенсификации процесса горения за счет активного взаимодействия топлива с катализатором [1], что позволяет обеспечить более высокую эффективность сгорания топлива, снизить тепловые потери и минимизировать выход вредных соединений (NOx, SOx, CO) в уходящих газах [2]. В качестве каталитических агентов, как правило, используют оксиды различных металлов, способные ускорять процесс окисления (полного сгорания) органического топлива [3–5].
Несмотря на ряд достоинств [1, 2], каталитическое сжигание имеет ограничение по организации процесса при слоевом сжигании угля ввиду проблем эффективного перемешивания угля и каталитических агентов. Вектор современных исследований в области слоевого каталитического сжигания угля указывает на необходимость поиска и разработки новых систем “уголь–катализатор”, основанных на использовании добавок солей [6–8], являющихся предшественниками оксидов металлов. В отличие от обширной библиографии по применению гетерогенных катализаторов на основе оксидов металлов, сведения по теории и экспериментальным исследованиям процессов совместного сжигания угля с активирующими солевыми добавками ограничены и требуют физико-химического обоснования.
Известно [9], что многие нитраты характеризуются сильными окислительными свойствами, низкой температурой плавления (разложения) и прекрасной растворимостью в воде. Последнее значительно упрощает их нанесение методом пропитки [10] на поверхность твердого топлива, например использование Ni(NO3)2 в качестве инициирующей добавки приводило к максимальному снижению температуры зажигания углей (около 50°С), по сравнению с добавками оксидов металлов [7].
Цель настоящей работы заключалась в экспериментальном определении параметров процесса окисления бурого и каменного углей (температуры, времени и скорости реакции, энергии активации) в присутствии нитрата железа, используемого в качестве активирующей добавки.
ЭКСПЕРИМЕНТАЛЬНАЯ И АНАЛИТИЧЕСКАЯ ЧАСТИ
В качестве исходных образцов были использованы следующие материалы: уголь бурый марки 2Б (УБ) и уголь каменный марки Т (УК) Бородинского и Алардинского месторождений соответственно. Крупнодисперсные образцы исходных углей (5–10 мм) измельчались в барабанной мельнице в течение 8 ч при равном соотношении массы мелющих тел и массы измельчаемого материала. После помола образцы фракционировались на ситах с размером ячеек 80 мкм. Результаты распределения размеров частиц образцов углей, которые были получены с помощью лазерного дифракционного анализатора частиц Analysette 22 (Fritsch, Германия) представлены в табл. 1.
Таблица 1.
Характеристики исследуемых образцов углей*
| Образец | W r | Ar | V r | Сr | Cdaf | Hdaf | Ndaf | Sdaf | Odaf | Влаго- емкость, мл/г | Распределение частиц по размерам, мкм | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| мас. % | % на daf | X10 | X50 | X90 | Xср | |||||||||
| УБ | 1.0 | 4.5 | 39.8 | 54.7 | 59.4 | 5.3 | 1.7 | 0.9 | 32.7 | 3.4 | 2.8 | 13.9 | 34.8 | 18.3 |
| УК | 0.3 | 16.5 | 13.1 | 70.1 | 80.0 | 2.8 | 2.5 | 0.4 | 14.3 | 2.6 | 4.6 | 20.4 | 57.6 | 26.5 |
Несмотря на однотипность процедуры подготовки образцов, средний диаметр частиц в их составе варьирует от 18.3 мкм (образец УБ) до 26.5 мкм (образец УК). Разница в размере частиц при подготовке проб прежде всего объясняется различной размолоспособностью углей, которая определяется составом, строением и их свойствами [11].
В табл. 1 также представлены данные технического и элементного анализов исследуемых углей, выполненных с использованием стандартных методик [12]. Массовая доля основных элементов в составе образцов (С, H, N, S, O) была определена с помощью анализатора элементного состава Euro EA 3000 (EuroVector, Италия). Исходные образцы бурого и каменного углей весьма различны по своим физико-химическим свойствам. Образец УБ характеризуется высоким значением выхода летучих веществ V r (~40%). В то же время, бурый уголь, в отличие от каменного, имеет сравнительно небольшую концентрацию углерода Cdaf (не более 65 мас. %) и почти в 4 раза меньшую величину зольного остатка Ar (не более 5 мас. %).
Отличие образцов УБ и УК также прослеживается и в морфологии частиц, что видно из микрофотографий, представленных на рис. 1. Снимки выполнены с использованием растрового электронного микроскопа JSM-6460LV (JEOL, Япония) c ионным сфокусированным пучком. Образец бурого угля, в отличие от каменного, характеризуется более аморфной структурой поверхности, со множеством углублений и трещин.
Активирующая добавка Fe(NO3)2 ⋅ 9H2O вводилась в состав образцов методом пропитки по влагоемкости [10]. Для преодоления гидрофобности угольного порошка использовался водно-спиртовой раствор с объемным соотношением C2H5OH/H2O = 50/50. Влагоемкость высушенных образцов углей (в мл/г) определялась непосредственно перед нанесением пропиточного раствора (табл. 1). Затем приготовленный раствор наносился на ранее подготовленные порошки угля с помощью механического дозатора. Пропитанные порошки угля выдерживались в сушильном шкафу при температуре 105°С в течение 20 ч. Массовая доля Fe(NO3)2 ⋅ 9H2O в модифицированных образцах (в пересчете на сухую соль) составляла 5%. Для проведения сравнительного анализа также были приготовлены контрольные образцы (без добавок), подвергнутые в точности таким же процедурам обработки. Модифицированные образцы углей были обозначены следующим образом: УБ/Fe – бурый уголь, УК/Fe – каменный уголь.
Исследование процесса окисления модифицированных образцов углей проводилось с помощью синхронного термического анализатора STA 449 C Jupiter (Netzsch, Германия). Эксперименты были проведены в одинаковых условиях при атмосферном давлении. Образец массой ~15 мг подвергался нагреванию в корундовом тигле с перфорированной крышкой в интервале температур 25–600°С при скорости нагрева 2.5°С/мин. В качестве окислительной среды использовали смесь воздуха (60 мл/мин) и азота (10 мл/мин). Азот использовался в качестве защитного газа для обеспечения надежной работы анализатора и корректной регистрации полученных данных.
Качественный анализ состава продуктов окисления углей (на выходе из термического анализатора) был выполнен с помощью квадрупольного масс-спектрометра QMS 403 D Aeolos (Netzsch, Германия).
В эксперименте определялись следующие характеристики процесса окисления углей: температура начала (ti) и окончания (tf) интенсивного окисления; максимальная скорость реакции (wmax) при соответствующей температуре (tmax); время прогрева образца до начала окисления (Te); общее время окисления (Tf); время достижения максимальной скорости реакции окисления (Tmax). Упомянутые параметры были рассчитаны из данных ТГА при помощи графического метода, подробное описание которого представлено в наших предыдущих работах [13, 14].Также было проведено вычисление значений энергии активации Ea окисления образцов с использованием метода Coats–Redfern [15] на основании полученных данных термогравиметрического анализа.
В основе данного метода лежит следующее соотношение:
где α – степень конверсии угля; T – температура, К; R – универсальная газовая постоянная, Дж/(моль·К); A – предэкспоненциальный множитель, 1/мин; Ea – энергия активации, Дж/моль; β – скорость нагрева, К/мин. Решение данного уравнения и определение основных кинетических показателей осуществлялось путем аппроксимации экспериментальной зависимости в координатах ln(–ln(1–α)/T2) от 1/T.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 2 представлены результаты термического анализа (ТГ- и ДТГ-кривые) исследуемых образцов углей в атмосфере воздуха. Видно, что введение нитрата железа в состав образцов приводит к заметному изменению характера процесса, что выражается в снижении начальной температуры интенсивного окисления ti.
Рис. 2.
Данные ТГ и ДТГ для процесса окисления образцов углей, модифицированных нитратом железа: образцы бурого угля (а); образцы каменного угля (б). Атмосфера – воздух (60 мл/мин), скорость нагрева 2.5 °С/мин.
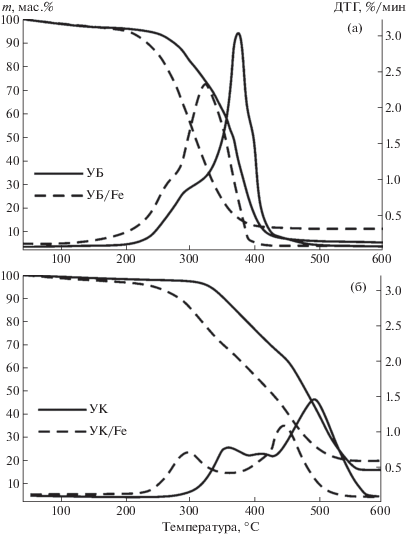
Процесс окисления образцов сравнения можно разделить на три или четыре основных стадии (в зависимости от марки угля). На первой стадии происходит испарение физически адсорбированной влаги (до 100°C). Для второй стадии характерна термическая деструкция частиц угля, сопровождаемая возгонкой летучих соединений (180–320°C для образца УБ и 300–420°C – для УК). На третьем и четвертом этапах наблюдается активное окисление высвобождаемых летучих соединений и образующегося коксового остатка (320–460°C для образца УБ, 420–580°C для образца УК). Отметим, что из ДТГ-кривых образцов бурого угля (в отличие от образцов серии УК, характеризующихся высокой степенью углефикации [16]) в данных экспериментальных условиях невозможно выделить переход между 3-й и 4-й стадиями, поскольку окисление образующегося коксового остатка для бурых углей происходит параллельно с высвобождающимися летучими компонентами.
Результаты термического анализа (рис. 2) показали, что наиболее значительное изменение характера окисления модифицированных образцов наблюдается в низкотемпературной области (для образца УБ/Fe до 360°С, для УК/Fe – 450°С), где происходит активное высвобождение летучих соединений. В результате интенсификации процесса для образцов с нанесенной добавкой Fe(NO3)2 происходит значительный сдвиг температуры начала интенсивного окисления ti в низкотемпературную область. Так, для образца УБ/Fe Δti составило 40°С, для УК/Fe – 77°С. Большее значение температурного сдвига Δti для образца УК/Fe объясняется более высокой степенью углефикации данного вида топлива [5], которое имеет незначительное количество кислорода, связанного в гидроксильные группы [17].
В области более высоких температур (свыше 450°С) скорость потери массы модифицированных образцов замедляется, и характер ТГ-кривых становится аналогичным образцам сравнения. Таким образом, в результате интенсификации процесса окисления на стадии высвобождения летучих соединений происходит смещение в область более низких температур, в результате чего уменьшается температура окончания процесса окисления tf (момент полного преобразования органической массы образца).
Аналогичная зависимость Δti проявляется также и в характерных точках ДТГ-кривых (tmax), где скорость протекания реакции окисления имеет наибольшее значение wmax. Максимальное изменение параметра tmax (температура, соответствующая наибольшей скорости протекания реакции) составило 41°С (образец УК/Fe). Для образца УБ/Fe Δtmax оказалось равным 20°С. При этом для серии образцов УК, имеющих бимодальное распределение ДТГ-кривых, разница значений Δtmax2 (стадия окисления коксового остатка) составила 22°С. Из анализа ДТГ-кривых для модифицированных образцов следует, что смещение температурных экстремумов (tmax) в область меньших температур сопровождается снижением максимальной скорости протекания реакции wmax.
На рис. 3 представлены масс-спектрометрические профили выделения газофазных продуктов окисления (СО2 и NOx) исследуемых образцов углей.
Рис. 3.
Профили выделения газофазных продуктов окисления (СО2 и NOx): образцы бурого угля (а); образцы каменного угля (б). Атмосфера – воздух (60 мл/мин), скорость нагрева 2.5 °С/мин.
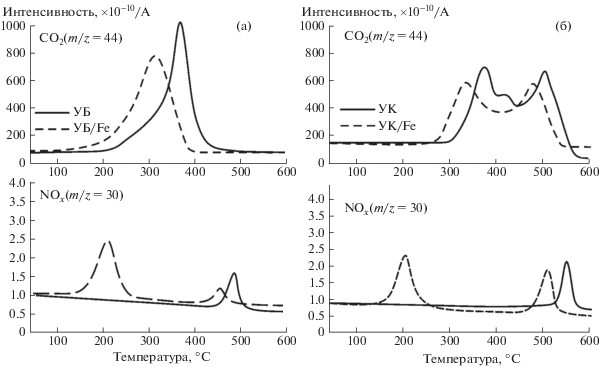
Результаты анализа масс-спектрометрических данных (температура максимумов tmax и их разница с образцом сравнения Δtmax, а также температура экстремума, соответствующая разложению нитратов металлов tразл) суммированы в табл. 2.
Таблица 2.
Влияние активирующей добавки Fe(NO3)2 на характер образования газофазных продуктов при окислении каменного угля (данные МС-анализа)
| Параметр | Образец | |||
|---|---|---|---|---|
| УБ | УБ/Fe | УК | УК/Fe | |
| CO2 (m/z = 44)* | ||||
| tmax (°С) | 356/– | 320/– | 380/505 | 320/480 |
| Δtmax (°С) | – | 36/– | – | 60/25 |
| NOx (m/z = 30) | ||||
| tразл (°С) | – | 206 | – | 200 |
| tmax (°С) | 460 | 486 | 552 | 518 |
| Δtmax(°С) | – | 26 | – | 34 |
Форма МС-профиля для диоксида углерода (m/z = 44) – основного продукта окисления горючего вещества, фактически является зеркальным отражением соответствующей ДТГ-кривой исследуемых образцов. Для исходного образца каменного угля первый максимум (380°С) связан с окислением десорбирующихся летучих веществ, а второй (505°С) – с последующим окислением коксового остатка. Введение активирующей добавки Fe(NO3)2 приводит к снижению температуры возгонки и началу интенсивного окисления летучих веществ; концентрационные кривые для CO2 в этом случае также характеризуются сдвигом экстремумов в низкотемпературную область. Наибольший сдвиг максимума наблюдается для образца УК/Fe $\Delta {{t}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ = 60°C в области возгонки и окисления летучих веществ. Для образца УБ/Fe $\Delta {{t}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ той же области составило 36°C.
Также на рис. 3 представлены масс-спектрометрические профили, соответствующие образованию оксидов азота NOx (m/z = 30). Видно, что в случае использования активирующей добавки Fe(NO3)2 наблюдается существенное изменение МС-профиля для NOx. В первую очередь стоит отметить образование широкого интенсивного пика в низкотемпературной области (180–240°C) для всех модифицированных образцов, что, вероятнее всего, связано с разложением нанесенного нитрата железа (рис. 3). Характер выделения NOx свидетельствует о том, что разложение Fe(NO3)2 начинается уже при ~165°C, что указывает на определенную степень участия носителя (угля) в данном процессе [18].
Вторая, менее интенсивная, волна выделения NOx имеет отношение к образованию оксидов азота в режиме окисления коксового остатка за счет вовлечения молекулярного азота N2 в процесс термического преобразования в воздушной среде (рис. 3). Следует подчеркнуть, что в данном случае также имеет место смещение второго пика ${\Delta }{{t}_{{{\text{N}}{{{\text{O}}}_{2}}}}}$ в низкотемпературную область (Δtmax = 34°С). Важно отметить, что данный процесс сопровождается заметным уменьшением интенсивности образования NOx, что следует из сопоставления данных на рис. 3.
Таким образом, оксиды азота NOx, образующиеся в результате разложения нанесенного нитрата железа, способствуют значительному ускорению процесса окисления углей [19], инициируя более раннее освобождение летучих соединений и их последующее окисление. Сопоставление результатов ДТГ- и МС-анализа (рис. 2 и 3) позволяет заключить, что сдвиг начальной температуры интенсивного окисления Δti находится в прямой корреляции с температурой разложения Fe(NO3)2.
Рассматривая возможное действие активирующей добавки на процесс окисления углей, следует упомянуть ряд ключевых уравнений реакций:
(1)
${\text{Fe}}{{({\text{N}}{{{\text{O}}}_{3}})}_{2}}\xrightarrow{{t{{,}^{ \circ }}{\text{C}}}}{\text{FeO}} + 2{\text{N}}{{{\text{O}}}_{2}} + {{{\text{O}}}_{2}},$(2)
$2{\text{Fe}}{{({\text{N}}{{{\text{O}}}_{3}})}_{2}} + 3{\text{C}}\xrightarrow{{t{{,}^{ \circ }}{\text{C}}}}2{\text{FeO}} + 4{\text{NO}} + 3{\text{C}}{{{\text{O}}}_{2}},$(3)
${\text{C}} + {\text{N}}{{{\text{O}}}_{2}}\xrightarrow{{t{{,}^{ \circ }}{\text{C}}}}{\text{CO}} + {\text{NO}},$(4)
$2{\text{CO}} + 2{\text{N}}{{{\text{O}}}_{2}}\xrightarrow{{t{{,}^{ \circ }}{\text{C}}}}2{\text{C}}{{{\text{O}}}_{2}} + {{{\text{N}}}_{2}},$(6)
${\text{C}} + {{{\text{O}}}_{2}}\xrightarrow{{{\text{F}}{{{\text{e}}}_{x}}{{{\text{O}}}_{y}}}}{\text{C}}{{{\text{O}}}_{2}}.$Во-первых, нагревание нитрата железа (до 190°С и выше) приводит к его разложению по уравнению (1). В то же время, согласно данным МС-анализа, разложение нанесенной соли Fe(NO3)2 начинается при более низкой температуре (165°С), что свидетельствует об участии углерода в данном процессе в качестве восстановителя (2). В результате разложения нитрата образуются оксиды азота NO и NO2 (NOx) последний из которых выступает в роли сильного окислителя, активирующего процесс горения углерода и летучих соединений (3) и (4). Взаимодействие угля с диоксидом азота сопровождается образованием NO, который далее легко окисляется кислородом воздуха в соответствии с обратимой газофазной реакцией (5). Таким образом, разложение нанесенной добавки способствует активации взаимодействия субстрата и окислительной средой в результате термической деструкции угля, которая выражается изменением внутренней и поверхностной структуры частиц.
Процесс разложения Fe(NO3)2 завершается образованием дисперсного нестехиометрического оксида железа FexOy, равномерно распределенного в структуре окисляемого образца. Известно [5], что нанесенный оксид железа обладает заметной каталитической активностью в реакциях полного окисления органических субстратов и топлива, что позволяет рассматривать дальнейшее участие образующихся частиц FexOy в качестве катализатора, ускоряющего процесс окисления углей (6). На поверхности дисперсных частиц оксида железа происходит активация дикислорода с последующей передачей активированного кислорода на углеродный носитель, что в конечном итоге способствует более быстрому окислению горючего субстрата.
В табл. 3 приведены характеристики процесса окисления исследуемых образцов углей, вычисленные по данным ДТА. Как уже отмечалось ранее, максимальный эффект, проявляющийся в снижении начальной температуры окисления угля, реализуется для модифицированного образца каменного угля (${\Delta }t_{i}^{{{\text{УК}}/{\text{Fe}}}}$ = 77°C). Наблюдаемая разница в значениях Δti для исследуемых серий образцов УБ и УК, по-видимому, связана с различиями в физико-химических характеристиках углей. Для всех модифицированных образцов наблюдается смещение процесса окисления в низкотемпературную область. Понижение температуры инициации окисления ti приводит к сокращению времени прогрева образца до момента начала интенсивного окисления Te (для бурого угля изменение Te составило 16 мин, для каменного ΔTe = 35.5 мин). При этом сокращение времени протекания процесса интенсивного окисления Tf наблюдается только для образца УБ/Fe ($\Delta T_{f}^{{УБ/{\text{Fe}}}}$ = 16 мин), что может быть связано с высоким выходом летучих веществ, содержащихся в составе бурого угля (табл. 1). Для образца УК/Fe основное воздействие активирующей добавки Fe(NO3)2 сосредоточено в области высвобождения и окисления летучих веществ. На стадии окисления коксового остатка, в условиях перехода процесса в низкотемпературную область, скорость реакции замедляется, о чем свидетельствует увеличение ширины пиков ДТГ-кривых (рис. 2).
Таблица 3.
Характеристики процесса окисления бурых и каменных углей, вычисленные по данным ДТА
| Параметр | Образец | |||
|---|---|---|---|---|
| УБ | УБ/Fe | УК | УК/Fe | |
| Температура начала интенсивного окисления, ti ,°С | 260 | 220 | 340 | 263 |
| Время прогрева образца до момента начала интенсивного окисления, Te, мин | 86 | 70 | 118 | 82.5 |
| Температура окончания процесса окисления, tf , °С | 500 | 420 | 578 | 520 |
| Время интенсивного окисления образца, Tf , мин | 96 | 80 | 95.2 | 102.3 |
| Температура при максимальной скорости реакции окисления*, tmax1/tmax2,°С | 380/– | 360/– | 361/497 | 320/475 |
| Максимальная скорость реакции окисления*, wmax1/wmax2, мас. %/мин | 3.1/– | 2.3/– | 0.8/1.5 | 0.7/0.9 |
| Время достижения максимальной скорости реакции окисления* Tmax1/Tmax2, мин | 48/– | 32 | 8.4/26 | 21.2/31.8 |
| Энергия активации процесса окисления, Ea, кДж/моль | 68.6 | 62.7 | 74.0 | 64.4 |
Согласно данным табл. 3, также видно, что с переходом процесса в низкотемпературную область, снижается и значение температуры tmax, соответствующей максимальной скорости реакции. Вследствие бимодального характера ДТГ-кривой для модифицированного образца каменного угля параметр tmax был определен для стадий высвобождения летучих веществ tmax1 (41°С) и окисления коксового остатка tmax2 (22°С).
Для образца УБ/Fe значение параметра Δtmax составило 20°С. Сопоставляя вычисленные значения характеристик процесса окисления с ранее полученными результатами [13], можно заключить, что добавка в виде Fe(NO3)2 имеет более сильные активирующие свойства, что приводит к смещению процесса в область более низких температур.
Результаты расчетов энергии активации по методу Coats–Redfern показали, что активирование образцов добавкой Fe(NO3)2 во всех случаях приводит к снижению Ea процесса окисления, причем максимальное снижение энергии активации, как и следовало ожидать, наблюдается для образца УК/Fe (ΔEa ~ 9.6 кДж/моль). Полученные значения энергии активации хорошо согласуются с литературными данными [13, 20].
ВЫВОДЫ
Результаты проведенного исследования показали, что введение активирующей добавки Fe(NO3)2 в состав образцов бурого и каменного углей в количестве 5 мас. % оказывает ускоряющее воздействие на процесс окисления в обоих случаях.
Показано, что присутствие активирующей добавки нитрата железа в составе образцов приводит к следующим эффектам: 1) снижение температуры, соответствующей началу высвобождения и окисления летучих соединений; 2) сокращение времени подготовительной стадии прогрева образцов до начала активного взаимодействия; 3) смещение процесса окисления в область более низких температур.
По результатам масс-спектрометрического и термогравиметрического анализа, для образцов, модифицированных добавкой Fe(NO3)2, температурная область выхода летучих веществ находится в прямой корреляции с температурой начала разложения нитрата железа (ниже 200°С). Оксид железа, образующийся в результате разложения нитрата железа, катализирует дальнейший процесс полного окисления углей. Также установлено, что смещение процесса окисления угля в низкотемпературную область способствует заметному снижению концентрации оксидов азота NOx, образующихся в результате горения углей в высокотемпературной области вследствие вовлечения молекулярного азота N2 в процесс окисления топлива.
Список литературы
Симонов А.Д., Федоров И.А., Дубинин Ю.В., Языков Н.А., Яковлев В.А., Пармон В.Н. // Катализ в промышленности. 2012. № 3. С. 50.
Пармон В.Н., Симонов А.Д., Садыков В.А., Тихов С.Ф. // Физика горения и взрыва. 2015. Т. 51. № 2. С. 5. Combustion, Explosion and Shock Waves, 2015, [vol. 51, Issue 2, p. 143.] https://doi.org/10.1134/S001050821502001X
Gong X., Guo Z., Wang Z.// Combust. Flame. 2010. V. 157. P. 351.
Gong X., Guo Z., Wang Z. // Energy. 2010. V. 35. P. 506.
Gong X., Guo X., Wang Z. // Energy Fuels. 2009. V. 23. P. 4547.
Abbasi-Atibeh E., Yozgatligil A.// Fuel. 2014. V. 115. P. 841.
Zhao G.W., Yu W.Q., Xiao Y.H. // Adv. Mater. Res. 2011. V. 236-238. P. 660.
Kim Y.K., Hao L.F., Park J.I., Miyawaki J., Mochida I., Yoon S.H. // Fuel. 2012. V. 94. P. 516.
Morozov I.V., Znamenkov K.O., Korenev Y.M., Shlyakhtin O.A. // Thermochim. Acta. 2003. V. 403. P. 173.
Tokareva I.V., Mishakov I.V., Korneev D.V., Vedyagin A.A., Golokhvast K.S. // Nanotechnologies in Russia. 2015. V. 10. P. 158.
Эпштейн С.А. // Горный информационно-аналитический бюллетень (научно-технический журнал). 2009. № 9. С. 71.
Miroshnichenko D.V., Balaeva Y.S. // Coke and Chemistry. 2013. V. 56. P. 85.
Ларионов К.Б., Мишаков И.В., Ведягин А.А., Губин В.Е. // ХТТ. 2019. № 2. С. 63.
Larionov K.B., Gromov A.A. // Int. J. Coal Sci. Technol. 2019. V. 6. P. 37.
Kok M.V. // Energy Sources. 2002. V. 24. P. 899.
Русьянова Н.Д., Попов Б.К., Бутакова В.И. // Киев: Наук. думка, 1985. 132 с.
Мустафина Г.А. // Вестник Национальной академии наук Республики Казахстан. 2006. № 2. С. 40.
Ruiz M.L., Lick I.D., Ponzi M.I., Castellón E.R., Jiménez-López A., Ponzi E.N. // Thermochim. Acta. 2010. V. 499. P. 21.
Wang Y., Wang J., Chen H., Yao M., Li Y. // Chem. Eng. Sci. 2015. V. 135. P. 294.
Wang H., Li C., Peng Z., Zhang S. // Energy Sources. Part A: Recovery, Utilization and Environmental Effects. 2015. V. 37. P. 2323.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива



